一种放射氟化试剂、制备及应用的制作方法
本发明涉及正电子发射断层扫描技术领域,具体涉及一种放射氟化试剂、制备以及其在合成放射氟化恶唑烷酮类化合物中的应用。
背景技术:
有机分子的化学,生物和物理性质可通过引入氟原子而得到显著的改变,因此有机氟化合物广泛用于医药,农业以及材料等化学工业领域。此外,18F标记的有机化合物在诊断医疗和临床药学研究中广泛用作正电子发射断层扫描(PET)试剂。因此,急需开发能够方便制备复杂含氟化合物的新型合成策略。从放射学的观点来看,由于18F的半衰期短,后期氟化策略将大大简化复杂放射性示踪剂的合成。
含有烯烃结构的化合物进行分子内氟代环化反应可以一步构建包括C-F键在内具有多个新键的环状结构,其可以用作构建脂肪族含氟生物活性化合物的通用结构单元。在已报道的合成方法中,使用亲电氟化试剂的氟代环化是最重要的方法之一。然而,亲电氟化试剂通常由氟气制备而来,制备成本高,这限制了其在工业和实验室,特别是在18F放射性标记中的应用。另外,亲电氟化反应通常具有低比活性,这限制了它们在放射性氟化反应中的应用。最近,在氟代环化反应的研究中,高价碘试剂作为氟源得到了广泛的关注,因为它们表现出独特的反应活性,并且可以容易的从廉价的氟化物获得。虽然这类反应的反应机理还不是十分明确,但大多数报道提出的是离子反应途径。这些反应中使用烷基取代的烯烃和苯乙烯衍生物作为有效的亲核试剂,而带有贫电子双键的底物进行氟代环化的反应未见文献报道。
技术实现要素:
本发明的目的是开发了一种放射氟化试剂,并且将该试剂应用于银促进环化/1,2-(杂)芳基迁移/氟化级联反应,用于制备放射氟代恶唑烷酮类化合物。
为达到上述目的,本发明提供的技术方案是:
本发明提供一种基于高价碘化合物的放射氟化试剂,将高价碘氯化合物和放射性[18F]-TBAF反应,将放射性氟原子引入到高价碘氟化合物中,制成新型放射氟化试剂,其结构式如下:
本发明还提供了上述放射氟化试剂的制备方法:将高价氯碘化合物的乙腈溶液与[18F]-TBAF在乙腈中混合,将反应混合物在80℃下反应10分钟,制成新型放射氟化试剂;
其反应式如下:
本发明利用上述放射氟化试剂作为中间体进行氟化反应得到放射性氟代恶唑烷酮类化合物所述化合物的结构式如下:
具体为以下八种化合物:
本发明采用一锅法实现放射氟环化反应得到放射氟代恶唑烷酮类化合物,具体包括以下步骤:
步骤一:放射性碘氟化合物中间体2制备
将高价氯碘化合物1(6μmol)在25μL无水MeCN中混合,然后将所得溶液与[18F]-TBAF在MeCN中合并,将反应混合物在80℃下反应10分钟,得到放射性碘氟化合物中间体18F-2即放射氟化试剂,无需进一步纯化直接进行下一步反应;
步骤二:氟环化反应合成放射性氟代恶唑烷酮类化合物
将烯烃前体苯乙烯或者丙烯酰胺类化合物2(6μmol)与AgOTf盐(6μmol)的乙腈溶液加入到上述反应混合物中,在80℃下反应10分钟,用1mL 1:1(v/v)水:MeCN淬灭,通过Sep-Pak轻质氧化铝N柱过滤,然后通过HPLC分离得到相应的放射性氟代恶唑烷酮类化合物;
其反应式如下:
合成产物包括:
进一步地,所述HPLC条件为:Phenomenex,5μm EVO C18250×4.6mm液相柱;溶剂A:0.1%TFA/水;溶剂B:0.1%TFA/乙腈;0至2分钟:在50%溶剂B,2至12分钟,50%至95%溶剂B的等度洗脱;流速:1mL/min,柱温度:19至21℃。
本发明为了验证合成的18F-恶唑烷-2-酮[18F]-3a的稳定性,我们分别对其进行了体内和体外实验。将[18F]-3a加入到pH值为7.5的磷酸缓冲溶液中,3h后进行分析,发现[18F]-3a几乎没有分解。随后,我们将[18F]-3a打入小鼠体内,1h后获取裸鼠的PET/CT图像,没有观察到因示踪剂脱氟而产生的骨吸收信号(见图1,图1是裸鼠的PET/CT图像(PET图像采集,通过尾静脉在1X PBS pH 7.5(300μL)中向裸鼠注射0.1mCi的[18F]-3a。在注射后时间点,使用异氟烷(2%的氧气)麻醉小鼠,然后放置在成像支架上,保持体温。然后实现和重建静态PET/CT采集用于分析。)。这些结论都可以说明这一类18F标记的放射氟代恶唑烷酮类化合物能够在体内生物医学研究领域得到应用。
尽管氟化反应已经有大量的文献报道,但是将这些方法成功地转化为实际的放射性氟化合成仍然是一个挑战。有效的放射性氟化合成存在以下困难:1)只有少数可利用的含18F的氟化物;2)由于18F-放射性同位素的半衰期为110分钟,所以反应必须快速完 成;3)人们对核辐射的关注越来越高。受上述实验结果的鼓励,我们尝试通过一锅合成法对烯烃前体(2a-c)进行放射性氟化标记,以便能够在最短时间内完成反应。然而,通过该方案没有成功地得到含有18F标记的环状化合物。这可能是由于化合物10与AgOTf生成了AgCl,从而抑制了放射性氟化反应的进行。
为了解决这个问题,我们决定采用一锅两步法进行放射性氟化标记,通过改变一系列的反应参数得到了合适的反应条件。该放射性氟化反应包括两个反应过程,即18F与Cl的原子交换以及氟化过程。我们首先改变两个过程的反应温度,发现氟化温度对放射化学产率(RCY)有影响,而18F-Cl交换温度对放射化学产率(RCY)几乎没有影响。因此,18F-Cl交换温度和18F-氟化温度分别设定为60℃和80℃。除反应温度外,反应液浓度,溶剂以及银盐种类对反应的影响较大。就溶剂种类和反应液浓度而言,只有在高浓度化合物10(0.24μM)的乙腈溶液中才能成功的得到18F标记的环状化合物。当采用低浓度的反应液或者用DMSO/DMF混合溶剂系统,该反应都不能成功的进行。此外,Ag盐在该反应中不可缺少,条件优化发现AgSbF6是最佳的银盐,能得到最高的放射性产率。然而,当AgSbF6的量减少至0.5或0.05当量时,氟化反应失败。为避免反应中额外引入19F,我们用AgOTf代替AgSbF6作为反应的催化剂制备了各种具有高放射性纯度的18F-恶唑烷-2-酮,结果如表1所示。
有益效果:
本发明将高价碘氯化合物和放射性[18F]-TBAF反应,将放射性氟原子引入到高价碘氟化合物中,制成新型放射氟化试剂,然后利用其作为反应中间体并采用一锅两步法可以迅速得到未见报道的放射性氟代恶唑烷酮类化合物,该类化合物作为PET示踪剂从而利用其对生物体进行无损伤性检查及疾病治疗研究,包括对生物体的新陈代谢过程进行无损伤性研究及对疾病进行化学及放射治疗。
附图说明
图1是注射[18F]-3a 1小时后裸鼠静脉扫描的衰变校正微PET/CT图像。A:冠状图像,B:矢状图像);
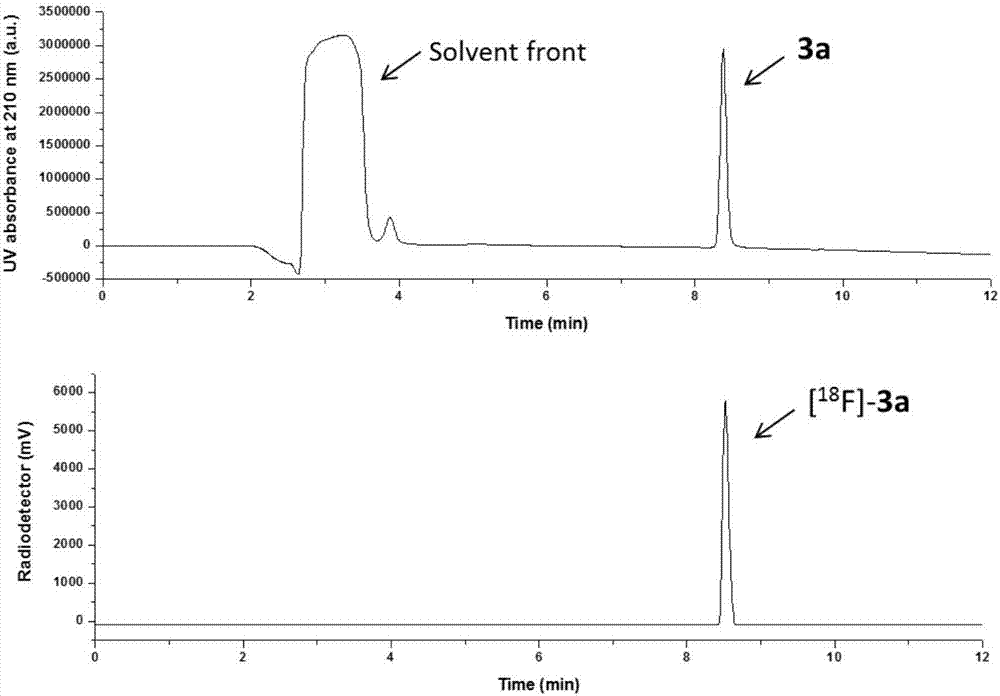
图2是与标准样(3a)文中并没有相应的结构共注射的纯化[18F]-3a溶液的HPLC UV-色谱图(上图)和放射色谱图(下图);
图3是与标准样(3b)共注射的纯化[18F]-3b溶液的HPLC UV-色谱图(上图)和放射色谱图(下图);
图4是与标准样(3c)共注射的纯化[18F]-3c溶液的HPLC UV-色谱图(上图)和放射色谱图(下图);
图5是与标准样(3d)共注射的纯化[18F]-3d溶液的HPLC UV-色谱图(上图)和放射色谱图(下图);
图6是与标准样(3e)共注射的纯化[18F]-3e溶液的HPLC UV-色谱图(上图)和放射色谱图(下图);
图7是与标准样(3f)共注射的纯化[18F]-3f溶液的HPLC UV-色谱图(上图)和放射色谱图(下图);
图8是与标准样(3g)共注射的纯化[18F]-3g溶液的HPLC UV-色谱图(上图)和放射色谱图(下图)。
具体实施方式
下面结合具体实施例对本发明作进一步说明。
实施例1
标准样制备:催化氟环化反应合成氟代恶唑烷酮类化合物
将底物2,所需量的化合物1(1.5当量),AgSbF6(0.1当量)和DCM引入加入到反应瓶中。并将混合物在20-60℃温度下搅拌,通过TLC监测反应的进行。当观察到反应结束,将反应混合物浓缩至干,通过柱色谱法提取分离得到恶唑烷酮类化合物3,分别为以下3a~3h八种化合物。
5-Benzyl-5-fluoro-3-(4-methoxyphenyl)oxazolidin-2-one(3a)
NMR(376 MHz,CDCl3)δ-92.52 ppm.13C NMR(101 MHz,CDCl3)δ156.96,152.32(d,J=1.7 Hz),132.23(d,J=4.2 Hz),130.37,130.20,128.95,128.03,120.68,114.49,112.31(d,J=233.1 Hz),55.58,54.10(d,J=30.6 Hz),42.03(d,J=29.1 Hz)ppm.IR(KBr)ν3005,2990,1771,1515,1456,1339,1275,1360,1080,828,764,750,704.HRMS(ESI)m/z calcd.for C17H16FNNaO3+(M+Na+):324.1006,Found:324.1002.
5-Benzyl-5-fluoro-3-(p-tolyl)oxazolidin-2-one(3b)
152.13,134.70,132.25(d,J=4.3 Hz),130.42,129.86,129.04,128.11,118.69,112.31(d,J=233.1 Hz),53.77(d,J=30.7 Hz),42.15(d,J=29.1 Hz),20.90 ppm.IR(KBr)ν3033,3006,2986,2921,2851,1774,1517,1468,1404,1335,1275,1261,1080,976,810,764,750,702.HRMS(ESI)m/z calcd.for C17H16FNNaO2+(M+Na+):308.1057,Found:308.1045.
5-Benzyl-3-(4-chlorophenyl)-5-fluorooxazolidin-2-one(3c)
ppm.13C NMR(101 MHz,CDCl3)δ151.90,135.81,132.00(d,J=4.2 Hz),130.39,130.18,129.36,129.08,128.20,119.66,112.24(d,J=233.9 Hz),53.51(d,J=30.8 Hz),42.03(d,J=28.9 Hz)ppm.IR(KBr)ν3005,2986,1771,1496,1338,1275,1261,1094,1080,978,826,764,750,704.HRMS(ESI)m/z calcd.for C16H14ClFNO2+(M+H+):306.0692,Found:306.0688.
Ethyl 2-(5-benzyl-5-fluoro-2-oxooxazolidin-3-yl)-3-phenylpropanoate(3d)
–3.04(m,3H),2.95–2.81(m,1H),[1.23(t,J=7.1 Hz),1.18(t,J=7.1 Hz),(3H)]ppm.19F NMR(376 MHz,CDCl3)δ-92.12,-94.35 ppm.13C NMR(101 MHz,CDCl3)δ169.95,169.81, 155.15(d,J=1.5 Hz),154.92(d,J=1.4 Hz),135.71,135.63,132.33(d,J=3.2 Hz),132.31(d,J=4.7 Hz),130.38,130.30,128.92,128.89,128.85,128.81,128.69,128.54,127.89,127.85,127.36,127.29,113.42(d,J=234.4 Hz),113.38(d,J=234.5 Hz),61.92,61.83,56.63,56.54,50.60(d,J=29.6 Hz),50.48(d,J=30.7 Hz),42.18(d,J=28.9 Hz),42.06(d,J=29.5 Hz),35.48,35.18,14.14 ppm.IR(KBr)ν3005,2989,1779,1738,1456,1275,1261,1031,897,765,750,703.HRMS(ESI)m/z calcd.for C21H22FNNaO4+(M+Na+):394.1425,Found:394.1425.
5-Fluoro-5-(4-fluorobenzyl)-3-(4-methoxyphenyl)oxazolidin-2-one(3e)
CDCl3)δ162.64(d,J=246.9 Hz),157.06,152.23,132.03(d,J=8.1Hz),130.13,127.96(t,J=3.7 Hz),120.72,115.93(d,J=21.4 Hz),114.56,112.07(dd,J=233.0,1.2 Hz),55.63,54.19(d,J=30.6 Hz),41.32(d,J=29.6 Hz)ppm.IR(KBr)ν3008,2992,2920,2845,1771,1760,1512,1275,1258,1080,826,764,750.HRMS(ESI)m/z calcd.for C17H16F2NO3+(M+H+):320.1093,Found:320.1091.
5-Fluoro-5-(4-methoxybenzyl)-3-(4-methoxyphenyl)oxazolidin-2-one(3f)
MHz,CDCl3)δ-92.77 ppm.13C NMR(101 MHz,CDCl3)δ159.46,157.00,152.40,131.46,130.31,124.19(d,J=4.6 Hz),120.69,114.55,114.43,112.49(d,J=232.9 Hz),55.64,55.41,54.04(d,J=30.6 Hz),41.23(d,J=29.4 Hz)ppm.IR(KBr)ν3005,2984,1771,1515,1456,1339,1275,1260,764,750.HRMS(ESI)m/z calcd.for C18H18FNNaO4+(M+Na+):354.1112,Found:354.1104.
5-Fluoro-3-(4-methoxyphenyl)-5-(thiophen-3-ylmethyl)oxazolidin-2-one(3g)
7.38–7.29(m,3H),7.23(d,J=1.8Hz,1H),7.08(d,J=4.9Hz,1H),6.91–6.83(m,2H),4.01,3.92(ABq,J=10.9Hz,1H),3.93,3.87(ABq,J=10.9Hz,1H),3.78(s,3H),3.49–3.32(m,2H)ppm.19F NMR(376MHz,CDCl3)δ-92.91ppm.13C NMR(101MHz,CDCl3)δ157.00,152.27,132.24(d,J=4.4Hz),130.18,128.99,126.64,124.68,120.72,114.53,112.05(d,J=232.9Hz),55.62,54.19(d,J=30.5Hz),36.79(d,J=30.7Hz)ppm.IR(KBr)ν2920,2849,1771,1646,1515,1469,1338,1276,1255,1090,1060,830,764,750.HRMS(ESI)m/z calcd.for C15H15FNO3S+(M+H+):308.0751,Found:308.0742.
5-Fluoro-3-(4-methoxyphenyl)-5-(thiophen-2-ylmethyl)oxazolidin-2-one(3h)
MHz,CDCl3)δ-93.23ppm.13C NMR(101MHz,CDCl3)δ157.10,152.14,133.14(d,J=5.2Hz),130.17,128.56,127.47,126.20,120.82,114.59,111.68(d,J=233.3Hz),55.65,54.00(d,J=30.4Hz),36.57(d,J=32.4Hz)ppm.IR(KBr)ν3006,2920,2849,1775,1646,1515,1469,1338,1275,1257,975,829,764,750.HRMS(ESI)m/z calcd.for C15H15FNO3S+(M+H+):308.0751,Found:308.0747.
实施例2
本发明放射氟化试剂及放射氟代恶唑烷酮类化合物的制备:
采用一锅法实现放射氟环化反应得到放射氟代恶唑烷酮类化合物
步骤一,将高价氯碘化合物1(6μmol)在25μL无水MeCN中混合,然后将所得溶液与[18F]-TBAF在MeCN中合并,将反应混合物在80℃下反应10分钟,得到放射性碘氟化合物中间体18F-2即放射氟化试剂,无需进一步纯化直接进行下一步反应。
步骤二,将烯烃前体苯乙烯或者丙烯酰胺类化合物2(6μmol)与AgOTf盐(6μmol)的乙腈溶液加入到上述反应混合物中,在80℃下反应10分钟,用1mL 1:1(v/v)水:MeCN淬灭,通过Sep-Pak轻质氧化铝N柱过滤。然后通过HPLC条件:Phenomenex, 5μm EVO C18250×4.6mm液相柱。溶剂A:0.1%TFA/水;溶剂B:0.1%TFA/乙腈;0至2分钟:在50%溶剂B,2至12分钟,50%至95%溶剂B的等度洗脱。流速:1mL/min,柱温度:19至21℃)分离得到相应的放射性氟代恶唑烷酮类化合物。产物鉴定是通过对比对标样在HPLC中的保留时间来判断。(如图2~8)
- 还没有人留言评论。精彩留言会获得点赞!