含1,2,5‑恶二唑并异吲哚‑5,7(6H)‑二酮的聚合物及其制法与应用的制作方法
本发明涉及聚合物应用于光电子材料与器件领域,特别涉及一种含1,2,5-恶二唑并异吲哚-5,7(6H)-二酮的聚合物及其制法与应用。
背景技术:
太阳能是一种绿色可再生资源,有机太阳能电池活性层材料的种类繁多且有机分子的化学结构容易修饰,化合物的制备提纯加工简便,可以制成大面积的柔性薄膜器件,拥有未来成本上的优势以及资源的广泛分布性。有机太阳能电池可制备成膜,并且可以制备形成可卷曲折叠的衬底上形成柔性的太阳能电池。有机太阳能电池具有制造面积大、廉价、简易、柔性等优点。因而具有巨大的商业开发和应用前景。但是,目前有机太阳能共轭分子材料种类开发不足,为了实现高效的光电转换,从活性层材料的角度上考虑,需要每个活性层材料对太阳光有高效率的吸收以及高载流子迁移率,从而得到高的转换效率。要实现这些目标,研制更多的新型给体聚合物就显得十分重要。
技术实现要素:
本发明的目的在于针对目前新型共轭分子材料开发的不足,提供能量转换效率较高的一种含1,2,5-恶二唑并异吲哚-5,7(6H)-二酮单元的聚合物。
本发明的另一目的在于提供所述的一种含1,2,5-恶二唑并异吲哚-5,7(6H)-二酮的聚合物的制备方法与应用。
本发明通过以下技术方案实现。
一种含1,2,5-恶二唑并异吲哚-5,7(6H)-二酮的聚合物,结构通式如下:
其中,R1为氢原子或烷基链;所述烷基链为具有1~24个碳原子的直链、支链或者环状烷基链,或烷基链中一个或多个碳原子被氧原子、烯基、炔基、芳基、羟基、氨基、羰基、羧基、酯基、氰基或硝基取代,氢原子被卤素原子或上述官能团取代;Ar1、Ar2为芳香基团;D为电子给体单元;所述n为1~10000的自然数;电子给体单元D与6-R1-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮以共轭方式相连,n为所述共轭聚合物的聚合度。
进一步地,所述芳香基团Ar1、Ar2为如下所述的一种或两种以上:
其中,R2为氢原子或烷基链,或烷基链中一个或多个碳原子被氧原子、烯基、炔基、芳基、羟基、氨基、氨基正离子、羰基、羧基、硝基、苯基或恶吩基取代,或烷基链中一个或多个氢原子被卤素原子取代。
进一步地,所述电子给体单元D为如下所示结构的一种以上:
其中,R3、R4为氢原子或烷基链,或烷基链中一个或多个碳原子被氧原子、卤素原子、烯基、炔基、芳基、羟基、氨基、羰基、羧基、硝基、苯基或恶吩基取代,或烷基链中一个或多个氢原子被卤素原子取代。
更进一步地,所述R2、R3、R4为具有1~30个碳原子的直链、支链或者环状烷基链。
更进一步地,所述R1、R2、R3、R4为具有1~24个碳原子的直链、支链或者环状烷基链。
制备以上所述的一种含6-R1-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮的聚合物的方法,包括以下步骤:将电子给体单元D与含6-R1-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮单体进行still偶联共聚反应,得到含6-R1-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮的聚合物。
进一步地,所述电子给体单元D与含6-R1-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮单体的摩尔比为1:1。
进一步地,所述反应的条件为微波200℃反应45min。
以上所述共轭聚合物在制备聚合物发光二极管器件的发光层、制备聚合物场效应晶体管中半导体活性层或制备聚合物太阳能光伏电池的活性层中应用。
本发明通过选择多种共轭电子给体单元分别与含6-R1-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮单体进行still偶联共聚,获得含6-R1-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮的共轭聚合物。
本发明6-R1-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮的共轭聚合物可采用如下方法制备:
以4'-硝基-[2,2':5',2“-三恶吩]-3'-胺为母体,与次氯酸钠和氢氧化钠反应得到(恶吩-2-基)-4H,6H-恶吩并[3,4-c][1,2,5]恶二唑1-氧化物;然后与三乙氧基磷反应得到(恶吩-2-基)-4H,6H-恶吩并[3,4-c][1,2,5]恶二唑;与丁炔二酸二甲酯反应,得到(恶吩-2-基)苯并[c][1,2,5]恶二唑-5,6-二甲酸二甲酯;再通过水解,得到(恶吩-2-基)苯并[c][1,2,5]恶二唑-5,6-二羧酸;然后与乙酸酐反应,得到(恶吩-2-基)-5H,7H-异苯并呋喃并[5,6-c][1,2,5]恶二唑-5,7-二酮;然后与辛胺反应,得到(恶吩-2-基)-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮;最后通过NBS溴化得到最终单体4,8-双(5-溴恶吩-2-基)-6-辛基-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮。
金属催化偶联反应:将含电子给体单元D的具有金属催化偶联反应活性官能团的单体与步骤(1)所得的4,8-双(5-溴恶吩-2-基)-6-辛基-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮在金属催化剂下反应,得到初步功能化的含电子给体单元结构和(恶吩-2-基)-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮的共轭聚合物。
在步骤(2)中可以通过D结构的调节变换使(恶吩-2-基)-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮衍生物具有良好的溶液加工性及光电性能,最终成功将(恶吩-2-基)-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮结构引入到聚合物中,制备系列含(恶吩-2-基)-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮的共轭聚合物。
通过核磁共振(NMR)、质谱(MS)和凝胶色谱(GPC)表征了小分子和聚合物材料的结构,通过紫外可见光谱仪测试聚合物材料的光谱性质,同时将所制得的聚合物制备成光电器件表征他们的光电性能。
根据报道,苯并恶二唑类聚合物在保持其带隙基本不变的条件下具有较高的Voc,并且能量损失较少,可以预测,本发明6-R1-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮可以在保持带隙基本不变的条件下,可以提高其Voc,同时具有较高的结晶性和迁移率。因此,含有6-R1-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮的共轭聚合物具有良好的光学性能,是一类具有商业化应用前景的材料。
基于6-R1-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮的共轭聚合物材料作为一类有前途的光电材料。目前为止,在该领域未曾有人报道。本发明首次合成出了含6-R1-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮的共轭聚合物并成功应用于光电领域。
与现有技术相比,本发明具有以下优点:
本发明的含6-R1-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮的聚合物具有多种功能,苯并恶二唑类化合物有较好的光学带隙和较高的稳定性。由于其良好的溶液加工性能、优异的光电性能如Voc较高,在制作聚合物发光二极管的发光层、聚合物场效应晶体管以及聚合物太阳能电池的活性层领域具有良好的应用。
附图说明
图1为所制备聚合物的薄膜吸收谱图;
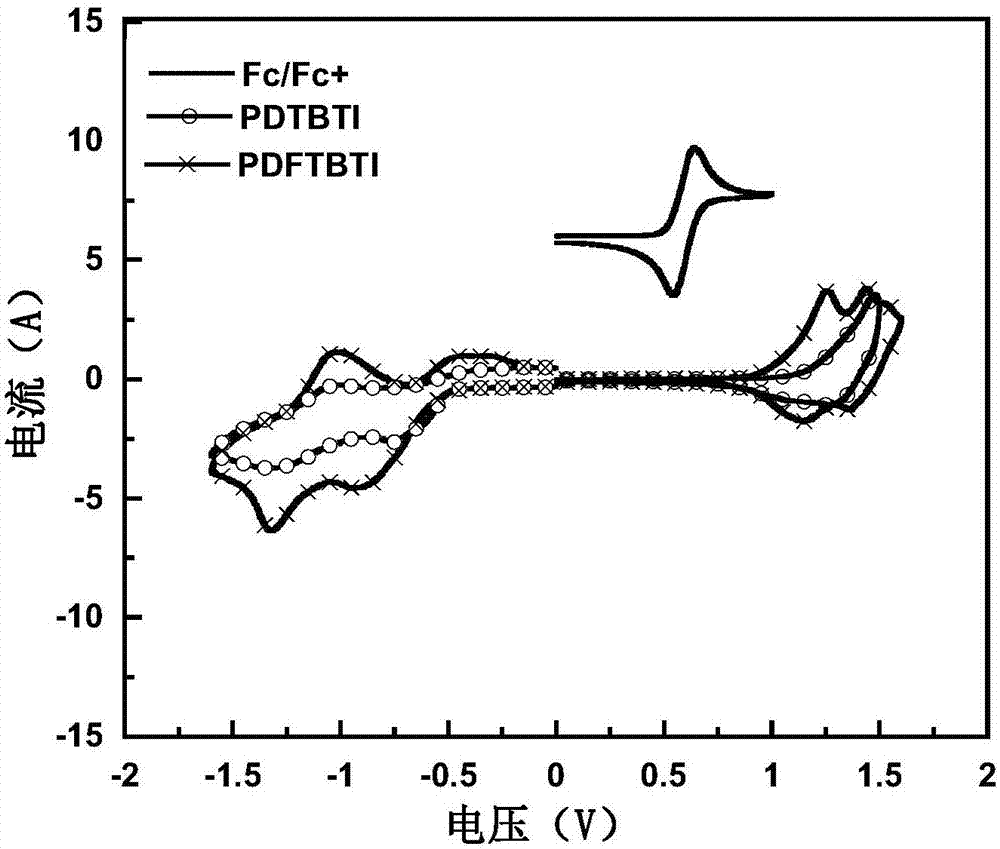
图2为所制备聚合物的电化学曲线图。
具体实施方式
以下结合实例对本发明的具体实施作进一步的说明,但本发明的实施方式不限于此。
实施例1
(恶吩-2-基)-4H,6H-恶吩并[3,4-c][1,2,5]恶二唑1-氧化物的制备:
在500mL的三颈瓶中,氮气保护下,加入化合物1(30g,97.3mmol),NaOH(1.30g,32.4mmol),再加入200mL四氢呋喃作溶剂,然后降温至0℃,然后将2ml 13wt%NaClO溶液逐滴加入反应装置中,将整个反应装置在0℃下反应2h。反应结束后,用二氯甲烷萃取3次,再用饱和氯化铵溶液洗,将反应混合物再用无水硫酸钠干燥,然后用真空旋转蒸发器将溶剂旋干,拌硅胶干法上柱得到黄色固体25.8g。产率:86%。1H NMR(500MHz,CDCl3)δ7.35(d,J=1.4Hz,2H),6.94(d,J=1.3Hz,2H),6.83(d,J=6.8Hz,2H),5.10(d,J=5.9Hz,2H),13C(151MHz,CDCl3)δ142.4,139.4,134.9,127.0,126.7,125.5,49。
(恶吩-2-基)-4H,6H-恶吩并[3,4-c][1,2,5]恶二唑的制备:
在500mL的三颈瓶中,氮气保护下,加入化合物2(25.8g,83.7mmol),N-亚磺酰苯胺(15.2g,91.7mmol),再加入300mL吡啶作溶剂,加热使其回流,过夜,反应结束后,使反应装置恢复到室温,将反应溶剂旋干,然后拌硅胶干法上柱,得到蓝色液体19.32g。产率:79%。1H NMR(500MHz,CDCl3)δ7.18(d,J=1.4Hz,2H),6.84(d,J=1.3Hz,2H),6.81(d,J=6.8Hz,4H),4.95(d,J=5.9Hz,2H).13C(151MHz,CDCl3)δ139.4,134.9,127.0,126.7,48.9.
(恶吩-2-基)苯并[c][1,2,5]恶二唑-5,6-二甲酸二甲酯的制备:
在250mL的三颈瓶中,氮气保护下,加入化合物3(19.32g,66.08mmol),丁炔二酸二甲酯(18.77g,132.15mmol),再加入150mL二甲苯作溶剂,加热至110℃反应12小时。反应停止后,将反应装置恢复到室温,旋蒸,除去二甲苯,再加入DCM,拌入硅胶粉,然后通过硅胶柱干法上柱进行分离提纯,石油醚:二氯甲烷为2:1。最终得到淡黄色固体17.19g。产率:65%。1H NMR(500MHz,CDCl3)δ7.70(d,J=1.4Hz,2H),7.40(d,J=1.3Hz,2H),7.13(s,2H),3.90(d,J=6.7Hz,6H).13C(151MHz,CDCl3)δ168.3,147.6,138.2,129.4,128.6,128.0,127.6,120.3,51.5.
(恶吩-2-基)苯并[c][1,2,5]恶二唑-5,6-二羧酸的制备:
在250mL的三颈瓶中,氮气保护下,加入化合物4(17.19g,42.93mmol),加入150mL无水乙醇,再逐滴加入NaOH(17.17mol/L,5mL)溶液,加热至100℃,通过点板判断反应进程。反应停止后,将反应装置恢复到室温,然后在反应混合物中加入10ml 2M盐酸水溶液,直至反应混合物为强酸性(用PH试纸判断),搅拌,过滤,得到黄色固体15.21g。
(恶吩-2-基)-5H,7H-异苯并呋喃并[5,6-c][1,2,5]恶二唑-5,7-二酮的制备:
在250mL的三颈瓶中,氮气保护下,加入化合物5(15.21g,40.85mmol)和乙酸酐(12.51g,122.55mmol),再加入160mL二甲苯作溶剂,加热至110℃,通过点板判断反应进程。反应停止后,将反应装置恢复到室温,直接旋蒸除掉溶剂二甲苯。得到黄色固体12.86g。直接进行下一步反应。
(恶吩-2-基)-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮的制备:
在500mL的三颈瓶中,氮气保护下,加入化合物6(12.86g,36.29mmol)和辛胺(9.38g,72.58mmol),再加入乙酸(180mL),加热至100℃反应8小时,然后用注射器加入乙酸酐(70mL),100℃下反应6小时。后处理:直接旋蒸,加入DCM溶解,干法上柱,石油醚:二氯甲烷为2:1,得到黄色固体13.18g。产率:78%1H NMR(500MHz,CDCl3)δ7.72(d,J=1.4Hz,2H),7.26(d,J=2.5Hz,2H),7.05(m,2H),3.68(d,J=6.6Hz,2H),1.68(m,J=13.7,7.1Hz,2H),1.29(m,J=27.6,12.9Hz,10H),0.87(m,J=10.1,6.7,3.3Hz,3H).13C(151MHz,CDCl3)δ167.9,146.9,138.2,130.0,128.6,128.0,127.6,118.1,40.0,31.9,30.2,29.3,26.7,22.7,14.1.
实施例2
4,8-双(5-溴恶吩-2-基)-6-辛基-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮的制备:
将化合物7(1.00g,2.15mmol)加入反应瓶中,加入氯仿80ml进行溶解,再加入3ml AcOH,称取NBS(1.15g,6.45mmol)加入反应瓶中,通入氮气。将反应装置用黑色袋子罩住。点板检测反应进程,结束反应。后处理:用DCM萃取,同时拌入硅胶粉,将粗产物用硅胶柱进行提纯,石油醚:二氯甲烷体积比为2:1。最后用甲醇和四氢呋喃进行重结晶。最终得到4,6-二(5-溴-4-(2-辛基十二烷基)恶吩-2-基)-2,6-二辛基-[1,2,3]三唑并[4,5-f]异吲哚-5,7(2H,6H)-二酮黄色固体1.05g,产率:78%。1H NMR(500MHz,CDCl3)δ7.13(s,2H),7.04(s,2H)3.76(t,J=7.2Hz,2H),1.70(m,2H),1.26–1.28(m,10H),0.88(m,3H).13C(151MHz,CDCl3)δ167.9,146.9,140.8,131.1,130.0,129.1,118.1,111.6,40.0,31.9,30.2,29.3,26.7,22.7,14.1.
实施例3
聚4-(3“,4'-二氟-5”-甲基-[2,2':5',2“-三联恶吩]-5-基)-8-(5-甲基恶吩-2-基)-6-辛基-5H-[1,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮的制备:
氩气保护下,在10mL微波管内,加入4,8-双(5-溴恶吩-2-基)-6-辛基-5H-[1,2,5]硒二唑并[3,4-f]的异吲哚-5,7(6H)-二酮(67mg,0.10mmol),DT(49.2mg,0.10mmol),四(三苯基膦)钯(8mg)和二甲苯(2mL),微波200℃反应45min,待反应降至室温后将反应液沉析在甲醇中,先后用甲醇、丙酮、正己烷进行索氏抽提,然后加入二乙基二硫代氨基甲酸钠三水合物的水溶液(225mg,1mmol,100mL水)于60℃搅拌8小时,除去反应中的钯催化剂,用甲醇、丙酮、正己烷进行索氏抽提,干燥,得到深绿色固体(102mg),产率:76.69%。核磁共振氢谱:(CDCl3)δ(ppm):1H NMR(500MHz,CDCl3)δ1H NMR(500MHz,CDCl3)δ7.48-7.51(m,3H),7.35(s,2H),6.87-7.91(m,3H),3.57(t,J=7.2Hz,2H),1.70(m,2H),1.26–1.28(m,10H),0.88(m,3H).
实施例4
聚(5“-甲基-[2,2':5',2”-三联恶吩]-5-基)-8-(5-甲基恶吩-2-基)-6-辛基-5H-[,2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮的制备:
氩气保护下,在10mL微波管内,加入4,8-双(5-溴恶吩-2-基)-6-辛基-5H-[1,2,5]硒二唑并[3,4-f]的异吲哚-5,7(6H)-二酮(63mg,0.10mmol),DT(49.2mg,0.10mmol),四(三苯基膦)钯(8mg)和二甲苯(2mL),微波200℃反应45min,待反应降至室温后将反应液沉析在甲醇中,先后用甲醇、丙酮、正己烷进行索氏抽提,然后加入二乙基二硫代氨基甲酸钠三水合物的水溶液(225mg,1mmol,100mL水)于60℃搅拌8小时,除去反应中的钯催化剂,用甲醇、丙酮、正己烷进行索氏抽提,干燥,得到深绿色固体(102mg),产率:76.69%。核磁共振氢谱:(CDCl3)δ(ppm):1H NMR(500MHz,CDCl3)δ1H NMR(500MHz,CDCl3)δ7.70(m,1H),7.55(s,2H),7.52(m,2H),7.40(t,J=7.2Hz,1H),7.13-7.19(m,3H),3.55(d,J=7.0Hz, 2H),1.70(m,2H),1.26-1.29(m,10H),0.88(m,18H).
实施例5
聚4-(5-(5-甲基恶吩并[3,2-b]恶吩-2-基)恶吩-2-基)-8-(5-甲基恶吩-2-基)-6-辛基-5H-[2,5]恶二唑并[3,4-f]异吲哚-5,7(6H)-二酮的制备:
氩气保护下,在10mL微波管内,加入4,8-双(5-溴恶吩-2-基)-6-辛基-5H-[1,2,5]硒二唑并[3,4-f]的异吲哚-5,7(6H)-二酮(60mg,0.10mmol),DT(49.2mg,0.10mmol),四(三苯基膦)钯(8mg)和二甲苯(2mL),微波200℃反应45min,待反应降至室温后将反应液沉析在甲醇中,先后用甲醇、丙酮、正己烷进行索氏抽提,然后加入二乙基二硫代氨基甲酸钠三水合物的水溶液(225mg,1mmol,100mL水)于60℃搅拌8小时,除去反应中的钯催化剂,用甲醇、丙酮、正己烷进行索氏抽提,干燥,得到深绿色固体(102mg),产率:76.69%。核磁共振氢谱:(CDCl3)δ(ppm):1H NMR(500MHz,CDCl3)δ1H NMR(500MHz,CDCl3)δ7.63(m,1H),7.51(s,1H),7.40(s,2H),7.28(m,2H),7.10(s,2H),3.45(t,J=7.2Hz,2H),1.70(m,2H),1.21-1.24(m,10H),0.88(m,3H).
实施例6
聚合物太阳能电池器件采用正装结构,以ITO玻璃衬底作为电子收集电极,ITO玻璃依次用丙酮,洗涤剂,去离子水和异丙醇超声洗涤,然后放入烘箱70℃过夜烘干。40nm厚的PEDOT:PSS旋涂在经4分钟plasma处理后的ITO基板上,150℃下退火20分钟。聚合物PDFT与ITIC溶解于二氯苯(DCB),旋涂于PEDOT:PSS上作为光活性层,厚度为80nm,活性层进行160℃/10min退火处理。在活性层上旋涂一层5nm的PFNDI-Br作为阴极界面。最后,在真空蒸镀仓内(2.0×10-6mbar),通过掩膜板在活性层上蒸镀一层厚度为80nm的铝作为阴极,器件的有效面积为0.058cm2.聚合物的器件数据如下表1所示:
表1
上述制备的聚合物的紫外-可见光吸收光谱图如图1、图2所示,紫外-可见光吸收光谱在Shimadzu UV-3600紫外分析仪上测量。由图1可以看出,聚合物PDTBTI、PDFTBTI在680nm有较强的吸收。其中聚合物PDTBTI、PDFTBDI的薄膜吸收最大峰680nm,说明上述聚合物对太阳光有较强的吸收,且吸收峰比较宽。
上述制备的聚合物的电化学曲线图如图2所示,可以看出上述聚合物具有较深的HOMO能级(HOMO能级为最高占据分子轨道、LUMO能级为最低未占分子轨道)。其能级如图表2所示:
表2
上述实施例为本发明较佳的实施方式,但本发明的实施方式并任何不受上述实施例的限制,其他的未背离本发明的精神实质与原理下所做的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!