一种提高异养微藻蛋白质含量的过补偿培养方法与流程
本发明属于微藻生物蛋白技术领域,具体而言,涉及小球藻的培养方法,特别涉及增加小球藻蛋白质产量的方法。
背景技术:
蛋白质是一切生命的物质基础,是细胞的重要组成部分,机体生长、发育、运动繁殖等生命活动都离不开蛋白质。联合国粮农组织2011年的调查显示,人口的增长速度已经远远超过了食品蛋白质供应的增长速度。蛋白质资源缺乏——这一世界性问题已经存在多年。随着我国经济建设的不断发展,人民生活水平不断提高,蛋白质总需求量逐年增加。加之我国是人口大国,人口的增长亦使得蛋白质缺乏这一问题尤为严重。因此,除努力提高蛋白质利用效率外,我们还迫切需要开发新的蛋白质资源以取代鱼粉、豆粕等价格昂贵的传统蛋白质。
利用生物技术开发高效能的单细胞蛋白引起人们的广泛关注,1967年,第一届国际单细胞蛋白质会议将富含蛋白质的微生物菌体统称为单细胞蛋白,其可以作为动物饲料,也可以作为食品添加剂、营养保健品被人类食用,以有效缓解食品蛋白质供应短缺问题。酵母菌、微藻、细菌和真菌是最重要的单细胞蛋白来源。
小球藻是第一种实现人工培养的微藻,细胞结构简单,易于培养,生长速度快,是进行生物技术研究的好材料。小球藻在自然界分布广泛,环境适应力较强;且营养价值较高,胞内蛋白质含量可达到大豆的1.25-1.5倍,各种氨基酸齐全,不饱和脂肪酸含量丰富,此外还含有多种生物活性物质,具有抗氧化、抗衰老、预防癌症、增加免疫力等功效。
发展小球藻作为饲料或食品添加剂已经有30多年的历史,已实现产业化的有小球藻面包、小球藻饮料、小球藻片和胶囊等。日本作为小球藻的生产和消费大国,目前呈现小球藻产品购销市场空前活跃的局面。
小球藻传统的培养方式为利用光能和CO2的自养,但由于自养培养获得的小球藻生物量较低,难以获得理想规模的藻细胞体,自养方式的商业化面临着经济和技术方面的问题。近年来,小球藻的异养培养成为研究热点。小球藻细胞在无光照条件下利用有机碳源进行异养生长,可大幅度提高细胞密度,但异养藻细胞内蛋白质的含量较自养显著降低。有研究发现微藻体内的物质代谢受外界条件改变而影响,例如,当氮源不足时,小球藻胞内油脂积累增加,当氮源充足时,物质代谢流会朝着蛋白质积累的方向进行。但小球藻氮代谢未观察到奢侈性吸收现象,无法实现蛋白质的奢侈性生产。如何在保证小球藻高生物质产量的前提下提高细胞蛋白质含量,是小球藻蛋白质资源开发利用所必需解决的关键问题。
技术实现要素:
本发明的目的在于针对目前异养小球藻蛋白质含量不高的缺陷,提供一种利用过补偿吸收效应增加小球藻生物体内蛋白质含量的方法。利用本发明方法,能够在保证异养小球藻高生物量的前提下,有效提高细胞蛋白质含量,实现小球藻蛋白质的高产量。
本发明的目的是通过如下技术方案实现的。
一种增加异养小球藻胞内蛋白质含量的方法,具体包括如下步骤:
所用普通小球藻购于中国科学院野生生物种质库——淡水藻种库,编号FACHB-8,生物学分类属于绿藻门、绿藻纲、绿球藻目、小球藻科、小球藻属。但本发明不限于此一种小球藻。
所用培养基为修改BG11+培养基。氮缺乏修改BG11+培养基配方:
(1)氮源,2-6 mmol L-1
(2)有机碳源,5-30 g L-1
(3)K2HPO4, 3.0-5.0 g溶于100 mL dH2O
(4)MgSO4·7H2O, 6.5-8.5 g溶于100 mL dH2O
(5)CaCl2·2H2O, 2.6-4.6 g溶于100 mL dH2O
(6) 柠檬酸, 0.4-0.8 g溶于100 mL dH2O
(7) 柠檬酸铁铵, 0.4-0.8 g溶于100 mL dH2O
(8)EDTA-Na2, 0.05-0.15 g溶于100 mL dH2O
(9)Na2CO3, 1.0-3.0 g溶于100 mL dH2O
(10)A5溶液:H3BO3, 2.86g L-1; MnCl2·4H2O, 1.86g L-1; ZnSO4·7H2O, 0.22g L-1; Na2MoO4·2H2O, 0.021g L-1; CuSO4·5H2O, 0.08g L-1; Co(NO3)2·6H2O, 0.05g L-1溶于水中。用1M NaOH或HCl调pH至7.1。
说明:配制母液(3)-(10)号时,药品分别配制,分别存放。(10)号中的药品按量配制后混合存放。配制工作液时,取(3)-(10)号母液各1mL,另取(1)氮源2-6 mmol L-1及(2)有机碳源5-30 g L-1,加入蒸馏水中并定容至1000 mL,然后用1 M NaOH或HCl调节pH至7.1,并115°C湿热灭菌20 分钟。固体BG11+培养基为BG11+培养基加入15-20 g L-1的琼脂粉。
具体操作方法如下。
(1)将固体BG11+平板培养基上的小球藻单菌落接种到BG11+液体培养基中,23-35°C,120-200 rpm,培养2-6天,作为一级种子液。
(2)将一级种子液以5%-40%(V/V)的接种量接种于BG11+液体培养基中,培养2-6天,作为二级种子液。培养条件同一级种子液。
(3) 将二级种子液以5%-40% (V/V)的接种量接种于氮浓度为2-6 mmolL-1的BG11+培养基中。于23-35°C,120-200 rpm下培养。
(4)待小球藻生长至指数期末期即在培养过程的第2-4 d,将发酵液转移至已灭菌的离心管中,2000-4500 rpm离心3-10 min,弃去上清液,藻体沉淀转移至氮浓度为12-20 mmol L-1的已灭菌培养基中。继续于23-35°C,120-200 rpm下培养。
(5)待小球藻生长至指数期结束即4-8 d,将藻液转移到离心管中,4000-8000 rpm离心5-12 min,收集藻体,减压干燥。
本专利提供的技术方案具有以下有益效果:
(1)本发明区别于传统的两步补料分批发酵。传统两步发酵的第一阶段积累生物量,第二阶段积累次级代谢产物;而本发明的过补偿吸收培养的氮缺乏阶段仅给予藻细胞氮饥饿刺激,氮充足阶段同时进行生物量和蛋白质产物的积累。而且本发明方法在小球藻生长对数期补充了充足的新鲜培养基以替代原有培养基,新鲜培养基中含有更丰富的微量元素,有利于小球藻的生长和蛋白质的积累;
(2)有学者研究发现添加植物激素也能刺激藻细胞蛋白质代谢,增加小球藻蛋白质含量,但植物激素会使小球藻的生长受到抑制,生物量降低,不利于小球藻蛋白质的生产。与添加植物激素提高小球藻蛋白质含量的方法相比,本发明既能保证小球藻的生物量,又可使其蛋白质含量提高;
(3)本发明得到的异养小球藻蛋白质含量显著提高,达到50%以上,与自养小球藻水平相当;
(4)本发明工艺简单、操作简便、生产周期短,条件温和,原料易得,易于规模化工业生产。
附图说明
图1: 无菌离心法与普通培养法所得小球藻的蛋白质含量、蛋白质产量及生物量。
图2:此方法所得小球藻中主要成分。
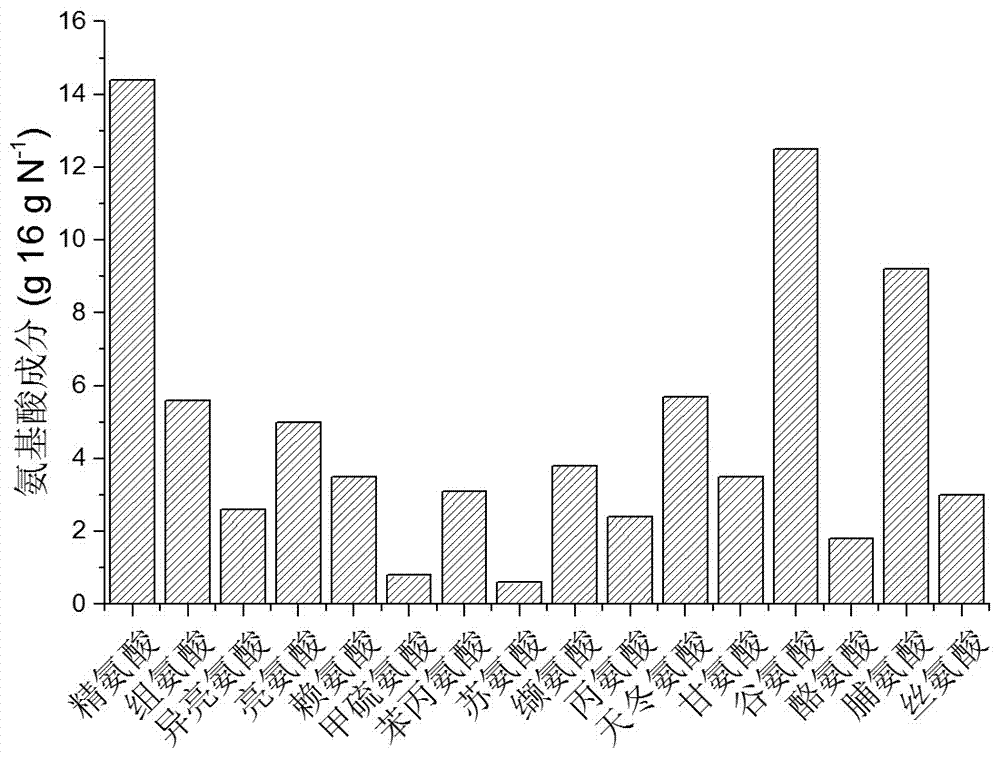
图3:此方法所得小球藻氨基酸组成。
具体实施方式
为了更好的理解本发明,下面将结合实施实例对本发明作进一步解释。但需要特别说明的是,实施实例仅用于对本发明进行进一步解释,本发明要求保护的范围并不局限于实施实例表示的范围。
实施实例1
将固体BG11+平板培养基上的小球藻接种到已灭菌的BG11+液体培养基中,25°C,180 rpm,培养3天,作为一级种子液。
将一级种子液以10%(V/V)的接种量接种于已灭菌的BG11+液体培养基中,培养3天,作为二级种子液。培养条件同一级种子液。
将二级种子液以10%(V/V)的接种量接种于已灭菌的低氮浓度为3 mmol L-1的BG11+培养基中。培养条件为温度25°C,摇床转速180 rpm。
待小球藻生长至指数期末期即在培养过程的第3 d时,在无菌操作条件下4000 rpm离心8 min、收集藻细胞。
将藻细胞立即重悬浮于等体积新鲜的已灭菌的18 mmol L-1高氮浓度培养基中,于25°C中继续培养。
待小球藻生长至第7 d时,4000 rpm离心10 min收集藻体,减压干燥,重量法测定其生物量,凯氏定氮法测定其蛋白质含量。
如附图1所示,相比普通培养方法,此方法显著提高了小球藻蛋白质含量,可以达到53.8%。此法获得的蛋白质产量达1.62 g L-1,生物量为3.01 g L-1。小球藻细胞成分见附图2、氨基酸成分见附图3。
实施实例2
将固体BG11+平板培养基上的小球藻接种到已灭菌的BG11+液体培养基中,25°C,180 rpm,培养3天,作为一级种子液。
将一级种子液以10%(V/V)的接种量接种于已灭菌的BG11+液体培养基中,培养3天,作为二级种子液。培养条件同一级种子液。
将二级种子液以10%(V/V)的接种量接种于已灭菌的低氮浓度为3mmol L-1的BG11+培养基中。培养条件为温度25°C,摇床转速180 rpm。
待小球藻生长至指数期末期即在培养过程的第3 d时,在无菌操作条件下4500 rpm离心5 min、收集藻细胞。
将藻细胞立即重悬浮于等体积新鲜的已灭菌的15 mmol L-1高氮浓度培养基中,于25°C中继续培养。
待小球藻生长至第7 d时,4500 rpm离心8 min收集藻体,减压干燥,重量法测定其生物量,凯氏定氮法测定其蛋白质含量。
此方法显著提高了小球藻蛋白质含量,使之达到50.0%,产量为1.54 g L-1,生物量为3.04 g L-1。
实施实例3
将固体BG11+平板培养基上的小球藻接种到已灭菌的BG11+液体培养基中,25°C,180 rpm,培养3天,作为一级种子液。
将一级种子液以10%(V/V)的接种量接种于已灭菌的BG11+液体培养基中,培养3天,作为二级种子液。培养条件同一级种子液。
将二级种子液以10%(V/V)的接种量接种于已灭菌的低氮浓度为3mmol L-1的BG11+培养基中。培养条件为温度25°C,摇床转速180 rpm。
待小球藻生长至指数期末期即在培养过程的第3 d时,在无菌操作条件下4500 rpm离心5 min、收集藻细胞。
将藻细胞立即重悬浮于等体积新鲜的已灭菌的12 mmol L-1高氮浓度培养基中,于25°C中继续培养。
待小球藻生长至第7 d时,4500 rpm离心8 min收集藻体,减压干燥,重量法测定其生物量,凯氏定氮法测定其蛋白质含量。
此方法显著提高了小球藻蛋白质含量,使之达到47.1%,产量为1.32 g L-1,生物量为2.81 g L-1。
- 还没有人留言评论。精彩留言会获得点赞!