一种兼具细胞膜穿透效应和双抗氧化物酶活性的76肽及其制备方法与流程
本发明涉及人工模拟酶领域,是一种兼具细胞膜穿透效应和双抗氧化物酶活性的76肽,具体地说,是一种通过基因重组技术制备的具有超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GPx)双活性的含硒金属76肽化合物。
背景技术:
机体内抗氧化系统的平衡和人类重大疾病的发生与发展息息相关,且机体内氧化还原平衡的维持需要依靠诸多抗氧化酶间的协同作用,仅对单一功能酶的研究很难深入探索这个复杂体系的作用机制,而进行构建具有多种抗氧化活性的模拟酶,有利于对抗氧化多酶体系中各种抗氧化酶的协同作用进行深入研究。超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)作为生物体天然抗氧化酶系的重要成员,大量研究表明两者的相互协同作用对清除和人类多种疾病相关的高浓度的ROS(reactive oxygen species,ROS)具有重要作用。因此,对SOD和GPx协同抗氧化效应的模拟化合物的研究至关重要。本申请人所在博士课题组曾经以具有晶体结构的SOD3为模板,保留了其活性必须的氨基酸序列,引入了SOD活性中心的Cu2+和稳定活性基团的Zn2+,同时插入了一段具有GPx底物GSH特异性结合位点的15肽,又通过结构模拟,在特定部位引入了除GPx活性残基Sec以外的对稳定活性部位起到至关重要的氨基酸残基Gln和Trp组成催化三联体,并利用Cys营养缺陷型表达系统,获得一种具有精巧的双酶活性中心结构域的铜锌含硒65肽即Se-CuZn-65P。相对大分子量模拟物,65P作为短肽提高了穿透细胞的效率,但效果依然不够理想。基于此,申请人在Se-CuZn-65P的氨基端连接上人免疫缺陷病毒(human immunodeficiency virus,HIV)反式转录激活因子(trans-activator of transcription,TAT)的蛋白穿膜结构域的氨基酸序列,即细胞穿膜肽(cell-penetrating peptide,CPP),使其具有穿透生物膜的能力,命名为Se-CuZn-76P,借助计算机模拟功能建立Se-CuZn-76P的三维结构模型,并与Se-CuZn-65P进行结构比对,分析其活性部位,预测其活性变化。然后在单一蛋白生产(single protein production,SPP)系统中进行半胱氨酸缺陷表达(cysteine auxotrophic expression),酶学特征及穿膜能力鉴定表明,Se-CuZn-76是一种具有双酶活性,位点清晰,结构稳定,催化机理明确且具有穿膜作用和抗氧化协同效应的小分子76肽,其对阐明酶的催化机理以及相互间协同作用有重要意义,而且还有广阔的药用前景。
技术实现要素:
本发明的目的之一是,提供一种兼具细胞膜穿透效应和双抗氧化物酶活性的76肽,通过引入系列催化氨基酸群和蛋白穿膜结构域的氨基酸序列,建立具有细胞膜穿透效应并兼具SOD和GPx催化活性的新型双功能模拟酶,其把SOD活性中心结构域和GPx活性中心结构域有机整合在一起,使它们能够在各自发挥活性的基础上又能相互协同作用,细胞穿膜肽使其具有穿透生物膜的能力,赋予其广阔的药用前景。本发明的另一目的是,提供一种科学合理,简单实用的兼具细胞膜穿透效应和双抗氧化物酶活性的76肽的制备方法。
实现本发明目的之一采用的技术方案是:一种兼具细胞膜穿透效应和双抗氧化物酶活性的76肽,结构中含有使细胞膜具有穿透功能的转录活化因子(Trans-activating transcriptional activator,TAT)序列,其特征是,还含有与超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GPx)相似的结构,其氨基酸一级序列为:Tyr-Gly-Arg-Lys-Lys-Arg-Arg-Gln-Arg-Arg-Arg-His-Gln-His-Gln-Phe-Gly-Asp-Leu-Ser-Gln-Gly-Ala-Glu-Ser-Thr-Gly-Pro-His-Tyr-Asn-Pro-Leu-Ala-Val-Pro-His-Pro-Gln-His-Pro-Gly-Asp-Trp-Gly-Asn-Phe-Ala-Val-Arg-Asp-Gly-Ser-Leu-Trp-Pro-Phe-Leu-Arg-His-Asn-Val-Tyr-Gly-Arg-Pro-Arg-Ala-Sec-Val-Val-His-Ala-Gly-Glu-Asp。
实现本发明目的之二采用的技术方案是:一种兼具细胞膜穿透效应和双抗氧化物酶活性的76肽的制备方法,其特征是,它包括以下步骤:
1)Se-CuZn-76P分子模型的建立与分析
以Se-CuZn-65P氨基酸序列为基础,连接上TAT序列(YGRKKRRQRRR),利用BLAST数据库和Homology模块进行同源序列比对并建立Se-CuZn-76P的三维结构模型,预测其活性变化;
BLAST搜索表明,天然SOD1(PDB entry 1HL5,1AZV),SOD3(PDB entry 2JLP)蛋白结构与Se-CuZn-76P有较高的同源性,依据其空间结构建立Se-CuZn-76P三维模型,优化后获得稳定结构,其具有发挥GPx活性的催化三联体(catalytic triad)结构和发挥SOD活性的金属离子配位(metal ion-coordinated)结构;
2)pColdⅠ(sp-4)-76P重组质粒的构建
参照OMEGAPlasmid Mini Kit I质粒提取试剂盒说明书:
将带有质粒的E.coli接种于5mL LB/抗生素培养液中,37℃摇床培养16h;
分次取5.0mL的菌液,室温下10000×g离心1min收集细菌,倒弃培养基;
加入250μl SolutionⅠ/RNaseA混合液,旋窝震荡使细胞完全悬浮;
加入250μl SolutionⅡ,轻轻颠倒混匀6次;
加入350μl SolutionⅢ,温和颠倒数次至形成白色絮状沉淀;
室温下,≥10000×g离心10min;
转移上清液至套有2mL收集管的HiBind DNA结合柱中,室温下,10000×g离心1min,倒去收集管中的滤液;
把柱子重新装回收集管,加入500μl HB Buffer,按上述条件离心,弃去滤液;
把柱子重新装回收集管,加入700μl DNA Wash Buffer按上述条件离心,弃去滤液。注意:浓缩的DNA Wash Buffer在使用之前必需按标签的提示用无水乙醇稀释,重复一次;
弃去滤液,把柱子重新装回收集管,10000×g离心空柱2min以甩干柱子基质;
把柱子装在干净的1.5mL离心管上,加入50μl Elution Buffer到柱子基质中,静置2min,10000×g离心1min洗脱出DNA。
对pET28a-76P和pColdⅠ(sp-4)pPelB质粒进行提取,并采用NdeⅠ和XbaⅠ限制性核酸内切酶对这两个质粒分别双酶切,再用T4DNA连接酶进行连接,双酶切和连接体系如下:
双酶切体系20μL如下:
37℃温育4h,1.5%琼脂糖凝胶电泳鉴定酶切结果并回收酶切片段;
连接体系10μL如下:
双酶切后的76P基因 4.5μL
双酶切后的pColdⅠ(sp-4)载体 1.5μL
H2O 2.5μL
45℃温育5min,冷却至室温,使酶切的目的基因和载体进行粘端退火连接,然后加入10×连接缓冲液1μL,T4DNA连接酶0.5μL,16℃连接16h;
重组质粒经CaCl2法转化入E.coli DH5α感受态菌株中,在含有100μg/mL Amp的卢-贝(Luria-Bertani,LB)固体培养基中筛选后,挑取单克隆在含有100μg/mL Amp的LB液体培养基中扩增培养,提取pColdⅠ(sp-4)-76P质粒,再用1%琼脂糖凝胶电泳进行酶切鉴定;
pColdⅠ(sp-4)-76P质粒为4587bp,由76P氨基端被转录增强元件(translation enhancing element,TEE)、6×组氨酸标签(6×His-Tag)和凝血酶切位点(FactorⅩa site)所表达肽段保护,使其不能发挥穿膜作用而在胞浆内高效表达,由限制性内切酶NdeⅠ和XbaⅠ单、双酶切后1%琼脂糖凝胶电泳鉴定结果可知pColdⅠ(sp-4)-76P质粒构建成功;
3)Se-CuZn-76P的表达和蛋白切割
将pColdⅠ(sp-4)-76P质粒和pMzaF质粒共转化入E.coli BL21(DE3)selB:cysE51感受态菌株中,建立成SPP表达系统,然后采用半胱氨酸缺陷表达法表达和纯化。从转化平板上挑取阳性单克隆接种20mL LB,含100μg/mL Ampicillin,50μg/mL Kanamycin培养基中,37℃振荡培养过夜,将过夜的种子液接种于500mL M9expression medium 1,含100μg/mL Ampicillin,100μg/mL Kanamycin,50μg/mL Cys培养基中,37℃振荡培养,当菌体的OD600达到1.0时,加入诱导剂IPTG使其终浓度达到1mM,37℃诱导10min,再加入Chloramphenicol终浓度为34μg/mL,37℃振荡培养5min后,6000rpm离心10min,弃上清液,菌体用与培养基等体积的0.9%NaCl重悬,6000rpm离心10min,弃上清液,重复洗涤一次,6000rpm离心15min,再次收集菌体,重悬于500mL M9expression medium 2,含100μg/mL Ampicillin,100μg/mL Kanamycin培养基中,同时加入利福平至终浓度为400mg/L,37℃振荡培养5h。离心收集菌体,于50mM,Tris-HCl(pH7.5)缓冲液中反复洗涤两次,重悬于4倍体积的50mM,Tris-HCl,pH7.5溶液中,加入蛋白酶抑制剂PMSF,溶于100μg/mL异丙醇,冰浴下超声破碎菌体,15000rpm离心30min,收集上清液;
M9expression medium 1:6g/L Na2HPO4;3g/L KH2PO4;0.5g/L NaCl;1g/L NH4Cl;400μM H3BO4;30μM CoCl2;10μM CuSO4;80μM MnCl2;10μM ZnSO4;10μM FeCl3;18种常见氨基酸,无Cys,各100μg/mL;1%甘油;0.4%葡萄糖;2mM MgSO4或50μg/mL半胱氨酸盐酸盐;硫胺素(VB1)5μg/mL;
M9expression medium 2:10g/L K2HPO4;1g/L NH4Cl;10mg/L CaCl2;3.6mg/L FeCl2;429mg/L MgAc;2g/L NaAc;丙氨酸、谷氨酸、谷氨酰胺、精氨酸、甘氨酸各400μg/mL;天门冬氨酸、天门冬酰胺、甲硫氨酸、组氨酸各250μg/mL;异亮氨酸、亮氨酸、赖氨酸、脯氨酸、苏氨酸、缬氨酸、酪氨酸各100μg/mL;色氨酸50μg/mL;丝氨酸1600μg/mL;0.5%甘油;0.2%蔗糖;胞嘧啶、鸟苷、脲嘧啶各125μg/mL,胸腺嘧啶50μg/mL;胺素(VB1)50μg/mL;烟酸50μg/mL;生物素100ng/mL;硒代胱氨酸200mg/L;
经Cys缺陷型表达后,把菌液6000rpm离心收集,弃上清,沉淀重悬于25mM,Tris-HCl,pH8.0缓冲液中,清洗3次后,超声破碎,留上清,用醋酸调pH值为5.2~5.4。加入终浓度为0.1mM的CuSO4室温放置1h,然后加入终浓度为0.1mM的ZnSO4室温放置30min,用25mM Tris-HCl缓冲液再次调整pH值为8.0,超滤浓缩后,蛋白上清经DEAE阴离子交换柱层析,用10倍柱体积的0~100mM NaCl洗脱,目的蛋白出现在20mM NaCl的洗脱液中,收集洗脱峰,用10mM PBS透析后,分别用截留分子量5KD和10KD的Millipore超滤离心管超滤,浓缩,用Tricine-SDS-PAGE鉴定目的小肽Se-CuZn-65P;
在表达0,12,24,48,72,96,120h时6000rpm离心10min收集沉淀;用50mM Tris-HCl,pH 8.0缓冲液中反复洗涤两次,重悬于4倍体积的50mM Tris-HCl,pH 8.0溶液中,冰浴下超声破碎菌体,15000rpm离心30min后收集上清液,用0.45mm滤膜过滤,考马斯亮蓝G-250方法测定表达蛋白浓度,用2%(w/w)的凝血酶对表达蛋白进行酶切,反应条件23℃,24h,用截留分子为3kDa的Milliproe超滤离心管收集目的肽,冻干备用,获得76肽。
本发明的一种兼具细胞膜穿透效应和双抗氧化物酶活性的76肽,以Se-CuZn-65为基础经过计算机模拟设计引入蛋白穿膜结构域的氨基酸序列,建立具有细胞膜穿透效应并兼具SOD和GPx催化活性的新型双功能模拟酶,并通过实验验证,获得具有双酶活性和穿透生物膜能力的76肽,具有广阔的药用前景。
本发明的一种兼具细胞膜穿透效应和双抗氧化物酶活性的76肽及其制备方法的进一步优点体现在:
1.保留原65肽中与天然SOD相似的三维结构和天然GPx相似的催化三联体结构,因此,同样兼具SOD和GPx的活性,其中GPx活力为109U/mg protein,SOD活力为1218U/mg protein,两种酶可以协同参与抗氧化效应,药物应用前景广阔;
2.在原有65肽功能基因基础上,引入携带抗氧化76肽穿透细胞膜功能的转录活化因子TAT穿膜肽基因,使其具有穿透细胞膜的功能,可进入细胞发挥其生物学效应;
3.采用单一蛋白生产(SPP)系统进行富集表达,该系统包括的MazF载体和冷休克表达载体pColdI。MazF表达的MazF蛋白,发挥对mRNA的ACA序列的剪切作用,从而抑制杂蛋白的合成,而不影响设计合成的不含ACA序列的目的蛋白表达,共转的携带目的基因的pColdI载体含有翻译增强元件(translational enhancer element,TEE)、6×His标签、Xa因子切割位点和多种限制性核酸内切酶切割位点,然后利用组氨酸标签纯化目的蛋白,简化了纯化步骤;
4.已被FITC成功标记,采用激光共聚焦显微镜在放大100倍状态下观察发现Se-CuZn-76P可以在TAT序列的协助下可穿透细胞膜而进入细胞。同时测定穿膜过程中细胞内GPx和SOD变化也发现,随着Se-CuZn-76P对L02细胞作用的时间延长,细胞内GPx和SOD活性增加,在第8h时间点上细胞内GPx和SOD活性分别为23.49U/mg protein和83.05U/mg protein,为L02细胞正常水平的1.65和4.12倍,这也可从侧面证明Se-CuZn-76P穿过了细胞膜。
5.其制备方法科学合理,简单实用。
附图说明
图1为Se-CuZn-76P的空间结构;
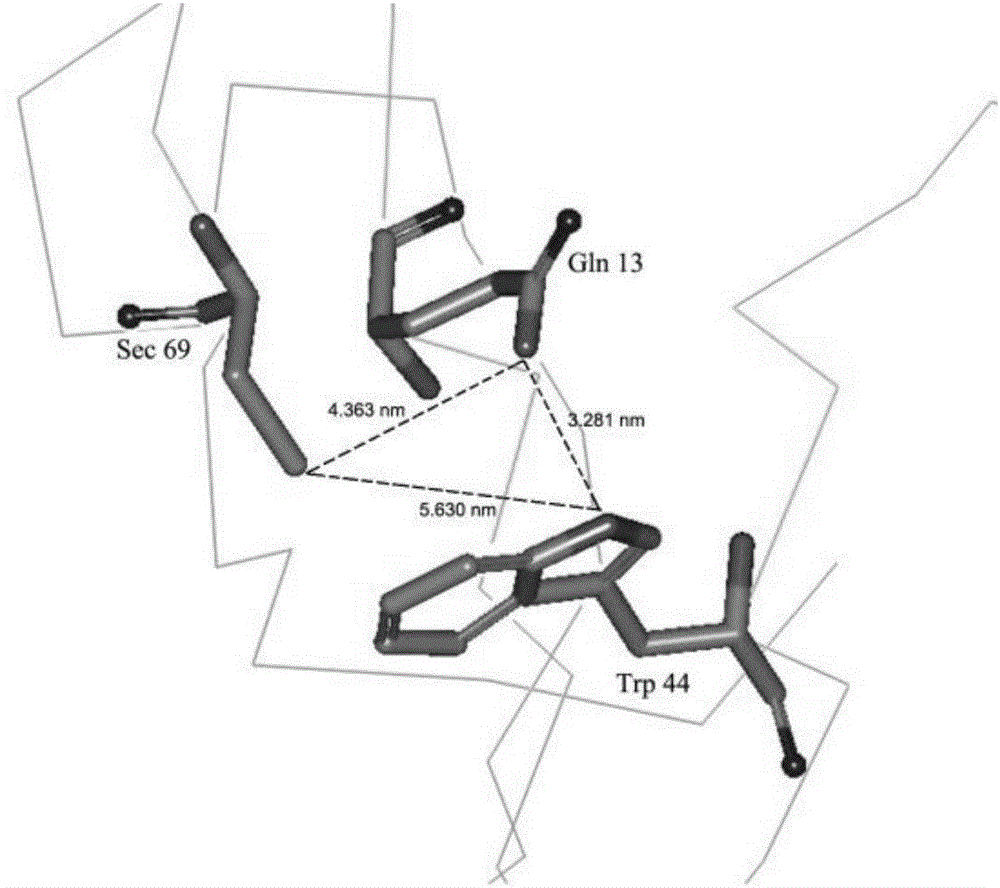
图2为Se-CuZn-76P发挥GPx活性的催化三联体结构;
图3为Se-CuZn-76P发挥SOD活性的金属离子配位结构;
图4为pColdⅠ(sp-4)-76P质粒构建的物理图谱;
图5为pColdⅠ(sp-4)-76P质粒构建的琼脂糖凝胶电泳鉴定图,
Lane1:DNA Marker;Lane2:pColdⅠ(sp-4)-76P;Lane3:pColdⅠ(sp-4)-76P+NdeⅠ;Lane4:pColdⅠ(sp-4)-76P+XbaⅠ;Lane5:pColdⅠ(sp-4)-76P+NdeⅠ+XbaⅠ);
图6为Se-CuZn-76P在SPP系统中表达与凝血酶切割的Tricine-SDS-PAGE鉴定图,
Lane1:Protein Marker;Lane2-8:表达不同时间(0h,12h,24h,48h,72h,96h,120h)的可溶性蛋白;Lane9:凝血酶切后纯化的Se-CuZn-76P;
图7为FITC-Se-CuZn-76P穿透L02细胞膜的示意图;
图8为在不同时间点上L02细胞内GPx和SOD活力示意图。
本发明的一种兼具细胞膜穿透效应和双抗氧化物酶活性的76肽,结构中含有使细胞膜具有穿透功能的转录活化因子(Trans-activating transcriptional activator,TAT)序列,其特征是,还含有与超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GPx)相似的结构,其氨基酸一级序列为:Tyr-Gly-Arg-Lys-Lys-Arg-Arg-Gln-Arg-Arg-Arg-His-Gln-His-Gln-Phe-Gly-Asp-Leu-Ser-Gln-Gly-Ala-Glu-Ser-Thr-Gly-Pro-His-Tyr-Asn-Pro-Leu-Ala-Val-Pro-His-Pro-Gln-His-Pro-Gly-Asp-Trp-Gly-Asn-Phe-Ala-Val-Arg-Asp-Gly-Ser-Leu-Trp-Pro-Phe-Leu-Arg-His-Asn-Val-Tyr-Gly-Arg-Pro-Arg-Ala-Sec-Val-Val-His-Ala-Gly-Glu-Asp。
本发明的一种兼具细胞膜穿透效应和双抗氧化物酶活性的76肽的制备方法,包括以下步骤:
1)Se-CuZn-76P分子模型的建立与分析
以Se-CuZn-65P氨基酸序列为基础,连接上TAT序列(YGRKKRRQRRR),利用BLAST数据库和Homology模块进行同源序列比对并建立Se-CuZn-76P的三维结构模型,预测其活性变化;
BLAST搜索表明,天然SOD1(PDB entry 1HL5,1AZV),SOD3(PDB entry 2JLP)蛋白结构与Se-CuZn-76P有较高的同源性,依据其空间结构建立Se-CuZn-76P三维模型,优化后获得稳定结构(图1),其具有发挥GPx活性的催化三联体(catalytic triad)结构(图2)和发挥SOD活性的金属离子配位(metal ion-coordinated)结构(图3);
2)pColdⅠ(sp-4)-76P重组质粒的构建
参照OMEGAPlasmid Mini Kit I质粒提取试剂盒说明书,对pET28a-76P和pColdⅠ(sp-4)pPelB质粒进行提取,并采用NdeⅠ和XbaⅠ限制性核酸内切酶对这两个质粒分别双酶切,再用T4DNA连接酶进行连接,双酶切和连接体系如下:
双酶切体系20μL如下:
37℃温育4h,1.5%琼脂糖凝胶电泳鉴定酶切结果并回收酶切片段;
连接体系10μL如下:
双酶切后的76P基因 4.5μL
双酶切后的pColdⅠ(sp-4)载体 1.5μL
H2O 2.5μL
45℃温育5min,冷却至室温,使酶切的目的基因和载体进行粘端退火连接,然后加入10×连接缓冲液1μL,T4DNA连接酶0.5μL,16℃连接16h;
重组质粒经CaCl2法转化入E.coli DH5α感受态菌株中,在含有100μg/mL Amp的卢-贝(Luria-Bertani,LB)固体培养基中筛选后,挑取单克隆在含有100μg/mL Amp的LB液体培养基中扩增培养,提取pColdⅠ(sp-4)-76P质粒,再用1%琼脂糖凝胶电泳进行酶切鉴定;
pColdⅠ(sp-4)-76P质粒为4587bp,由其物理图谱(图4)可知表达的76P氨基端被转录增强元件(translation enhancing element,TEE)、6×组氨酸标签(6×His-Tag)和凝血酶切位点(Factor Ⅹasite)所表达肽段保护,使其不能发挥穿膜作用而在胞浆内高效表达。由限制性内切酶NdeⅠ和XbaⅠ单、双酶切后1%琼脂糖凝胶电泳鉴定(图5)结果可知pColdⅠ(sp-4)-76P质粒构建成功;
3)Se-CuZn-76P的表达和蛋白切割
将pColdⅠ(sp-4)-76P质粒和pMzaF质粒共转化入E.coli BL21(DE3)selB:cysE51感受态菌株中,建立成SPP表达系统,然后采用半胱氨酸缺陷表达法表达和纯化。从转化平板上挑取阳性单克隆接种20mL LB,含 100μg/mL Ampicillin,50μg/mL Kanamycin培养基中,37℃振荡培养过夜,将过夜的种子液接种于500mL M9 expression medium 1,含100μg/mL Ampicillin,100μg/mL Kanamycin,50μg/mL Cys培养基中,37℃振荡培养,当菌体的OD600达到1.0时,加入诱导剂IPTG使其终浓度达到1mM,37℃诱导10min,再加入Chloramphenicol终浓度为34μg/mL,37℃振荡培养5min后,6000rpm离心10min,弃上清液,菌体用与培养基等体积的0.9%NaCl重悬,6000rpm离心10min,弃上清液,重复洗涤一次,6000rpm离心15min,再次收集菌体,重悬于500mL M9 expression medium 2,含100μg/mL Ampicillin,100μg/mL Kanamycin培养基中,同时加入利福平至终浓度为400mg/L,37℃振荡培养5h。离心收集菌体,于50mM,Tris-HCl(pH7.5)缓冲液中反复洗涤两次,重悬于4倍体积的50mM,Tris-HCl,pH7.5溶液中,加入蛋白酶抑制剂PMSF,溶于100μg/mL异丙醇,冰浴下超声破碎菌体,15000rpm离心30min,收集上清液;
M9expression medium 1:6g/L Na2HPO4;3g/L KH2PO4;0.5g/L NaCl;1g/L NH4Cl;400μM H3BO4;30μM CoCl2;10μM CuSO4;80μM MnCl2;10μM ZnSO4;10μM FeCl3;18种常见氨基酸,无Cys,各100μg/mL;1%甘油;0.4%葡萄糖;2mM MgSO4或50μg/mL半胱氨酸盐酸盐;硫胺素(VB1)5μg/mL;
M9expression medium 2:10g/L K2HPO4;1g/L NH4Cl;10mg/L CaCl2;3.6mg/L FeCl2;429mg/L MgAc;2g/L NaAc;丙氨酸、谷氨酸、谷氨酰胺、精氨酸、甘氨酸各400μg/mL;天门冬氨酸、天门冬酰胺、甲硫氨酸、组氨酸各250μg/mL;异亮氨酸、亮氨酸、赖氨酸、脯氨酸、苏氨酸、缬氨酸、酪氨酸各100μg/mL;色氨酸50μg/mL;丝氨酸1600μg/mL;0.5%甘油;0.2%蔗糖;胞嘧啶、鸟苷、脲嘧啶各125μg/mL,胸腺嘧啶50μg/mL;胺素(VB1)50μg/mL;烟酸50μg/mL;生物素100ng/mL;硒代胱氨酸200mg/L;
经Cys缺陷型表达后,把菌液6000rpm离心收集,弃上清,沉淀重悬于25mM,Tris-HCl,pH8.0缓冲液中,清洗3次后,超声破碎,留上清,用醋酸调pH值为5.2~5.4。加入终浓度为0.1mM的CuSO4室温放置1h,然后加入终浓度为0.1mM的ZnSO4室温放置30min,用25mM Tris-HCl缓冲液再次调整pH值为8.0,超滤浓缩后,蛋白上清经DEAE阴离子交换柱层析,用10倍柱体积的0~100mM NaCl洗脱,目的蛋白出现在20mM NaCl的洗脱液中,收集洗脱峰,用10mM PBS透析后,分别用截留分子量5KD和10KD的Millipore超滤离心管超滤,浓缩,用Tricine-SDS-PAGE鉴定目的肽;
在表达0,12,24,48,72,96,120h时6000rpm离心10min收集沉淀;用50mM Tris-HCl,pH 8.0缓冲液中反复洗涤两次,重悬于4倍体积的50mM Tris-HCl,pH 8.0溶液中,冰浴下超声破碎菌体,15000rpm离心30min后收集上清液,用0.45mm滤膜过滤,考马斯亮蓝G-250方法测定表达蛋白浓度,用2%(w/w)的凝血酶对表达蛋白进行酶切,反应条件23℃,24h,用截留分子为3kDa的Milliproe超滤离心管收集目的肽,冻干备用,获得76肽。
pColdⅠ(sp-4)-76P质粒在含有SPP系统的E.coli BL21cysE51表达,Tricine-SDS-PAGE实验结果(图6)初步证明的结果发现在表达的第2天即可表达较纯的可溶性蛋白,理论分子量为10.8kDa,说明以Se-CuZn-76P为主体的可溶性蛋白可以在SPP系统成功表达,表达的可溶性蛋白经凝血酶FactorⅩa切割和超滤纯化后获得暴漏出穿膜肽的Se-CuZn-76P,理论分子量为9.3kDa;
4)Se-CuZn-76P的酶活力和元素含量测定
利用试剂盒测定Se-CuZn-76P的GPx和SOD活力,采用原子吸收分光光度法测定Cu2+和Zn2+的含量,采用氢化物原子荧光光谱法测定硒含量。
经检测Se-CuZn-76P的GPx活力为109U/mg protein,SOD活力为1218U/mg protein,每分子Se-CuZn-76P中含Se、Cu、Zn原子各1个,这些指标均与Se-CuZn-65P相当,但与天然酶相比,Se-CuZn-76P的GPx活力和SOD活力依然比较低,见表1。
表1 Se-CuZn-76P的SOD活力、GPx活力和Se、Cu、Zn元素含量
5)Se-CuZn-76P穿膜实验
采用Kawamura法将FITC荧光素标记于Se-CuZn-76P的氨基端,生成FITC-Se-CuZn-76P,经Sephadex G-25凝胶层析除去未结合的荧光素。制备的FITC-Se-CuZn-76P加入0.01%叠氮化钠后冻干保存。标记后的鉴定:用紫外分光光度计测定FITC-Se-CuZn-76P在495nm和280nm处的吸光度值(absorbance,A),A495/A280比值在0.3~1.0范围内表示FITC成功标记在蛋白质上。将肝L02细胞接种于6孔板中(5×103细胞/孔),用含10%FBS的RPMI-1640培养液在37℃,5%CO2环境中培养,待细胞贴壁后,加入0.2g/L的FITC-Se-CuZn-76P,继续培养1、2、4、8h。分别在各个时间点上收集细胞,破碎细胞后利用试剂盒测定细胞内GPx和SOD活力。在第8h时间点上,弃去培养液,加入10mg/L DAPI和25μmol/L DiI两种染液,在37℃下孵育10min,然后用0.02mol/L pH7.4磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗5遍,加入2%多聚甲醛固定15min,激光共聚焦显微镜下观察细胞染色。
测定FITC-Se-CuZn-76P的A495/A280比值为0.43,说明Se-CuZn-76P已被FITC成功标记。采用激光共聚焦显微镜在放大100倍状态下观察FITC-Se-CuZn-76P进入细胞的情况(图7)发现Se-CuZn-76P可以在TAT序列的协助下可穿透细胞膜而进入细胞。同时测定穿膜过程中细胞内GPx和SOD变化(图5)也发现,随着Se-CuZn-76P对L02细胞作用的时间延长,细胞内GPx和SOD活性增加,在第8h时间点上细胞内GPx和SOD活性分别为23.49U/mg protein和83.05U/mg protein,为L02细胞正常水平的1.65和4.12倍,这也可从侧面证明Se-CuZn-76P穿过了细胞膜。
6.统计学方法
应用SPSS13.0统计软件进行统计学分析,各项指标检测数据以平均值±标准差(±SD)表示。图中结果可以看出Se-CuZn-76P兼具GPx和SOD双酶活性(图8)。
结论:本发明将SOD和GPx催化活性中心和蛋白穿膜结构域的氨基酸序列结合,以原有工作为基础,构建了新型的一种兼具细胞膜穿透效应和双抗氧化物酶活性的76肽,实验也证明,76肽不但具有较高的SOD和GPx双酶活性,同时具有穿透生物膜的能力,Se-CuZn-76P的成功获得,不仅为构建抗氧化协同作用的模拟酶领域提供了一个新策略,也将对阐明酶的催化机制,探讨蛋白质结构与功能的关系有重要科学意义,并具有重大的药物应用前景。
- 还没有人留言评论。精彩留言会获得点赞!