一种菊芋酶解发酵产乙醇过程中膜蒸馏原位分离乙醇的方法与流程
本发明涉及一种菊芋酶解发酵产乙醇过程中膜蒸馏原位分离乙醇的方法,属于生物质水解、发酵领域。
背景技术:
在菊芋发酵的过程中,生成的乙醇通过以下三种方式对发酵体系产生抑制:对酵母细胞生长的抑制、对糖发酵产醇反应的抑制(即产物抑制)、对酵母细胞的毒害作用。
将膜分离技术应用在发酵液中抑制物质的提取已有一些报道,在进行发酵液中丁醇的分离时,一般采用渗透汽化技术,因为丁醇的沸点要高于水,采用真空膜蒸馏技术只能进行丁醇溶液的浓缩,馏出液中水的浓度是高于丁醇浓度的。而对于发酵液中生物质乙醇的分离多采用膜蒸馏的方式来进行,虽然与渗透汽化相比,真空膜蒸馏对乙醇的分离因子往往较低,但是通量却更大。antonia等在2014年时对真空膜蒸馏及气扫式膜蒸馏进行乙醇原位分离的研究进行了比较,采用乙醇和水配比成模拟发酵液。实验结果表明,真空膜蒸馏对乙醇的分离具有更高的通量,这是因为真空膜蒸馏的气相通过膜孔的驱动力更高,真空膜蒸馏及气扫式膜蒸馏对乙醇的分离因子相当,但气扫式膜蒸馏被认为更易操作和能耗更低。
技术实现要素:
本发明的目的是为了对菊芋发酵液中的乙醇进行分离以便减小抑制作用,从而提高糖醇转化率的问题,提供一种菊芋酶解发酵产乙醇过程中膜蒸馏原位分离乙醇的方法。
本发明的目的是通过下述技术方案实现的。
一种实现快速菊芋酶解的方法,将酵母直接接种至菊芋料液中,得到混合溶液,本方法将产酶和水解环节耦合,能够实现快速菊芋酶解。(二耦合)
所述混合溶液中的水解液或料渣作为种子植入新一批次的菊芋料液中进行第二批次产酶水解耦合;重复此过程,即再取第二批次的水解液/料渣做为种子植入下一批次的菊芋料液中进行第三批次的耦合过程,实现连续接种的多批次产酶水解耦合工艺。
所述酵母为该酵母发酵后产生的酶能够对菊芋进行水解的酵母;
所述酵母包括克鲁维酵母;
所述菊芋料液的制备方法为将菊芋粉末溶解在水中。
当酵母处于对数成长期的,取混合溶液中的固态物质(料渣)直接接种至新的待水解的菊芋料液中,即可继续对菊芋进行水解。
所述对数成长期为酵母接种至菊芋料液中12-28h时。
固态物质的最佳接种量为1-10%(v/v)。
一种菊芋酶解耦合酿酒酵母发酵制备乙醇的方法,酶解耦合发酵工艺(ssf):将酵母直接接种至菊芋料液中,实现产酶水解耦合,得到料液;在产酶水解耦合工艺进行一段时间后,将料液移入发酵罐,再向发酵罐中加入复水活化后的酿酒酵母。(三耦合)
耦合发酵开启时间为8-20h。
一种菊芋酶解发酵产乙醇过程中膜蒸馏原位分离乙醇的方法,将酵母直接接种至菊芋料液中,实现产酶水解耦合,得到料液;在产酶水解耦合工艺进行一段时间后,将料液移入发酵罐,再向发酵罐中加入复水活化后的酿酒酵母,进行发酵产醇,定时取样检测发酵液中还原糖、总糖和乙醇浓度的变化;当所产乙醇达到预定浓度时,开启真空膜蒸馏操作,进行乙醇的原位分离。(四耦合)
实现所述一种菊芋酶解发酵产乙醇过程中膜蒸馏原位分离乙醇的方法的装置,包括:料液罐1、进料泵2、流量计3、膜组件4、冷凝管5、馏出液收集瓶6、缓冲瓶7、真空泵8、温度传感器9、压力传感器10、真空表11和测控柜12;
装有菊芋发酵液的料液罐1置于控温的水浴锅中,当进料泵2开启时,发酵液通过进料泵2先后流经控制阀和转子流量计3进入膜组件4,再流回料液罐1中。流量计3和膜组件4之间的管路上设置有温度传感器9和压力传感器10;料液在经过膜组件4时,受膜两侧各组分压差的推动,挥发性组分以气体的形式通过膜孔,到达渗透侧,继而经过冷凝管5,被冷凝并流至馏出液收集瓶6。在膜组件4的入口处设有温度传感器9,进行温度的检测和控制;膜组件4的出口处装有一个温度传真空表11,能够观察到膜蒸馏渗透侧的真空度并进行调节。在冷凝管5与馏出液收集瓶6的连接处装有一个带有真空阀的玻璃燕尾,通过此燕尾可以在不影响膜蒸馏真空条件的情况下进行馏出液的连续取样。真空泵8与膜组件4蒸汽透过侧连接产生真空条件,并通过连接在真空泵8与膜组件4蒸汽透过侧之间的缓冲瓶7的真空阀调节真空度;测控柜12用于采集温度传感器9和压力传感器10传递的数据,并调节水浴锅的温度。所述管路均用保温材料包裹,以减小管路散热导致的热量损失。
所述复水活化后的酿酒酵母包括安琪酿酒酵母;
当产酶水解的乙醇含量到3-8wt%时开启膜蒸馏体系。
所述菊芋料液的浓度为5wt%至40wt%;
有益效果
1、菊芋发酵产乙醇的膜蒸馏原位分离方法,首次构建了产酶-水解-发酵-原位分离“四耦合工艺”,利用真空膜蒸馏技术将菊芋发酵料液中的乙醇进行原位分离,降低乙醇浓度,减弱抑制作用,推动发酵反应的快速进行。研究着重讨论了各步骤之间的耦合时间对发酵产醇的影响,结果表明,对于18wt%的菊芋料液,开启耦合膜蒸馏较佳时间为23.5h,在连续两次开启膜蒸馏进行乙醇原位分离后,体系的乙醇收率可达到98.9%,远高于不耦合真空膜蒸馏时的84.8%,整个“四耦合工艺”的运行周期也由传统发酵所需的上百小时缩短为为34h。并且所构建的利用菊芋高效产醇的四耦合工艺生产全程无污染,不产生环境负担,所有原料最终均可回归自然,属清洁生产技术。
2、所述装置可以进行菊芋发酵液中乙醇的有效分离,对于15wt%的菊芋发酵清液其最大通量和最佳分离因子可分别达到10.5kgh-1m-2和6.5;
3、菊芋发酵液的中固形物组分虽然导致膜蒸馏通量的降低,却能够增加料液湍动、减弱浓差极化、提高分离选择性,使分离因子由6.5提高到8;
4、膜蒸馏过程产生的膜污染为可逆膜污染,不会带来分离膜的大量消耗。
附图说明
图1为不同浓度菊芋水解液的发酵曲线,菊芋浓度:10wt%(a),15wt%(b),20wt%(c);
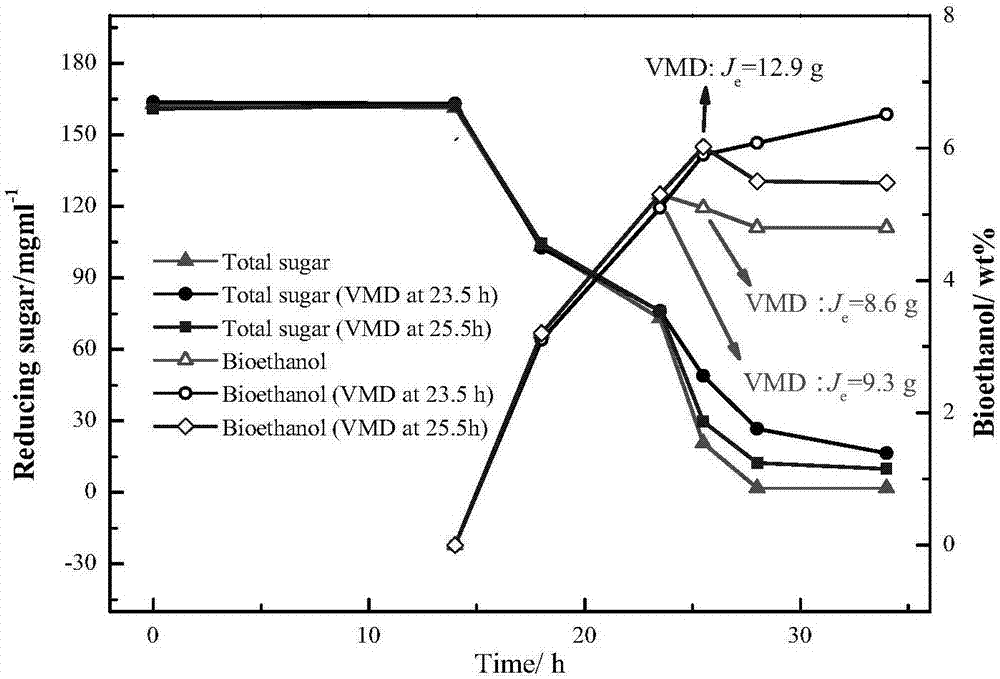
图2为18wt%菊芋料液的四耦合曲线;
图3为真空膜蒸馏设备示意图;
图4为实施例1的菊芋料液发酵制乙醇的四耦合工艺路线;
图5为耦合时间不同的15wt%菊芋料液产醇曲线;10h-3%(a),10h-4%(b),14h-3%(c),14h-4%(d):其中10h-3%代表在产酶水解过程进行至第10h时开始耦合发酵,当测定到发酵液乙醇浓度达3wt%时再开启膜蒸馏。
其中,1—料液罐;2—进料泵;3—流量计;4—膜组件;5—冷凝管;6—馏出液收集瓶;7—缓冲瓶;8—真空泵;9—温度传感器;10—压力传感器;11—真空表;12—测控柜;
具体实施方式
下面结合附图与实施例对本发明作进一步说明。
实施例1
真空膜蒸馏对发酵产乙醇的原位分离:当菊芋料液的“二耦合”过程进行至一定时间,加入复水活化的安琪酿酒酵母,移入发酵罐,进行发酵产醇,定时取样检测发酵液中还原糖、总糖和乙醇浓度的变化。当所产乙醇达到一定浓度时,开启真空膜蒸馏操作,进行乙醇的原位分离。每次膜蒸馏的操作时间为2h,每隔30min更换馏出液收集瓶,测量渗透通量和馏出液中的乙醇浓度,膜蒸馏操作完毕后,将通过计算得到的馏出液中水的质量补加至体系中,测定补水后料液中的糖含量和乙醇浓度。如图4所示。
在采用15wt%的菊芋料液作为原料时,分别在产酶水解耦合进行至10h,14h时开始发酵耦合,并分别在体系中乙醇达到3wt%,4wt%时开启膜蒸馏操作,测样和补水后继续进行发酵。并对不同耦合工艺下体系中的各项参数进行了比较。
结果如图5所示,耦合了vmd的发酵体系在进行膜蒸馏2h并补水后,乙醇浓度略有下降。继续在40℃下进行发酵。最后计算得到发酵终点时,10h-4%与14h-4%体系的乙醇产量分别可达到理论值的97.5%和98%。结果表明,真空膜蒸馏对乙醇的原位分离能够有效促进发酵反应的进行,提高乙醇收率。对于15wt%的菊芋料液,在进行“四耦合工艺”生产乙醇的时候,14h仍为较合适的开启发酵耦合的时间。
在18wt%菊芋料液“三耦合工艺”中乙醇生产进入平台期时开启耦合膜蒸馏。在生产工艺进行至第23.5h时开启膜蒸馏,此时体系中乙醇浓度已达到5wt%,膜蒸馏运行时间为2h,在第25.5h时,开启第二次膜蒸馏,仍然运行2h。
图2为18wt%菊芋料液耦合真空膜蒸馏开启时间不同时体系中总糖和产醇曲线的变化。对于乙醇含量达到6wt%时开启膜蒸馏的体系,真空膜蒸馏得到的乙醇质量为12.9g,加上料液中的乙醇32.6g,共计44.5g,达到理论产醇的94.9%;对于连续在23.5h和25.5h进行两次膜蒸馏得到的乙醇质量分别为9.3g和8.6g,加上料液中的乙醇28.5g,共计46.4g,达到理论产醇的98.9%。可以看到,对于18wt%的菊芋料液四耦合工艺同样适用,并且耦合周期也控制在了34h内,这个时间远远短于传统的分步发酵法,而未耦合膜蒸馏操作的发酵体系在第34h时产醇只达到了理论产醇的84.8%。
本发明所用膜蒸馏冷凝装置为冷凝管,冷凝水采用为低温自来水,所以并不能达到冷凝co2的效果,进入到膜蒸馏渗透侧的co2气体会被直接吸入真空泵。与真空膜蒸馏的耦合不仅能够进行料液中乙醇的原位分离,降低料液中乙醇浓度,推动发酵的进行,还能够达到一定的消泡效果,降低料液中另一种产物co2的浓度,利于料液中co2分子的逸出,减少料液中co2对酿酒酵母细胞的负面影响。
表4为本发明提出的各耦合工艺与传统分步发酵法在生产周期和乙醇收率上的比较,可以看到,随着耦合步骤的增多,生产周期逐渐缩短,而乙醇收率在耦合了真空膜蒸馏之后得到了有效的提高。
表4菊芋制乙醇不同工艺生产周期与乙醇收率比较
本发明提出的菊芋制乙醇“四耦合工艺”整个生产过程中,涉及到的原料只含有纯菊芋,水,食品级的乳酸克鲁维酵母,可食用的安琪酿酒酵母四种。获得的产物有生物质乙醇(生产过程中已被分离收集),菊芋发酵料渣即发酵工业中的“酒糟”(含有纤维素,两种酵母,未完全水解的多糖,未完全发酵的还原糖,微量副产物如甘油、有机酸)。酒糟中的干物质含有粗蛋白20-30%,粗纤维10-20%,可以用来生产scp(单细胞蛋白,singlecellprotein),又称微生物蛋白或菌体蛋白。除此之外,菊芋发酵料渣还可以用来当做有机肥料,进行堆肥或直接埋于农田深处待其自行发酵,可以增强土壤疏松性和提高土壤肥力,或者利用菊芋发酵料渣来进行沼气的生产。可见,本论文提出的菊芋发酵产乙醇的“四耦合工艺”属一种清洁生产技术,“清洁生产”的概念由联合国环境署工业与环境规划行动中心(unepec/pac)于1989年5月首次提出,是实现可持续发展的先决条件。在此工艺中,不产生有毒有害的产品,不使用有毒有害的原料,不对环境造成危害;所有产物为可降解产物,不会造成环境负担;还能够废物利用,进行深度能源开发;工艺过程中采用的膜分离技术为低能耗分离过程,符合节能减排原则。
实施例2
如图3所示,装有菊芋发酵液的料液罐置于控温的水浴锅中,当进料泵开启时,发酵液通过进料泵先后流经控制阀和转子流量计进入膜组件,再流回料液罐中。料液在经过膜蒸馏组件时,受膜两侧各组分压差的推动,挥发性组分以气体的形式通过膜孔,到达渗透侧,继而经过冷凝管,被冷凝并流至收集瓶。此装置所有管路均用保温材料包裹,以减小管路散热导致的热量损失。在膜组件的入口处设有温度传感器,进行温度的检测和控制;膜组件的出口处装有一个温度传真空表,可以观察到膜蒸馏渗透侧的真空度并进行调节。在冷凝管与收集瓶的连接处装有一个带有真空阀的玻璃燕尾,通过此燕尾可以在不影响膜蒸馏真空条件的情况下进行馏出液的连续取样。
每隔30min更换收集瓶以进行通量的测定,再取出部分馏出液进行乙醇质量分数的测定。膜蒸馏通量通过公式(1)计算,乙醇质量分数通过气相色谱采用外标法进行测定。分别选取料液温度46、48、50℃来进行菊芋发酵清液的膜蒸馏操作,流量选用50lh-1和80lh-1。观察不同浓度的菊芋发酵料液在不同膜蒸馏操作参数下的通量和分离因子的变化。对比菊芋发酵清液和菊芋带渣发酵液的膜蒸馏分离效果来观察发酵液中固形物对菊芋发酵液膜蒸馏过程的影响,并尝试在40℃对带渣菊芋发酵液进行真空膜蒸馏的操作,观察膜通量和分离因子随真空度的变化。膜通量和乙醇的分离因子分别通过公式1和2来计算。
式中,m为馏出液的质量,单位:g;a为有效膜面积,单位:m2;t为取样时间,单位:h;α为分离因子;ωp为渗透侧乙醇质量分数;ωf为原料中乙醇质量分数。
采用贝士德仪器科技(北京)有限公司的泡压法滤膜孔径分析仪测定平板膜的平均孔径分布。首先剪取一元硬币大小的ptfe平板膜,用porofil浸润液(表面张力:16dyn/cm)充分浸泡润湿。再把润湿后的膜片置于不锈钢网格上,保证膜片平整,将装有膜片的不锈钢网放在样品池内,压上密封垫圈,拧紧上盖。开启n2阀门,设置通气速率为0.005lmin-1,最终压力为10bar,开始测试。测试完毕给出孔径的分布报告。
膜疏水性能测试采用data-physicsoca-15e接触角测量仪(dataphysicsinstrumentsgmbh,filderstadt,germany)中的座滴法(sessiledropmethod)来测量膜表面的静态水接触角(wca)。液滴在膜表面稳定10s后抓拍其测试图片,然后通过软件计算其接触角。在测定原膜的接触角之前须将平板膜小心取出,浸泡于乙醇中,在室温下震荡洗涤24h,将制膜过程中残留在膜表面的物质进行去除,在50℃烘箱中烘干后再进行测定。每次实验需要在同一长条行膜片的不同位置选取5个点进行平行测量,然后取平均值,即为该膜的接触角。分别采用纯水、5wt%乙醇/水溶液和15wt%菊芋发酵清液作为参照液体进行接触角的测试。
采用型号为jsm-7401f(日本电子株式会社)的场发射扫描电镜(sem)分析膜的表面形貌。测试前需用导电胶把制备好的膜样品固定在样品台上,放在高真空蒸发器中进行喷金处理10分钟。
将污染后的平板膜用去离子水反复冲洗,烘干后再次用sem进行表面形貌的观察,发现膜污染已经彻底被清洗掉,已经无法观察到污染物的存在。对清洗后的分离膜再次进行了孔径分布的测试,清洗后的ptfe膜实测泡点孔径0.345μm,最小孔径0.176μm,平均孔径0.246μm。测试结果表明,并没有大量的污染物进入膜孔道,造成孔径的缩小或孔道的堵塞。对清洗后膜进行了接触角的测量,采用5wt%的乙醇/水溶液做参照液,测得接触角为129°±1.3°,与原膜的130°±2.2°接近,说明分离膜的疏水性也得到恢复。这些结果表明只需要用去离子水对发生污染的ptfe平板膜进行冲洗即可将膜污染移除。这说明对于本发明中的发酵体系,产生的膜污染为可逆膜污染,能够通过去离子水的冲刷进行再生,不会因为膜污染导致分离膜的使用成本增高。
实施例3
酿酒酵母的复水活化:将干酵母置于10倍以上的2wt%葡萄糖水溶液中(此葡萄糖水溶液需进行高温高压灭菌并冷却,即置于高温蒸汽灭菌锅中在121℃下灭菌20min,然后冷却至室温)在36~38℃下复水15~20分钟,再置于34℃以下活化1h,然后以5‰(w/w)的比例添加到发酵体系中进行发酵。
分步糖化发酵(shf):将产酶水解耦合工艺的水解料液灭菌后移入自制发酵罐中,再加入5‰(w/w)的酿酒酵母,在40℃下进行发酵,每隔一定时间取样,离心后测定上清液的还原糖,总糖及乙醇浓度,离心条件为8000rpm,5min。
同步糖化发酵,即酶解耦合发酵工艺(ssf):将克鲁维酵母直接接种至菊芋料液中,实现产酶水解耦合,得到料液;在产酶水解耦合工艺进行到10h、14h以及18h后,将料液移入发酵罐,以5‰(w/w)的比例加入复水活化后的酿酒酵母,在40℃下进行发酵,每隔一定时间取样,离心后测定上清液的还原糖,总糖及乙醇浓度,离心条件为8000rpm,5min。
在酿酒酵母加入菊芋水解液后,水解液中的糖分被酵母吸附并渗入细胞内,经过酵母细胞内各种酶的作用快速发酵,产生乙醇、co2和能量,能量的一部分被酿酒酵母用作细胞新陈代谢的能源,余下的部分和乙醇及co2一起通过细胞膜排出细胞外。生成的乙醇和co2会快速渗透到周围介质中,当co2在发酵液中的溶解达到饱和时,就会附着在酿酒酵母细胞的表面,直至超过细胞的吸附力。当气泡逐渐增大,产生的浮力克服了细胞重力时,气泡就带着细胞上浮,直至气泡破裂,co2被释放到发酵罐的上层气相空间,随着排气管排出发酵罐,而酿酒酵母细胞则留在发酵液中慢慢下沉。由于co2的上升,带动了发酵液中酵母细胞的移动,增加了酵母细胞与糖的接触,有助于加速糖的发酵。
三种浓度(10wt%,15wt%,20wt%)菊芋水解液的发酵曲线如图1所示。菊芋水解液发酵产醇的过程可以分为三个阶段:(1)前发酵期,当酿酒酵母刚加入菊芋水解液的时候,体系中酵母细胞的浓度不大,在经过短暂的停滞期后,酿酒酵母开始繁殖,此时发酵液中含有一定的溶解氧,营养成本也比较充分,所以酿酒细胞开始迅速繁殖,发酵作用不强。这时发酵液的表面很平静,观察不到明显的气泡产生。(2)主发酵期,经过前发酵期酿酒酵母细胞的大量繁殖,细胞密度已经较高,发酵作用增强,大量生成乙醇,co2的释放带动发酵料液上下翻动,还原糖浓度快速下降。(3)后发酵期,此时菊芋水解液中的大部分糖已经被酿酒酵母用来发酵产醇,发酵速率减慢,观察到的气泡逸出速度也很慢,产生的热量也大为减少。各浓度发酵液最终的乙醇收率及残糖见表2。
不同浓度菊芋水解液在第36h的残糖量和乙醇收率列于表2中。可以看出,体系中的残糖量随着菊芋浓度的增高而升高,但乙醇的“实际产醇/理论产醇”值随着菊芋浓度的增高而下降。这是因为虽然发酵时乙醇从酵母细胞排出后以非常快的速度渗透到周围介质中,但是随着发酵的进行,料液主体中乙醇浓度逐渐升高,最终会达到产生抑制的程度。体系中乙醇浓度越高,对发酵反应的抑制作用越强,乙醇收率越低。
表2第36h发酵体系残糖和乙醇收率
可知,shf的发酵终点选为36h,而ssf工艺的发酵终点选为50h。在这里,shf的36h只含有发酵一个步骤,而ssf的50h却包括了酵母产酶、菊芋水解、糖的发酵三个步骤。
表3shf与ssf工艺的发酵终点各项指标比较
从表3所列实验结果可以看出,通过将产酶过程耦合入发酵工艺,成功改善了产物抑制导致的水解率下降。
实施例4
克鲁维酵母在纯菊芋提取物中的培养:取一环保存在yepd平板培养基上的克鲁维酵母,接种至装有100ml灭菌冷却后的2wt%菊芋提取物的250ml锥形瓶中,在30℃下振荡培养,转速为170rpm。每隔一段时间取出3ml培养液,使用紫外可见分光光度计在600nm下进行od600的测定,测定所采用的空白样为未进行克鲁维酵母培养的菊芋提取物溶液。
克鲁维酵母产酶及菊芋酶解过程的耦合(cbp):取一环保存在yepd平板培养基上的克鲁维酵母,直接接种至装有100ml10wt%菊芋料液的250ml容器中。在30℃下振荡培养,转速为170rpm。此步称为对产酶、水解环节的第一次整合生物工艺(thefirstconsolidatedbioprocessing,cbp)。每隔一定时间取样,离心后测定上清液的还原糖,总糖,菊粉酶活力。离心条件:8000rpm,5min。
在耦合过程的前10个小时,因为体系中菊粉酶的含量较低,无法进行准确的测定,但是从菊粉酶酶活测量曲线可以看到,克鲁维酵母在菊芋料液中培养时能够快速的产酶,并且在培养后期仍呈现出一个快速的上升趋势,在整个耦合工艺过程中,克鲁维酵母保持着良好的产酶能力,使得体系中不断有高活力的菊粉酶被生产出来,参与到水解反应中去,从体系的还原糖变化曲线也可以得到相同的结果,耦合过程中还原浓度不断增加,并维持增高趋势直至24h后达到一个稳定期,此时的菊粉水解率已达到91.2%。通过对体系中的总糖浓度进行测定,发现在耦合工艺过程中并未观察到总糖浓度的明显降低,证明克鲁维酵母并未消耗大量的还原糖。
- 还没有人留言评论。精彩留言会获得点赞!