一种氟苯尼考胺人工抗原的合成方法与流程
本发明涉及一种氟苯尼考胺人工抗原的合成方法,属于生物化工技术领域。
背景技术:
氟苯尼考是替代禁用药物氯霉素的一种理想的药物,现已广泛应用于水产养殖的防病抗病上。尽管氟苯尼考毒性低于氯霉素,但由于不正确或超量的使用,势必造成氟苯尼考在畜禽水产品中的残留,特别是现已出现了对氟苯尼考耐药的菌株,而且氟苯尼考的用量呈上升的趋势,这对人类的身体健康造成了潜在的威胁。氟苯尼考在动物组织中的主要代谢产物为氟苯尼考胺( florfenicol amine,FFA) ,许多国家以氟苯尼考胺作为使用氟苯尼考的残留标示物。我国规定氟苯尼考残留标示物为氟苯尼考胺,欧洲药品管理局(EMA)确定的残留标示物则为FF+FFA,其在不同动物肌肉组织中的最大残留限量值MRL为100~300μg/kg。因此,研究氟苯尼考胺残留监控技术对保障我国人民身体健康和水产品食用安全具有重要意义。
酶联免疫法(ELISA)是一种极为高效、敏感、快速的检测方法,然而得到高亲和力和高特异性的单克隆单体是免疫学检测的前提,其中人工抗原的合成是其中重要的一步。
技术实现要素:
本发明的目的是提供一种氟苯尼考胺人工抗原的合成方法,所制备的产品用于氟苯尼考胺免疫分析方法研究,为今后人们的研究提供了很好的人工抗原。
本发明的技术方案:一种氟苯尼考胺人工抗原的合成方法,其由氟苯尼考与4-溴丁酸苄酯、20% H2SO4、K2CO3、NH3.CH3OH反应得到具有羧基的产物,即半抗原FFA-2,用碳二亚胺法将半抗原FFA-2与载体蛋白偶联,即得到氟苯尼考胺人工抗原;步骤为:
(1)半抗原FFA-2的合成:
合成路线如下:
称取10.0g(28.0mmol)FF溶于150mL乙酸中, 在10℃下逐滴地加入120 mL 20% H2SO4溶液中,然后在110℃下搅拌3h,再冷却至室温,并调节pH至14,混合物通过萃取吸收(EA)技术提取, 再用Na2SO4浓缩干燥,得到白色固体FFA 5.0g(20.2mmol),摩尔产率72.4%。
称取500.0mg(2.02mmol)FFA和335mg(2.42 mmol)K2CO3溶于5mL乙腈中,加入624 mg(2.42 mmol)4-溴丁酸苄酯,在50℃下搅拌过夜,然后将混合物倒入水中, 通过萃取吸收(EA)技术提取,再用Na2SO4浓缩干燥,得到粗产物;再将粗产物用硅胶柱纯化,得到白色固体FFA-1 805mg(1.90mmol,),摩尔产率94.0%。
称取805 mg(1.90 mmol )FFA-1,用8.00 mL、2 M NH3.CH3OH溶解,在室温下搅拌过夜,混合物用DCM清洗浓缩,得到白色固体FFA-2 271 mg(0.81mmol),摩尔产率42.8%。
(2)完全抗原的制备:步骤(1)制备的半抗原FFA-2,与KLH偶联得到偶联物完全抗原FFA-2-KLH;或与BSA偶联得到偶联物完全抗原FFA-2-BSA。
步骤(2)所述完全抗原FFA-2-KLH制备方法如下:
a、称取步骤(1)中制得的2.2mg FFA-2,1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐5mg,N-羟基琥珀酰亚胺3mg,用400μL无水N,N-二甲基甲酰胺溶解,室温搅拌反应4-5h,称为A液;取匙孔血蓝蛋白KLH 0.735mL(6.8mg/mL, FFA-2与KLH摩尔比为6000︰1),加入等体积硼酸缓冲溶液,称为B液;在室温条件,逐滴将A液加入到B液中,室温反应过夜,即得偶联物FFA-2-KLH混合液;
b、透析:取8cm的透析袋,于沸水中煮沸10min,再用50℃的去离子水冲洗2min,保存在4℃去离子水中备用;将偶联物FFA-2-KLH混合液装入透析袋于0.01mol/L的PBS中透析3天,每天换液3次,即得完全抗原FFA-2-KLH。
步骤(2)所述完全抗原FFA-2-BSA制备方法如下:
a、称取步骤(1)中制得的1.5mg FFA-2,1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐4mg,N-羟基琥珀酰亚胺2.5mg,用250μL无水N,N-二甲基甲酰胺溶解,室温搅拌反应4-5h,称为A液;称取5mg 牛血清蛋白BSA(FFA-2与BSA摩尔比为60︰1),溶解于1mL碳酸钠/碳酸氢钠缓冲溶液中,加入等体积硼酸缓冲溶液,称为B液;在室温条件,逐滴将A液加入到B液中,室温反应过夜,即得偶联物FFA-2-BSA混合液;
b、透析:取8cm的透析袋,于沸水中煮沸10min,再用50℃的去离子水冲洗2min,保存在4℃去离子水中备用;将偶联物FFA-2-BSA混合液放入透析袋于0.01mol/L的PBS中透析3天,每天换液3次,即得完全抗原FFA-2-BSA。
氟苯尼考胺人工抗原的鉴定
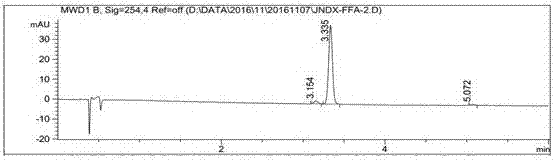
(1)采用核磁共振和液质联用技术鉴定半抗原。
(2)人工抗原采用紫外法鉴定其偶联结果,利用偶联物中小分子与蛋白的浓度,计算其偶联比。
偶联比测定:估算偶联物中被偶联的两种分子的比率(偶联比率)的方法,虽然测定方法种类很多,但都是依据检测偶联物中被偶联的两种分子含量(或相对含量)的原理建立起来的。紫外法是依据合成的人工抗原中的小分子浓度与蛋白浓度的比确定偶联比的。
偶联物蛋白浓度测定:将反应前蛋白的质量除以透析后偶联物的体积即得到偶联物中蛋白的含量。
偶联物中小分子浓度的测定:浓度为Xμg/mL的小分子在特征峰处的吸光值A1,偶联物在特征峰处的吸光值A2,小分子的分子量为M,所以,偶联物中小分子的浓度= ( A2×X)/ A1
偶联比=(( A2×X)/ A1/M)/(蛋白浓度/蛋白分子量)×(稀释倍数)
本发明的有益效果:本发明成功合成了氟苯尼考胺的人工抗原,合成步骤简洁、有效,完全可用于免疫分析中,为以后人们的研究提供了方便的途径。
附图说明
图1半抗原FFA-2的NMR鉴定图。
图2半抗原FFA-2的LC-MS鉴定图,为FFA-2的色谱图。
图3半抗原FFA-2的LC-MS鉴定图,为FFA-2的质谱图。
图4 FFA-2-KLH人工抗原的免疫原紫外鉴定图。
图5 FFA-2-BSA人工抗原的免疫原紫外鉴定图。
具体实施方式
实施例1 半抗原FFA-2的合成
称取10.0g(28.0mmol)FF溶于150mL乙酸中, 在10℃下逐滴地加入120 mL、20% H2SO4,然后在110℃下搅拌3h,再冷却至室温,并调节pH至14,混合物通过萃取吸收(EA)技术提取, 再用Na2SO4浓缩干燥,到白色固体FFA 5.0g(20.2mmol),摩尔产率72.4%。
称取500.0mg(2.02mmol)FFA和335mg(2.42 mmol)K2CO3溶于5mL乙腈中,加入624 mg(2.42 mmol)4-溴丁酸苄酯,在50℃下搅拌过夜,然后将混合物倒入水中, 通过萃取吸收(EA)技术提取, 再用Na2SO4浓缩干燥,得到粗产物。再将粗产物用硅胶柱纯化,得到白色固体FFA-1 805mg(1.90mmol),摩尔产率94.0%。
称取805 mg(1.90 mmol)FFA-1,用8.00 mL、2 M NH3.CH3OH溶解,在室温下搅拌过夜,混合物用DCM清洗浓缩,得到白色固体FFA-2 271 mg(0.81mmol),摩尔产率42.8%。
(2)完全抗原的制备:步骤(1)制备的半抗原FFA-2,与KLH偶联得到偶联物完全抗原FFA-2-KLH;或与BSA偶联得到偶联物完全抗原FFA-2-BSA。
实施例2 所述完全抗原FFA-2-KLH制备方法如下:
a、称取步骤(1)中制得的2.2mg FFA-2,1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐5mg,N-羟基琥珀酰亚胺3mg,用400μL无水N,N-二甲基甲酰胺溶解,室温搅拌反应4-5h,称为A液。取匙孔血蓝蛋白KLH 0.735mL(6.8mg/mL, FFA-2与KLH摩尔比为6000︰1),加入等体积硼酸缓冲溶液,称为B液。在室温条件,逐滴将A液加入到B液中,室温反应过夜,即得偶联物FFA-2-KLH混合液;
b、透析:取8cm的透析袋,于沸水中煮沸10min,再用50℃的去离子水冲洗2min,保存在4℃去离子水中备用;将偶联物FFA-2-KLH混合液装入透析袋于0.01mol/L的PBS中透析3天,每天换液3次,即得完全抗原FFA-2-KLH。
实施例3所述完全抗原FFA-2-BSA制备方法如下:
a、称取步骤(1)中制得的1.5mg FFA-2,1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐4mg,N-羟基琥珀酰亚胺2.5mg,用250μL无水N,N-二甲基甲酰胺溶解,室温搅拌反应4-5h,称为A液。称取5mg 牛血清蛋白BSA(FFA-2与BSA摩尔比为60︰1),溶解于1mL碳酸钠/碳酸氢钠缓冲溶液中,加入等体积硼酸缓冲溶液,称为B液。在室温条件,逐滴将A液加入到B液中,室温反应过夜,即得偶联物FFA-2-BSA混合液;
b、透析:取8cm的透析袋,于沸水中煮沸10min,再用50℃的去离子水冲洗2min,保存在4℃去离子水中备用;将偶联物FFA-2-BSA混合液放入透析袋于0.01mol/L的PBS中透析3天,每天换液3次,即得完全抗原FFA-2-BSA。
实施例4 氟苯尼考胺人工抗原的鉴定
(1)采用核磁共振和液质联用技术鉴定半抗原。
(2)人工抗原采用紫外法鉴定其偶联结果,利用偶联物中小分子与蛋白的浓度,计算其偶联比。
偶联比测定:估算偶联物中被偶联的两种分子的比率(偶联比率)的方法,虽然测定方法种类很多,但都是依据检测偶联物中被偶联的两种分子含量(或相对含量)的原理建立起来的。紫外法是依据合成的人工抗原中的小分子浓度与蛋白浓度的比确定偶联比的。
偶联物蛋白浓度测定:将反应前蛋白的质量除以透析后偶联物的体积即可得到偶联中蛋白的含量。
实施例2中FFA-2-KLH免疫原的紫外鉴定图如图4所示。
实施例3中FFA-2-BSA免疫原的紫外鉴定图如图5所示。
FFA-2免疫原偶联物中小分子浓度的测定: 浓度为0.05mg/mL的小分子在特征峰267nm处的吸光值A1= 0.501,偶联物在267nm处的吸光值A2=0.412,小分子的分子量为333.3g/mol,所以,偶联物中小分子的浓度 =(0.412×0.05mg/mL)/ 0.501=0.041mg/mL;BSA浓度2mg/mL,BSA分子量67000。
偶联比=(0.041mg/mL/333.3)/(2mg/mL /67000)×3(稀释倍数)=12.4。
- 还没有人留言评论。精彩留言会获得点赞!