一种海洋低温超氧化物歧化酶提取分离工艺的制作方法
本发明涉及海洋生物制品的高值化开发技术领域,特别涉及一种海洋低温超氧化物歧化酶提取分离工艺。
背景技术:
超氧化物歧化酶(superoxidedismutase,ecl.15.1.1,简称sod)是一类广泛存在于生物体内的金属酶,能够催化超氧阴离子自由基和氢离子反应形成过氧化氢和分子氧,从而清除生物体内的氧自由基,起到保护生物体免受伤害作用。1969年mccord和fridovich发现该酶生物催化活性并命名为超氧化物歧化酶。按其结合的金属种类不同,可将其分为三类:一类是蓝绿色的cu,zn-sod,相对分子量约32000,主要存在于真核细胞的胞液和叶绿体中,是目前研究最多、最深入的一类;第二类是紫红色的mn,fe-sod,相对分子量约40000,主要存在于原核生物细胞及线粒体的基质中;第三类是黄褐色的fe-sod,相对分子量约为38700,主要存在于原核细胞及一些植物中。
sod作为生物酶制剂,医疗上主要用于辅助放疗与化疗,肾、肝、心脏等器官的保护和移植,消除辐射引起的副作用,以及作为某些疾病的探针等;食品工业作为添加剂应用于饮料和啤酒等。近年来sod被广泛用于治疗氧中毒、老年性白内障、糖尿病、心血管疾病、各种炎症等多种疾病。几十年来sod一直是国内外研究热点,起初阶段多集中于从动物血液或组织中提取sod,到中期阶段微生物发酵生产sod的研究开始起步并日渐增多,到目前为止微生物生产sod已然成为研究的主体。但多为中、高温sod,最适作用温度一般在45℃以上,而人体的生理温度一般为36.5~37℃,致使微生物发酵生产的中、高温sod不能充分发挥作用,出现治疗效果差或没有效果。低温sod最适作用温度一般为35~40℃,比较接近人体的生理温度,应用于治疗效果比较明显。但低温sod产业化、规模化生产及应用还未见报道。鉴于动物血液来源困难及微生物发酵生产的中、高温sod最适作用温度的局限性,利用微生物发酵生产的低温sod具有很大的应用优势。低温sod在自然环境温度下具有高酶活力及高催化效率,且对热敏感,经过温和的热处理即可使低温酶的活力丧失,如果将sod应用于食品工业从而大大缩短处理过程的时间并省却昂贵的加热或冷却费用,且不影响产品品质,这将有助于低温sod的推广和使用。可从根本上摆脱繁琐的提取工艺及中、高温酶的加热、冷却设备和流程,在提高得率及酶活性的同时降低能耗及生产成本。鉴于低温sod在自然和生理条件下的优势,低温sod在医疗保健、食品、化妆品等方面拥有更加广泛的应用前景和开发潜力。
技术实现要素:
本发明的目的是提供一种海洋低温超氧化物歧化酶的提取分离工艺,以微生物为原料进行发酵,生产周期短,操作简单,便于保存和运输,且生产成本低,不易霉变和虫蛀,安全性及稳定性高,产品得率高,易于规模化生产,具有广泛应用前景。
本发明通过以下方法实现,提供一种海洋低温超氧化物歧化酶的提取分离工艺,利用海洋细菌菌体提取纯化低温超氧化物歧化酶。
所述的海洋低温超氧化物歧化酶的提取分离工艺过程是:将海洋细菌破壁离心得到粗酶液,经硫酸铵沉淀、超滤浓缩,sephadexg-100柱层析、喷雾干燥,得到外观微带浅蓝绿色、酶活力576.83u/mg的低温超氧化物歧化酶。
上述的海洋低温超氧化物歧化酶的提取分离工艺,所述粗酶液的制备方法为:通过无菌操作,将活化好的海样菌株接种到液体发酵培养基中,于20℃,160r/min发酵48h,发酵菌液于4℃,6000r/min离心30min,得到湿菌体,4℃,6000r/min离心30min,湿菌体用磷酸缓冲液溶解,于480w超声波冰浴下破碎30min(破碎5s,间隔5s),破碎后,4℃,12000r/min离心15min,上清即为粗酶液,上述液体发酵培养基配方百分比为:葡萄糖2.0,酵母膏0.5,陈海水配制,ph自然。
上述的海洋低温超氧化物歧化酶的提取分离工艺,所述硫酸铵沉淀的方法为:制备6份25ml粗酶液,分别向其中加入固体冷硫酸铵,使其饱和溶液浓度分别20%、30%、40%、50%、60%、70%、80%、90%,4℃盐析16h,ph7.8磷酸缓冲液溶解沉淀蛋白,确定低温超氧化物歧化酶活性最高硫酸铵盐析条件。
所述冷硫酸铵是将硫酸铵冷至-20℃。
上述的海洋低温超氧化物歧化酶的提取分离工艺,所述超滤浓缩方法为:将盐析完成样品转入经过预处理的截留分子量10kda超滤管,4℃,6000r/min,超滤30min,去除so42-和部分小分子蛋白,移液枪小心取出浓缩液,4℃,保藏备用,部分溶于磷酸缓冲液,测定低温超氧化物歧化酶酶活力,计算蛋白回收率。
上述的海洋低温超氧化物歧化酶的提取分离工艺,所述sephadexg-100柱层析方法为:用ph7.8磷酸缓冲液平衡sephadexg-100凝胶柱,待基线平衡后,取2ml超滤后酶液加入ph7.8磷酸缓冲液平衡过的sephadexg-100凝胶柱(ф1.6cm×60cm),调节设置自动收集器,每管收集2ml左右。根据显示器上的洗脱峰,确定含sod酶各管,收集并测定其酶活力,合并含酶活力各管,4℃,保藏备用。
上述的海洋低温超氧化物歧化酶的提取分离工艺,所述喷雾干燥的参数设置为进口温度110℃、出口温度为60℃、压力位2kgf/cm2、液体流速为5ml/min。
上述的海洋低温超氧化物歧化酶的提取分离工艺,所述喷雾干燥中的保护剂中海藻糖、蔗糖、海藻酸钠的用量为2%-5%,可溶性淀粉的用量为6%-8%,保护剂的总用量控制在10%以内。
上述的海洋低温超氧化物歧化酶的提取分离工艺,所述海洋细菌为海黏假交替单胞菌、海假交替单胞菌、栖珊瑚假交替单胞菌。
附图说明
图1为本发明海洋低温超氧化物歧化酶分离纯化结果;
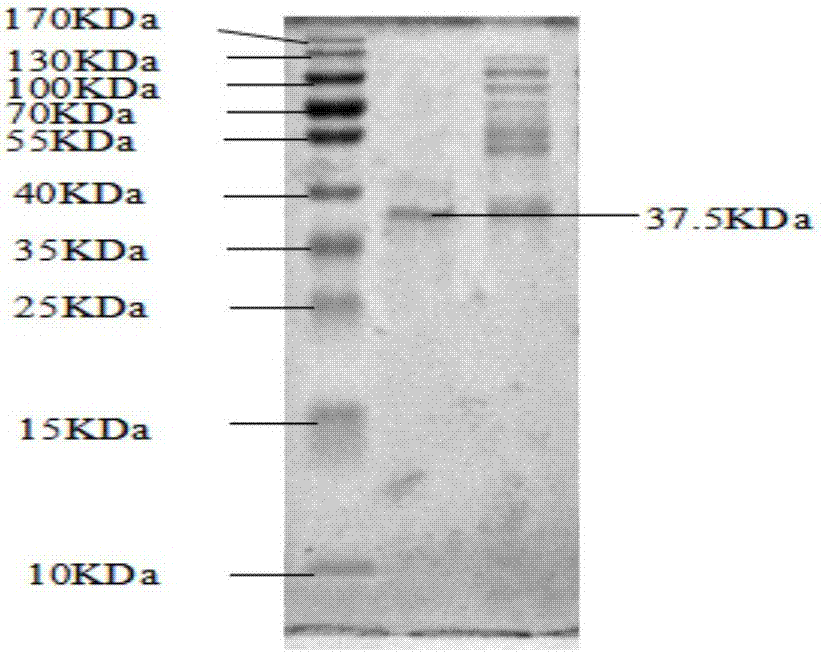
图2为本发明海洋低温超氧化物歧化酶聚丙烯酰胺凝胶电泳结果;
图3为本发明海洋低温超氧化物歧化酶酶类型鉴定结果。
具体实施方式
结合具体实施方式对说明书做进一步说明。
实施例1
所述的一种海洋低温超氧化物歧化酶的提取分离工艺,包括以下步骤:
1.粗酶液的制备:1l海洋细菌海黏假交替单胞菌pseudoalteromonasmariniglutinosa(编号:1.8476,中科院微生物研究所菌种保藏中心)发酵液得到50克酵母菌菌泥,用蒸馏水洗涤2-3次,4℃,6000r/min离心30min,得到湿菌体,4℃,6000r/min离心30min,湿菌体用磷酸缓冲液溶解,于480w超声波冰浴下破碎30min(破碎5s,间隔5s),破碎后,4℃,12000r/min离心15min,上清即为粗酶液,上述液体发酵培养基配方百分比为:葡萄糖2.0,酵母膏0.5,陈海水配制,ph自然。
2.硫酸铵沉淀:制备6份25ml粗酶液,分别向其中加入固体冷硫酸铵,使其饱和溶液浓度分别20%、30%、40%、50%、60%、70%、80%、90%,4℃盐析16h,ph7.8磷酸缓冲液溶解沉淀蛋白,确定sod活性最高硫酸铵盐析条件。
3.超滤浓缩:将盐析完成样品转入经过预处理的截留分子量10kda超滤管,4℃,6000r/min,超滤30min,去除so42-和部分小分子蛋白,移液枪小心取出浓缩液,4℃,保藏备用,部分溶于磷酸缓冲液,测定低温超氧化物歧化酶酶活力,计算蛋白回收率。
4.sephadexg-100柱层析:用ph7.8磷酸缓冲液平衡sephadexg-100凝胶柱,待基线平衡后,取2ml超滤后酶液加入ph7.8磷酸缓冲液平衡过的sephadexg-100凝胶柱(ф1.6cm×60cm),调节设置自动收集器,每管收集2ml左右。经蛋白含量测定和低温超氧化物歧化酶酶活性测定,将含低温超氧化物歧化酶活性高的洗脱液合并,即可得到高活力的低温超氧化物歧化酶酶液20ml,总酶活为576.83u/mg。最后用聚丙酰胺凝胶电泳鉴定超氧化物歧化酶的酶纯度,结果见图2;经酶类型鉴定为铜锌超氧化物歧化酶,结果见图3。
5.喷雾干燥:其参数设置为进口温度110℃、出口温度为60℃、压力位2kgf/cm2、液体流速为5ml/min。喷雾干燥中的保护剂中海藻糖、蔗糖、海藻酸钠的用量为2%-5%,可溶性淀粉的用量为6%-8%,保护剂的总用量控制在10%以内。
实施例2
所述的一种海洋低温超氧化物歧化酶的提取分离工艺,包括以下步骤:
1.粗酶液的制备:1l海洋细菌海假交替单胞菌pseudoalteromonasmarina(编号:1.10151,中科院微生物研究所菌种保藏中心)发酵液得到50克酵母菌菌泥,用蒸馏水洗涤2-3次,4℃,6000r/min离心30min,得到湿菌体,4℃,6000r/min离心30min,湿菌体用磷酸缓冲液溶解。于480w超声波冰浴下破碎30min(破碎5s,间隔5s)。破碎后,4℃,12000r/min离心15min,上清即为粗酶液,上述液体发酵培养基配方百分比为:葡萄糖2.0,酵母膏0.5,陈海水配制,ph自然。
2.硫酸铵沉淀:制备6份25ml粗酶液,分别向其中加入固体冷硫酸铵,使其饱和溶液浓度分别20%、30%、40%、50%、60%、70%、80%、90%,4℃盐析16h,ph7.8磷酸缓冲液溶解沉淀蛋白,确定低温超氧化物歧化酶活性最高硫酸铵盐析条件。
3.超滤浓缩:将盐析完成样品转入经过预处理的(截留分子量10kda)超滤管,4℃,6000r/min,超滤30min,去除so42-和部分小分子蛋白,移液枪小心取出浓缩液,4℃,保藏备用,部分溶于磷酸缓冲液,测定低温超氧化物歧化酶酶活力,计算蛋白回收率。
4.sephadexg-100柱层析:用ph7.8磷酸缓冲液平衡sephadexg-100凝胶柱,待基线平衡后,取2ml超滤后酶液加入ph7.8磷酸缓冲液平衡过的sephadexg-100凝胶柱(ф1.6cm×60cm),调节设置自动收集器,每管收集2ml左右。经蛋白含量测定和低温超氧化物歧化酶酶活性测定,将含低温超氧化物歧化酶活性高的洗脱液合并,即可得到高活力的低温超氧化物歧化酶酶液20ml,总酶活为576.83u/mg。最后用聚丙酰胺凝胶电泳鉴定超氧化物歧化酶的酶纯度,结果见图2;经酶类型鉴定为铜锌超氧化物歧化酶,结果见图3。
5.喷雾干燥:其参数设置为进口温度110℃、出口温度为60℃、压力位2kgf/cm2、液体流速为5ml/min。喷雾干燥中的保护剂中海藻糖、蔗糖、海藻酸钠的用量为2%-5%,可溶性淀粉的用量为6%-8%,保护剂的总用量控制在10%以内。
实施例3
所述的一种海洋低温超氧化物歧化酶的提取分离工艺,包括以下步骤:
1.粗酶液的制备:1l海洋细菌栖珊瑚假交替单胞菌pseudoalteromonasparagorgicola(编号:1.10153,中科院微生物研究所菌种保藏中心)发酵液得到50克酵母菌菌泥,用蒸馏水洗涤2-3次,4℃,6000r/min离心30min,得到湿菌体,4℃,6000r/min离心30min,湿菌体用磷酸缓冲液溶解。于480w超声波冰浴下破碎30min(破碎5s,间隔5s)。破碎后,4℃,12000r/min离心15min,上清即为粗酶液,上述液体发酵培养基配方百分比为:葡萄糖2.0,酵母膏0.5,陈海水配制,ph自然。
2.硫酸铵沉淀:制备6份25ml粗酶液,分别向其中加入固体冷硫酸铵,使其饱和溶液浓度分别20%、30%、40%、50%、60%、70%、80%、90%,4℃盐析16h,ph7.8磷酸缓冲液溶解沉淀蛋白,确定低温超氧化物歧化酶活性最高硫酸铵盐析条件。
3.超滤浓缩:将盐析完成样品转入经过预处理的(截留分子量10kda)超滤管,4℃,6000r/min,超滤30min,去除so42-和部分小分子蛋白,移液枪小心取出浓缩液,4℃,保藏备用,部分溶于磷酸缓冲液,测定低温超氧化物歧化酶酶活力,计算蛋白回收率。
4.sephadexg-100柱层析:用ph7.8磷酸缓冲液平衡sephadexg-100凝胶柱,待基线平衡后,取2ml超滤后酶液加入ph7.8磷酸缓冲液平衡过的sephadexg-100凝胶柱(ф1.6cm×60cm),调节设置自动收集器,每管收集2ml左右。经蛋白含量测定和低温超氧化物歧化酶酶活性测定,将含低温超氧化物歧化酶活性高的洗脱液合并,即可得到高活力的低温超氧化物歧化酶酶液20ml,总酶活为576.83u/mg。最后用聚丙酰胺凝胶电泳鉴定超氧化物歧化酶的酶纯度,结果见图2;经酶类型鉴定为铜锌超氧化物歧化酶,结果见图3。
5.喷雾干燥:其参数设置为进口温度110℃、出口温度为60℃、压力位2kgf/cm2、液体流速为5ml/min。喷雾干燥中的保护剂中海藻糖、蔗糖、海藻酸钠的用量为2%-5%,可溶性淀粉的用量为6%-8%,保护剂的总用量控制在10%以内。
实施例4
低温超氧化物歧化酶活性的测定
在试管中分别按照表1加入0.1mol/ltris-hcl缓冲液、双蒸水、低温超氧化物歧化酶酶液、10mmol/lhcl,于20℃恒温20min后,在样品管和对照管中加入20℃预热过的邻苯三酚(邻苯三酚添加量以邻苯三酚自氧化速率为0.07/min为基准),迅速摇匀,立即用移液枪将样品移入石英比色杯中,在波长325nm处每30s测定一次吸光值,共测3min,结果见图1。
表1邻苯三酚自氧化法测定低温sod加样表
v1:反应液总体积,ml;v2:测定样品体积,ml;n:样品稀释液倍数;
oda:邻苯三酚自氧化速率;odb:样品od值变化速率
实施例5
蛋白质含量测定标准曲线
采用bradford法,以牛血清蛋白为标准蛋白,绘制标准蛋白曲线测定酶液蛋白质含量。
①标准bsa溶液
②染料试剂:100mg考马斯亮蓝g-250,50ml乙醇(95%),磷酸(85%),用水稀释成1l,过滤备用。
③按下表加入相应试剂,5min测定595nm处吸光值。
表2蛋白浓度标准曲线
以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!