III型聚酮合酶及其编码基因和用途的制作方法
本发明涉及一种酶及其编码基因和用途,尤其涉及一种iii型聚酮合酶及其编码基因和用途。
背景技术:
沉香为名贵中药,始载于梁代陶弘景《名医别录》,列为上品,其味辛、苦,性微温。有行气止痛、温中止呕、纳气平喘的功效。沉香为沉香属植物经雷电、火烧、病虫害感染后自身防御反应产生的树脂,在东南亚国家,如印尼、马来西亚、泰国、越南、缅甸等国,也有瑞香科其他属植物产生的树脂作为沉香使用。《中国药典》2015年版一部收载的沉香为瑞香科植物白木香[aquilariasinensis(lour.)gilg]含脂的木材,主产于广东、海南、广西等地,又称土沉香,香树,女儿香,莞香。沉香自古以来不仅是一种名贵中药,而且由于其具有特殊的芳香气味,一直作为名贵熏香和香料使用,名列“沉檀龙麝”四大香料之首,市场需求量一直很大。长期以来,在经济利益的驱使下,乱砍乱伐以及自然灾害使得白木香野生资源大量减少,已经被国家列为二级保护野生植物,已载入《中国植物红皮书》和《广东省珍稀濒危植物图谱》。为了缓解沉香资源的紧缺,我国广东、海南、广西、福建等省区发展了白木香的大规模种植,并针对沉香的人工结香方法,国内外也进行了大量的研究,以期解决自然条件下沉香形成缓慢这一瓶颈问题。虽然目前已经发展出了多种人工结香的方法,很大程度上改善了自然结香缓慢的情况,但由于沉香形成的分子机制还不明确,因此,目前采用的人工诱导加速结香技术,有时会造成白木香树体的死亡或结香效率低甚至不结香等问题。
2-(2-苯乙基)色酮是沉香的特征性成分之一,其含量高低与沉香的质量密切相关。2015版《中华人民共和国药典》中关于沉香的质量控制,也以2-(2-苯乙基)色酮类化合物作为控制指标。目前,关于2-(2-苯乙基)色酮类化合物的生物合成机制及其相关的调控基因的研究尚属空白。研究该类成分的生物合成途径,阐明调控其合成的相关基因,对于阐明沉香的形成机制及建立高效的人工结香方法具有重要意义。
技术实现要素:
本发明的第一目的是提供一种iii型聚酮合酶,能够催化合成二芳基戊二酮化合物如5-(4-羟基苯基)-1-苯基-1,3-戊二酮、(e)-5-(4-羟基苯基)-1-苯基-4-烯-1,3-戊二酮等的合成,为阐明沉香中2-(2-苯乙基)色酮化合物的生物合成机制研究奠定基础。 并为制备该类化合物及其类似物提供新方法。
本发明的第二目的是提供所述iii型聚酮合酶的用途,最直接的用途是作为苄基丙酮合成酶和/或类姜黄素合成酶,进一步可以用来制备苄基丙酮化合物及姜黄素、二去甲氧基姜黄素、二去甲氧基四氢姜黄素等二芳基庚二酮化合物。
本发明的第三目的是提供一种与沉香的形成相关的iii型聚酮合酶基因,其参与调控沉香特征成分2-(2-苯乙基)色酮类化合物的合成,能够为结香机制及结香方法研究提供新途径。
本发明的第四目的是提供所述基因的用途,涉及利用该基因测定沉香生成效率、制备人工结香液、构建转基因组织(植株)等相关方面的用途。
本发明提供一种iii型聚酮合酶,所述iii型聚酮合酶具有如下(a)或(b)的氨基酸序列:
(a)seqidno:14所示的氨基酸序列,
(b)在(a)的氨基酸序列中经过取代、缺失或添加一个或几个氨基酸的由(a)衍生的氨基酸序列。
根据本发明所述的iii型聚酮合酶,优选地,所述iii型聚酮合酶具有所述(b)的氨基酸序列且保留有seqidno:14所示的氨基酸序列的如下位点:cys164、his303和asn336,位点序号为紫花苜蓿medicagosativachs的p30074序列中相应的氨基酸编号,p30074序列如seqidno:15所示。
本发明也提供上述iii型聚酮合酶的用途,所述iii型聚酮合酶用于催化合成苄基丙酮、二芳基庚二酮化合物或者二芳基戊二酮化合物。
根据本发明所述的iii型聚酮合酶的用途,优选地,所述iii型聚酮合酶用于催化以下反应之一:
(1)催化对羟基肉桂酰辅酶a与丙二酰辅酶a产生具有c6-c4骨架的对羟基亚苄基丙酮和双去甲氧基姜黄素;
(2)催化3-芳基取代丙(烯)酰辅酶a与丙二酰辅酶a生成二芳基庚二酮类化合物;
(3)催化3-芳基取代丙(烯)酰辅酶a与丙二酰辅酶a、苯甲酰辅酶a反应生成二芳基戊二酮类化合物,
其中,所述3-芳基取代丙(烯)酰辅酶a为3-芳基取代丙酰辅酶a或3-芳基取代丙烯酰辅酶a。
根据本发明所述的iii型聚酮合酶的用途,优选地,所述3-芳基取代丙(烯)酰辅酶a的芳基选自未取代的苯基、吲哚基、吡啶基、吡咯基或呋喃基,或者所述3-芳基取代丙(烯)酰辅酶a的芳基选自环上氢原子被羟基、甲氧基或卤素原子取代的苯基、吲哚基、吡啶基、吡咯基或呋喃基。
本发明也提供一种基因,所述基因为编码上述iii型聚酮合酶的基因。
根据本发明所述的基因,优选地,所述的基因具有如seqidno:1所示的碱基序列或其简并序列。
本发明还提供上述基因的用途,利用所述基因构建生物工程菌或植物组织。
本发明还提供上述基因在测定沉香生成效率方面的用途,通过测定产沉香的植物组织中所述基因的表达量,表征沉香的相对生成效率。
本发明还提供上述基因的用途,将所述的基因应用于人工结香液、转基因组织或转基因植物中,以提高沉香的生成效率或质量。
本发明提供的iii型聚酮合酶是首次从诱导后的白木香愈伤组织中成功克隆并表达的iii型聚酮合酶,其在体外具有催化活性,同时具有苄基丙酮合成酶和类姜黄素合成酶的活性,催化合成苄基丙酮和姜黄素、二去甲氧基四氢姜黄素等二芳基庚二酮化合物。此外,所述iii型聚酮合酶可以催化合成具有c6-c5-c6骨架的二芳基庚二酮化合物,这类化合物能够进一步被转化生成沉香特征成分2-(2-苯乙基)色酮。因此,本发明提供的iii型聚酮合酶为体外合成二芳基庚(戊)二酮化合物及类似物提供了绿色的合成方法,为阐明沉香特征性成分2-(2-苯乙基)色酮的生物合成途径奠定基础。本发明提供的编码所述iii型聚酮合酶的基因,能用于测定白木香等产香植物的沉香生成效率;能够应用于相关人工结香液、转基因组织或转基因植物中,以提高沉香的生成效率或质量;还能够用于构建生物工程菌,用于制备苄基丙酮、二芳基庚(戊)二酮化合物及类似物。本发明提供的iii型聚酮合酶及其编码基因和用途对阐明沉香形成的分子机制、建立高效的人工结香方法、体内(外)快速合成制备苄基丙酮、二芳基庚(戊)二酮化合物及类似物具有重要意义。
附图说明
图1为本发明的iii型聚酮合酶aspks1氨基酸序列与另几种iii型聚酮合酶序列比对图;
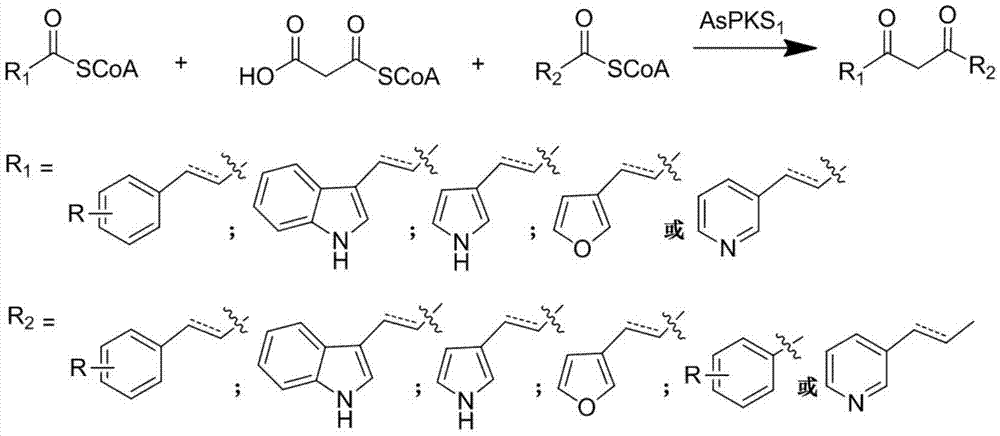
图2为本发明的iii型聚酮合酶aspks1所催化的反应式;
图3为aspks15′-race所得片段的琼脂糖凝胶电泳图;
图4为aspks1全长cdna的琼脂糖凝胶电泳图;
图5为本发明异源表达得到的iii型聚酮合酶aspks1的sds-page电泳图;
图6~9为本发明异源表达得到的iii型聚酮合酶aspks1所催化的反应式;
图10a~d为实时荧光定量pcr分析nacl诱导白木香愈伤组织240h内aspks1基因表达量与2-苯乙基色酮产量的关系的柱状分析图。
具体实施方式
下面结合附图以及具体实施例对本发明作进一步的说明,但本发明的保护范围并不限于此。
本发明所述的“序列a具有序列b”中的“具有”,并不排除序列a还含有其它序列,例如,本发明所述的基因具有如seqidno:1所示的orf序列,是指,所述基因可以为如seqidno:1所示的orf序列,也可以为如seqidno:2所示的cdna序列。关于蛋白,“具有”一词为同样含义。
<iii型聚酮合酶>
本发明提供的iii型聚酮合酶,具有如下(a)或(b)的氨基酸序列:
(a)seqidno:14所示的氨基酸序列,
(b)在(a)的氨基酸序列中经过取代、缺失或添加一个或几个氨基酸的由(a)衍生的氨基酸序列。
本发明提供的具有(a)的氨基酸序列的iii型聚酮合酶命名为aspks1。
aspks1氨基酸序列在ncbi中blast比对相似度最高的是两个白木香中的查耳酮合成酶序列,分别在93%和66%。将aspks1氨基酸序列与另几种iii型聚酮合酶氨基酸序列比对,相似性结果如图1所示。图1中的几种iii型聚酮合酶氨基酸序列的来源分别为m.schs(紫花苜蓿medicagosativachs2,序列如seqidno:15所示,ncbi编号为p30074);r.pbas(大黄rheumpalmatumbas,序列如seqidno:16所示,ncbi编号为aak82824);c.ldcs(姜黄curcumalongadcs,序列如seqidno:17所示,ncbi编号为bah56225.1);c.lcurs(姜黄curcumalongacurs1,序列如seqidno:18所示,ncbi编号为c0svz6.1);o.scus(水稻oryzasativacus,序列如seqidno:19所示,ncbi编号为q8lil0.2);aspks1(白木香aquilariasinensispks1,序列如seqidno:14所示)。图1中标记了iii型聚酮合酶保守的催化活性中心氨基酸位点(cys164,his303,andasn336,位点序号为紫花苜蓿chs中相应的氨基酸编号)和能够调控活性腔大小的关键氨基酸位点:thr132,thr197,phe265,ser338,glu192,phe215,gly256,位点序号为紫花苜蓿chs中相应的氨基酸编号)。
aspks1具有iii型聚酮合酶保守的cys-his-asn三联体催化活性中心。在aspks1中一些能够控制酶催化活性腔大小的氨基酸位点如thr132、thr197、phe265和ser338(数字为紫花苜蓿chs中相应的氨基酸编号)则相应的被ser、asn、pro和phe所代替,这表明aspks1可能具有特殊的催化活性。
<iii型聚酮合酶的用途>
本发明提供的所述的iii型聚酮合酶的用途为,催化合成苄基丙酮、二芳基庚二酮化合物或者二芳基戊二酮化合物。二芳基庚二酮化合物如姜黄素、二去甲氧基姜黄素等;二芳基戊二酮化合物如5-(4-羟基苯基)-1-苯基-1,3-戊二酮、(e)-5-(4-羟基苯基)-1-苯基-4-烯-1,3-戊二酮。
根据本发明提供的所述iii型聚酮合酶的用途,优选地,催化以下反应之一:
(1)催化对羟基肉桂酰辅酶a与丙二酰辅酶a产生具有c6-c4骨架的对羟基亚苄基丙酮和双去甲氧基姜黄素;如图6所示,本发明的iii型聚酮合酶aspks1能够催化1分子对羟基肉桂酰辅酶a与1分子丙二酰辅酶a缩合产生具有c6-c4骨架的对羟基亚苄基丙酮,同时催化2分子对羟基肉桂酰辅酶a与1分子丙二酰辅酶a缩合产生双去甲氧基姜黄素。
(2)催化3-芳基取代丙(烯)酰辅酶a与丙二酰辅酶a生成二芳基庚二酮化合物;
(3)催化3-芳基取代丙(烯)酰辅酶a与丙二酰辅酶a、苯甲酰辅酶a反应生二芳基戊二酮化合物,
其中,所述3-芳基取代丙(烯)酰辅酶a为3-芳基取代丙酰辅酶a或3-芳基取代丙烯酰辅酶a。
根据本发明所述的iii型聚酮合酶的用途,优选地,所述3-芳基取代丙(烯)酰辅酶a的芳基选自未取代或环上氢原子被羟基、甲氧基或卤素原子取代的苯基、吲哚基、吡啶基、吡咯基及呋喃基。就是说,所述3-芳基取代丙(烯)酰辅酶a的芳基可以为苯基、吲哚基、吡啶基、吡咯基或呋喃基,也可以为环上氢原子被羟基、甲氧基或卤素原子取代的苯基、吲哚基、吡啶基、吡咯基或呋喃基。作为优选,所述3-芳基取代丙(烯)酰辅酶a的芳基选自未取代的苯基或苯环上氢原子被羟基或甲氧基取代的苯基。
图2对催化3-芳基取代丙酰辅酶a与丙二酰辅酶a、苯甲酰辅酶a反应生二芳基戊二酮化合物的反应进行了举例说明。
根据本发明所述的iii型聚酮合酶的用途,优选地,还催化以下反应之一:
(4)催化阿魏酰辅酶a与丙二酰辅酶a生成姜黄素和具有c6-c4骨架的3-甲氧基-4-羟基亚苄基丙酮。如图6所示,本发明的iii型聚酮合酶aspks1也可以接受阿魏酰辅酶a与丙二酰辅酶a缩合生成姜黄素(2b),并且也可以产生少量具有c6-c4骨架的3-甲氧基-4-羟基亚苄基丙酮(2a)。
(5)催化肉桂酰辅酶a与丙二酰辅酶a生成无取代姜黄素。如图6所示,在aspks1催化肉桂酰辅酶a与丙二酰辅酶a的反应中,只有无取代姜黄素(3)的生成,并没有检测到有苄基丙酮的产生。
(6)催化对羟基苯丙酰辅酶a与丙二酰辅酶a生成四氢双去甲氧基姜黄素。如图7所示,以对羟基苯丙酰辅酶a为起始底物与丙二酰辅酶a反应时,出现单一的产物四氢双去甲氧基姜黄素。
根据本发明所述的iii型聚酮合酶的用途,优选地,利用所述iii型聚酮合酶催化三种底物生成二芳基-1,3-戊二酮,其中的一种底物为对羟基苯丙酰辅酶a或对羟基肉桂酰辅酶a,另两种底物为丙二酰辅酶a和苯甲酰辅酶a。如图8和图9的反应所示。
根据本发明所述的iii型聚酮合酶的用途,优选地,利用所述iii型聚酮合酶制备2-(2-苯乙基)色酮化合物,包括以下步骤:
(1)按照所述的用途制得二芳基-1,3-戊二酮;
(2)利用所述二芳基-1,3-戊二酮生成2-(2-苯乙基)色酮。
<编码iii型聚酮合酶的基因>
编码所述iii型聚酮合酶的基因包括相关简并序列。
所述iii型聚酮合酶,具有如下(a)或(b)的氨基酸序列:
(a)seqidno:14所示的氨基酸序列,
(b)在(a)的氨基酸序列中经过取代、缺失或添加一个或几个氨基酸的由(a)衍生的氨基酸序列。
上述(b)的氨基酸序列是(a)的氨基酸经过所述突变(取代、缺失或添加一个或几个氨基酸)并具有iii型聚酮合酶活性的序列。所述“几个”为小于9,优选为小于5。
根据本发明所述的基因,优选地,具有如seqidno:1所示的碱基序列或其简并序列。seqidno:1所示的碱基序列为具有seqidno:14所示的氨基酸序列的iii型聚酮合酶aspks1的开放阅读框(orf)序列。优选地,具有如seqidno:2所示的碱基序列。seqidno:2所示的碱基序列为具有seqidno:14所示的氨基酸序列的iii型聚酮合酶aspks1的cdna序列。
aspks1的cdna序列可以用如下方法得到:提取诱导的白木香愈伤组织总rna,以带有接头的引物反转录总rna得到cdna,以cdna为模板,利用文献中所报道的iii型pks简并引物扩增核心区片段,获得核心区片段。然后进行3′-race,根据接头引物和核心区片段dna序列设计特异性引物进行巢式pcr扩增,获得特异性cdna片段。然后进行5′-race,进行5′末端的扩增。分析5′-race和3′-race所得到的cdna片段序列,设计一对带有酶切位点的特异性引物,利用该特异性引物扩增得到cdna序列全长。优选地,可以采用以下具体操作方法:提取100mg氯化钠诱导5天的白木香愈伤组织总rna,以带有接头的引物反转录总rna得到cdna (race-1),以cdna为模板,利用文献中所报道的iii型pks简并引物(112s,174s,368a,380a)扩增核心区片段,获得大小约580bp的核心区片段。然后进行3′-race,根据接头引物和核心区片段dna序列设计特异性引物进行两轮巢式pcr扩增(race-2,race-3),获得长约299bp的特异性cdna片段。然后进行5′-race,利用takara5′-race系统,以设计的5′-race特异性引物进行5′末端的扩增,得到长约821bp的特异性cdna片段(图3为其琼脂糖凝胶电泳图)。
其中,所使用的引物如下:
race-1引物序列如seqidno:3所示;
扩增核心区片段简并引物序列如seqidno:4~7所示,依次为本领域披露的引物112s、174s、368a、380a,引物前的数字表示紫花苜蓿chs中相应的氨基酸的位置;
race-2引物序列如seqidno:8~9所示;
race-3引物序列如seqidno:10~11所示;
5′-race引物序列如seqidno:12~13所示。
分析5′-race和3′-race所得到的cdna片段序列,设计一对带有酶切位点的特异性引物,序列如seqidno:12~13所示,其中seqidno:12所示的序列5'-cgcggatccatggcagcccaacctgtggagtgggtg-3'加下划线的是bamhi酶切位点序列,seqidno:13所示的序列5'-cccaagcttctatgcgtctgtgagcgttgcagtag-3'加下划线的是hindiii酶切位点序列。利用该特异性引物扩增得到约1200bp的cdna序列全长,琼脂糖凝胶电泳如图4所示。测得的序列如seqidno:2所示。
<iii型聚酮合酶基因的用途>
本发明提供的所述的基因的用途之一为,利用所述基因构建生物工程菌或植物组织。继而可以用来生产所述基因编码的iii型聚酮合酶。
本发明提供的所述的基因的用途之二为所述的基因在测定沉香生成效率方面的用途,其通过测定产沉香的植物组织中所述基因的表达量,表征沉香的相对生成效率。
本发明提供的所述的基因的用途之三,将所述的基因使用于人工结香液、转基因组织或转基因植物中,以提高沉香的生成效率或质量。
上述用途之一是利用基因生成酶的常规应用。上述应用之二和三的可行性也已得到实验验证,最重要的验证为,定量pcr实验证实了aspks1基因的表达量与2-(2-苯乙基)色酮化合物的积累量正相关。
图10a~d表示了实时荧光定量pcr分析nacl诱导白木香愈伤组织240h内aspks1基因表达量与2-苯乙基色酮产量的关系。其中,图10a表示了正常继代白木香 愈伤组织在240h内的相对细胞活力;图10b表示了nacl诱导白木香愈伤组织240h内的相对细胞活力;图10c表示了nacl诱导白木香愈伤组织240h内aspks1基因的表达量;图10d表示了nacl诱导白木香愈伤组织240h内2-苯乙基色酮ah6、ah8产生量的变化趋势。
由图10c和10d可以看出,受到伤害胁迫的白木香愈伤组织中2-(2-苯乙基)色酮的产量变化与aspks1的转录水平正相关,aspks1在120h表达量最大,此时,2-(2-苯乙基)色酮的产量增加最快;随后,aspks1的转录水平降到很低,2-苯乙基色酮的产量增长速度明显减慢。
<测试方法>
下面将详细描述本发明的实施例中所使用的测试方法。
1、琼脂糖凝胶电泳分析
样品加入含溴化乙锭(eb,ethidiumbromide)的琼脂糖凝胶中,以100v电压进行电泳分离,待样品中溴酚蓝移动到距离胶板下沿约1cm处时,停止电泳。以凝胶成像系统检测结果。
sds-page凝胶电泳分析
15μl蛋白样品经sds-page电泳(4.5%浓缩胶,10%分离胶)分离(采用美国伯乐(bio-rad)公司mini-protean3电泳槽(mini-protean3electrophoresismodule)进行)。先以90v电泳,待样品进入分离胶后,加大电压电泳至溴酚兰刚刚跑出,停止电泳。经考马斯亮蓝g50染色后,脱色。
2、实时荧光定量pcr分析(相对细胞活力/2-苯乙基色酮ah6、ah8产生量)
实时荧光定量pcr分析采用sybrgreeni荧光染料法,在美国伯乐(bio-rad)公司实时荧光定量pcr仪上进行。根据文献报道,选取白木香的actin基因作为目标基因定量表达的内参基因。每个样品设三个重复。内参基因引物序列为:act-1caaagtcaagggcaatgtagg(如seqidno:20所示);act-2cgagtgggcgtacaacag(如seqidno:21所示)。反应体系中含有10μlpcr试剂(2×
称取0.45g愈伤组织细胞,置于3ml0.04%2,3,5-三苯基氯化四氮唑(ttc)溶液中,室温下暗反应18h后,用3ml蒸馏水漂洗细胞以洗净表面残留的ttc。用5ml 95%的乙醇提取已经还原的ttc(红色),以酶标仪测定480nm处的光吸收值。以继代0小时的细胞为对照细胞,活力设为100%,计算不同细胞的相对细胞活力。
取诱导后的0.5g愈伤组织湿细胞,干燥后以3ml甲醇超声提取,用液相质谱仪lcms-it-tof(岛津,日本)分析2-(2-苯乙基)色酮ah6、ah8的产生情况。记录总离子流图中ah6、ah8的峰面积计算相对含量。
ah6、ah8的结构如下:
3、液相质谱检测:
采用液相质谱仪lcms-it-tof(岛津,日本)进行检测。检测条件为:色谱柱安捷伦eclipsexdbc18柱(250×4.6mmi.d.5μm),流速1.0ml/min,dad检测器全波长扫描,流动相采用乙腈-水梯度洗脱,洗脱系统0-10min,30%乙腈;10-20min,30-60%乙腈,20-25min,60-70%乙腈,25-30min,70-80%乙腈,30-35min,80-100%乙腈,35-40min,100%乙腈(以上乙腈的百分比浓度都为体积浓度)。
实施例1
aspks1原核表达载体构建以及异源表达
构建带有aspks1基因的原核表达质粒pet28a-aspks1,转入表达宿主大肠杆菌e.colibl21(de3)中进行异源表达。采用20℃低温诱导aspks1蛋白的表达。根据重组蛋白aspks1在n端含有一个his标签,利用镍离子亲和层析柱(ni-ntahis-bindtmresin)纯化aspks1蛋白。蛋白表达纯化结果如图5所示,可以看出镍离子亲和层析对目的蛋白的纯化可以达到很好的效果,纯化后杂蛋白很少,目的蛋白的大小约在45kd左右。经过滤膜(millipore,30kd)浓缩脱盐后得到浓度在2mg/ml以上的aspks1蛋白。
实施例2
利用实施例1得到的aspks1蛋白,催化对羟基肉桂酰辅酶a与丙二酰辅酶产生具有c6-c4骨架的对羟基亚苄基丙酮和双去甲氧基姜黄素。具体操作步骤如下:
利用镍离子亲和柱纯化后的重组蛋白aspks1进行酶反应实验。将29nmol丙二酰辅酶a,26nmol起始底物(对羟基肉桂酰辅酶a)以及37.5μg纯化的aspks1蛋 白,一起加入到500μl100mm磷酸钾缓冲液(kpb缓冲液)(ph7.0)中,于恒温水浴摇床(45℃)反应12h后加入50μl20重量%hcl终止酶反应。反应液以800μl乙酸乙酯萃取3次,合并萃取液,氮气吹干,再以50μl甲醇复溶,进液相质谱仪(lcms-it-tof)检测。通过分析高分辨质谱中一级质谱分子离子峰,二级质谱碎片离子裂解规律,预测分子式,并与标准品对照的方法鉴定酶反应的产物结构。
根据测得的产物和化学反应原理可知,本实施例的反应为,iii型聚酮合酶aspks1催化1分子对羟基肉桂酰辅酶a与1分子丙二酰辅酶a缩合产生具有c6-c4骨架的对羟基亚苄基丙酮(1a),同时催化2分子对羟基肉桂酰辅酶a与1分子丙二酰辅酶a缩合产生双去甲氧基姜黄素(1b)。相关反应式请见图6。
实施例3
利用实施例1得到的aspks1蛋白,催化阿魏酰辅酶a与丙二酰辅酶a生成姜黄素和具有c6-c4骨架的3-甲氧基-4-羟基亚苄基丙酮。
按照实施例2的具体操作步骤进行操作,将起始底物替换为阿魏酰辅酶a,其它条件和操作方法与实施例2相同。根据测得的产物和化学反应原理可知,本实施例的反应式如图6所示,即,iii型聚酮合酶aspks1催化阿魏酰辅酶a与丙二酰辅酶a缩合生成姜黄素(2b),并且产生少量具有c6-c4骨架的3-甲氧基-4-羟基亚苄基丙酮(2a)。
实施例4
利用实施例1得到的aspks1蛋白,催化肉桂酰辅酶a与丙二酰辅酶a生成无取代姜黄素(3)。
按照实施例2的具体操作步骤进行操作,将起始底物替换为肉桂酰辅酶a,其它条件和操作方法与实施例2相同。
经检测,本实施例中,aspks1催化肉桂酰辅酶a与丙二酰辅酶a的反应,只有无取代姜黄素的生成,并没有检测到有苄基丙酮的产生。
实施例5
利用实施例1得到的aspks1蛋白,催化对羟基苯丙酰辅酶a与丙二酰辅酶a生成四氢双去甲氧基姜黄素。
按照实施例2的具体操作步骤进行操作,将起始底物替换为对羟基苯丙酰辅酶a,其它条件和操作方法与实施例2相同。
根据测得的产物和化学反应原理可知,本实施例的反应式如图7所示,aspks1催 化对羟基苯丙酰辅酶a与丙二酰辅酶a反应,出现单一的产物四氢双去甲氧基姜黄素。
实施例6
利用实施例1得到的aspks1蛋白,催化对羟基苯丙酰辅酶a、丙二酰辅酶a和苯甲酰辅酶a,生成5-(4-羟基苯基)-1-苯基-1,3-戊二酮(图8)。
具体操作步骤如下:
58nmol丙二酰辅酶a,26nmol对羟基苯丙酰辅酶a,58nmol苯甲酰辅酶a以及40μg纯化的aspks1蛋白,一起加入到500μl100mmkpb缓冲液(ph7.0)中,于恒温水浴摇床中37℃反应12h后加入50μl20重量%hcl终止酶反应。反应液以800μl乙酸乙酯萃取3次,合并萃取液,氮气吹干,再以50μl甲醇复溶,进液相质谱仪(lcms-it-tof)检测。反应的产物经检测为5-(4-羟基苯基)-1-苯基-1,3-戊二酮。
实施例7
利用实施例1得到的aspks1蛋白,催化对羟基肉桂酰辅酶a、丙二酰辅酶a和苯甲酰辅酶a,生成(e)-5-(4-羟基苯基)-1-苯基-4-戊烯-1,3-二酮(图9)。
具体操作步骤如下:
58nmol丙二酰辅酶a,26nmol对羟基肉桂酰辅酶a,58nmol苯甲酰辅酶a以及40μg纯化的aspks1蛋白,一起加入到500μl100mmkpb缓冲液(ph7.0)中,于恒温水浴摇床中37℃反应12h后加入50μl20重量%hcl终止酶反应。反应液以800μl乙酸乙酯萃取3次,合并萃取液,氮气吹干,再以50μl甲醇复溶,进液相质谱仪(lcms-it-tof)检测。反应的产物经检测为(e)-5-(4-羟基苯基)-1-苯基-4-戊烯-1,3-二酮。
本发明并不限于上述实施方式,在不背离本发明的实质内容的情况下,本领域技术人员可以想到的任何变形、改进、替换均落入本发明的范围。
- 还没有人留言评论。精彩留言会获得点赞!