一种溴代烃厌氧降解菌剂的制备方法及应用与流程
本发明涉及采用生物法治理地下水污染领域,具体涉及一种溴代烃厌氧降解菌剂制备方法与应用。
背景技术:
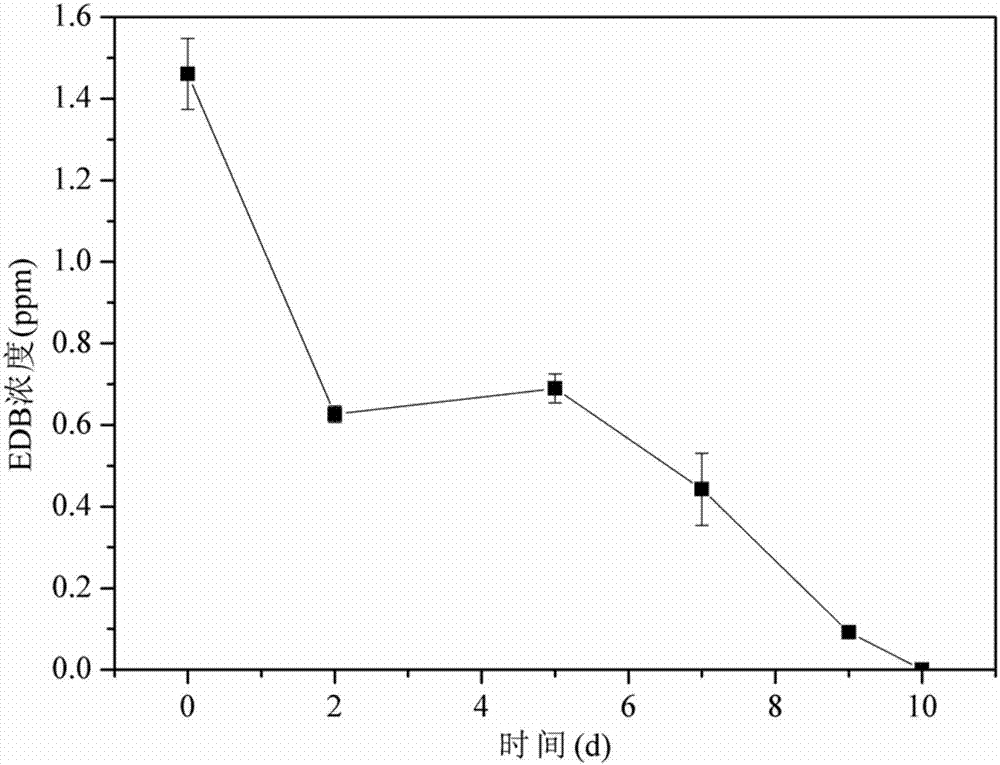
:溴代烃,如溴代阻燃剂、溴代烷烃等作为一类典型的持久性有机污染物,大多具有“三致”效应,对人体健康具有很大的潜在危害,引起了人们的广泛关注。因此,研究地下水环境中溴代烃污染物的修复问题对于保护地下水资源,减少对人体健康和生态环境的危害,促进经济和社会的可持续发展具有重要的现实意义。目前地下水污染修复技术主要分为物理方法、化学方法、生物修复方法和复合方法。物理方法目前以抽出处理法为代表,在地下水修复前期应用广泛。化学方法包括原位化学还原、原位化学氧化等,成本较高。生物修复包括微生物修复技术和植物修复技术。与物理方法与化学方法相比,生物修复和生物化学联合修复等方法因成本低廉、无二次污染等优点近年来备受关注。微生物修复技术是20世纪80年代兴起的一种清除和治理环境污染的生物工程技术,主要是指依靠某些功能微生物群,通过生物强化或生物刺激等手段,使地下水中的污染物得以清除或降解、转化为无毒或低毒物质的过程,是生物和生物化学等修复方法的重要组成部分。由于溴代烃毒性强、自然衰减速率低,土著微生物群中可能缺少降解溴代烃的微生物,此外,在实际地下水的修复工程实施过程中,由于受到气体在地下环境中传输的限制,工程应用中厌氧微生物修复技术远比好氧微生物修复技术容易实现。因此,筛选出溴代烃高效厌氧降解菌对于地下水中溴代烃污染修复具有重要的意义。技术实现要素:解决的技术问题:本发明提供一种溴代烃厌氧降解菌剂的制备方法和应用。技术方案:一种溴代烃厌氧降解菌剂的制备方法,制备方法包括如下步骤:(1)厌氧培养基的配制与分装:配制无机盐培养基,分装到100ml的厌氧瓶中;(2)对厌氧瓶进行除氧处理:利用氮吹仪向厌氧瓶中通氮气30min,用溶氧仪测定厌氧瓶中溶解氧含量,除氧结束后,将厌氧瓶封口;(3)灭菌:将厌氧瓶放入高压灭菌锅于121℃灭菌30min;(4)接种:灭菌完成后将装有培养基的厌氧瓶放入厌氧培养箱进行厌氧操作,加入10ml厌氧污泥,将厌氧瓶用压盖钳封密封后取出;(5)添加标液:用一次性无菌注射器加0.22μm有机相滤头向厌氧瓶中加入edb标准液,用硅橡胶水将瓶盖扎针处密封,用铝箔遮光袋包裹厌氧瓶,放入培养箱中30℃条件下培养;(6)菌剂富集:向另一个按步骤(1)至(5)处理后的厌氧瓶内转接10ml上述步骤(5)获得的培养液,置于恒温摇床中培养,经过4~5次转接后,制得溴代烃厌氧降解菌剂。上述步骤(1)中所述无机盐培养基的组成为:k2hpo4-3h2o,1.05g/l;nah2po4-h2o,0.25g/l;nh4cl,0.49g/l;n(ch2co2na)3-h2o,0.03g/l;mgso4-7h2o,0.05g/l;feso4-7h2o,0.003g/l;mnso4-h2o,0.74mg/l;znso4-7h2o,0.74mg/l;cocl2-6h2o,0.25mg/l;维生素b12,0.05mg/l;l-乳酸钠,1mm。上述制备方法制得的溴代烃厌氧降解菌剂。上述溴代烃厌氧降解菌剂在溴代烃污染的地下水修复中的应用。其治理条件是:地下水厌氧环境中溴代烃浓度在1~2ppm,ph范围在6-8。有益效果:(1)本发明从厌氧污泥中筛选、驯化出了能够耐受edb且对其具有一定降解能力的微生物菌株;并且利用这些微生物在厌氧条件下对地下水污染进行治理;(2)本发明对溴代烃污染的地下水修复工作具有实践可操作性强、经济、高效、对周围环境影响小、无二次污染等优点;(3)本发明为溴代烃降解提供了一种快速有效的菌剂,是原位生物修复和原位生物化学修复中的一项重要环节。附图说明图1为edb初始浓度为1ppm时其浓度随时间变化;图2为edb初始浓度为2ppm时其浓度随时间变化;图3为种水平物种分布柱状图。具体实施方式以下实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人是能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所做的等效变换或修饰,都应涵盖在本发明的保护范围之内。实施例1溴代烃厌氧降解菌剂的制备方法具体步骤如下:(1)厌氧培养基的配制与分装:配制无机盐培养基,分装到100ml的厌氧瓶中。(2)对厌氧瓶进行除氧处理:利用氮吹仪向厌氧瓶中通氮气30min,用溶氧仪测定厌氧瓶中溶解氧含量,除氧结束后,将厌氧瓶封口。(3)灭菌:将厌氧瓶放入高压灭菌锅于121℃灭菌30min。(4)接种:灭菌完成后将装有培养基的厌氧瓶放入厌氧培养箱进行厌氧操作,加入10ml厌氧污泥,将厌氧瓶用压盖钳封密封后取出。(5)添加标液:用一次性无菌注射器加0.22μm有机相滤头向厌氧瓶中加入edb标准液,用硅橡胶水将瓶盖扎针处密封,用铝箔遮光袋包裹厌氧瓶,放入培养箱中30℃条件下培养。(6)菌剂富集:向另一个按步骤(1)至(5)处理后的厌氧瓶内转接10ml上述步骤(5)获得的培养液,置于恒温摇床中培养,经过4~5次转接后,溴代烃厌氧降解菌剂得到有效富集。(7)样品采集及分析:每天用一次性无菌注射器从厌氧瓶中抽取培养液,置于10ml密闭玻璃瓶。用微量注射器取500μl加入到已加入9.5ml去离子水和3g氯化钠的gc进样瓶中,用气相色谱仪进行分析,记录edb的检测数据。取2ml培养液加入比色皿中,用紫外分光光度计分析,记录菌液od600的变化。步骤(1)中所述无机盐培养基的组成为:k2hpo4-3h2o,1.05g/l;nah2po4-h2o,0.25g/l;nh4cl,0.49g/l;n(ch2co2na)3-h2o,0.03g/l;mgso4-7h2o,0.05g/l;feso4-7h2o,0.003g/l;mnso4-h2o,0.74mg/l;znso4-7h2o,0.74mg/l;cocl2-6h2o,0.25mg/l;维生素b12,0.05mg/l;l-乳酸钠,1mm。本方法能够驯化筛选出对溴代烃厌氧降解性能好的菌群,降解率最高达到100%。如图1所示,当edb初始浓度为0.8ppm时,0-2dedb降解较为缓慢,由0.8ppm降至0.75ppm,edb的降解速率为0.025ppm/d,去除了6.25%;第2-4dedb降解较为迅速,由0.75ppm降至0.2ppm,edb的降解速率为0.275ppm/d,去除了68.75%;4-5d降解速率下降,edb浓度由0.2ppm降至0,edb的降解速率为0.2ppm/d,去除了25%;5d降解过程中,edb总降解率达到100%,完成一个降解周期。如图2所示,当edb初始浓度为1.5ppm时,0-2dedb降解较为迅速,由1.5ppm降至0.6ppm,edb的降解速率为0.45ppm/d,去除了60%;3-7d降解速率下降,edb浓度由0.6ppm降至0.4ppm,edb的降解速率为0.04ppm/d,去除了13.33%;8-10d降解速率升高,edb浓度由0.4ppm降至0,edb的降解速率为0.13ppm/d,去除了26.67%;10d降解过程中,edb总去除率达到100%,完成一个降解周期。溴代烃厌氧降解菌群落组成分析对本发明方法驯化的菌群进行分析,在ncbi数据库中,通过blast比对,表征了所得菌群的群落特征。1、基因组dna电泳检测根据样本类型,选择了最佳的抽提方法:蛋白酶k裂解法进行基因组dna抽提。2、pcr引物的设计根据illuminamiseq高通量测序要求,进行双向测序,设计目标区域和带有5'-miseq接头-barcode-测序引物-特异引物-3'的融合引物。引物序列:f5'-aatgatacggcgaccaccgagatctacac-barcode-tctttccctacacgacgctcttccgatct-特异引物-3'r5'-caagcagaagacggcatacgagat-barcode-gtgactggagttccttggcacccgagaattcca-特异引物-3'特异引物序列列表如下:3、pcr扩增文库构建采用两步pcr扩增的方法,首先采用特异引物(下面描述为内侧引物)扩增目的片段,将目的片段进行胶回收,而后将回收产物作为模板进行二次pcr扩增(下面描述为外侧引物进行扩增)。根据实验需求,设计引物如下:f内侧引物:5'-ttccctacacgacgctcttccgatct-特异引物-3'f外侧引物:5'-aatgatacggcgaccaccgagatctacac-barcode-tctttccctacacgacgctc-3'r内侧引物:5'-gagttccttggcacccgagaattcca-特异引物-3'r外侧引物:5'-caagcagaagacggcatacgagat-barcode-gtgactggagttccttggcacccgaga-3'3.1一次pcr扩增pcr扩增体系:5xbuffer10μldntp(10mm)1μlphusion超保真dna聚合酶1uf/r内侧引物(10um)各1μl模板5ng-50ngddh2o补至50μlpcr扩增程序:将pcr扩增产物于2%琼脂糖凝胶电泳切胶回收。dgge16s采用axygen公司的axyprepdna凝胶回收试剂盒回收产物,进行二次pcr扩增。3.3二次pcr扩增pcr扩增体系:5xbuffer8μldntp(10mm)1μlphusion超保真dna聚合酶0.8uf/r内侧引物(10um)各1μl模板5μlddh2o补至40μlpcr扩增程序:将测序结果在ncbi数据库中,通过blast比对结果中查找与条带最为相似的序列,确定每条序列代表的菌种类型,种水平物种分布柱状图如图3所示,自下而上依次包括clostridium_sp._fcb45、bacterium_b3c1-6、rhodocyclales_bacterium_tp139、treponema_sp._hm、clostridium_sp._6-44、veillonellaceae_bacterium_6-15、thermomarinilinea_lacunifontana、geobacter_lovleyi、chlorobi_bacterium_feline_oral_taxon_101、unidentified_eubacterium_clone_bsv40、ottowia_shaoguanensis、ornatilinea_apprima、desulfovibrio_sp._an30h-mm、paracoccus_kocurii、longilinea_arvoryzae、bacterium_s4531、litorilinea_aerophila、clostridium_bowmanii、bacterium_kaz4、rhodanobacter_sp._7b-393、riemerella_sp._lo3、thauera_sp._hw-37等菌株。在筛选得到的菌剂中,现有研究表明geobacter_lovleyi、riemerella_sp._lo3、rhodanobacter_sp._7b-393可分别用于三氯乙烯、三硝基甲苯、多环芳烃的生物降解,但目前尚没有将这三种菌应用于溴代烃的生物降解领域。此外,其他菌种也尚无应用于溴代烃的生物降解领域的先例。sequencelisting<110>中国科学院南京土壤研究所<120>一种溴代烃厌氧降解菌剂的制备方法及应用<130><160>8<170>patentinversion3.3<210>1<211>58<212>dna<213>人工序列<400>1aatgatacggcgaccaccgagatctacactctttccctacacgacgctcttccgatct58<210>2<211>57<212>dna<213>人工序列<400>2caagcagaagacggcatacgagatgtgactggagttccttggcacccgagaattcca57<210>3<211>19<212>dna<213>人工序列<400>3gtgccagcmgccgcggtaa19<210>4<211>20<212>dna<213>人工序列<400>4ccgtcaattcmtttgagttt20<210>5<211>26<212>dna<213>人工序列<400>5ttccctacacgacgctcttccgatct26<210>6<211>49<212>dna<213>人工序列<400>6aatgatacggcgaccaccgagatctacactctttccctacacgacgctc49<210>7<211>26<212>dna<213>人工序列<400>7gagttccttggcacccgagaattcca26<210>8<211>51<212>dna<213>人工序列<400>8caagcagaagacggcatacgagatgtgactggagttccttggcacccgaga51当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1