一种含氮的共轭有机微孔聚合物、制备方法及应用与流程
本发明属于吸附材料制备技术领域,特别是涉及一种含氮共轭微孔聚合物、制备方法及应用。
背景技术:
长期以来,由于人类生活和工业生产不断消耗化石燃料,二氧化碳的排放量不断增长,这使人类的生存环境和生态系统遭受了极大污染。目前,全球气候变暖成为人类亟需解决的重要环境问题,其中二氧化碳的浓度过高是主要的原因。同其他环境问题相比,二氧化碳的排放影响空间大且作用时间长,因此解决起来非常困难。人类迫切寻求新的清洁能源来代替化石燃料,从而减少二氧化碳在大气中的浓度。在能源结构转变之前,人类主要通过限制二氧化碳排放量及研究能将二氧化碳捕获和存储的新型材料等方法来解决此问题。随着研究的不断深入,有机多孔聚合物随之产生,它是一类具有较大比表面积和永久孔结构的新型多孔材料。有机多孔聚合物具有合成方法多样、尺寸可调控、表面可修饰、化学及物理性质稳定等特点,并且它在气体存储、分离及非均相催化等方面表现出巨大的潜能,逐渐成为近年来发展较快的研究热点之一。根据结构特点的不同,有机多孔聚合物主要可分为自具微孔聚合物(polymersofintrinsicmicroporosity,pims)、超交联聚合物(hypercross-linkedpolymers,hcps)、共轭微孔聚合物(conjugatedmicroporouspolymers,cmps)和共价有机骨架聚合物(covalentorganicframeworks,cofs)。与无机微孔材料和金属有机网络相比,微孔有机聚合物的合成才刚刚起步。但有机合成化学和聚合物化学却已为此类材料的合成提供了多样性和广阔的发展空间。因此,无论从科研探索还是从实际应用的方面,设计合成具有良好co2吸附性能的微孔有机材料均具有重要的意义。
为了满足人类生活和工业生产的发展,人类对无温室气体释放、清洁且安全的能源需求正在快速增长,核能则具有这些优势。虽然,核能被认为是一种高效和非碳排放的能源,但在核能优点的背后出现了不可忽略的环境问题,就是由铀的核裂变产生的危害人类健康的放射性核废料。129i,131i,3h和85kr等都是核废料中含有的挥发性放射性核素。特别是在发生反应堆泄漏事故的时候,针对的主要就是放射性碘。因为在核燃料中,放射性碘的毒性大,产额高,还拥有长达1.57×107年的放射性半衰期,所以对于放射性碘的相应问题引起了能源界的广泛关注。因此,为了促进未来核能的进一步发展,人类非常需要能够有效捕获和储存放射性碘的材料及方法。
现实生活中,co2可以从工厂的排烟道中及酸性天然气中被捕获和分离。这些环境条件对于捕获co2材料的要求很高。目前,人们普遍使用胺净化器对二氧化碳进行收集,该方法需要消耗大量的能源,且成本较高,限制了它的应用。所以,科学家们需要寻找成本低、消耗少的材料来代替现有材料。
另外,现在普遍捕获碘技术是用天然或合成的金属交换沸石作为碘吸附剂,这些材料具有化学性质稳定和水热稳定的特点。然而,它们有限的吸附能力导致低的碘吸附量,这极大限制了该材料在碘吸附方面的应用。
技术实现要素:
针对现有技术中存在的问题,本发明提供了一种含氮的共轭有机微孔聚合物,该聚合物可作为吸附剂对二氧化碳气体和碘进行高效吸附,实现二氧化碳气体和碘的高效捕获和存储。
具体的,本发明提供的含氮的共轭有机微孔聚合物,以n2,n4,n6-三(4-溴苯基)-1,3,5-三嗪-2,4,6-三胺和炔苯作为共聚单体,在pd(0)催化下,通过sonogashira进行偶联,然后在700~820℃高温热解制得。
优选地,所述炔苯选自1,3-二乙炔苯、1,4-二乙炔苯、1,3,5-三乙炔苯中任意一种。
优选地,所述聚合物比表面积为630~736m2/g,孔径分布0~1nm。
本发明还提供了该含氮的共轭有机微孔聚合物作为气体吸附剂或放射性碘吸附剂的应用。
本发明还提供了该含氮的共轭有机微孔聚合物在碘或二氧化碳捕获中的应用。
优选地,在273k,1.05bar条件下,所述含氮的共轭有机微孔聚合物对co2的吸附量为3.37~3.96mmol/g;在常压,350k条件下,所述含氮的共轭有机微孔聚合物对i2的吸附值为1.49~1.92g/g。
本发明还提供了该含氮的共轭有机微孔聚合物的制备方法,具体制备过程如下:
s1:以n2,n4,n6-三(4-溴苯基)-1,3,5-三嗪-2,4,6-三胺和炔苯作为共聚单体,在pd(0)催化下,通过sonogashira偶联反应制备含有n的共轭微孔聚合物材料;
s2:将s1制备得到的n的共轭微孔聚合物材料在氮气保护下,经700~820℃直接热解2h,得到所述含氮的共轭有机微孔聚合物。
更优选地,s2中,热解温度为800℃。
本发明制得的含氮的共轭有机微孔聚合物拥有大的比表面积、良好的多孔性质、较好的热稳定性及化学稳定性,在气体分离、气体吸附等领域具有广阔的应用前景。与传统化学吸附过程相比,本发明提供的聚合物使用物理吸附更方便的施行捕获并释放二氧化碳的可逆过程,不仅需要的能量更少而且有利于二氧化碳的再利用。在碘吸附方面,我们制得的聚合物对碘分子展现出了非常优越的吸附能力。而且该聚合物材料吸附的碘可以通过简单的洗脱操作把碘从聚合物骨架中洗脱出来,有效的回收碘。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明实施例1~3所得聚合物的x射线粉末衍射谱图;
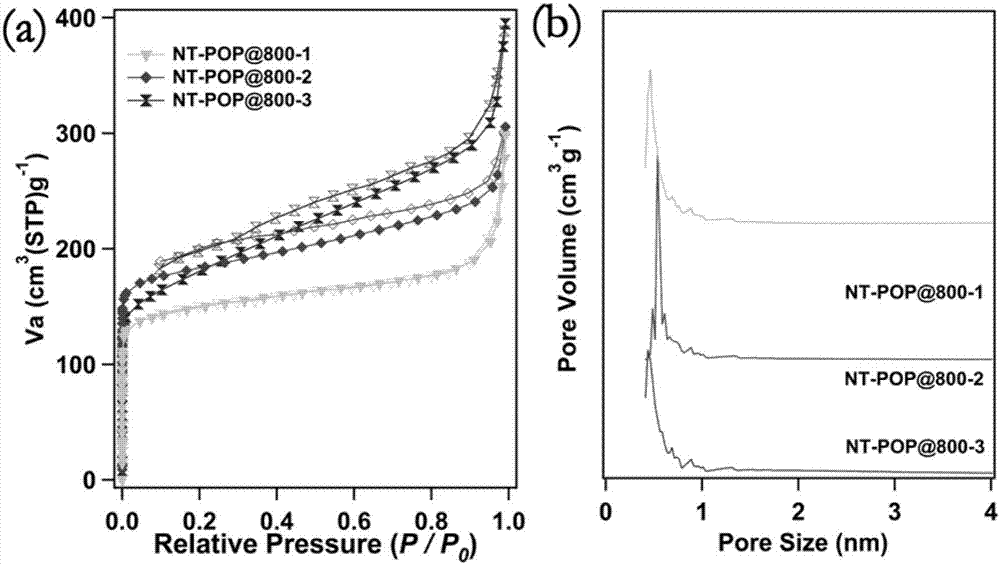
图2为本发明实施例1~3所得聚合物的的氮气吸脱附分析和孔径分布图,其中:图(a)为氮气吸脱附分析图,图(b)为氮气吸脱附分析图;
图3本发明实施例1~3所得聚合物的扫描电镜图;
图4本发明实施例1~3所得聚合物的透射电镜图。
具体实施方式
为了使本领域技术人员更好地理解本发明的技术方案能予以实施,下面结合具体实施例对本发明作进一步说明,但所举实施例不作为对本发明的限定。
除非另有定义,下文中所用是的所有专业术语与本领域技术人员通常理解的含义相同。本文中所使用的专业术语只是为了描述具体实施例的目的,并不是旨在限制本发明的保护范围。
除非另有特别说明,本发明以下各实施例中用到的各种原料、试剂、仪器和设备均可通过市场购买得到或者通过现有方法制备得到。
实施例1
本实施例一种含氮的共轭有机微孔聚合物,具体制备过程为:以n2,n4,n6-三(4-溴苯基)-1,3,5-三嗪-2,4,6-三胺(147.8mg,0.25mmol)和1,4-二乙炔苯(70.6mg,0.56mmol)作为共聚单体,在pd(0)作为催化剂和氮气保护下,无水dmf和三乙胺作为溶剂,120℃条件下反应48h,制备了含有n的共轭微孔聚合物材料,记为nt-pop-1;将制备得到的聚合物材料,在氮气保护下,经800℃直接热解2h,得到含氮的共轭有机微孔聚合物,记为nt-pops@800-1。
实施例2
本实施例一种含氮的共轭有机微孔聚合物,具体制备过程为:以以n2,n4,n6-三(4-溴苯基)-1,3,5-三嗪-2,4,6-三胺(147.8mg,0.25mmol)和1,4-二乙炔苯(70.6mg,0.56mmol)作为共聚单体,在pd(0)作为催化剂和氮气保护下,无水dmf和三乙胺作为溶剂,120℃条件下反应48h,记为nt-pop-2;将制备得到的聚合物材料,在氮气保护下,经800℃直接热解2h,得到含氮的共轭有机微孔聚合物,记为nt-pops@800-2。
实施例3
本实施例一种含氮的共轭有机微孔聚合物,具体制备过程为:以n2,n4,n6-三(4-溴苯基)-1,3,5-三嗪-2,4,6-三胺(147.8mg,0.25mmol)和1,3,5-三乙炔苯(56.6mg,0.375mmol)作为共聚单体,在pd(0)作为催化剂和氮气保护下,无水dmf和三乙胺作为溶剂,120℃条件下反应48h,记为nt-pop-3;将制备得到的聚合物材料,在氮气保护下,经800℃直接热解2h,得到含氮的共轭有机微孔聚合物,记为nt-pops@800-3。
上述实施例1~3提供的聚合物的合成过程如式1所示:
针对实施例1~3所提供的聚合物,我们进行了性能测试,具体的,实施例1~3提供的聚合物的结构通过x射线粉末衍射数据确认,其x射线粉末衍射谱如图1所示,由图1可以看出:该材料不同于结晶性的共轭有机骨架,其结构是无定型的。
图2为实施例1~3提供的聚合物的氮气吸脱附分析和孔径分布,由图2(a)可以看出:在相对压力p/p0<0.01的区域,等温吸附曲线有一个比较尖锐的增长,表明该材料含有大量微孔结构。等温吸附曲线的磁滞回线的产生应该是聚合物骨架在高浓度氮气条件下发生膨胀而导致的。在相对压力0.9~1.0的区域,等温曲线呈现的尖锐增长是由于材料中存在打孔道结构。比表面积结果是由相对压力范围0.015~0.1区间的数据计算而来的,计算结果表明nt-pops@800-1,nt-pops@800-2和nt-pops@800-3的bet比表面积分别为630m2/g,736m2/g,643m2/g。该材料的孔分布主要集中在0~1nm,计算结果由saito-flory方法得来(如图2(b)所示)。此外,nt-pops@800-1,nt-pops@800-2和nt-pops@800-3的总孔体积分别为0.4328,0.4634和0.6021cm3/g,由相对压力p/p0=0.99处的氮气吸附数据计算而来。
图3为实施例1~3提供的聚合物的扫描电镜图(sem),由图3可以看出:该材料形貌呈块状,直径范围分布在300-500nm之间。图4为实施例1~3提供的聚合物的透射电镜图(tem),由图4可以看出:该材料拥有清晰的多孔无定型结构纹理。
由上可见,本发明实施例1~3所提供的聚合物具有大的比表面积、窄的孔径分布,且经常规分析发现还具有物理化学稳定性高和骨架密度低的特点,可作为吸附材料来使用,特别是用于吸附二氧化碳和碘。这对于捕获和存储二氧化碳和放射性核废料特别是放射性碘具有非常重要的意义。
下面对本发明实施例1~3所提供的聚合物对二氧化碳和碘的吸附性能进行考察,具体过程如下:
(1)吸附co2
模拟烟道气:选用由体积比为85:15的氮气和二氧化碳组成的混合气模拟烟道主要气体成分,将聚合物在真空干燥箱120℃下干燥10小时进行活化,脱除聚合物孔道内存留的水分和小分子气体等。在273k,1.05bar条件下,使用bel-sorp-max仪器测得在模拟烟道气中聚合物对co2的吸附值,应用理想吸附溶液理论算出二氧化碳对氮气在273k条件下的选择性。
(2)吸附i2
上述聚合物对i2的吸附分固态吸附和液态吸附两种情况进行,其中,
液态吸附过程具体是,制备浓度为4mg/ml的碘的正己烷溶液,取,再称取30mg的活化的聚合物于5ml螺口小瓶中,加入3ml碘的正己烷溶液,密封小瓶,室温下静置,分别于1h、4h、8h、18h、24h、48h的时间点取出100微升溶液,稀释一百倍,测定其紫外吸收曲线。根据标准紫外吸收曲线计算每个时间点聚合物吸附i2的质量和吸附i2质量占溶液i2质量的百分比,得到最终聚合物对i2的吸附值。
固态吸附过程具体是,将上述聚合物与单质碘装在一个密闭容器中,在常压350k条件下,每隔一定时间取出药品进行称重,待称重示数保持不变,则得到最终药品对i2的饱和吸附值。
经上述方法测定,实施例1提供的聚合物nt-pops@800-1,在273k1.05bar条件下,对co2的吸附量为3.68mmol/g;在常压,350k条件下,聚合物nt-pops@800-1对i2的吸附值为1.92g/g。实施例2提供的聚合物nt-pops@800-2,在273k1.05bar条件下,对co2的吸附量为3.96mmol/g;在常压,350k条件下,聚合物nt-pops@800-2对i2的吸附值为1.49g/g;实施例3提供的聚合物nt-pops@800-3,在273k1.05bar条件下,对co2的吸附量为3.37mmol/g;在常压,350k条件下,聚合物nt-pops@800-3对i2的吸附值为1.52g/g。
需要说明的是,本发明权利要求书中涉及数值范围时,应理解为每个数值范围的两个端点以及两个端点之间任何一个数值均可选用,由于采用的步骤方法与实施例1~3相同,为了防止赘述,本发明的描述了优选的实施例,但是本发明并不局限于此,而是还能以处于所附权利要求中定义的技术方案的范围内的其他方式来具体实现。
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,其保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内,本发明的保护范围以权利要求书为准。
- 还没有人留言评论。精彩留言会获得点赞!