用于治疗神经变性的细胞疗法的制作方法
本申请是申请日为2013年02月06日、申请号为2013800753669、发明名称为“用于治疗神经变性的细胞疗法”的发明专利申请的分案申请。本公开描述细胞组合物和用于治疗神经变性的方法。
背景技术:
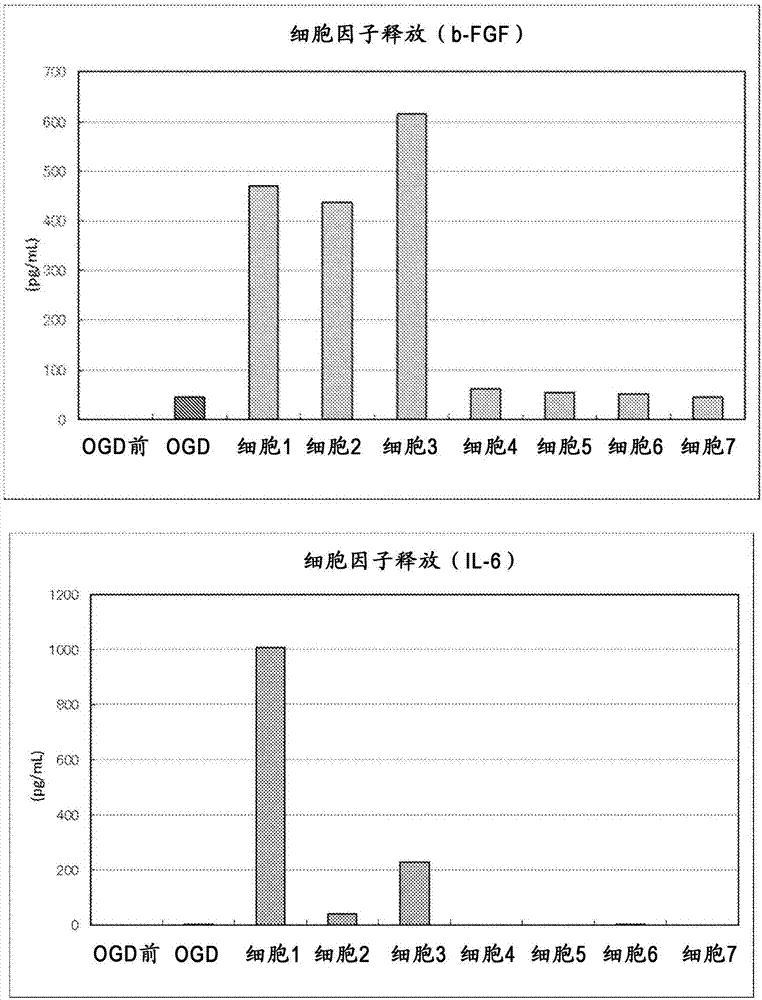
:神经变性是导致神经细胞死亡的病理状态。尽管神经变性的成因可能多种多样而且并不总能确定,但是许多神经病症都具有神经变性作为共同的病理状态。例如,阿尔兹海默症、帕金森症、亨廷顿症和肌萎缩侧索硬化症(als)都引起慢性神经变性,其特征在于神经细胞在若干年期间缓慢且逐渐死亡,而急性神经变性的特征在于由缺血(例如,中风)或创伤(例如,创伤性脑损伤)导致的,或者由例如因脊椎受伤或多发性硬化而引起的脱髓鞘或创伤造成的轴索切断(axonaltransection)导致的神经细胞死亡的突然发作。各种各样的由例如酗酒、药物成瘾、暴露于神经毒素和辐射所导致的神经细胞损伤也可引发神经变性。神经变性的迹象甚至在痴呆、癫痫、各种精神病症中都可发现,而且也是正常老化过程的一部份。无论根本原因是什么,越来越多证据表明,一旦引发神经变性,所有这些病症的结局始终相同——神经细胞的最终死亡。中风涉及由通向大脑或大脑内的血管的阻塞(缺血性中风)或破裂(出血)导致的急性神经变性(中枢神经系统神经细胞快速损耗并伴随功能丧失)。由于中风可以引起永久性神经损害、全身并发症和甚至死亡,因此中风通常构成医疗急诊。在美国和欧洲,中风是成人致残的主要原因,也是世界范围内的第二死因。在美国,每十五人中有超过一人死于中风,而且中风在所有死因中排名第三,仅次于心脏病和癌症(美国心脏协会,心脏疾病与中风统计资料–2009年更新版,美国德州达拉斯:美国心脏协会;2009;rosamond等,心脏疾病与中风统计资料–2007年更新版:来自美国心脏协会统计委员会和中风统计小组委员会的报告,circulation,2007;115:e69-e171)。每三次中风就有一个致死结果(等,riskfactorsofstrokeincidenceandmortality,a12-yearfollow-upoftheoslostudy,stroke,199324(10;1484-0)。65岁以下的所有死亡中有约6%和65岁以上的所有死亡中有10%是由于中风(donnan等,stroke,lancet,2008;317(9624):1612-23)。因此统计数据证明了对于许多中风受害者来说,严重致残是不幸但却太过频繁发生的结果。实际上,中风是用于长期成人护理的住院患者医保理赔的第一原因。在美国和其他主要工业国,与中风治疗和康复相关的总成本现已超过每年4500万美元,并且毫无疑问地持续促成医保成本的总体增加。缺血性中风是最常见的中风形式,占所有中风的超过80%。缺血性中风由动脉堵塞引起,而动脉堵塞通常是因为血栓形成或者不太常见地是因为栓塞。发作通常是突发性的,并且通常接着发生局部神经功能缺损。约20%的患者在数天内死亡,特别是如果梗塞很大的话。另外10%的患者在初次中风的数周内死亡。不幸地是,存活者通常严重致残。取决于受影响的脑部面积,症状包括单侧面部或肢体虚弱和感觉障碍以和认知和语言障碍。受影响的脑部面积越大,越多的功能可能受损。一些功能改善可在数天内开始出现,并且常见在数月期间进一步恢复。然而,恢复的程度是不可预期的,并且通常是不完全的。根据美国中风协会,中风存活者中有15%至30%的人永久致残,20%的人在发作后需要三个月的机构护理(harmsen等,long-termriskfactorsforstroke:twenty-eightyearsoffollow-upof7457middle-agedmeninsweden,stroke,2006;37(7):1663-7)。缺血性中风导致核心病变(corelesion)和周围的半暗带(penumbra),在核心病变内的神经细胞在数分钟内缺氧而死亡,周围的半暗带接收到一些血流因而接收到一些氧气,但仍少于正常情况。在缺血半暗带中,细胞死亡进行得较为缓慢,一般在数小时内死亡,并且由多变性缺氧症(variableanoxia)和缺血级联反应与所述核心病变内释放的谷氨酸盐产生的毒性物质引起。因此目前的治疗干预主要着重于缓和中风半暗带中的有害情况。然而,用于急性缺血性中风的疗法仍然有限。由于脑损伤的发生是流向脑部的血液减少的结果,目前的疗法致力于通过溶解凝块(血栓溶解)或者通过机械性地除去凝块(血栓切除术)来除去动脉堵塞。血流恢复越快,脑细胞死亡越少,可以避免永久性后遗症的机会越大。目前,只有两种疗法在美国经fda批准用于中风:●重组组织纤溶酶原活化剂(rt-pa;genentech),溶解动脉凝块的药物;和●梅西恢复系统(merciretrievalsystem)(concentricmedicalinc.)和penumbra系统(penumbrainc.),机械性去除血栓的装置。上述所有治疗方法都具有主要限制。为求有效,使用溶栓剂的疗法必须在症状发作的3到4.5小时内进行,这表示仅有约3%的患有急性缺血性中风的患者接受有效的rt-pa治疗。此外,溶栓疗法具有实质上增加的脑出血风险,这进一步限制了其在一些个体中的使用。基于上述理由,本领域中对于缓和和/或预防神经变性,特别是由缺血引起的神经变性的安全且有效的疗法存在尚未得到满足而又迫切的需求。发明简述因此,在一个实施方式中,本发明提供一种通过以下方法制备的异质性骨髓(bm)细胞亚群,该方法包括:a)从未处理的骨髓获得骨髓细胞群;b)将骨髓细胞群以低密度接种在塑料表面上;c)洗涤接种的细胞群以除去未附着的细胞;d)在含血清的培养基中将附着的细胞群培养至接近汇合;e)将培养的细胞群连续传代不超过约七次连续传代,其中,在每次传代时,以低密度接种培养的细胞;和f)获得异质性骨髓细胞亚群,其中有效量的异质性骨髓细胞亚群有效治疗神经变性。在一个方面,有效量的异质性骨髓细胞亚群有效治疗由缺血引起的神经变性。在一个方面,异质性骨髓细胞亚群在含血清的培养基中培养。在一个方面,骨髓细胞群以约102-106个细胞/cm2的密度接种。在一个方面,在传代时,培养的细胞以约750个细胞/cm2或更小的密度接种。未处理的骨髓可以从没有使用任何调控细胞分裂的试剂预治疗的受试者获得,所述试剂例如是用于化疗的抗肿瘤药物,包括抗代谢药物,如5-氟尿嘧啶。在一个方面,异质性骨髓细胞亚群不能通过密度分离法如ficolltm或percolltm梯度或者通过ack(铵-氯化物-钾)裂解液来分离。在本发明的进一步的方面,异质性骨髓细胞亚群进一步在由缺血引起的神经变性的实验模型中测试,其中仅选择显示治疗神经变性的能力的那些细胞群。该由缺血引起的神经变性的实验模型可以是氧/葡萄糖剥夺(ogd)细胞培养模型或中风动物模型。在一个方面,该实验模型可以是氧/葡萄糖剥夺(ogd)细胞培养模型和随后的中风动物模型。在另一个方面,在注射至血流中后,异质性亚群中的细胞迁移至神经变性位置。在一个方面,由缺血引起的神经变性是缺血性中风。在另一个实施方式中,本发明还提供一种治疗由缺血引起的神经变性的方法,包括将上述异质性骨髓细胞亚群注射至患有神经变性的哺乳动物的血流中,其中异质性骨髓细胞亚群的注射减少由神经变性造成的神经功能缺损。当神经变性由缺血性中风引起时,该方法可还包括用于增加通过阻塞血管的血流的附加治疗,其中注射异质性骨髓细胞亚群与附加治疗的组合导致比单独的附加治疗或者注射异质性骨髓细胞亚群但不使用附加治疗后的神经功能缺损的更大减少。在一个方面,用于增加通过阻塞血管的血流的附加治疗与注射异质性骨髓细胞亚群同时进行。在另一个方面,在注射异质性骨髓细胞亚群前,进行用于增加通过阻塞血管的血流的附加治疗。当神经变性由缺血性中风引起时,血管可以被血块阻塞。血块可以由动脉粥样硬化斑块的破裂产生。当神经变性由缺血性中风引起时,用于增加通过阻塞血管的血流的附加治疗可包括施用溶栓剂。溶栓剂可以是链激酶、尿激酶和重组组织纤溶酶原活化剂中的至少一个。而且,该重组组织纤溶酶原活化剂可以是阿替普酶、瑞替普酶、去氨普酶或替奈普酶。在另一个方面,当神经变性由缺血性中风引起时,用于增加通过阻塞血管的血流的附加治疗可包括从阻塞血管机械性除去血块。在进一步的方面中,可以使用过滤器捕捉血块。在另一个方面,当神经变性由缺血性中风引起时,用于增加通过阻塞血管的血流的附加治疗可包括进行血管成形术和/或血管支架手术。异质性骨髓细胞亚群可以通过静脉、动脉(例如注射至颈动脉中)或脑内注射。在另一个实施方式中,本发明还提供一种治疗由缺血引起的神经变性的方法,包括将异质性骨髓细胞亚群注射至患有由缺血引起的神经变性的哺乳动物的血流中,其中异质性骨髓细胞亚群的注射减少由缺血引起的梗塞的体积。当神经变性由缺血性中风引起时,该方法可还包括用于增加通过阻塞血管的血流的附加治疗,其中注射异质性骨髓细胞亚群与附加治疗的组合导致比单独的附加治疗或者注射异质性骨髓细胞亚群但不使用附加治疗后的梗塞体积的更大减少。在一个方面,当神经变性由缺血性中风引起时,所述用于增加通过阻塞血管的血流的附加治疗包括施用溶栓剂。溶栓剂可以是链激酶、尿激酶和重组组织纤溶酶原活化剂中的至少一个。而且,重组组织纤溶酶原活化剂可以是阿替普酶、瑞替普酶、去氨普酶或替奈普酶。在另一个方面,当神经变性由缺血性中风引起时,用于增加通过阻塞血管的血流的附加治疗可包括进行血管成形术和/或支架手术。在另一个方面,当神经变性由缺血性中风引起时,用于增加通过阻塞血管的血流的附加治疗可包括机械性除去梗塞位点附近的血块。根据第二种方法,异质性骨髓细胞亚群可以通过静脉、动脉(例如可注射至颈动脉中)或者脑内注射。当神经变性由缺血性中风引起时,本发明还可提供一种包含溶栓剂和上述异质性骨髓细胞亚群的试剂盒。溶栓剂可为是链激酶、尿激酶和重组组织纤溶酶原活化剂中的至少一个。而且,重组组织纤溶酶原活化剂可以是阿替普酶、瑞替普酶或替奈普酶。当神经变性由缺血性中风引起时,本发明还可提供一种包含根据上述异质性骨髓细胞亚群和用于机械性除去血块的工具的试剂盒。此外,当神经变性由缺血性中风引起时,本发明可提供一种用于治疗由缺血引起的神经变性的组合物,其包含溶栓剂、上述异质性骨髓细胞亚群和用于注射该组合物的载体。溶栓剂可以是链激酶、尿激酶和重组组织纤溶酶原活化剂中的至少一个。而且,重组组织纤溶酶原活化剂可以是阿替普酶、瑞替普酶或替奈普酶。本发明也可提供一种制备用于治疗神经变性的异质性骨髓细胞亚群的方法,包括:a)从未处理的骨髓获得异质性骨髓细胞群;b)将异质性骨髓细胞群以低密度接种在塑料表面上;c)洗涤接种的细胞群以除去未附着的细胞;d)在含血清的培养基中将来自洗涤的细胞群的附着的细胞培养至接近汇合;e)将培养的细胞连续传代不超过约七次连续传代,其中,在每次传代时,以低密度接种培养的细胞,由此获得异质性骨髓细胞亚群。在一个方面,上述未处理的骨髓可以从没有使用任何调控细胞分裂的试剂预治疗的受试者获得,所述试剂是例如用于化疗的抗肿瘤药物,包括抗代谢药物,如5-氟尿嘧啶。在一个方面,异质性骨髓细胞亚群不能通过密度分离法例如ficolltm或percolltm梯度或通过ack(铵-氯化物-钾)裂解液来分离。在本发明的进一步方面,异质性骨髓细胞亚群可进一步在由缺血引起的神经变性实验模型中测试,其中仅选择显示治疗由缺血引起的神经变性的能力的那些细胞群。由缺血引起的神经变性实验模型可以是氧/葡萄糖剥夺(ogd)细胞培养模型和中风动物模型。在一个方面,该实验模型可以是氧/葡萄糖剥夺(ogd)细胞培养模型和随后的中风动物模型。在一个方面,两种模型都可用于测试异质性骨髓细胞亚群。在另一个方面,本发明还可提供一种优化用于分离治疗由缺血引起的神经变性的异质性细胞群的实验方案的方法,其包括以下步骤:根据实验方案分离细胞群;其中该细胞群治疗由缺血引起的神经变性;和其中通过测试每个参数对分离的细胞群在缺血实验模型中治疗由缺血引起的神经变性的效果的影响来决定方案的每个步骤的最佳参数。在一个方面,参数可包括接种时的细胞密度、细胞传代次数、培养基组成或细胞分离方法。在另一个方面,缺血实验模型可以是氧/葡萄糖剥夺(ogd)细胞培养模型或中风动物模型,如大脑中动脉阻塞(mcao)动物模型。同样的,这两种模型都可以使用。在一个方面,该实验模型可以是氧/葡萄糖剥夺(ogd)细胞培养模型和随后的中风动物模型。上述方面具有许多优点,包括异质性骨髓细胞亚群治疗由缺血性中风引起的神经变性的能力。细胞群极大减小梗塞面积并改善神经功能。与溶栓剂和机械性血块除去方法相结合,该细胞疗法有望对中风后的患者生存、功能运作和生活质量产生显著临床影响。本发明还涉及以下项目:1.一种通过以下方法制备的异质性骨髓细胞亚群,所述方法包括:a)从未处理的骨髓获得骨髓细胞群;b)将所述骨髓细胞群以低密度接种在塑料表面上;c)洗涤所述接种的细胞群以除去未附着的细胞;d)在含血清的培养基中将所述附着的细胞群培养至接近汇合;将所述培养的细胞群连续传代不超过约七次连续传代,其中,在每次传代时,以低密度接种所述培养的细胞;和e)获得所述异质性骨髓细胞亚群,其中有效量的所述异质性骨髓细胞亚群有效治疗神经变性。2.根据项目1所述的异质性骨髓细胞亚群,其中所述神经变性由缺血引起。3.根据项目2所述的异质性骨髓细胞亚群,其进一步在神经变性实验模型中测试,其中选择显示治疗神经变性的能力的那些细胞群。4.根据项目3所述的异质性骨髓细胞亚群,其中所述神经变性实验模型是氧/葡萄糖剥夺(ogd)细胞培养模型。5.根据项目3所述的异质性骨髓细胞亚群,其中所述神经变性实验模型是中风动物模型。6.根据项目1所述的异质性骨髓细胞亚群,其中所述骨髓细胞群以约102-106个细胞/cm2的密度接种。7.根据项目1所述的异质性骨髓细胞亚群,其中所述获得的骨髓细胞亚群在含血清的培养基中培养。8.根据项目1所述的异质性骨髓细胞亚群,其中,在每次传代时,所述培养的细胞以少于约750个细胞/cm2的密度接种。9.根据项目1所述的异质性骨髓细胞亚群,其中在注射至血流中后,所述亚群中的细胞迁移至神经变性位点。10.根据项目1所述的异质性骨髓细胞亚群,其中所述未处理的骨髓从没有使用化疗剂预治疗的受试者获得。11.根据项目10所述的异质性骨髓细胞亚群,其中所述化疗剂是5-氟尿嘧啶。12.根据项目1所述的异质性骨髓细胞亚群,其中所述骨髓细胞群不能通过密度分离法或通过ack裂解液来分离。13.根据项目12所述的异质性骨髓细胞亚群,其中所述密度分离法需要ficolltm或percolltm梯度。14.一种治疗神经变性的方法,其包括:将根据项目1所述的异质性骨髓细胞亚群注射至患有神经变性的哺乳动物的血流中,其中所述骨髓细胞亚群的所述注射减少由所述神经变性造成的神经功能缺损。15.根据项目14所述的治疗神经变性的方法,其中所述神经变性由缺血性中风引起。16.根据项目15所述的治疗神经变性的方法,其还包括用于增加通过阻塞血管的血流的附加治疗,其中注射所述骨髓细胞亚群与所述附加治疗的组合导致比单独的附加治疗或者注射所述骨髓细胞亚群但不使用所述附加治疗后的所述神经功能缺损的更大减少。17.根据项目16所述的治疗神经变性的方法,其中所述用于增加通过阻塞血管的血流的附加治疗与注射所述骨髓细胞亚群同时进行。18.根据项目16所述的治疗神经变性的方法,其中在注射所述骨髓细胞亚群前,进行所述用于增加通过阻塞血管的血流的附加治疗。19.根据项目16所述的治疗神经变性的方法,其中所述血管被血块阻塞。20.根据项目20所述的治疗神经变性的方法,其中所述血块由动脉粥样硬化斑块破裂产生。21.根据项目16所述的治疗神经变性的方法,其中所述用于增加通过阻塞血管的血流的附加治疗包括施用溶栓剂。22.根据项目21所述的治疗神经变性的方法,其中所述溶栓剂是选自链激酶、尿激酶和重组组织纤溶酶原活化剂中的至少一个。23.根据项目22所述的治疗神经变性的方法,其中所述重组组织纤溶酶原活化剂是阿替普酶、瑞替普酶、去氨普酶或替奈普酶。24.根据项目16所述的治疗神经变性的方法,其中所述用于增加通过阻塞血管的血流的附加治疗包括从所述阻塞血管机械性除去血块。25.根据项目16所述的治疗神经变性的方法,其中所述用于增加通过阻塞血管的血流的附加治疗还包括使用过滤器捕捉所述血块。26.根据项目16所述的治疗神经变性的方法,其中所述用于增加通过阻塞血管的血流的附加治疗包括进行血管成形术和/或血管支架手术。27.根据项目14所述的治疗神经变性的方法,其中所述骨髓细胞亚群通过静脉或动脉注射。28.根据项目14所述的治疗神经变性的方法,其中所述骨髓细胞亚群注射至颈动脉中。29.根据项目14所述的治疗神经变性的方法,其中所述骨髓细胞亚群通过脑内注射。30.一种治疗由缺血性中风引起的神经变性的方法,其包括:将根据项目1所述的异质性骨髓细胞亚群注射至患有由缺血引起的神经变性的哺乳动物的血流中,其中所述骨髓细胞亚群的所述注射减少由所述神经变性引起的梗塞体积。31.根据项目30所述的治疗神经变性的方法,其还包括用于增加通过阻塞血管的血流的附加治疗,其中注射所述骨髓细胞亚群与所述附加治疗的组合导致比单独的附加治疗或者注射所述骨髓细胞亚群但不使用所述附加治疗后的所述梗塞体积的更大减少。32.根据项目31所述的治疗神经变性的方法,其中所述用于增加通过阻塞血管的血流的附加治疗包括施用溶栓剂。33.根据项目32所述的治疗神经变性的方法,其中所述溶栓剂是选自链激酶、尿激酶和重组纤溶酶原活化剂中的至少一个。34.根据项目33所述的治疗神经变性的方法,其中所述重组纤溶酶原活化剂是阿替普酶、瑞替普酶、去氨普酶或替奈普酶。35.根据项目31所述的治疗神经变性的方法,其中所述用于增加通过阻塞血管的血流的附加治疗包括进行血管成形术和/或支架手术。36.根据项目31所述的治疗神经变性的方法,其中所述用于增加通过阻塞血管的血流的附加治疗包括机械性除去所述梗塞位点附近的血块。37.根据项目30所述的治疗神经变性的方法,其中所述骨髓细胞亚群通过静脉或动脉注射。38.根据项目30所述的治疗神经变性的方法,其中所述骨髓细胞亚群注射至颈动脉中。39.根据项目30所述的治疗神经变性的方法,其中所述骨髓细胞亚群通过脑内注射。40.一种试剂盒,其包含溶栓剂和根据项目1所述的异质性骨髓细胞亚群。41.根据项目40所述的试剂盒,其中所述溶栓剂是选自链激酶、尿激酶和重组组织纤溶酶原活化剂中的至少一个。42.根据项目41所述的试剂盒,其中所述重组组织纤溶酶原活化剂是阿替普酶、瑞替普酶或替奈普酶。43.一种试剂盒,其包含根据项目1所述的异质性骨髓细胞亚群和用于机械性除去血块的工具。44.一种用于治疗由缺血性中风引起的神经变性的组合物,其包含溶栓剂、根据项目1所述的骨髓细胞亚群和用于注射所述组合物的载体。45.根据项目44所述的组合物,其中所述溶栓剂是选自链激酶、尿激酶和重组组织纤溶酶原活化剂中的至少一个。46.根据项目45所述的组合物,其中所述重组组织纤溶酶原活化剂是阿替普酶、瑞替普酶或替奈普酶。47.一种制备用于治疗神经变性的异质性骨髓细胞亚群的方法,其包括:a)从未处理的骨髓获得骨髓细胞群;b)将所述骨髓细胞群以低密度接种在塑料表面上;c)洗涤所述接种的细胞群以除去未附着的细胞;d)在含血清的培养基中将来自所述洗涤的细胞群的所述附着的细胞培养至接近汇合;e)将所述培养的细胞连续传代不超过约七次连续传代,其中,在每次传代时,以低密度接种所述培养的细胞;和f)获得所述异质性骨髓细胞亚群,其中所述异质性骨髓细胞亚群治疗神经变性。48.根据项目47所述的方法,其中所述未处理的骨髓从没有使用化疗剂进行预治疗的受试者获得。49.根据项目48所述的方法,其中所述化疗剂是5-氟尿嘧啶。50.根据项目48所述的方法,其中所述骨髓细胞群不能通过密度分离法或通过ack裂解液来分离。51.根据项目50所述的方法,其中所述密度分离法需要ficolltm或percolltm梯度。52.根据项目47所述的方法,其中所述神经变性由缺血引起。53.根据项目47所述的方法,其还包括在神经变性实验模型中测试所述异质性骨髓细胞亚群,其中只选择显示治疗神经变性的能力的那些群。54.根据项目53所述的方法,其中所述实验模型是缺血实验模型。55.根据项目54所述的方法,其中所述缺血实验模型是氧/葡萄糖剥夺(ogd)细胞培养模型。56.根据项目54所述的方法,其中所述实验模型是中风动物模型。57.一种优化用于分离治疗神经变性的细胞群的实验方案的方法,其包括:根据实验方案分离细胞群;其中所述细胞群治疗神经变性;和其中通过测试每个参数对所述分离的细胞群在神经变性实验动物模型中治疗神经变性的效果的影响来确定所述方案的每个步骤的最佳参数。58.根据项目57所述的方法,其中所述神经变性由缺血性中风引起。59.根据项目57所述的方法,其中所述参数包括接种时的细胞密度、细胞传代次数、培养基组成或细胞分离方法。60.根据项目57所述的方法,其中所述神经变性实验模型是缺血实验模型。61.根据项目60所述的方法,其中所述缺血实验动物模型是氧/葡萄糖剥夺(ogd)细胞培养模型。62.根据项目60所述的方法,其中所述缺血实验动物模型是中风动物模型。63.根据项目60所述的方法,其中所述缺血实验模型是大脑中动脉阻塞(mcao)动物模型。附图说明本领域技术人员将理解下述附图仅仅出于说明目的。图形并非旨在以任何方式限制教导的范围。图1描述了使用体外ogd模型(图1a、1b和1e)和体内mcao大鼠模型(图1c、1d和1f)筛选源自骨髓的候选细胞亚群的结果。图1a和1b分别描述了响应于源自骨髓的7种不同候选细胞亚群的存在或不存在,体外ogd模型中的宿主细胞存活和细胞因子释放(bfgf和il-6)。图1c和1d比较了响应于静脉注射(iv)或动脉注射(ica)ncs-01骨髓细胞亚群或盐水,体内mcao大鼠模型中的宿主细胞存活、梗塞体积和神经功能。图1e描述了响应于ncs-01骨髓细胞亚群的存在或不存在,体外ogd模型中的宿主细胞存活和细胞因子释放(bfgf和il-6)。图1f示出了响应于注射3x105、106和107个ncs-01骨髓细胞,体内mcao大鼠模型中的梗塞体积和神经功能的变化。图2示出了响应于ica注射1ml的7.5x106个ncs-01细胞或盐水溶液,暂时性(60分钟)或永久性mcao大鼠模型中的梗塞体积(a图)和神经功能(b图,以改良bederson评量法测量(modifiedbedersonscale,0=正常至3=最严重))的变化。图3示出了描述在体外氧葡萄糖剥夺(ogd)分析中所使用的方案的示意图。图4示出了在加入盐水、li细胞或ncs-01细胞后,ogd分析的细胞培养基中分泌的bfgf和il-6细胞因子的相对水平。图5a和5b描述了响应于注射盐水、li细胞和ncs-01细胞,体内mcao大鼠模型中的宿主细胞存活、梗塞体积和神经功能。发明详述除非另有说明,本发明的实践采用本领域技术范围内的常规分子生物技术。这种技术是本领域技术人员所公知的,并且在文献中充分解释。参见例如ausubel等人编写,currentprotocolsinmolecularbiology,johnwiley&sons,inc.,ny,n.y.(1987-2008),包括所有补充内容;sambrook等人,molecularcloning:alaboratorymanual,第二版,coldspringharbor,n.y.(1989)。除非另有定义,本文中所用的全部技术和科学术语都具有与本领域技术人员所普遍理解的相同含义。本说明书还提供术语定义以帮助解释本申请的公开内容和权利要求。在定义与其他地方的定义不一致的情况下,将以本申请中所述的定义为准。源自骨髓(bm)的细胞包括许多不同类型的细胞的异质性混合物。骨髓由属于两种不同的谱系—造血组织和相关的支持基质的两种主要细胞系统组成。因此,已知骨髓中共存至少两种不同的干细胞,即造血干细胞(hsc)和间充质干细胞(msc)(bianco,m.riminucci,s.gronthos和p.g.robey,"bonemarrowstromalstemcells:nature,biology,andpotentialapplications,"stemcells,第19卷,第3期,第180-192页,2001)。msc可同时通过细胞表面标志物和通过它们附着于组织/细胞培养塑料的能力来广泛定义。因此,msc群必然是异质性的,即,不是克隆细胞群。即使msc亚群共有一个或多个共同的细胞表面标志物,然而,取决于用来分离这些亚群的生产方法,这些亚群在它们的生物活性上可能具有明显差异。本公开描述了两步骤筛选方案,其可用于鉴定有效治疗包括由缺血引起的包括急性发作神经变性的神经变性的异质性骨髓细胞群。在第一步骤中,筛选出具有在包含候选骨髓亚群和神经细胞的共培养物中减轻氧葡萄糖剥夺(ogd)作用的能力的骨髓亚群。候选骨髓亚群减轻神经变性的活性通过测量培养基中的营养因子(bfgf和il-6)的分泌以及在ogd分析中测定宿主细胞存活来评估。在第二步骤中,在ogd分析中具有最强活性的源自骨髓的细胞群随后通过在由缺血引起的神经变性的体内mcao大鼠模型中进行测试来进一步筛选。这一筛选程序有助于鉴定称为ncs01的异质性骨髓亚群,其极大减轻由缺血引起的神经变性,如本文所定义。本领域技术人员容易获得未处理的骨髓细胞。如本文中所用,术语“未处理的骨髓”是指未经任何附加处理如密度分离法或细胞分选的人骨髓抽出物。在其他实施方式中,“未处理的骨髓”从未使用任何干预正常细胞生长和分裂的试剂预治疗的受试者获得,所述试剂包括例如化疗剂,如抗有丝分裂剂或抗代谢剂。在cancerprinciplesandpracticeofoncology,v.t.devita和s.hellman(编者),第六版(2001年2月15日),lippincottwilliams&wilkinspublishers中可找到这种试剂的实例。如本文中所用,“抗代谢”剂涉及抑制或中断导致细胞死亡的dna合成的化合物。抗代谢剂的实例包括,但不限于,6-巯基嘌呤;阿糖胞苷;氟达拉宾;氟尿苷;5-氟尿嘧啶;卡培他滨;雷替曲塞;甲氨蝶呤;克拉屈滨;吉西他滨;盐酸吉西他滨;硫鸟嘌呤;羟基脲;dna脱甲基化剂,如5-氮杂胞苷和地西他滨;依达曲沙;和叶酸拮抗剂如,但不限于,培美曲塞。如本文中所用,术语“密度分离法”是指使用ficoll-paquetm或percolltm梯度基于细胞密度分离骨髓细胞的公知实验室程序。例如,将ficoll-paquetm置于圆锥形管的底部,随后缓慢地将未处理的骨髓层覆在ficoll-paquetm的顶部上。在离心细胞以使细胞通过ficoll梯度之后,细胞会根据密度分成数层,从顶部至底部:血浆和其他成分;称为暗黄层(buffycoat)的单核细胞层,其包含外周血液单核细胞(pbmc)和单核细胞(mnc),和沉淀中的红细胞与粒细胞。该分离程序分开了红细胞与pbmc。乙二胺四乙酸(edta)和肝素常与ficoll-paquetm共同使用以防止凝结。如本文中所用,术语“ack裂解液(acklysis)”是指用于在edta抗凝全血中裂解红细胞的氯化铵钾(ammoniumchloridepotassium)裂解缓冲液(ack裂解缓冲液)。如本文中所用,术语“以低密度接种骨髓细胞群”是指在细胞培养开始时所加入的骨髓细胞浓度。在一个方面,骨髓细胞以约102或约103或约104或约105或约106个细胞/cm2的密度接种。在优选方面中,骨髓细胞以约105-约106个细胞/cm2的密度接种。如本文中所用,“神经变性”是指任何导致包括神经细胞死亡的神经细胞的结构或功能逐渐丧失的病理状态。因此,神经变性是神经失调引起的病理状态。在一个实施方式中,短语“神经细胞(neuralcell)”包括神经细胞(nervecell)(即,神经元,例如单极、双极或多极神经元)和它们的前体以及神经胶质细胞(例如,大胶质细胞,如,少突胶质细胞、雪旺细胞和星形胶质细胞或小胶质细胞)和它们的前体。在一个实施方式中,“有效量”是指引起与神经变性相关的症状和/或病理状态的临床上明显改善(包括减缓、停止或逆转神经变性、减少神经功能缺损或改善神经反应)所需要的最佳细胞数量。在一些实施方式中,有效量的ncs-01细胞群是指减少由中风后急性神经变性的突然发作引起的梗塞体积所需要的最佳细胞数量。本领域技术人员可使用常规实验测定用于特定生物体的ncs-01细胞群的适当的有效量。如本文中所用,“治疗神经变性”是指通过ncs-01细胞群治疗神经变性,导致与神经变性相关的症状和/或病理状态的临床上明显改善,包括减缓、停止或逆转神经变性、减少神经功能缺损或改善神经反应。如本文中所用,“溶栓剂”是指在称为溶栓的程序中医学上用于溶解血块的药物。溶栓药物的非限制性实例包括组织纤溶酶原组织活化剂tpa、阿替普酶(activase)、瑞替普酶(retavase)、替奈普酶(tnkase)、阿尼普酶(eminase)、链激酶(kabikinase、streptase)和尿激酶(abbokinase)。下文描述了用于从未处理的全骨髓中分离并表征异质性骨髓细胞亚群的程序,其能最佳治疗包括治疗由缺血引起的神经变性的神经变性。分离有效治疗由缺血引起的神经变性的候选骨髓细胞群从未使用抗有丝分裂剂或抗代谢剂,如5-氟尿嘧啶(5-fu),预治疗的哺乳动物获取未处理的全骨髓。然后将该未处理的骨髓直接铺板在组织/细胞培养塑料上并在含血清的培养基中连续传代以进行扩增。在每次传代时,细胞以极低的细胞密度接种,即约750个细胞/cm2或更少,并在附加传代之前培养至接近汇合。通过洗涤除去未附着的细胞。由于骨髓不通过密度分离法处理,初始全骨髓细胞群包括造血细胞与非造血细胞以及成核骨髓细胞与非成核骨髓细胞二者。然后优选地分别在第3代传代和第5代传代时建立主细胞库(mastercellbank,mcb)和工作细胞库(workingcellbank,wcb),并冷藏保存。在需要时,以极低的密度接种wcb细胞,例如约750个细胞/cm2或更少,并在使用标准程序收获并冷藏保存之前在含血清的培养基中进行扩增。用于评估骨髓细胞群减轻神经变性的能力的两步骤选择方案“候选”骨髓细胞群可随后使用两步骤程序进行筛选,选择用于治疗神经变性的最佳骨髓细胞群。在第一步骤中,在体外氧葡萄糖剥夺分析中测试候选骨髓细胞群,在该分析中在模拟神经变性的实验条件下共培养候选骨髓细胞群与神经细胞。然后筛选显示体外减轻神经变性的细胞群的体内治疗神经变性的能力。在第二步骤中,在由缺血引起的神经变性的大鼠mcao模型中评估选择的候选骨髓细胞群。然后选择显示出最高的体内减轻神经变性的活性的候选异质性骨髓细胞群。通过该两步骤筛选程序选择的异质性骨髓细胞群被称为ncs-01细胞群或ncs-01。鉴定用于分离具有神经变性减轻活性的骨髓细胞群的最佳细胞培养条件该两步骤筛选程序也可用于鉴定最佳实验条件,如用于培养能够治疗神经变性的骨髓细胞群的接种时的细胞密度、细胞传代次数、培养基组成或细胞分离方法。因此,使用该两步骤程序,每次传代时的最佳再接种细胞浓度为约750个细胞/cm2或更少。最佳培养基是含血清的培养基。从初次铺板未处理的全骨髓开始,ncs-01细胞群可传代不超过约7次、或约6次、或约5次、或约4次、或约3次或约2次。从初次铺板未处理的全骨髓开始,延长的传代,即超过7次传代,减少或消除ncs-01在ogd体外分析和在mcao大鼠模型中治疗神经变性的能力。ogd分析和神经变性mcao大鼠模型现在下文中详细描述。体外筛选能够治疗神经变性的骨髓细胞群首先在模拟由缺血引起的神经变性的氧-葡萄糖剥夺(ogd)培养条件之后在神经元-星形胶质细胞共培养物中筛选具有预防神经变性的能力的候选骨髓细胞群。首先使大鼠或人的神经元和星形胶质细胞的初级混合培养物暴露于氧葡萄糖剥夺(ogd)培养条件(例如,8%的氧气,不含葡萄糖的培养基)约0.5小时至3小时以诱导神经变性。然后中断细胞培养物的氧葡萄糖剥夺,将经ogd诱导的神经细胞在生理条件下培养2小时,然后在候选骨髓细胞群存在的情况下再共培养3小时。然后在ogd之后0小时和5小时,通过测量在候选骨髓细胞群存在或不存在的情况下的宿主细胞活力来评估神经变性。宿主细胞(神经元和星形胶质细胞)活力可使用例如台盼蓝染色法和/或mtt(溴化-3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四氮唑)分析来评估。在候选骨髓细胞群存在的情况下的细胞活力比对照(不添加候选骨髓细胞群)的细胞活力增加约5%、或约10%、或约15%、或约20%或约25%或更高,表明候选骨髓细胞群可以保护并挽救神经元/星形胶质细胞共培养物免受由氧和葡萄糖剥夺引起的神经变性。此外,也可以使用可商购elisa试剂盒来分析在候选骨髓细胞群存在或不存在的情况下下经受ogd条件的神经元/星形胶质细胞培养物的培养基的营养因子例如bfgf和/或il-6的诱导分泌。在某些实施方式中,根据候选骨髓细胞群响应氧葡萄糖剥夺(而不是在氧葡萄糖剥夺不存在的情况下)而诱导神经元-星形胶质细胞共培养物的培养基中的分泌的bfgf和/或il-6的量增加的能力来选择候选骨髓细胞群。在其他实施方式中,根据候选骨髓细胞群响应氧葡萄糖剥夺(而不是在氧葡萄糖剥夺不存在的情况下)而诱导神经元-星形胶质细胞共培养物的培养基中分泌的bfgf和/或il-6的量增加至少两倍或更多的能力来选择候选骨髓细胞群。然后,选择降低ogd诱导的细胞死亡发生率并诱导分泌的营养因子(如bfgf和/或il-6)的量增加的候选骨髓细胞群,以用于在体内mcao大鼠模型中进行筛选(参见下文)。例如,如果候选骨髓细胞群使ogd诱导的细胞死亡发生率降低超过约25%并使分泌的营养因子的量增加至少10%或更多,可选择该候选骨髓细胞群以进行进一步筛选。体内筛选能够治疗神经变性的候选骨髓细胞群测试上述ogd分析筛选步骤中选择的候选骨髓细胞群的体内治疗神经变性的能力。例如,可测试候选骨髓细胞群在包括神经变性疾病的转基因模型的神经变性实验动物模型中治疗神经变性的能力(参见,例如,harvey等,transgenicanimalmodelsofneurodegenerationbasedonhumangeneticstudies,jneuraltransm.(2011)118(1):27-45;trancikova等,geneticmousemodelsofneurodegenerativediseases.progmolbioltranslsci.(2011),100:419-82;chan等,generationoftransgenicmonkeyswithhumaninheritedgeneticdiseasemethods(2009)49(l):78-84;rockenstein等,transgenicanimalmodelsofneurodegenerativediseasesandtheirapplicationtotreatmentdevelopmentadvdrugdelivrev.(2007)59(11):1093-102)。在一个实施方式中,神经变性实验动物模型可以是中风/脑缺血动物模型(graham等人综述,compmed.200454(5):486-96),如mcao大鼠模型,其中围绕脑动脉的手术植入的结扎线的收缩通过限制流向大脑的血流来模拟缺血性中风的效果并引起缺血和后续的神经变性。在暂时性mcao模型中,通过恒定速率输注至暂时性mcao大鼠的血流中来施用ogd分析中选择的候选骨髓细胞群。本领域技术人员可以测定范围可以例如从7.5x104至3.75x107个细胞的适合剂量。细胞可注射至例如颈静脉(iv)或颈动脉(ica)中。对照由施用等体积冷藏保存培养基或盐水溶液组成。然后,候选骨髓群中的细胞迁移至由暂时性mcao引起的梗塞的位点。然后,在梗塞形成后的不同时间使用改良bederson神经测试法(modifiedbedersonneurologictest)评估ogd选择的骨髓细胞群存在或不存在的情况下的神经功能。随后,处死大鼠,并通过苏木精与曙红(h&e)或尼氏染色法(nisslstaining)对来自经处理和未经处理的mcao大鼠的脑组织切片进行染色,测量梗塞体积和宿主细胞存活。然后在mcao后最多28天,根据骨髓细胞群与对照动物相比改善神经功能、增加宿主细胞存活和减少梗塞体积的能力来选择骨髓细胞群。用于治疗由缺血性中风引起的神经变性的组合疗法使通过大脑中动脉的血流停止延长的时间段,模拟血块造成的永久性动脉阻塞。在允许再灌注的恢复之前使通过脑动脉的血流停止有限的时间段的暂时性阻塞,旨在模拟疗法如溶栓或机械性血块去除,其在由缺血性中风引起的动脉阻塞之后立即恢复使血液流向中风半暗带。在许多方面,对暂时性mcao大鼠施用ncs-01细胞群模拟溶栓或机械性血块去除(包括血管成形术或手术植入支架)导致的阻塞动脉再灌注。当神经变性由缺血性中风引起时,ncs-01细胞群可与溶栓疗法结合来治疗由缺血引起的神经变性。在例如美国专利第5,945,432号和第6,821,985号中可找到溶栓剂和它们的施用的描述。缺血事件后注射的溶栓剂可在注射ncs-01细胞群之前、同时或之后施用。根据本领域公知的程序,可与注射所公开的ncs-01细胞组合物组合的用于改善流向中风半暗带的血流的机械程序的非限制性实例包括血管成形术或植入支架。本发明将参考以下实施例作进一步详细描述。实施例实施例陈述了根据本发明的用于分离、选择和使用骨髓细胞亚群来治疗神经变性的方法。应理解这些实施例中描述的方法步骤并非旨在限制。本发明除上文所述以外的进一步目的和优势从实施例来看将是明显的,所述实施例并非旨在限制本发明的范围。实施例1:分离ncs-01细胞群1)分离候选骨髓细胞群通过以下生产方法分离异质性骨髓细胞群:●从合格商业供货商提供的年龄为50岁或更年轻的经预筛选的健康供体收获未处理的人骨髓。从未使用任何抗有丝分裂剂如5-氟尿嘧啶预治疗的供体收获骨髓。●然后,以低密度(102-106个细胞/cm2)将经处理过或未经处理的骨髓接种于组织/细胞培养塑料表面上,并在存在含血清的培养基的情况下培养;●在允许细胞附着于塑料的若干天后,通过洗涤除去未附着的细胞;和●在含血清的培养基中将附着的细胞群培养至接近汇合;对培养的细胞群连续传代不超过约七次连续传代,其中,在每次传代时,以低密度接种培养的细胞。为选择用于分离可以治疗神经变性的骨髓细胞群的最佳培养条件,将细胞群最初在不同培养条件下生长,所述培养条件如接种时的细胞密度、细胞传代次数、培养基组成或细胞分离方法(参见表i)。在补充有2mmglutamax(invitrogen)和10%胎牛血清(fbs,hyclone或gibco)的α-mem或者补充有2mmglutamax(invitrogen)和10%胎牛血清(fbs,hyclone或gibco)的α-mem(mediatech)的存在下,将来自未处理的骨髓或者在密度分离法或ack裂解后的骨髓细胞接种在组织/细胞培养塑料上。在洗涤以除去未附着的细胞之后,允许附着的细胞增殖至接近汇合。然后将细胞连续传代总计3次、4次、5次或6次传代。然后测试候选骨髓细胞群在体外ogd分析和体内mcao研究中治疗神经变性的能力。表i细胞细胞部分培养基传代细胞1未处理的bm*αmem+10%fbs3细胞2使用ficollαmem+10%fbs3细胞3使用ack裂解液αmem+10%fbs3细胞4使用ficoll不含血清的培养基(stempro)6细胞5使用ack裂解液不含血清的培养基(stempro)5细胞6使用ficoll不含血清的培养基(stempro)4细胞7使用ack裂解液不含血清的培养基(stempro)4*骨髓2)使用体外氧/葡萄糖剥夺(ogd)方案进行初次筛选使用体外氧/葡萄糖剥夺(ogd)实验方案来评估上文概述的生产方法中的不同参数,如在密度分离法存在或不存在的情况下制备骨髓、接种密度、传代次数、培养基和/或它们的组合,从而确定用于分离治疗神经变性的候选骨髓细胞群的最佳程序。由于体外ogd模型模拟由缺血性中风引起的神经变性,选择其作为初步筛选。具体而言,ogd测试特定候选骨髓细胞亚群是否可以预防培养物中的神经细胞死亡并诱导分泌神经保护性营养因子,如bfgf和il-6。在体外氧葡萄糖剥夺(ogd)模型中,大鼠神经元与星形胶质细胞(以1:1的比例)的初级混合培养物暴露于ogd损伤(8%的氧气;不含葡萄糖的厄尔平衡盐溶液)90分钟,并回到生理条件下持续2小时,在此之后,将候选骨髓细胞群加入经ogd处理的神经元-星形胶质细胞共培养物中再培养3小时。在ogd后立即使用和在ogd后5小时时使用标准台盼蓝染色法和mtt(溴化-3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四氮唑)方法评估神经细胞活力。细胞培养根据供货商的方案(cambrex,md)将大鼠神经元与星形胶质细胞的初级混合培养物维持在培养物中。解冻后立即将细胞(4x104个细胞/孔)接种在涂覆有聚赖氨酸的96孔板中,并在含有2mm的l-谷氨酸盐、2%的b27(gibco,ca)和50u/ml的盘尼西林与链霉素的神经基础培养基(gibco,ca)中,在含有5%co2的潮湿气氛中在37℃下生长7-10天。然后分别使用map2和gfap免疫染色法评估神经元细胞群和星形胶质细胞群的纯度,发现高于99%。氧-葡萄糖剥夺(ogd)和与候选骨髓细胞群共培养使培养的细胞暴露于如前所述但略加修改的ogd损伤模型(malagelada等,stroke(2004)35(10):2396-2401)。简单来说,将培养基用不含葡萄糖的厄尔平衡盐溶液(bss)替代,该不含葡萄糖的厄尔平衡盐溶液具有以下组成:116mm的nacl、5.4mm的kcl、0.8mm的mgso4、1mm的nah2po4、26.2mm的nahco3、0.01mm的甘氨酸、1.8mm的cacl2且ph调节至7.4。将培养的细胞置于加湿室中以使用92%n2与8%o2的连续流平衡15分钟。在平衡完成之后,密封所述室并将其在37℃培养箱中放置90分钟。在这一时间段之后,通过将葡萄糖加入培养基中来终止ogd,并将培养物返回至标准的95%o2和5%co2培养箱。然后在标准培养基中且在正常含氧量条件下允许进行2小时“再灌注”,在此之后,将候选骨髓(bm)细胞群加入经ogd处理的混合神经元-神经胶质细胞培养物中约3小时。然后通过洗涤从混合培养物分离上清液和骨髓细胞群。之后,在细胞上进行细胞活力和免疫细胞化学试验,并如下所述使用可商购elisa分析来测量分泌的营养因子的量。细胞活力分析在两个时间点评估细胞活力:在ogd后立即进行,和在ogd后5小时时进行(即,再灌注2小时加上使用选择的骨髓细胞群处理3小时)。对于ogd后活力分析,使含有源自骨髓的细胞的上清液与附着的混合神经细胞培养物分离。进行台盼蓝染色法,并在每个孔(每个处理条件n=5)中的三个随机选择区域(0.2mm2)中计算平均活细胞数,以显示每个处理条件的细胞活力。此外,对从上清液中作为沉淀收获的源自骨髓的细胞亚群进行台盼蓝染色。elisa分析推测源自骨髓的细胞所分泌的营养因子如bfgf和il-6以及可能的神经营养因子参与治疗由ogd培养条件模拟的神经变性。因此,测量分泌到培养基中的这些分子的量提供了借此评估可以体内治疗神经变性的候选骨髓细胞群的标准。收集来自标准培养条件下或暴露于ogd的神经细胞与候选骨髓细胞群的共培养物的上清液,并根据制造商说明书使用可商购elisa试剂盒分析其中营养因子分泌的存在。图1a和1b示出根据上文表i中描述的参数处理的源自骨髓的细胞群的ogd分析结果。基于图1a和1b所述结果,选择αmem+10%fbs作为最佳细胞培养基,并发现未处理的骨髓优于通过密度分离法(如ficoll-paque或percoll)或ack裂解液处理的骨髓。发现未处理的骨髓细胞在αmem+10%fbs的培养基中的最佳传代次数是不超过7次传代。3)使用体内大脑中动脉阻塞大鼠模型进行候选骨髓细胞群的第二次筛选和选择基于在体外ogd模型中的初步筛选所获得的结果,通过比较使用候选骨髓细胞群处理的mcao大鼠与仅接受盐水溶液处理的mcao大鼠的神经功能缺损和梗塞体积,评估每种候选骨髓细胞群治疗神经变性的生物活性。大脑中动脉阻塞(mcao)手术使用异氟醚(在氧气中含1.5%~2.5%)麻醉动物。将头皮剃毛,并使用酒精和氯己定手术擦拭液擦拭。然后将动物置于立体定位装置中。从眼部稍微后方处开始,制造长约2.5cm的中线矢状切口,使用手术铲的圆端使颅骨区域暴露。以前囱作为参考点,从以下坐标(ap:+2.0,ml:±2.0)获得基线(即,中风手术前)激光多普勒记录。将从下颌到胸骨柄处的颈腹侧(ventralneck)上的皮肤剃毛,并使用酒精和氯己定手术擦拭液擦拭。然后将动物移至手术显微镜下方。在右侧颈动脉上方制造皮肤切口。分离颈外动脉,并在尽可能远处的地方将其结扎。烧灼枕动脉。有时可能也需要烧灼从颈外动脉延伸出的另一条或两条分支。在颈外动脉近端处设置第二个结扎,然后在结扎之间切断颈外动脉。结扎翼颚动脉。在此之后,在颈总动脉周围临时缝合以提供张力并限制血流。使用结扎拉回颈外动脉的近端,有效地拉直颈动脉分叉。使用微型剪刀对在颈外动脉的端部(stump)制造切口,将具有预制末端的4-0尼龙线插入颈内动脉并向上递入直到感到阻力为止(约15-17毫米)。这有效地阻断大脑中动脉(mca)。在颈外动脉的近端周围利用结扎将线固定在适当的位置。分离对侧的颈总动脉,并使用临时结扎将其固定。使用缝合钉闭合皮肤切口。然后将动物固定于立体定位装置,以进行激光多普勒记录来显示成功的mca阻塞。5分钟后,除去对侧颈总动脉的结扎。中断异氟醚,并将动物置于电热毯上的恢复笼中。60分钟后,再次使用异氟醚麻醉动物,打开切口以在暂时性模型中进行测试。除去引起阻塞的线,并将靠近颈动脉分叉的颈外动脉端部结扎。使用缝合钉闭合皮肤切口。再次将动物固定于立体定位装置,以进行激光多普勒记录来显示成功的再灌注。最后,将动物置于电热毯上的恢复笼中。神经功能测试对每只大鼠进行公知的改良bederson神经测试,其涉及获得以下各项来自每只大鼠的评分:●对侧后肢回缩,其在将动物后肢朝侧向移动2-3cm后,测量动物将后肢复位的能力,评级从0(立刻复位)到3(没有复位);●横木行走能力,评级从容易横穿2.4cm宽、80cm长的横木的大鼠的0级到不能在横木上停留10秒的大鼠的3级;和●双边前爪抓握,其测量在2mm直径钢杆上保持的能力,评级从具有正常前爪抓握行为的大鼠的0级至不能使用前爪抓握的大鼠的3级。在每个评估日,在约15分钟的时间段内评估所有三项测试的评分。计算三项测试的平均评分以提供范围从0(正常神经功能)到最大为3(严重神经功能缺损)的综合神经功能缺损评分。因此,分数越高,神经功能缺损越大。基于初步研究,评分高于约2.5则代表动物具有中风的神经功能缺损特征。组织学脑切片制备脑切片制备旨在鉴定脑损伤区域。在mca阻塞后7天或28天,使大鼠安乐死,使用盐水,然后是4%的聚甲醛,通过跨心脏灌注来灌注大鼠。然后将脑固定在4%的聚甲醛中,接着浸渍在25%蔗糖中。将每个前脑切成30μm厚的冠状组织切片,其具有对应于每只动物从前囱5.2mm至前囱-8.8mm的前后坐标。测量梗塞体积处理每个大脑至少4个冠状组织切片,以用于苏木精与曙红(h&e)或尼氏染色法。使用其中从对侧半球面积中减去同侧半球的未受损面积的间接的病变区域来显示脑梗塞。病变体积表现为病变与对侧半球相比较的体积百分比。病变体积的组织学测定使用苏木精与曙红(h&e)或尼氏染色法,以及经由nihimagej软件数字捕捉并处理代表性图像,并进行量化图像分析来进行。根据以下公式测定病变体积:切片厚度×所有脑切片中梗塞面积之和。为最小化梗塞面积中由缺血后水肿所产生的人为因素(artifact),通过从对侧半球的未受损总面积中减去同侧半球中的非梗塞面积来间接测量同侧半球中的梗塞面积。测量缺血性外围梗塞区中的细胞存活使用随机选择的对应于皮质外围梗塞区的高倍视野来计数该缺血区域中存活的细胞(见yasuhara等,stemcellsanddev,2009)。为估算缺血皮质区域内的宿主神经细胞活力,使用结晶紫溶液(sigma,st.louis,mo)进行尼氏染色,并用相机(carlzeiss,axiophot2)捕获3个切片中的皮质区域和对应的对侧未受损皮质中的随机选择的视野,并通过计数随机选择的高倍视野(28,800μm2)中的细胞来测定细胞数量。计算受损皮质中保存的神经元相对于未受损侧的百分比,并将其用于统计学分析。对脑切片进行盲编码(blind-coded),并使用abercrombie公式校正所计数的染色细胞总数。使用mcao中风动物模型筛选候选骨髓细胞群使3只(用于iv施用)或6只(用于ica施用)雄性大鼠/组经受1小时暂时性mcao,然后对其注射含有盐水或根据上述方案分离的7.5x106个源自骨髓的细胞(称为ncs-01细胞群)的1ml注射介质。施用细胞后,随访动物直至7天。图1c和1d示出了当施用于患有暂时性mcao的大鼠中时,iv或ica施用的ncs-01骨髓细胞群提供了实质性的神经学或病理学益处。而且,ncs-01通过治疗缺血诱导的神经变性,从而减少梗塞体积并改善神经功能缺损来预防宿主细胞死亡。重复初步体外筛选和二次体内筛选程序直到方法可靠且可再现地产生能够治疗神经变性的最佳源自骨髓的细胞亚群(称为ncs-01细胞群)。在体外ogd模型中再次测试优化的ncs-01细胞群来确认在与人神经元和星形胶质细胞共培养物中的抗神经变性活性(参见图1e),并在大鼠mcao模型中再次体内测试(参见图1f)。图1f描述的实验也示出ncs-01细胞群治疗神经变性的能力是剂量依赖性的。实施例2:用于产生能治疗神经变性的ncs-01细胞群的标准化生产程序从未使用任何抗有丝分裂剂或抗代谢剂如5-氟尿嘧啶(5-fu)预治疗的哺乳动物收获未处理的全骨髓。由于不通过密度分离法或ack裂解来处理骨髓,起始全骨髓细胞群可包括造血细胞和非造血细胞以及成核骨髓细胞和非成核骨髓细胞二者。稀释上述未处理的骨髓,并以低密度(105~106个细胞/cm2)接种在组织/细胞培养塑料表面上,并在含血清的培养基(补充有2mmglutamax(invitrogen)和10%胎牛血清(fbs,hyclone或gibco)的α-mem(不含酚红)或者补充有2mmglutamax(invitrogen)和10%胎牛血清(fbs,hyclone或gibco)的α-mem(mediatech))的存在下培养。然后将细胞培养物在37℃、5%co2、80%rh(相对湿度)下培养72小时。使用d-pbs冲洗细胞以从细胞培养塑料上除去未附着的细胞和rbc,接着使用完全培养基替换经补充的α-mem,该完全培养基用于所有后续喂养。然后将细胞培养物(第0次传代或p0)在37℃、5%co2、80%rh下培养。对于第1次传代,使用d-pbs冲洗细胞,使用细胞分离剂使塑料附着细胞脱离。通过在300g(~1000rpm)离心8-10分钟来收获分离的细胞。使用经补充的α-mem来再悬浮沉淀细胞,并以约750个细胞/cm2的密度将其接种在组织/细胞培养塑料表面上。在额外传代之前,将细胞培养至接近汇合。收获细胞,并再次如上所述以约750个细胞/cm2的密度将其接种在组织/细胞培养塑料表面上以进行第2次传代。对于第3次传代,如上所述使用细胞分离剂和离心来收获细胞。然后再悬浮沉淀细胞并将其集中。将细胞再悬浮在冷藏保存培养基中,并将1ml细胞悬浮液分装在冷冻管中(nunc)。使用控制速度的冷冻机冷冻小瓶,一旦冷冻程序完成,将小瓶移至干冰上以在气相液氮冷冻器中永久保存。含有第3次传代(p3)的细胞的小瓶构成mcb。解冻一个mcb小瓶,以约750个细胞/cm2的密度将在补充有10%fbs与glutamaxtm的α-mem中的复原细胞(第4次传代或p4)接种在组织/细胞培养塑料上。然后将细胞在37℃、5%co2、80%rh下培养。对于第4次传代,在额外传代之前,将细胞培养至接近汇合。如上所述收获细胞并将其接种在新的组织/细胞培养塑料表面上。对于第5次传代,依照上述针对mcb的方法收获并冷冻细胞。分装在小瓶中并在第5次传代(p5)时冷藏保存的细胞构成wcb。需要时,解冻一个wcb小瓶,以约750个细胞/cm2的密度将补充有10%fbs与glutamaxtm的α-mem中的复原细胞接种在组织/细胞培养塑料上。然后将细胞在37℃、5%co2、80%rh下培养。对于第6次传代,在额外传代之前,将细胞培养至接近汇合。如上所述,收获细胞并将其接种在新的组织/细胞培养塑料表面上。在传代中途改变培养基(wcb到第6次传代和第6次传代和第7次传代)。对于第7次传代,依照上述针对mcb的方法收获并冷冻细胞。实施例3:使用ncs-01细胞治疗由永久性对比暂时性大脑中动脉阻塞(mcao)引起的神经变性比较经ncs-01处理的永久性mcao大鼠与经ncs-01处理的暂时性(60分钟)mcao大鼠的梗塞体积和神经功能。暂时性mcao模拟使用恢复流向中风半暗带的血流的现有标准临床程序治疗由中风引起的动脉阻塞。这些程序包括施用溶栓剂以及涉及机械性除去血块的程序如血管成形术和/或血管支架。使3只或6只大鼠的组经受永久性或暂时性mcao(使用再灌注)。然后在缺血后24小时ica施用1ml盐水或1ml的7.5x106个ncs-01细胞,并监测大鼠直至28天。然后使用改良bederson神经测试法评估神经功能。暂时性阻塞模型模拟其中经tpa治疗或经受凝块除去的中风患者的情形。图2结果示出在两种mcao范例中使用ncs-01细胞群处理的显著组织学益处(梗塞体积;a图)和临床益处(改良bederson评量;b图)。暂时性阻塞模型中的益处比永久性阻塞模型中的益处高出2倍至3倍。神经响应的时间时程(b图)示出在梗塞后高达28天的稳定改善,在这个时段期间,未再灌注(永久性阻塞)且未经处理的对照平均改善11%,而再灌注(暂时性阻塞)且经ncs-01处理的动物平均改善67%。预料不到的是,ncs-01在暂时性阻塞模型中更有效地治疗症状,这启示当加入ncs-01与除去凝块(无论是施用溶栓剂后,还是使用机械装置除去凝块后)结合时可获得最大效果。实施例4:ncs-01细胞与其他源自骨髓的细胞之间的比较1)根据li等分离骨髓细胞群如li等的出版物(journalofcerebralbloodflowandmetabolism(2000)20:1311-1319)所述正确制备骨髓细胞群(下文称li骨髓细胞群)。从在收获前2天接受腹腔内注射抗代谢药物5-氟尿嘧啶(5-fu,150mg/kg)的成年小鼠获得初级培养的骨髓细胞(randall和weissman,1997)。使用连接到含有磷酸盐缓冲盐水(pbs,0.5ml)的1ml针筒的21号针从胫骨和股骨无菌收获新鲜的完整骨髓。机械性分离骨髓直到形成牛奶状均质单细胞悬浮液。使用0.84%nh4cl从骨髓中除去红细胞,并使用血细胞计数器测定成核骨髓细胞数量。将2x106个成核细胞在补充有胎牛血清(10%)的伊思考夫改良杜尔贝可培养基中接种在组织培养烧瓶中。孵育3天后,细胞紧密附着在塑料上,使细胞再悬浮于新烧瓶中的新鲜伊思考夫改良杜尔贝可培养基中,并使细胞生长以用于进行另外三次传代。2)在体外ogd分析中比较li细胞群与ncs-01细胞群从同一mcb和骨髓的不同wcb制造两批ncs-01,并将其与li细胞群在图3概述的体外ogd模型中一起测试。如图4所示,两批ncs-01细胞都在il-6和bfgf二者的分泌中产生相同的增加。因此,使用上述优化的生产程序产生的ncs-01细胞群在体外ogd分析中一致地治疗神经变性。相比之下,如li(2002)出版物中所述正确分离的li细胞群在ogd分析中产生比ncs-01细胞群少4-5倍的bfgf和il-6。2)在体内mcao分析中比较li细胞群与ncs-01细胞群使用mcao大鼠模型体内测试ncs-01细胞群和li细胞群体内治疗神经变性的能力。图5a和5b中示出细胞对宿主细胞活力、梗塞体积和神经功能缺损的影响。与上述研究一致,ncs-01细胞群通过治疗缺血诱导的神经变性,从而减少梗塞体积并改善神经功能缺损(参见图5b)来预防宿主细胞死亡(参见图5a)。相比之下,li细胞群在梗塞体积或神经功能方面未能示出任何统计学显著的活性。因此,这些数据证实了ncs-01群治疗神经变性的能力由生产方法限定,并且ncs-01细胞群与li在2000年的出版物中所述的细胞群不同。本说明书中提到的任何专利、专利申请、出版物或其他公开材料都在此通过引用而全文并入。所述通过引用在此并入的任何材料或其部分若与本文所述现有定义、陈述或其他公开材料相矛盾,则仅以不在所并入的材料与本公开材料之间产生矛盾的程度而并入。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1