一种柞蚕微孢子虫模板DNA的提取方法及其在分子诊断方面的应用与流程
本发明属于病原微生物的dna提取方法及应用
技术领域:
,具体涉及一种快速获取柞蚕微孢子虫模板dna的方法及其在分子诊断方面的应用。
背景技术:
:柞蚕(antheraeapernyi)起源于中国,是人类最宝贵的生物资源之一。我国是世界柞蚕业第一大国,产茧量占世界总产茧量的90%。目前我国柞蚕茧年产量8万吨以上,直接产值25亿元,蚕茧加工及综合利用产值180多亿元。柞蚕业已成为我国山区农村难以替代的主导优势产业。然而,自柞蚕产业形成规模之后,柞蚕微粒子病一直困扰着柞蚕业的发展,该病害的主要特点是危害时间长,资源浪费严重,分布广泛,传染途径复杂,该病害一旦爆发会造成重大经济损失,因此被列为柞蚕生产上重要的检疫性病害。柞蚕微粒子病是由柞蚕微孢子虫(nosemapernyi,np)寄生柞蚕所引起,主要通过胚种和食下进行传染。由于柞蚕野外放养的产业特点,杜绝胚种传播成为防治微粒子病的主要途径。目前,生产上普遍使用光学显微镜检查法(镜检,microscopy)在制种过程中对雌蛾进行筛查,通过淘汰病蛾及其卵来切断微孢子虫的传播。该法简单易学、实用性强。但该法对制种人员的经验依赖性较高,检测结果的灵敏度和准确性差异较大。而且,微孢子虫的发育大致可分为孢原质期(sporoplasmodium)、裂殖期(merogony)、产孢期(sporogony)以及成熟孢子期(spore)四个阶段,而镜检主要针对成熟的微孢子虫,必然会存在漏检的情况,对于有效控制微粒子病害的作用有限。同时,镜检费时、费力,易诱发检测人员眼部疾病。在现有技术中,王伯阳等人公开了一种利用柞蚕微孢子虫孢子液直接免疫家兔获得柞蚕微孢子虫多克隆抗体的方法,建立了胶体金免疫层析检测法,但是该法灵敏度偏低,当柞蚕微孢子虫浓度低于8000个/μl时,该检测试纸条显色较浅或不显色,结果不稳定,无法进行准确判定。随后,姜义仁等人建立了柞蚕微孢子虫间接竞争酶联免疫吸附剂测定(elisa)法,将检测灵敏度提高到160个/μl,但其操作非常繁琐,配合生产难度大。分子诊断技术通过特异性扩增靶标基因达到诊断目的,灵敏度高,特异性好,广泛应用于病原微生物的检测。分子诊断中的关键技术涉及靶标dna的提取、靶标基因的扩增引物、结果的快速、准确读出等。柞蚕微孢子虫具有一层几丁质外壳,导致其dna释放困难,目前公开的的组织裂解液在从柞蚕中取样进行裂解的时候,通常伴有液氮研磨操作以破坏微孢子虫壁,达到良好的提取效果,但是液氮研磨费时、费力、污染风险高。因此,快速、简便的靶标dna提取技术成为柞蚕微孢子虫分子诊断中的研究重点和难点。截至目前,仅邓真华等人公开了一种柞蚕微孢子虫的pcr诊断技术,该技术检测柞蚕微孢子虫灵敏度高,特异性好,检测下限低(每个反应体系中含有柞蚕微孢子虫基因组dna0.94ng)。但是,该技术存在dna提取过程繁琐、耗时、干扰因素多、通量低等问题。该法采用斑迹抽提液加入蛋白酶k于55℃消化4h后,用酚氯仿抽提得到模板dna,相比以往公开的发芽处理、sds法、tek法,ctab法有进步,无需研磨和调节ph值等繁琐操作,但是加热消化过程,容易造成蒸汽污染,同时时间较长(一般需要3~5h),酚氯仿抽提对环境污染大,抽提需要辅助离心操作通量低。同时,该公开技术的研究主体是纯化后的柞蚕微孢子虫,而实际从柞蚕体内采样,极易受到黑化、蚕尿和蚕卵表面胶的干扰,不仅局限了取样操作,同时也影响了蛋白酶k的消化效果,所提dna品质也会大打折扣,严重影响pcr诊断结果的准确性。因此,现行dna提取方法存在的问题,如操作繁琐费时、通量低、交叉污染风险高(普遍需要加热操作、研磨、多步操作换管等引进污染)、提取过程制约因素多(黑化、尿液、卵胶干扰等)等,大大制约了柞蚕微孢子虫分子诊断技术的检测通量、灵敏度、便利性,成为应用分子诊断技术进行柞蚕微粒子病防疫的瓶颈问题。考虑到现行dna分离纯化技术主要有酚氯仿抽提法,硅胶膜柱吸附法和磁珠分离法。酚氯仿抽提和硅胶膜柱吸附法都需要多次离心操作,对提取通量制约严重,磁珠分离法以可以特异性结合核酸的磁珠为载体,利用外加磁场进行核酸和杂蛋白的分离,无需离心操作,通量高,已经广泛应用于核酸自动提取仪设备的开发及生物医药,农林牧渔等研究领域,但是应用到柞蚕微孢子虫的检测领域尚未见公开。技术实现要素:本发明针对现行柞蚕微孢子虫检测技术操作繁琐、通量低、检测灵敏度不高等
背景技术:
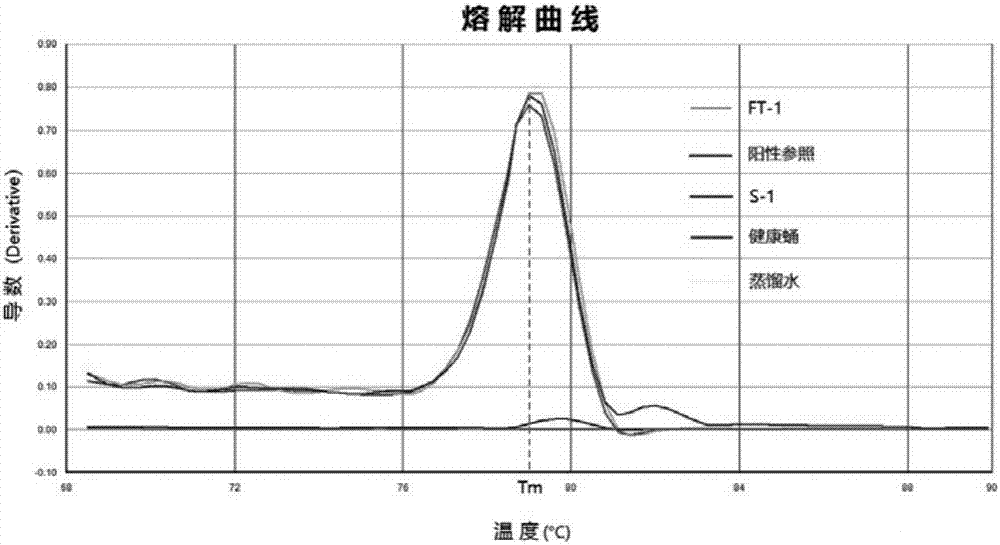
中列举的各种问题,提供了一种柞蚕微孢子虫模板dna的获取方法及其试剂盒,并公开了其在分子诊断方面的应用。具体的,所述柞蚕微孢子虫模板dna的获取方法所采用的技术方案是:用碱溶液对待测样本进行裂解处理,用磁珠进行dna的富集、分离与纯化;本发明中涉及的待测样本的来源与采集方法显著区别于现有技术,具体为:所述柞蚕微孢子虫的样本可以来源于柞蚕的任一时期的任何身体部位或者通过人工纯化、培养得到。从柞蚕上采集样品的时期可以是卵期、蚕期、蛹期和蛾期,采集样品的部位可以是组织、表皮、血液等。人工纯化培养的柞蚕微孢子虫可以是其细胞培养液、有缓冲溶液的悬浮液等。并可以实现活体取样。在优选的情况下,上文所述的技术方案,所述碱为无机碱,例如可以是氢氧化钠、氢氧化钾、碳酸钠等,所述碱溶液的浓度可以是0.05~1m,处理过程通常伴有震荡、混匀操作,处理时间为1分钟~40天。在优选的情况下,上文所述的技术方案,所述裂解处理过程可以同时在碱液中加入十二烷基硫酸钠(sodiumdodecylsulfate,sds),浓度低于10%。处理时间1min~120h,处理温度为0-40℃。在优选的情况下,上文所述的技术方案,所述裂解处理过程可以是在加入碱液后可在-20~-16℃条件下进行冻融,冻融次数可以是1次或者多次,单次冷冻时间为10分钟~40天。具体的,对于上文所述的技术方案中,所述的磁珠作为分离载体在生物分离中有广泛的应用,在磁分离过程中,将磁性微球直接放入含有目标物的混合溶液中,目标物与磁性微球紧密结合,然后利用外部磁场进行分离。具体应用于本发明的磁珠为含有二氧化硅和四氧化三铁成分的磁性微球,例如sio2@fe3o4,c@sio2@fe3o4等。具体的,上文所述的技术方案中,所述dna富集的过程,是将磁珠或者磁珠的悬浮液加入所述裂解液中,混匀,静置片刻。同时在裂解液中加入无水乙醇能提高富集效率,无水乙醇与裂解液的体积比例通常为0.7~1:1。具体的,上文所述的技术方案中,所述dna的分离过程,是指通过外加磁场将磁珠与液相分离并丢弃液相。所述外加磁场通常使用磁铁。具体的,上文技术方案中所述的dna纯化过程,通常用70-75%的酒精对已经富集dna的磁珠进行清洗,清洗后通常伴有干燥、洗脱步骤,洗脱通常采用ddh2o、te缓冲液或pcr反应液。此外,上文技术方案中所述的dna纯化过程,当样本量十分低的情况下,可以直接使用pcr反应体系进行模板dna的洗脱。例如,在后续采取常规pcr诊断时,配置反应体系,每25μl的反应体系含如seqidno:1和seqidno:2所示的引物(10pm)各0.5μl、rtaq0.25μl,10×buffer2.5μl,dntpsmix2μl,去离子水19.25μl。混匀后用该反应体系对富集有目标物的磁珠进行洗脱,并将洗脱液直接用于pcr反应。值得注意的是,当所述样本来源于柞蚕(幼虫、蛹、蛾、卵)时,通过上述方法所获取的模板dna是总基因组dna,包含柞蚕基因组dna、柞蚕微孢子虫基因组dna及其他寄生于柞蚕体内的微生物的基因组dna。进一步,本发明还提供了上述获取模板dna的方法在柞蚕微孢子虫分子诊断方面的应用。具体为:通过dna扩增技术对上述获取模板dna的方法所得到的模板dna进行扩增,进行柞蚕微孢子虫的分子诊断。具体的,上文所述的dna扩增技术可以是常规pcr,巢式pcr(nested-pcr),重组酶聚合酶扩增(recombinasepolymeraseamplification,rpa),环介导等温扩增(loop-mediatedisothermalamplification,lamp)及实时荧光定量pcr(real-timepcr,rt-pcr)等。当所述dna扩增技术,结果易读、可视的时候(如sybrgreen实时荧光定量pcr),通过串联核酸自动提取仪和荧光pcr仪可实现柞蚕微孢子虫高通量、可视化、自动化分子诊断。进一步,本发明还提供了一种柞蚕微孢子虫分子诊断试剂盒。具体的,上文所述试剂盒中的试剂,可以包含上文所述的柞蚕微孢子虫模板dna的获取方法中或柞蚕微孢子虫分子诊断方法中所使用的试剂组合;主要包括的试剂有碱溶液和十二烷基硫酸钠(sodiumdodecylsulfate,sds);其中,所述碱溶液选自氢氧化钠、氢氧化钾、碳酸钠等;碱溶液浓度可以是0.05~1m或者便于贮存的高浓度;所述sds浓度可以是0.1~10%或者便于贮存的高浓度。有益效果:本发明所提供的获取柞蚕微孢子虫模板dna的方法,首次采用碱裂解结合磁珠富集、分离与纯化,具有明显先进于现行技术的优点:1)本发明所提供的柞蚕微孢子虫dna的提取方法,采用碱溶液作为裂解液,对柞蚕组织、血液及微孢子虫进行处理,不仅比现行技术普遍使用蛋白酶k消化所需成本低,而且干扰因素少,能显著克服现行技术(普遍采用的蛋白酶k消化法)提取dna易受组织黑化和取样中掺杂蚕尿、卵胶等影响的技术缺点,降低了因dna品质的不稳定性带来的分子诊断结果不确定性,这是本发明的重要突破之一;2)本发明所提供的柞蚕微孢子虫dna的提取方法,采用碱裂解结合磁珠进行富集、分离与纯化,无需研磨等繁琐操作,简单快速;同时,该技术无需离心,可以在96孔板甚至384孔板上进行多样本的同时提取,通量高。这是相对现行柞蚕微孢子虫dna提取技术的最大突破,对柞蚕微孢子虫分子诊断的生产应用具有巨大推动作用。因为柞蚕产业自身的特点,通常需要在短时间内集中的对大量样本进行处理和诊断,淘汰感染微孢子虫的个体,达到切断微粒子病母体传播的目的,而现行柞蚕分子诊断技术受限于繁琐、低通量的dna提取技术,难于应用到生产实践中,提高操作的简便性和通量将会带来显著收益。3)本发明所提供的柞蚕微孢子虫dna的提取方法,无需研磨,取样量要求低,损耗少,能实现活体取样,具有更高的经济效益和更广阔的市场前景;4)本发明所提供的柞蚕微孢子虫dna提取方法,整个提取过程无需加热,无需多次换管,大大降低了因高温造成的蒸汽污染风险和因换管等繁琐操作引入的不确定污染,也免去了控温设备的费用,更易实现生产化应用;5)本发明所提供的柞蚕微孢子虫dna的提取方法,所用的磁珠能回收再利用,经济、环保,也是现有技术难以实现的一点。6)本发明所提供的获取柞蚕微孢子虫模板dna的方法在分子诊断方面的应用,结合pcr检测技术的高灵敏度、高通量、准确等优势,通过串联核酸自动提取仪和pcr仪,能实现在多孔板上进行集批量dna提取与分子诊断于一体的柞蚕微孢子虫自动化检测技术;通过优选结果易读、可视的pcr技术,则进一步能实现全过程高通量、可视化、自动化、高灵敏度、准确检测。这对柞蚕产业集中检疫柞蚕微粒子病和种质资源保护具有重要意义。附图说明图1所示的是本发明实施例1的实时荧光定量pcr的标准曲线图;图2所示的是本发明实施例1的实时荧光定量pcr的熔解曲线图;图3所示的是本发明实施例2的琼脂糖凝胶电泳图;图4所示的是本发明实施例4的琼脂糖凝胶电泳图;图5所示的是本发明实施例5的page凝胶电泳图;图6所示的是本发明实施例6的琼脂糖凝胶电泳图;图7所示的是本发明实施例7的琼脂糖凝胶电泳图。具体实施方式以下结合实施例对本发明作进一步描述。应该指出,以下说明都是示例性的,旨在对本发明提供进一步的说明。除非另有说明,本发明使用的所有科学和技术术语与本发明所属
技术领域:
人员通常理解的含义相同。本发明实施例所涉及的材料、实际和实验设备,如无特别说明,均符合病原微生物分子诊断领域的市售产品。本发明实施例所涉及的引物均由委托生物工程公司合成,具体引物信息如下:seqidno:1:5’-gacggaagaataccacaaggagt-3’seqidno:2:5’-ctatatgagggtctcacatcttgt-3’seqidno:3:5’-gtgcggcttaatttgactcaacg-3’seqidno:4:5’-ctatatgagggtctcacatcttg-3’seqidno:5:5’-ttgacggaagaataccacaag-3’seqidno:6:5’-tacctggtaaattaccccgcg-3’seqidno:7:5’-tcgtgcatgcacttccacaaggagtggattgtgcggcttaatttgacmumcmamamcmgmcmgmgmgmgmuma/invdt/-3’序列seqidno:7中的划线内容为甲氧基化的引物,用作探针。seqidno:8:5'-gtgatctcggtctacggttctc-3'seqidno:9:5'-tagttcaccatctttcgggtcc-3'实施例1柞蚕微孢子虫模板dna的获取及sybrgreen荧光定量pcr诊断柞蚕微孢子虫选取感染柞蚕微孢子虫的病蛹一枚,取少量组织分别置于2个1.5ml的ep管中,编号分别为s-1和ft-1。在s-1管中加入裂解液s(0.2mnaoh,1%sds)200μl,震荡混匀,室温放置40分钟,加入磁珠悬浮液10μl(sigma)和无水乙醇150ml,轻轻震荡混匀,将ep管置于磁力架上分离,待磁珠与液相完全分离,倒去液相,移去磁力架,加入70%的乙醇150μl,震荡、混匀后置于磁力架上分离,弃液体,移去磁力架,再次加入70%的乙醇150μl,震荡、混匀后置于磁力架上分离,移液枪尽可能吸取液体,移去磁力架,ep管置于37℃培养箱干燥30分钟,50μlte洗脱。dna-20℃冻存待用。在ft-1管中加入裂解液ft(0.2m,koh)200μl,震荡混匀,室温放置30分钟,放入-20℃冷冻,次日取出,室温融化后,加入磁珠悬浮液10μl(sigma)和无水乙醇150ml,轻轻震荡混匀,将ep管置于磁力架上分离,待磁珠与液相完全分离,倒去液相,移去磁力架,加入70%的乙醇150μl,震荡、混匀后置于磁力架上分离,弃液体,移去磁力架,再次加入70%的乙醇150μl,震荡、混匀后置于磁力架上分离,移液枪尽可能吸去液体,移去磁力架,ep管置于37℃培养箱干燥30分钟,50μlte洗脱。dna-20℃冻存待用。sybrgreenreal-timepcr技术进行柞蚕微孢子虫分子诊断:所用仪器为abi7300荧光定量pcr仪。每20μl体系含如seqidno:1和seqidno:2所示的引物(10pm)各0.4μl、模板dna2μl、sybrpremixextaqii10μl,roxreferencedye0.4μl,去离子水6.8μl。荧光定量pcr条件为95℃30秒;以(95℃5秒,60℃31秒)进行40个循环,熔解曲线反应条件为:95℃15s,60℃60s,95℃15s,60℃15s。dna模板依次为:标准质粒梯度稀释品(拷贝数为107,106,105,104,103,102,10),另有阳性参照,健康蛹dna和去离子水。标准质粒梯度稀释品的ct值分别是:15.4878、19.2066、22.0543、25.6265、29.358、33.3541和35.8138,标准曲线如图1所示。标准质粒熔解曲线tm值为79.0±0.3℃。ft-1、s-1和阳性参照的ct值分别为21.199,21.9279,13.4479;健康蛹和去离子水显示未测得,熔解曲线如图2所示。对结果的说明如下:根据ct<35,溶解曲线和阳性参照在相同位置出峰进行阳性结果判定:ft-1和s-1为阳性,说明样本感染柞蚕微孢子虫,同时说明ft-1和s-1的dna提取技术效果佳。另外,荧光定量pcr的引物特异性好,灵敏度高,检测结果读出容易、可视,节约时间和人力。实施例2柞蚕微孢子虫模板dna的获取及常规pcr诊断柞蚕微孢子虫。选取感染柞蚕微孢子虫的病蛹4枚,编号分别为s1,s2,s3,s4。s1和s2各取少量组织,其中,s1采用手术刀片于蛹背部划开约5mm的刀口,迅速用牙签挑取组织少许后用75%的酒精棉消毒刀口,用融化的切片蜡(华灵牌)进行蜡封。s1蛹放入茧壳内部,并胶带封合茧壳,室温(15~30℃)下放置,观察孵化情况。s3取少量蛹皮和蛹血混合物,s4取少量蛹皮和组织混合物,分别置于4个1.5ml的ep管中。分别加入裂解液s(0.2mnaoh,1%sds)200μl,震荡混匀,室温放置半小时,加入磁珠悬浮液10μl(磁珠:c@sio2@fe3o4,用50%乙醇悬浮)和无水乙醇150ml,轻轻震荡混匀,将ep管置于磁力架上分离,待磁珠与液相完全分离,倒去液相,移去磁力架,加入70%的乙醇150μl,震荡、混匀后置于磁力架上分离,弃液体,移去磁力架,再次加入70%的乙醇150μl,震荡、混匀后置于磁力架上分离,移液枪尽可能吸去液体,移去磁力架,ep管置于37℃培养箱干燥30分钟,20μlte洗脱。dna-20℃冻存待用。作为参照,dna样本还包括阳性参照、健康蛹(阴性参照)和去离子水。常规pcr技术进行柞蚕微孢子虫分子诊断:每25μl体系含如seqidno:1和seqidno:2所示的引物(10pm)各0.5μl、模板dna2μl、rtaq0.25μl,10×buffer2.5μl,dntps2μl,去离子水17.25μl。pcr条件为95℃4min;以95℃30秒,60℃30秒,72℃1分钟进行40个循环,再在72℃下延伸5min,得到的pcr产物加入核酸染色剂,用2%的琼脂糖进行凝胶电泳,电泳结束后在紫外光下观测结果,如图3所示。此外,s1蚕蛹在室温放置13天后孵化成蛾。对结果的说明如下:去离子水和阴性参照无特异性条带,样品s1、s2、s3、s4和阳性参照在相同位置有特异性条带,为阳性。同时说明本发明的dna提取技术对于不同取样部位的样品均有较高质量的dna提取能力。此外,s1伤蛹孵化成蛾,说明活蛹取样的可行性。实施例3选取已产完卵的母蛾60只,编号分别为1#-60#。分别挑取少量组织置于60个含有200μl0.2mkoh的1.5ml的ep管中(其中,4例样本因蛾肚里组织量少,各取卵2粒),待采样完毕,5min后将ep管置于-20℃下冷冻,30天后取出融化,转移各ep管中的裂解液上清各100μl于96孔板中不同样品孔,分别加入磁珠悬浮液10μl(sigma)和无水乙醇75ml,轻轻震荡混匀,将ep管置于96孔磁力架上分离,待磁珠与液相完全分离,倒去液相,移去磁力架,各加入70%的乙醇100μl,震荡、混匀后置于磁力架上分离,弃液体,移去磁力架,再次加入70%的乙醇100μl,震荡、混匀后置于磁力架上分离,使用排枪尽可能吸去液体,移去磁力架,96孔板室温干燥1小时,分别加入20μltebuffer洗脱。dna-20℃冻存待用。作为参照,dna样本还包括阳性参照、健康蛹(阴性参照)和去离子水。常规pcr技术进行柞蚕微孢子虫分子诊断:配置63个反应体系(除dna模板),每23μl体系含如seqidno:3和seqidno:4所示的引物(10pm)各0.5μl、rtaq0.25μl,10×buffer2.5μl,dntps2μl,去离子水17.25μl,分装至96孔板中63个样品孔,排枪转移dna模板各2μl。pcr反应条件为95℃4min;以95℃30秒,65℃30秒,72℃1分钟进行40个循环,再在72℃下延伸5min,得到的pcr产物加入核酸染色剂,用2%的琼脂糖进行凝胶电泳,电泳结束后在紫外光下观测结果,其中59例阴性,1例阳性。同时,对该60例样本蛾组织进行取样,研磨,涂片后显微镜观察,镜检结果显示其全为阴性。本实施例说明,本方法提取dna快速、通量高,结合后期分子诊断,对微粒子病的检出率显著高于现行生产上普遍采用的镜检技术。实施例4选取感染柞蚕微孢子虫的病蛹1枚,挑取少量组织于无菌的研钵中,加入适量pbs稍加研磨分散,充分吹打均匀,10倍稀释两个梯度,分别编号sample-1#和sample-2#,室温放置20min黑化。取1#和2#黑化后的悬浮液各三份,每份100μl,分别加入6个1.5ml的ep管中,分别编号ft-1,ft-2,s-1,s-2,pk-1,pk-2分别在ft-1和ft-2管中加入0.4mkoh,在s-1和s-2管中加入2×裂解液s(终浓度:naoh0.2m,sds1%),在pk-1和pk-2管中加入2×斑迹抽提液(含蛋白酶k10μl)。将pk-1和pk-2置于56℃恒温水浴中,将ft-1、ft-2、s-1和s-2室温放置。pk-1和pk-2置于56℃恒温水浴中3小时后,取出,加入10μl磁珠悬浮液(sigma)和无水乙醇150ml,轻轻震荡混匀,将ep管置于磁力架上分离,待磁珠与液相完全分离,倒去液相,移去磁力架,加入70%的乙醇150μl,震荡、混匀后置于磁力架上分离,弃液体,移去磁力架,再次加入70%的乙醇150μl,震荡、混匀后置于磁力架上分离,移液枪尽可能吸去液体,移去磁力架,ep管置于37℃培养箱干燥30分钟,20μlte洗脱。ft-1和ft-2和s-1和s-2室温放置40min后,将ft-1和ft-2置于-20℃冷冻,在s-1和s-2管中加入10μl磁珠(sigma)和无水乙醇150ml,轻轻震荡混匀,将ep管置于磁力架上分离,待磁珠与液相完全分离,倒去液相,移去磁力架,加入70%的乙醇150μl,震荡、混匀后置于磁力架上分离,弃液体,移去磁力架,再次加入70%的乙醇150μl,震荡、混匀后置于磁力架上分离,移液枪尽可能吸去液体,移去磁力架,ep管置于37℃培养箱干燥30分钟,20μlte洗脱。dna-20℃冻存待用。次日,将ft-1和ft-2取出,室温融化后再次放入-20℃冷冻后取出室温融化,加入10μl磁珠(sigma)和无水乙醇150ml,轻轻震荡混匀,将ep管置于磁力架上分离,待磁珠与液相完全分离,倒去液相,移去磁力架,加入70%的乙醇150μl,震荡、混匀后置于磁力架上分离,弃液体,移去磁力架,再次加入70%的乙醇150μl,震荡、混匀后置于磁力架上分离,移液枪尽可能吸去液体,移去磁力架,ep管置于37℃培养箱干燥30分钟,20μlte洗脱。取纯化的柞蚕微孢子虫细胞培养液,10倍稀释两个梯度,每个梯度各取100μl于2个1.5mlep管中,分别加入加入2×斑迹抽提液(含蛋白酶k10μl),置于56℃恒温水浴中3小时后,取出,加入10μl磁珠(sigma)和无水乙醇150ml,轻轻震荡混匀,将ep管置于磁力架上分离,待磁珠与液相完全分离,倒去液相,移去磁力架,加入70%的乙醇150μl,震荡、混匀后置于磁力架上分离,弃液体,移去磁力架,再次加入70%的乙醇150μl,震荡、混匀后置于磁力架上分离,移液枪尽可能吸去液体,移去磁力架,ep管置于37℃培养箱干燥30分钟,20μlte洗脱,编号pkna-1和pkna-2。作为参照,dna样本还包括阳性参照、健康蛹(阴性参照)和去离子水。pcr技术进行柞蚕微孢子虫分子诊断:每25μl体系含如seqidno:1和seqidno:2所示的引物(10pm)各0.5μl、rtaq0.25μl,10×buffer2.5μl,dntps2μl,去离子水17.25μl和dna模板2μl。pcr反应条件为95℃4min;以95℃30秒,60℃30秒,72℃1分钟进行40个循环,再在72℃下延伸5min,得到的pcr产物加入核酸染色剂,用2%的琼脂糖进行凝胶电泳,电泳结束后在紫外光下观测结果如图4所示。对实验结果的说明:凝胶电泳孔道1-11#分别是ft-1,ft-2,s-1,s-2,pk-1,pk-2,pkna-1,pkna-2,去离子水、健康蛹参照,阳性参照。如图4所示,ft-1,ft-2,s-1,s-2,pk-1,pkna-1和pkna-2为阳性结果,pk-2为阴性结果。实际pk-2是阳性结果,但因黑化导致蛋白酶k消化效果不好而出现假阴性结果,可见本发明方法与传统方法相比,dna提取过程抗干扰能力强,提取的dna品质更高,后期分子诊断对微孢子虫的诊断假阳性率更低,灵敏度更好,准确度更高。实施例5质粒标准品的制备:取柞蚕微孢子虫悬浮液,5000r/min离心5min,去除上清后保留孢子沉淀,加入抽提液(10mmol/ltris-hclph8.0;10mmol/ledtaph8.0;100mmol/lnacl;2%sds;0.039mol/ldtt),再加蛋白酶k(终浓度为100μg/ml),于55℃消化4小时,以酚/氯仿抽提,70%乙醇清洗两次,干燥后te洗脱得到柞蚕微孢子虫的基因组dna。以上述柞蚕微孢子虫的基因组dna进行常规pcr,pcr体系为:10×pcrbuffer2.5μl,10mmoldntps2μl,mgcl22μl,10μmol/l如seqidno:5和seqidno:6所述的上下游引物各0.5μl,1utaq酶,模板dna2μl,加无菌去离子水至25μl。反应条件:94℃预变性5min;94℃30s,65℃30s,72℃60s,共35个循环;72℃延伸10min。反应结束后取10μlpcr扩增产物用2%琼脂糖凝胶进行电泳检测,回收72bp的特异性pcr产物并纯化,连接到pmd-18t载体上,转化于dh5α感受态细胞,涂布于平板培养基上进行培养,挑取阳性菌落提取质粒dna,酶切和测序进行鉴定,序列正确的确定为质粒标准品。健康柞蚕蛹基因组dna的提取:取健康柞蚕蛹组织少许,液氮研磨后加入到组织抽提液中(10mmol/ltris-hclph8.0;10mmol/ledtaph8.0;100mmol/lnacl;2%sds;0.039mol/ldtt),再加蛋白酶k(终浓度为100μg/ml),于55℃消化4小时,以酚/氯仿抽提,70%乙醇清洗两次,干燥后te洗脱得到健康柞蚕蛹基因组dna。样品dna的提取:选取感染柞蚕微孢子虫的病蛹一枚,取少量组织分别置于1.5ml的ep管中,加入裂解液(0.2mnaoh,1%sds)200μl,震荡混匀,室温放置20分钟,加入磁珠10μl(sigma)和无水乙醇150ml,轻轻震荡混匀,将ep管置于磁力架上分离,待磁珠与液相完全分离,倒去液相,移去磁力架,加入70%的乙醇150μl,震荡、混匀后置于磁力架上分离,弃液体,移去磁力架,再次加入70%的乙醇150μl,震荡、混匀后置于磁力架上分离,移液枪尽可能吸取液体,移去磁力架,ep管置于37℃培养箱干燥30分钟,20μlte洗脱。dna于-20℃冻存待用。重组酶聚合扩增技术进行柞蚕微孢子虫的诊断:配置体系如下:醋酸钾100mm聚乙二醇5%tris缓冲液(ph7.9)50mm二硫苏糖醇(dtt)4mmdntps200umatp3mm磷酸肌酸(phosphocreatine)50mm肌酸激酶(creatinekinase)0.025u/μl二甲基亚砜(dmso)5%edta0.5mmbsa0.1μg/μl蔗糖150mm蔗糖磷酸化酶0.125u/μlbsu0.0625u/μlgp32250ng/μluvsx120ng/μluvsy22ng/μl醋酸镁10mm正向引物(seqidno:5)480nm反向引物(seqidno:6)480nm甲氧基化的引物(seqidno:7)480nm重组酶聚合扩增反应的条件:扩增温度为38℃,扩增时间为60min。扩增结束后,将pcr产物水煮2分钟,取10μl进行page凝胶电泳,电泳结束后在紫外灯下观察,得到结果如图5所示。对结果的说明如下:m代表核酸电泳markerdl2000,t-na代表标准质粒,na代表样品dna,gm代表健康柞蚕蛹基因组dna,h2o代表去离子水。扩增阳性产物的大小为72bp。可见本发明方法与传统方法相比,提取的dna普遍适用于各种后续pcr诊断技术,同时,特异性更好,灵敏度更高。实施例6采用thermo核酸自动提取仪706对柞蚕微孢子虫dna进行自动提取。取12例微粒子病蛹的组织少许,分别浸泡于210μl裂解液中(0.1mnaoh,1%sds)2小时,移取上清200μl备用。采用仪器预设的kf_tissuedna_duo程序,对a列dw孔的溶剂量略作调整:取已经充分裂解样本的裂解液200μl,磁珠悬浮液20μl(sigma),无水乙醇140μl。所提dna,取2μl作为pcr模板配置反应体系:每25μl体系含如seqidno:3和seqidno:4所示的引物(10pm)各0.5μl、rtaq0.25μl,10×buffer2.5μl,dntps2μl,去离子水17.25μl和dna模板2μl。pcr反应条件为95℃4min;以95℃30秒,65℃30秒,72℃1分钟进行40个循环,再在72℃下延伸5min,得到的pcr产物加入核酸染色剂,用2%的琼脂糖进行凝胶电泳,电泳结束后在紫外光下观测结果如图6所示。对结果的说明如下:m代表核酸电泳markerdl2000,1-12号样品孔均在144bp左右出现特异性条带。可见通过自动化提取的dna均有较好质量,说明本方法完全可以实现自动化提取。实施例7磁珠的循环使用:选取感染柞蚕微孢子虫的病蛹一枚,取少量组织置于1.5ml的ep管中,编号pos。在管中加入裂解液s(0.2mnaoh,1%sds)200μl,震荡混匀,室温放置60分钟,加入磁珠悬浮液20μl(sigma)和无水乙醇150ml,轻轻震荡混匀,将ep管置于磁力架上分离,待磁珠与液相完全分离,倒去液相,移去磁力架,加入70%的乙醇150μl,震荡、混匀后置于磁力架上分离,弃液体,移去磁力架,再次加入70%的乙醇150μl,震荡、混匀后置于磁力架上分离,移液枪尽可能吸取液体,移去磁力架,ep管置于37℃培养箱干燥30分钟,50μlte洗脱,转移洗脱液,dna-20℃冻存待用。在已经转移洗脱液的ep管中加入水1ml,移液枪吹打,是磁珠均匀分散于水中,置于磁力架上,待水相澄清,移除水相,重复该操作5次后,加入50μlte洗脱磁珠,转移洗脱液,编号washed,4℃保存待用,并回收磁珠,将含有磁珠的ep管置于37℃培养箱烘干20min待用。选取确定未感染柞蚕微孢子虫的健康蛹一枚,取少量组织置于1.5ml的ep管中,编号neg。在管中加入裂解液s(0.2mnaoh,1%sds)200μl,震荡混匀,室温放置60分钟,将裂解液转移至上述回收磁珠ep管中,加入无水乙醇150ml,轻轻震荡混匀,将ep管置于磁力架上分离,待磁珠与液相完全分离,倒去液相,移去磁力架,加入70%的乙醇150μl,震荡、混匀后置于磁力架上分离,弃液体,移去磁力架,再次加入70%的乙醇150μl,震荡、混匀后置于磁力架上分离,移液枪尽可能吸取液体,移去磁力架,ep管置于37℃培养箱干燥30分钟,50μlte洗脱,转移洗脱液,dna-20℃冻存待用。对pos,washed,neg样本进行常规pcr,每25μl体系含如seqidno:1和seqidno:2所示的引物(10pm)各0.5μl、模板dna2μl、rtaq0.25μl,10×buffer2.5μl,dntps2μl,去离子水17.25μl。pcr条件为95℃4min;以95℃30秒,60℃30秒,72℃1分钟进行40个循环,再在72℃下延伸5min。另取neg模板dna2μl,加入如seqidno:8和seqidno:9所示的柞蚕28srrna特异性引物(10pm)各0.5μl,rtaq0.25μl,10×buffer2.5μl,dntps2μl,去离子水17.25μl。配置的体系进行常规pcr,pcr条件为95℃4min;以95℃30秒,55℃30秒,72℃1分钟进行40个循环,再在72℃下延伸5min。将上述两个pcr得到的产物加入核酸染色剂,用2%的琼脂糖进行凝胶电泳,电泳结束后在紫外光下观测结果,如图7所示。对结果的说明如下,样品孔从左至右,1-3号依次为pos、washed、neg的柞蚕微孢子虫特异引物扩增结果,4号为neg样本的柞蚕特异性引物扩增结果:用新鲜的磁珠提取的pos样本在173bp左右特异性出带,确定含有柞蚕微孢子虫基因组dna;washed样本和neg样本未见柞蚕微孢子虫特异性条带,说明提取该样本的磁珠经过清洗后,磁珠上不含可被洗脱下来的柞蚕微孢子虫基因组dna,同时清洗后的磁珠再次利用时对样本无假阳性干扰;neg样本在106bp出现柞蚕特异性条带,说明回收的磁珠依旧具有高质量提取dna的能力。该实施例充分说明了磁珠的可回收性,也说明本方法经济、绿色。实施例8对产完卵的88例镜检阴性柞蚕母蛾,取其肚中脂肪体分别置于装有200μl裂解液(0.2mnaoh,1%sds)的ep管中,浸泡过夜,次日,将裂解液转移100μl至96孔板,各加入磁珠buffer10μl,无水乙醇70μl,轻微震荡混匀,置于磁力架上分离,倒去液相,70%乙醇清洗3次,37℃鼓风烘箱干燥30分钟,各30μlte洗脱,-20℃保存待用。应用abi7300荧光定量pcr仪进行扩增。配置96个荧光定量pcr反应体系,每20μl反应体系含sybrpremixextaq10μl,roxreferencedyeⅰ0.4μl,如seqidno:3和seqidno:4所示的引物各0.2μl(10pm),dna模板2μl。dna模板包括上述88份样本,5份标准质粒(106-102拷贝数),三份水做阴性参照,荧光定量pcr反应程序:95℃30s;95℃5s,62.5℃30s,共40个循环。在60℃条件下进行单点荧光采集。熔解曲线检测条件:95℃15s,60℃60s,95℃15s,60℃15s。反应结束后,进行结果判定。对结果的说明,88例样本中检测出3例阳性,而多次镜检显示该88例样本为阴性。本实施例说明,本发明所述方法具有对柞蚕微孢子虫高灵敏度、高特异性检出的优点,同时说明,本方法具有简单快速、高通量、可视化的先进性,能实现集“dna提取——分子诊断——结果读出”于一体的高通量、可视化柞蚕微孢子虫分子诊断,这对于种茧保护、微粒子病防治意义重大。本发明的分子诊断方法已经通过较好的实施例进行了描述,相关技术人员明显能在不脱离本
发明内容、精神的范围内对本文所述的方法进行改动或适当变更与组合来实现被发明技术。特别需要指出的是,所有类似的替换和改动:如类似的引物的替换和改动,如pcr循环温度的改动,如所用pcr反应体系成分的合理替换和改动,如碱浓度、处理时间的合理改变等,对本领域技术人员来说是显而易见的,它们被视为包括在本发明精神、范围和内容中。序列表<110>辽宁省农业科学院大连生物技术研究所<120>一种柞蚕微孢子虫模板dna的提取方法及其在分子诊断方面的应用<141>2017-07-27<160>9<170>siposequencelisting1.0<210>1<211>23<212>dna<213>人工合成引物<400>1gacggaagaataccacaaggagt23<210>2<211>24<212>dna<213>人工合成引物<400>2ctatatgagggtctcacatcttgt24<210>3<211>23<212>dna<213>人工合成引物<400>3gtgcggcttaatttgactcaacg23<210>4<211>23<212>dna<213>人工合成引物<400>4ctatatgagggtctcacatcttg23<210>5<211>21<212>dna<213>人工合成引物<400>5ttgacggaagaataccacaag21<210>6<211>21<212>dna<213>人工合成引物<400>6tacctggtaaattaccccgcg21<210>7<211>47<212>dna<213>人工合成引物<400>7tcgtgcatgcacttccacaaggagtggattgtgcggcttaatttgac47<210>8<211>22<212>dna<213>人工合成引物<400>8gtgatataggtctacggttctc22<210>9<211>22<212>dna<213>人工合成引物<400>9tagttcaccatctttcgggtcc22当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1