一种氧杂蒽类有机化合物及其在OLED器件上的应用的制作方法
本发明涉及半导体
技术领域:
,尤其是涉及一种以氧杂蒽为核心的有机化合物及其在oled器件上的应用。
背景技术:
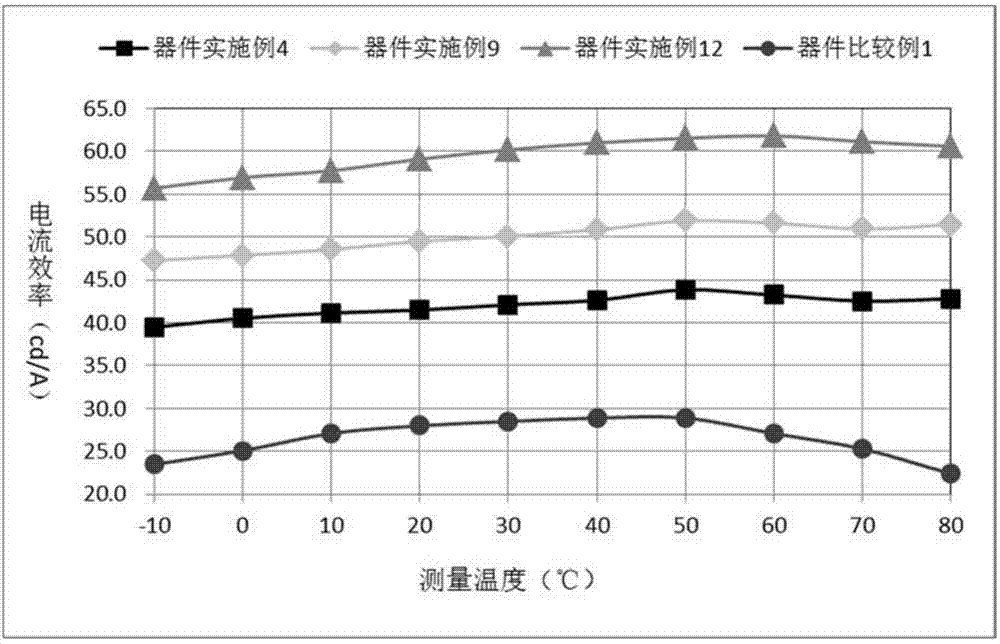
:有机电致发光(oled:organiclightemissiondiodes)器件技术既可以用来制造新型显示产品,也可以用于制作新型照明产品,有望替代现有的液晶显示和荧光灯照明,应用前景十分广泛。oled发光器件犹如三明治的结构,包括电极材料膜层以及夹在不同电极膜层之间的有机功能材料,各种不同功能材料根据用途相互叠加在一起共同组成oled发光器件。oled发光器件作为电流器件,当对其两端电极施加电压,并通过电场作用有机层功能材料膜层中的正负电荷时,正负电荷进一步在发光层中复合,即产生oled电致发光。当前,oled显示技术已经在智能手机,平板电脑等领域获得应用,进一步还将向电视等大尺寸应用领域扩展,但是,和实际的产品应用要求相比,oled器件的发光效率和使用寿命等性能还需要进一步提升。目前对oled发光器件提高性能的研究包括:降低器件的驱动电压、提高器件的发光效率、提高器件的使用寿命等。为了实现oled器件的性能的不断提升,不但需要从oled器件结构和制作工艺的创新,更需要oled光电功能材料不断研究和创新,创制出更高性能的oled功能材料。应用于oled器件的oled光电功能材料从用途上可划分为两大类,分别为电荷注入传输材料和发光材料。进一步,还可将电荷注入传输材料分为电子注入传输材料、电子阻挡材料、空穴注入传输材料和空穴阻挡材料,还可以将发光材料分为主体发光材料和掺杂材料。为了制作高性能的oled发光器件,要求各种有机功能材料具备良好的光电性能,譬如,作为电荷传输材料,要求具有良好的载流子迁移率,高玻璃化转化温度等,作为发光层的主体材料具有良好双极性,适当的homo/lumo能阶等。构成oled器件的oled光电功能材料膜层至少包括两层以上结构,产业上应用的oled器件结构则包括空穴注入层、空穴传输层、电子阻挡层、发光层、空穴阻挡层、电子传输层、电子注入层等多种膜层,也就是说应用于oled器件的光电功能材料至少包括空穴注入材料、空穴传输材料、发光材料、电子传输材料等,材料类型和搭配形式具有丰富性和多样性的特点。另外,对于不同结构的oled器件搭配而言,所使用的光电功能材料具有较强的选择性,相同的材料在不同结构器件中的性能表现也可能完全迥异。因此,针对当前oled器件的产业应用要求以及oled器件的不同功能膜层,器件的光电特性需求,必须选择更适合、性能更高的oled功能材料或材料组合,才能实现器件的高效率、长寿命和低电压的综合特性。就当前的oled显示照明产业的实际需求而言,目前oled材料的发展还远远不够,落后于面板制造企业的要求,作为材料企业开发更高性能的有机功能材料显得尤为重要。技术实现要素:针对现有技术存在的上述问题,本申请人提供了一种以氧杂蒽为核心的有机化合物及其在oled器件上的的应用。本发明化合物含有氧杂蒽结构,具有较高的玻璃化温度和分子热稳定性,合适的homo和lumo能级,较高eg,通过器件结构优化,可有效提升oled器件的光电性能以及oled器件的寿命。本发明的技术方案如下:一种氧杂蒽类有机化合物,所述有机化合物的结构如通式(1)所示:通式(1)中,ar1表示为取代或未取代的c6-60芳基、含有一个或多个杂原子的取代或未取代的5~60元杂芳基;所述杂原子为氮、氧或硫;ar2表示为单键、取代或未取代的c6-60亚芳基、含有一个或多个杂原子的取代或未取代的5~60元杂亚芳基;所述杂原子为氮、氧或硫;通式(1)中,r表示为通式(2)所示结构;通式(2)中,x表示为氧原子、硫原子、c1-10直链或支链烷基取代的亚烷基、芳基取代的亚烷基、烷基取代的亚胺基或芳基取代的亚胺基中的一种;ar3表示为取代或未取代的c6-60芳基、含有一个或多个杂原子的取代或未取代的5-60元杂芳基;所述杂原子为氮、氧或硫;r1表示为通式(3)、通式(4)或通式(5)所示结构;通式(3)和通式(4)中,其中x1、x2、x3分别独立的表示为氧原子、硫原子、c1-10直链或支链烷基取代的亚烷基、芳基取代的亚烷基、烷基取代的亚胺基或芳基取代的亚胺基中的一种;通式(3)、通式(4)、通式(5)通过cl1-cl2键、cl2-cl3键或cl3-cl4键和通式(2)连接。优选的,所述化合物选自通式(6)或通式(7)所示结构:其中使用的符号和标记具有权利要求1中给出的含义。优选的,所述化合物选自通式(8)、通式(9)或通式(10)所示结构:其中使用的符号和标记具有权利要求1中给出的含义。优选的,所述化合物选自通式(11)、通式(12)或通式(13)所示结构:其中使用的符号和标记具有权利要求1中给出的含义。优选的,ar2表示为亚苯基、亚二联苯基、亚三联苯基、亚萘基、亚蒽基、亚菲基、亚芘基、亚呋喃基、亚噻吩基、亚吡啶基、亚嘧啶基、亚哒嗪基、亚吡嗪基或亚三嗪基中的一种,ar2还表示为单键;ar1和ar3分别独立的表示为苯基、二联苯基、三联苯基、萘基、蒽基、菲基、芘基、呋喃基、噻吩基、吡啶基、嘧啶基、哒嗪基、吡嗪基或三嗪基中的一种。优选的,所述化合物选自通式(14)、通式(15)、通式(16)、通式(17)、通式(18)、通式(19)、通式(20)、通式(21)、通式(22)、通式(23)、通式(24)或通式(25)所示结构:其中使用的符号和标记具有上文中给出的含义。优选的,所述化合物选自通式(26)、通式(27)、通式(28)、通式(29)、通式(30)、通式(31)、通式(32)、通式(33)、通式(34)、通式(35)、通式(36)或通式(37)所示结构:其中使用的符号和标记具有上文中给出的含义。更优选的,所述通式(2)表示为:中的任意一种。更优选的,所述具体化合物表示为:中的任意一种。本申请人还提供了一种所述氧杂蒽类有机化合物的制备方法,制备过程中发生的反应方程式为:具体制备方法为:称取中间体i和中间体ii,用体积比为1.5~3:1的甲苯乙醇混合溶剂溶解;再加入na2co3水溶液、pd(pph3)4;在惰性气氛下,将上述反应物的混合溶液于反应温度90~110℃下反应10~24小时,冷却、过滤反应溶液,滤液旋蒸,过硅胶柱,得到目标产物;所述中间体i与中间体ii的摩尔比为1:1.0~1.5;pd(pph3)4与中间体i的摩尔比为0.006~0.02:1;na2co3与中间体i的摩尔比为2.0~3.0:1。本申请人还提供了一种所述氧杂蒽类有机化合物用于制备有机电致发光器件的应用。所述有机电致发光器件包括至少一层功能层含有所述的氧杂蒽类有机化合物。本申请人还提供了一种有机电致发光器件,包括电子阻挡层,所述电子阻挡层材料为所述的氧杂蒽类有机化合物。本申请人还提供了一种有机电致发光器件,包括发光层,所述发光层含有所述的氧杂蒽类有机化合物。本发明有益的技术效果在于:本发明化合物结构为氧杂蒽通过碳碳键与咔唑并环结构或者苯并六元环并环结构相连,碳碳键连接既提高了材料化学稳定性又避免了支链基团活泼位置裸露,而且整个分子是一个较大的刚性结构,且空间位阻大,不易转动,使得本发明化合物材料的立体结构更加稳定。而且本发明化合物三线态能级t1主要分布在支链上,而支链具有高的t1能级,因此本发明化合物同样具有高t1能级;本发明化合物作为oled的电子阻挡层材料使用时,高t1能级能够有效地阻挡能量从发光层向空穴传输层传递,减少了能量损失,使发光层主体材料能量充分传递至掺杂材料,从而提升材料应用于器件后的发光效率。本发明的有机化合物的结构使得电子和空穴在发光层的分布更加平衡,在恰当的homo能级下,提升了空穴注入和传输性能;在合适的lumo能级下,又起到了电子阻挡的作用,提升激子在发光层中的复合效率;作为oled发光器件的发光功能层材料使用时,氧杂蒽搭配本发明范围内的支链可有效提高激子利用率和高荧光辐射效率,降低高电流密度下的效率滚降,降低器件电压,提高器件的电流效率和寿命。本发明的有机化合物在oled器件应用时,通过器件结构优化,可保持高的膜层稳定性,可有效提升oled器件的光电性能以及oled器件的寿命。本发明所述化合物在oled发光器件中具有良好的应用效果和产业化前景。附图说明图1为本发明所列举的材料应用于oled器件的结构示意图;其中,1、透明基板层,2、ito阳极层,3、空穴注入层,4、空穴传输层5、电子阻挡层,6、发光层,7、空穴阻挡/电子传输层,8、电子注入层,9、阴极反射电极层。图2为本发明化合物的发光效率随温度的变化曲线。具体实施方式实施例1:中间体i和中间体ii的合成a.中间体i的合成:(1)称取原料u和mg粉,用干燥四氢呋喃(thf)溶解;在惰性气氛下,加入微量催化剂i2,加热至40℃搅拌至溶液由黄色变为无色,再将上述混合溶液加热至60~90℃下,搅拌反应3~5小时,无镁粉剩余,反应完全,生成格式试剂中间体v;所述原料u与mg的摩尔比为1:1.0~1.2;i2与原料u的摩尔比为0.006~0.02:1;(2)称取占吨酮,用干燥thf溶解;在惰性气氛下,滴加上述格式试剂中间体v,将所得混合溶液于60~90℃下,搅拌反应10~24小时,生成大量白色沉淀,然后冷却至室温,加入饱和nhcl4将格式盐转化为醇;反应完毕后,乙醚萃取,干燥旋蒸,过硅胶柱,得到略带黄色的固体叔醇中间体w;所述占吨酮与中间体v的摩尔比为1:1.0~1.2;(3)称取中间体w,用甲苯溶解;在混合溶液中缓慢滴加48%hbr水溶液,在20~25℃下搅拌反应15~30小时,反应结束后分液,水相用甲苯萃取,有机相合并后用无水硫酸钠干燥,抽滤,滤饼再用乙酸乙酯冲洗,将滤液和冲洗液旋蒸至无溶剂,过硅胶柱,得到中间体i'。所述48%hbr水溶液的体积为20ml对应每0.01mol中间体w。(4)在氮气保护下,称取中间体i'溶于四氢呋喃中,冷却至-78℃,然后向反应体系中加入1.6mol/l正丁基锂的四氢呋喃溶液,在-78℃下反应3h后加入硼酸三异丙酯,反应2h,然后将反应体系升至0℃,加入2mol/l盐酸溶液,搅拌3h,反应完全,加入乙醚萃取,萃取液加入无水硫酸镁干燥,旋蒸,用乙醇溶剂重结晶,得到中间体y;所述中间体i'与正丁基锂的摩尔比为1:1~1.5;所述中间体i'与硼酸三异丙酯的摩尔比为1:1~1.5。(5)称取中间体y和原料x,用体积比为1.5~3:1的甲苯乙醇混合溶剂溶解;再加入na2co3水溶液、pd(pph3)4;在惰性气氛下,将上述反应物的混合溶液于反应温度90~110℃下反应10~24小时,冷却、过滤反应溶液,滤液旋蒸,过硅胶柱,得到目标产物i;所述中间体y与原料x的摩尔比为1:1.0~1.5;pd(pph3)4与中间体y的摩尔比为0.006~0.02:1,na2co3与中间体y的摩尔比为2.0~3.0:1。以中间体i-1、i-2合成为例:(1)250ml的三口瓶,在通入氮气的气氛下,加入0.05mol原料u1,0.06molmg粉,用60ml干燥四氢呋喃溶解,加入0.0004mol单质i2,加热至40℃搅拌至溶液由黄色变为无色,将上述混合溶液加热至80℃下,搅拌反应4小时,无镁粉剩余,反应完全,生成格式试剂中间体v1,无需提纯,直接进行下一步。(2)250ml的三口瓶,在通入氮气的气氛下,加入0.03mol占吨酮,用40ml干燥四氢呋喃溶解,缓慢滴加上述格式试剂中间体v1溶液,加热回流15小时,生成大量白色沉淀,然后冷却至室温,加入饱和nhcl4将格式盐转化为醇;反应完毕后,乙醚萃取,干燥旋蒸,过硅胶柱,得到略带黄色的固体叔醇中间体w1,hplc纯度99.5%,收率76.3%。元素分析结构(分子式c19h14o2):理论值c,83.19;h,5.14;o,11.67;测试值:c,83.17;h,5.14;o,11.69。esi-ms(m/z)(m+):理论值为274.10,实测值为274.35。(3)250ml的三口瓶,加入0.02mol中间体w1,用50ml甲苯溶解,缓慢滴加48%hbr水溶液(40ml),在25℃下搅拌反应24小时,反应结束后分液,水相用甲苯萃取,有机相合并后用无水硫酸钠干燥,抽滤,滤饼再用乙酸乙酯冲洗,将滤液和冲洗液旋蒸至无溶剂,过硅胶柱,得到中间体i-1,hplc纯度99.2%,收率75.2%。元素分析结构(分子式c19h13bro):理论值c,67.67;h,3.89;br,23.70;o,4.74;测试值:c,67.66;h,3.88;br,23.71;o,4.75。esi-ms(m/z)(m+):理论值为336.01,实测值为336.27。(4)在氮气保护下,称取中间体i-1溶于四氢呋喃中,冷却至-78℃,然后向反应体系中加入1.6mol/l正丁基锂的四氢呋喃溶液,在-78℃下反应3h后加入硼酸三异丙酯,反应2h,然后将反应体系升至0℃,加入2mol/l盐酸溶液,搅拌3h,反应完全,加入乙醚萃取,萃取液加入无水硫酸镁干燥,旋蒸,用乙醇溶剂重结晶,得到中间体y;所述中间体i-1与正丁基锂的摩尔比为1:1~1.5;所述中间体i-1与硼酸三异丙酯的摩尔比为1:1~1.5。元素分析结构(分子式c19h15bo3):理论值c,75.53;h,5.00;b,3.58;测试值:c,75.53;h,5.00;b,3.57。esi-ms(m/z)(m+):理论值为302.11,实测值为302.81。(5)称取中间体y和原料x,用体积比为1.5~3:1的甲苯乙醇混合溶剂溶解;再加入na2co3水溶液、pd(pph3)4;在惰性气氛下,将上述反应物的混合溶液于反应温度90~110℃下反应10~24小时,冷却、过滤反应溶液,滤液旋蒸,过硅胶柱,得到目标产物i-2;所述中间体y与原料x的摩尔比为1:1.0~1.5;pd(pph3)4与中间体y的摩尔比为0.006~0.02:1,na2co3与中间体y的摩尔比为2.0~3.0:1。元素分析结构(分子式c25h17bro):理论值c,72.65;h,4.15;br,19.33;测试值:c,72.65;h,4.15;br,19.32。esi-ms(m/z)(m+):理论值为412.05,实测值为413.11。b.r1表示为通式(3)所示结构时,中间体ii的合成:b1:中间体ii-1(x1为氧原子)的合成:(1)称取原料a溶于乙酸中,用冰盐浴降温至0℃;称取液溴溶于冰醋酸中,并缓慢滴加至原料a的乙酸溶液中,室温搅拌5h,取样点板,显示无原料a剩余,反应完全;反应结束后,向反应液中加入碱液中和,用二氯甲烷萃取,分层,取有机相过滤,滤液减压旋蒸至无馏分,过硅胶柱,得到中间体s1;所述原料a与液溴的摩尔比为1:1~1.5;(2)称取中间体s1和原料b,用体积比为1.5~3.0:1的甲苯乙醇混合溶剂溶解;再加入na2co3水溶液、pd(pph3)4;在惰性气氛下,将上述混合溶液于95~100℃下,搅拌反应10~24小时,然后冷却至室温、过滤反应溶液,滤液旋蒸,过硅胶柱,得到中间体s2;所述原料b与中间体s1的摩尔比为1:1.5~3.0;pd(pph3)4与原料b的摩尔比为0.006~0.02:1,na2co3与原料b的摩尔比为2.0~3.0:1;(3)在氮气保护下,称取中间体s2和对甲苯磺酸,用甲苯溶解,加热至95~100℃,反应10~24小时;取样点板,显示无中间体s2剩余,反应完全;反应结束后,向反应体系中加入饱和碳酸钠溶液淬灭,用乙酸乙酯萃取,分液,有机相用无水硫酸钠干燥后减压旋蒸至无馏分,所得粗产物过中性硅胶柱,得到中间体s3;所述中间体s2与对甲苯磺酸的摩尔比为1:1~1.5;(4)称取中间体s3溶于乙酸中,用冰盐浴降温至0℃;称取液溴溶于冰醋酸中,并缓慢滴加至中间体s3的乙酸溶液中,室温搅拌5h,取样点板,显示无原料s3剩余,反应完全;反应结束后,向反应液中加入碱液中和,用二氯甲烷萃取,分层,取有机相过滤,滤液减压旋蒸至无馏分,过硅胶柱,得到中间体s4;所述中间体s4与液溴的摩尔比为1:1~1.5;(5)在氮气保护下,称取中间体s4溶于四氢呋喃中,冷却至-78℃,然后向反应体系中加入1.6mol/l正丁基锂的四氢呋喃溶液,在-78℃下反应3h后加入硼酸三异丙酯,反应2h,然后将反应体系升至0℃,加入2mol/l盐酸溶液,搅拌3h,反应完全,加入乙醚萃取,萃取液加入无水硫酸镁干燥,旋蒸,用乙醇溶剂重结晶,得到中间体ii-1;所述中间体s4与正丁基锂的摩尔比为1:1~1.5;所述中间体s4与硼酸三异丙酯的摩尔比为1:1~1.5。此类以中间体o1的合成为例:(1)在250ml的三口瓶中加入0.1mol原料a1,50ml乙酸溶解,用冰盐浴降温至0℃;在0℃下向反应体系中逐滴加入溶于20ml冰醋酸的6.2ml(0.12mol)液溴,升至室温,搅拌5h;取样点板,显示无原料a1剩余,反应完全,反应结束后,向反应液中加入碳酸钠溶液中和,用二氯甲烷萃取,分层,取有机相,干燥过滤,滤液减压旋蒸至无馏分,过硅胶柱,得到中间体s1-1,hplc纯度99.4%,收率68.4%。元素分析结构(分子式c21h18brno):理论值c,66.33;h,4.77;br,21.01;n,3.68;测试值:c,66.33;h,4.77;br,21.01;n,3.67。esi-ms(m/z)(m+):理论值为379.06,实测值为379.56。(2)500ml的三口瓶,在氮气保护下,加入0.05mol原料b1,0.06mol中间体s1-1,用混合溶剂溶解(180ml甲苯,90ml乙醇),然后加入0.15molna2co3水溶液(2m),通氮气搅拌1小时,然后加入0.0005molpd(pph3)4,加热回流15小时,取样点板,反应完全。自然冷却,过滤,滤液旋蒸,过硅胶柱,得到中间体s2-1,hplc纯度99.3%,收率66.8%。元素分析结构(分子式c27h23no2):理论值c,82.42;h,5.89;n,3.56;测试值:c,82.42;h,5.89;n,3.57。esi-ms(m/z)(m+):理论值为393.17,实测值为393.44。(3)250ml的三口瓶,在氮气保护下,加入中间体0.03mol中间体s2-1和0.036mol对甲苯磺酸,用100ml甲苯溶解,加热至100℃,反应15小时;取样点板,显示无中间体s2-1剩余,反应完全;反应结束后,向反应体系中加入饱和碳酸钠溶液淬灭,用乙酸乙酯萃取,分液,有机相用无水硫酸钠干燥后减压旋蒸至无馏分,所得粗产物过中性硅胶柱,得到中间体s3-1,hplc纯度99.0%,收率64.1%。元素分析结构(分子式c27h21no):理论值c,86.37;h,5.64;n,3.73;测试值:c,86.37;h,5.64;n,3.74。esi-ms(m/z)(m+):理论值为375.16,实测值为375.16。(4)在100ml的三口瓶中加入0.15mol中间体s3-1,30ml乙酸溶解,用冰盐浴降温至0℃;在0℃下向反应体系中逐滴加入溶于10ml冰醋酸的9.2ml(0.18mol)液溴,升至室温,搅拌5h;取样点板,显示无中间体s3-1剩余,反应完全;反应结束后,向反应液中加入碳酸钠溶液中和,用二氯甲烷萃取,分层,取有机相,干燥过滤,滤液减压旋蒸至无馏分,过硅胶柱,得到中间体s4-1,hplc纯度98.6%,收率61.3%。元素分析结构(分子式c27h20brno):理论值c,71.37;h,4.44;br,17.59;n,3.08;测试值:c,71.37;h,4.44;br,17.59;n,3.07。esi-ms(m/z)(m+):理论值为453.07,实测值为453.71。(5)250ml的三口瓶,在通入氮气的气氛下,加入0.08mol中间体s4-1,40ml四氢呋喃溶解完全,冷却至-78℃,然后向反应体系中加入60ml的1.6mol/l正丁基锂的四氢呋喃溶液,在-78℃下反应3h后加入0.096mol硼酸三异丙酯,反应2h,然后将反应体系升至0℃,加入50ml的2mol/l盐酸溶液,搅拌3h,反应完全,加入乙醚萃取,萃取液加入无水硫酸镁干燥,旋蒸,用乙醇溶剂重结晶,得到中间体o1,纯度99.2%,收率57.3%。元素分析结构(分子式c27h22bno3):理论值c,77.34;h,5.29;b,2.58;n,3.34;测试值:c,77.34;h,5.29;b,2.58;n,3.35。esi-ms(m/z)(m+):理论值为419.17,实测值为419.67。中间体ii-1的合成分为五步:原料a溴化形成中间体s1;中间体s1和原料b合成中间体s2;中间体s2经成环反应形成中间体s3;中间体s3溴化形成中间体s4;最后由中间体s4和硼酸三异丙酯合成中间体ii-1,具体结构如表1所示。表1b2:中间体ii-2(x1为硫原子)的合成:(1)称取原料c溶于乙酸中,用冰盐浴降温至0℃;称取液溴溶于冰醋酸中,并缓慢滴加至原料c的乙酸溶液中,室温搅拌5h,取样点板,显示无原料c剩余,反应完全;反应结束后,向反应液中加入碱液中和,用二氯甲烷萃取,分层,取有机相过滤,滤液减压旋蒸至无馏分,过硅胶柱,得到中间体s5;所述原料c与液溴的摩尔比为1:1~1.5;(2)称取中间体s5和原料d,用体积比为1.5~3.0:1的甲苯乙醇混合溶剂溶解;再加入na2co3水溶液、pd(pph3)4;在惰性气氛下,将上述混合溶液于95~100℃下,搅拌反应10~24小时,然后冷却至室温、过滤反应溶液,滤液旋蒸,过硅胶柱,得到中间体s6;所述原料d与中间体s5的摩尔比为1:1.5~3.0;pd(pph3)4与原料d的摩尔比为0.006~0.02:1,na2co3与原料d的摩尔比为2.0~3.0:1;(3)在氮气保护下,称取中间体s6和碳酸铯,用dmso溶解,加热至140~150℃,反应8~12小时;取样点板,显示无中间体s6剩余,反应完全;将反应体系冷却至室温,加入饱和的氯化钠溶液,用乙酸乙酯萃取,分液,有机相用无水硫酸钠干燥,减压旋蒸,所得粗产物过中性硅胶柱,得到中间体s7;所述中间体s6与对碳酸铯的摩尔比为1:1~1.5;(4)称取中间体s7溶于乙酸中,用冰盐浴降温至0℃;称取液溴溶于冰醋酸中,并缓慢滴加至中间体s7的乙酸溶液中,室温搅拌5h,取样点板,显示无中间体s7剩余,反应完全;反应结束后,向反应液中加入碱液中和,用二氯甲烷萃取,分层,取有机相过滤,滤液减压旋蒸至无馏分,过硅胶柱,得到中间体s8;所述中间体s7与液溴的摩尔比为1:1~1.5;(5)在氮气保护下,称取中间体s8溶于四氢呋喃中,冷却至-78℃,然后向反应体系中加入1.6mol/l正丁基锂的四氢呋喃溶液,在-78℃下反应3h后加入硼酸三异丙酯,反应2h,然后将反应体系升至0℃,加入2mol/l盐酸溶液,搅拌3h,反应完全,加入乙醚萃取,萃取液加入无水硫酸镁干燥,旋蒸,用乙醇溶剂重结晶,得到中间体ii-2;所述中间体s8与正丁基锂的摩尔比为1:1~1.5;所述中间体s8与硼酸三异丙酯的摩尔比为1:1~1.5。中间体ii-2的合成分为五步:原料c溴化形成中间体s5;中间体s5和原料d合成中间体s6;中间体s6经成环反应形成中间体s7;中间体s7溴化形成中间体s8;最后由中间体s8和硼酸三异丙酯合成中间体ii-2,具体结构如表2所示。表2b3.中间体ii-3(x1为c1-10直链或支链烷基取代的亚烷基或芳基取代的亚烷基)的合成(1)称取原料e和原料f,用体积比为1.5~3.0:1的甲苯乙醇混合溶剂溶解;再加入na2co3水溶液、pd(pph3)4;在氮气保护下,将上述混合溶液于95~100℃下,搅拌反应10~24小时,然后冷却至室温、过滤反应溶液,滤液旋蒸,过硅胶柱,得到中间体s9;所述原料f与原料e的摩尔比为1:1.5~3.0;pd(pph3)4与原料f的摩尔比为0.006~0.02:1,na2co3与原料f的摩尔比为2.0~3.0:1;(2)在氮气保护下,称取中间体s9,用四氢呋喃搅拌溶解;将混合溶液用冰盐浴降温至0℃,缓慢滴加新制的对应格式试剂的四氢呋喃溶液,室温反应6~12小时,取样点板,显示无中间体s9剩余,反应完全;自然放置至室温,过滤,滤液进行减压旋蒸至无馏分,过中性硅胶柱,得到中间体s10;所述中间体s9与格式试剂的摩尔比为1:2~4;(3)在氮气保护下,称取中间体s10,用体积比为1:2.0~4.0的浓h3po4与水的混合液作为溶剂,溶解,室温反应6~12小时,取样点板,显示无中间体s10剩余,反应完全;加入naoh水溶液中和至ph=7,加入二氯甲烷萃取,分层,取有机相过滤,滤液减压旋蒸至无馏分,过中性硅胶柱,得到中间体s11;所述中间体s10与浓磷酸的摩尔比为1:3~6;(4)称取中间体s11溶于乙酸中,用冰盐浴降温至0℃;称取液溴溶于冰醋酸中,并缓慢滴加至中间体s11的乙酸溶液中,室温搅拌5h,取样点板,显示无中间体s11剩余,反应完全;反应结束后,向反应液中加入碱液中和,用二氯甲烷萃取,分层,取有机相过滤,滤液减压旋蒸至无馏分,过硅胶柱,得到中间体s12;所述中间体s11与液溴的摩尔比为1:1~1.5;(5)在氮气保护下,称取中间体s12溶于四氢呋喃中,冷却至-78℃,然后向反应体系中加入1.6mol/l正丁基锂的四氢呋喃溶液,在-78℃下反应3h后加入硼酸三异丙酯,反应2h,然后将反应体系升至0℃,加入2mol/l盐酸溶液,搅拌3h,反应完全,加入乙醚萃取,萃取液加入无水硫酸镁干燥,旋蒸,用乙醇溶剂重结晶,得到中间体ii-3;所述中间体s12与正丁基锂的摩尔比为1:1~1.5;所述中间体s12与硼酸三异丙酯的摩尔比为1:1~1.5。中间体ii-3的合成分为五步:由原料e和原料f合成中间体s9;中间体s9和格式试剂生成中间体s10;中间体s10成环生成中间体s11;中间体s11溴化形成中间体s12;最后由中间体s12和硼酸三异丙酯合成中间体ii-3,具体结构如表3所示。表3b4:中间体ii-4(x1为芳基取代的叔胺基)的合成(1)称取原料g和原料h,用体积比为1.5~3.0:1的甲苯乙醇混合溶剂溶解;再加入na2co3水溶液、pd(pph3)4;在氮气保护下,将上述混合溶液于95~100℃下,搅拌反应10~24小时,然后冷却至室温、过滤反应溶液,滤液旋蒸,过硅胶柱,得到中间体s13;所述原料h与原料g的摩尔比为1:1.5~3.0;pd(pph3)4与原料h的摩尔比为0.006~0.02:1,na2co3与原料h的摩尔比为2.0~3.0:1;(2)在氮气保护下,将上一步制备的中间体s13溶于邻二氯苯中,加入三苯基膦,在170~190℃下搅拌反应12~16小时,反应结束后冷却至室温,过滤,滤液减压旋蒸,过中性硅胶柱,得中间体s14;所述中间体s13与三苯基膦摩尔比为1:1~2;(3)在氮气保护下,依次称取中间体s14、原料j'、叔丁醇钠、pd2(dba)3、三叔丁基膦,用甲苯搅拌混合,加热至110~120℃,回流反应12~24小时,取样点板,显示无中间体s14剩余,反应完全;自然冷却至室温,过滤,滤液减压旋蒸至无馏分,过中性硅胶柱,得到中间体s15;所述中间体s14与原料j'的摩尔比为1:1~2;所述pd2(dba)3与中间体s14的摩尔比为0.006~0.02:1,所述三叔丁基膦与中间体s14的摩尔比为0.006~0.02:1;所述叔丁醇钠与中间体s14的摩尔比为2.0~3.0:1;(4)称取中间体s15溶于乙酸中,用冰盐浴降温至0℃;称取液溴溶于冰醋酸中,并缓慢滴加至中间体s15的乙酸溶液中,室温搅拌5h,取样点板,显示无中间体s15剩余,反应完全;反应结束后,向反应液中加入碱液中和,用二氯甲烷萃取,分层,取有机相过滤,滤液减压旋蒸至无馏分,过硅胶柱,得到中间体s16;所述中间体s15与液溴的摩尔比为1:1~1.5;(5)在氮气保护下,称取中间体s16溶于四氢呋喃中,冷却至-78℃,然后向反应体系中加入1.6mol/l正丁基锂的四氢呋喃溶液,在-78℃下反应3h后加入硼酸三异丙酯,反应2h,然后将反应体系升至0℃,加入2mol/l盐酸溶液,搅拌3h,反应完全,加入乙醚萃取,萃取液加入无水硫酸镁干燥,旋蒸,用乙醇溶剂重结晶,得到中间体ii-4;所述中间体s16与正丁基锂的摩尔比为1:1~1.5;所述中间体s16与硼酸三异丙酯的摩尔比为1:1~1.5。中间体ii-4的合成分为五步:由原料g和原料h合成中间体s13;中间体s13经成环反应形成中间体s14;中间体s14和原料j合成中间体s15;中间体s15溴化形成中间体s16;最后由中间体s16和硼酸三异丙酯合成中间体ii-4,具体结构如表4所示。表4c.r1表示为通式(4)所示结构时,中间体ii的合成:当x为时(r3为甲基或苯基):(1)在氮气保护下,依次称取原料k、原料l、叔丁醇钠、pd2(dba)3、三叔丁基膦,用甲苯搅拌混合,加热至110~120℃,回流反应12~24小时,取样点板,显示无原料l剩余,反应完全;自然冷却至室温,过滤,滤液减压旋蒸至无馏分,过中性硅胶柱,得到中间体s17。上述反应中,原料l与原料k的摩尔比为1:1~2;原料l与叔丁醇钠的摩尔比为1:1~3;原料l与pd2(dba)3和三叔丁基膦的摩尔比均为1:0.01~0.05;(2)在氮气保护下,称取中间体s17,加入四氢呋喃搅拌溶解,用冰盐浴降温至0℃;然后缓慢滴加新制的对应格氏试剂的四氢呋喃溶液,室温反应6~12小时,取样点板,显示无中间体s17剩余,反应完全;自然冷却至室温,过滤,滤液减压旋蒸至无馏分,过中性硅胶柱,得到中间体s18。上述反应中,中间体s17与格氏试剂试剂的摩尔比为1:2~4;(3)在氮气保护下,称取中间体s18,加入浓h3po4与水体积比为1:3的混合液,搅拌混合,室温反应6~12小时,取样点板,显示无中间体s18剩余,反应完全;加入naoh水溶液中和至ph=7,加入二氯甲烷萃取,分层,取有机相过滤,滤液减压旋蒸至无馏分,过中性硅胶柱,得到中间体s19;中间体s18与浓磷酸摩尔比为1:3~6。(4)在氮气保护下,依次称取中间体s19、原料j、叔丁醇钠、pd2(dba)3、三叔丁基膦,用甲苯搅拌混合,加热至110~120℃,回流反应12~24小时,取样点板,显示无中间体s19剩余,反应完全;自然冷却至室温,过滤,滤液进行减压旋蒸至无馏分,过中性硅胶柱,得到中间体s20。上述反应中,中间体s19与原料c摩尔比为1:1~2;中间体s19与叔丁醇钠的摩尔比为1:1~3;中间体s19与pd2(dba)3的摩尔比为1:0.01~0.05;中间体s19与三叔丁基膦的摩尔比为1:0.01~0.05;(5)称取中间体s20溶于乙酸中,用冰盐浴降温至0℃;称取液溴溶于冰醋酸中,并缓慢滴加至中间体s20的乙酸溶液中,室温搅拌5h,取样点板,显示无原料s20剩余,反应完全;反应结束后,向反应液中加入碱液中和,用二氯甲烷萃取,分层,取有机相过滤,滤液减压旋蒸至无馏分,过硅胶柱,得到中间体s21;所述中间体s20与液溴的摩尔比为1:1~1.5;(6)在氮气保护下,称取中间体s21溶于四氢呋喃中,冷却至-78℃,然后向反应体系中加入1.6mol/l正丁基锂的四氢呋喃溶液,在-78℃下反应3h后加入硼酸三异丙酯,反应2h,然后将反应体系升至0℃,加入2mol/l盐酸溶液,搅拌3h,反应完全,加入乙醚萃取,萃取液加入无水硫酸镁干燥,旋蒸,用乙醇溶剂重结晶,得到中间体ii-5;所述中间体s21与正丁基锂的摩尔比为1:1~1.5;所述中间体s21与硼酸三异丙酯的摩尔比为1:1~1.5。中间体ii-5的合成分为六步:由原料k和原料l合成中间体s17;中间体s17经格氏试剂形成中间体s18;中间体s18脱水合成中间体s19;中间体s19与原料j合成中间体s20;中间体s20溴化形成中间体s21;最后由中间体s21和硼酸三异丙酯合成中间体ii-5,具体结构如表5所示。表5当x为o原子时:(1)在氮气保护下,依次加入原料m、原料n、碘、二甘醇,搅拌混合,加热至260~280℃,反应12~24小时;取样点板,显示无原料m剩余,反应完全;反应结束后,自然冷却至室温,有固体析出,过滤,滤饼用真空干燥箱烘干,然后过中性硅胶柱,得到中间体s22;上述反应中,原料m与原料n的摩尔比为1:1~2,原料m与碘的摩尔比为1:0.05~0.1。(2)在氮气保护下,依次称取中间体s22、原料j、叔丁醇钠、pd2(dba)3、三叔丁基膦,用甲苯搅拌混合,加热至110~120℃,回流反应12~24小时,取样点板,显示无中间体s22剩余,反应完全;自然冷却至室温,过滤,滤液进行减压旋蒸至无馏分,过中性硅胶柱,得到中间体s23。上述反应中,中间体s22与原料j摩尔比为1:1~2;中间体s22与叔丁醇钠的摩尔比为1:1~3;中间体s22与pd2(dba)3的摩尔比为1:0.01~0.05;中间体s22与三叔丁基膦的摩尔比为1:0.01~0.05;(3)称取中间体s23溶于乙酸中,用冰盐浴降温至0℃;称取液溴溶于冰醋酸中,并缓慢滴加至中间体s23的乙酸溶液中,室温搅拌5h,取样点板,显示无原料s23剩余,反应完全;反应结束后,向反应液中加入碱液中和,用二氯甲烷萃取,分层,取有机相过滤,滤液减压旋蒸至无馏分,过硅胶柱,得到中间体s24;所述中间体s23与液溴的摩尔比为1:1~1.5;(4)在氮气保护下,称取中间体s24溶于四氢呋喃中,冷却至-78℃,然后向反应体系中加入1.6mol/l正丁基锂的四氢呋喃溶液,在-78℃下反应3h后加入硼酸三异丙酯,反应2h,然后将反应体系升至0℃,加入2mol/l盐酸溶液,搅拌3h,反应完全,加入乙醚萃取,萃取液加入无水硫酸镁干燥,旋蒸,用乙醇溶剂重结晶,得到中间体ii-6;所述中间体s24与正丁基锂的摩尔比为1:1~1.5;所述中间体s24与硼酸三异丙酯的摩尔比为1:1~1.5。中间体ii-6的合成分为四步:由原料m和原料n合成中间体s22;中间体s22与原料j合成中间体s23;中间体s23溴化形成中间体s24;最后由中间体s24和硼酸三异丙酯合成中间体ii-6,具体结构如表6所示。表6实施例2:化合物11的合成:250ml的三口瓶,在通入氮气的气氛下,加入0.01mol中间体i-1,0.015mol中间体o1,用混合溶剂溶解(90ml甲苯,45ml乙醇),然后加入0.03molna2co3水溶液(2m),通氮气搅拌1小时,然后加入0.0001molpd(pph3)4,加热回流15小时,取样点板,反应完全。自然冷却,过滤,滤液旋蒸,过硅胶柱,得到目标产物,纯度99.2%,收率78.4%。元素分析结构(分子式c46h33no2):理论值c,87.45;h,5.27;n,2.22;测试值:c,87.44;h,5.27;n,2.23。esi-ms(m/z)(m+):理论值为631.25,实测值为631.55。实施例3:化合物22的合成:250ml的三口瓶,在通入氮气的气氛下,加入0.01mol中间体i-1,0.015mol中间体p1,用混合溶剂溶解(90ml甲苯,45ml乙醇),然后加入0.03molna2co3水溶液(2m),通氮气搅拌1小时,然后加入0.0001molpd(pph3)4,加热回流15小时,取样点板,反应完全。自然冷却,过滤,滤液旋蒸,过硅胶柱,得到目标产物,纯度99.4%,收率74.6%。元素分析结构(分子式c46h33nos):理论值c,85.28;h,5.13;n,2.16;s,4.95;测试值:c,85.28;h,5.13;n,2.16;s,4.94。esi-ms(m/z)(m+):理论值为647.23,实测值为647.63。实施例4:化合物34的合成:250ml的三口瓶,在通入氮气的气氛下,加入0.01mol中间体i-1,0.015mol中间体q1,用混合溶剂溶解(90ml甲苯,45ml乙醇),然后加入0.03molna2co3水溶液(2m),通氮气搅拌1小时,然后加入0.0001molpd(pph3)4,加热回流15小时,取样点板,反应完全。自然冷却,过滤,滤液旋蒸,过硅胶柱,得到目标产物,纯度99.5%,收率75.7%。元素分析结构(分子式c49h39no):理论值c,89.46;h,5.98;n,2.13;测试值:c,89.47;h,5.98;n,2.12。esi-ms(m/z)(m+):理论值为657.30,实测值为658.30。实施例5:化合物44的合成:化合物44的制备方法同实施例2,不同之处在于采用中间体r1替换中间体o1。元素分析结构(分子式c52h38n2o):理论值c,88.36;h,5.42;n,3.96;测试值:c,88.36;h,5.42;n,3.97。esi-ms(m/z)(m+):理论值为706.30,实测值为706.60。实施例6:化合物47的合成:化合物47的制备方法同实施例2,不同之处在于采用中间体q2替换中间体o1。元素分析结构(分子式c55h43no):理论值c,90.01;h,5.91;n,1.91;测试值:c,90.01;h,5.91;n,1.92。esi-ms(m/z)(m+):理论值为733.33,实测值为733.43。实施例7:化合物57的合成:化合物57的制备方法同实施例2,不同之处在于采用中间体r2替换中间体o1。元素分析结构(分子式c52h38n2o):理论值c,88.36;h,5.42;n,3.96;测试值c,88.36;h,5.42;n,3.95。esi-ms(m/z)(m+):理论值为706.30,实测值为707.30。实施例8:化合物70的合成:化合物70的制备方法同实施例2,不同之处在于采用中间体q3替换中间体o1。元素分析结构(分子式c55h43no):理论值c,90.01;h,5.91;n,1.91;测试值:c,90.00;h,5.91;n,1.92。esi-ms(m/z)(m+):理论值为733.33,实测值为733.53。实施例9:化合物84的合成:化合物84的制备方法同实施例2,不同之处在于采用中间体o2替换中间体o1。元素分析结构(分子式c52h37no2):理论值c,88.23;h,5.27;n,1.98;测试值:c,88.24;h,5.27;n,1.97。esi-ms(m/z)(m+):理论值为707.28,实测值为707.54。实施例10:化合物95的合成:化合物95的制备方法同实施例2,不同之处在于采用中间体r3替换中间体o1。元素分析结构(分子式c49h32n2o2):理论值c,86.45;h,4.74;n,4.11;测试值:c,86.44;h,4.74;n,4.12。esi-ms(m/z)(m+):理论值为680.25,实测值为680.85。实施例11:化合物107的合成:化合物107的制备方法同实施例2,不同之处在于采用中间体x1替换中间体o1。元素分析结构(分子式c52h45no):理论值c,89.23;h,6.48;n,2.00;测试值:c,89.22;h,6.48;n,2.01。esi-ms(m/z)(m+):理论值为699.35,实测值为699.66。实施例12:化合物120的合成:化合物120的制备方法同实施例2,不同之处在于采用中间体x2替换中间体o1。元素分析结构(分子式c55h44n2o):理论值c,88.20;h,5.92;n,3.74;测试值:c,88.19;h,5.92;n,3.75。esi-ms(m/z)(m+):理论值为748.35,实测值为748.95。实施例13:化合物132的合成:化合物132的制备方法同实施例2,不同之处在于采用中间体t1替换中间体o1。元素分析结构(分子式c52h38n2o2):理论值c,86.40;h,5.30;n,3.88;测试值:c,86.41;h,5.30;n,3.87。esi-ms(m/z)(m+):理论值为722.29,实测值为722.98。实施例14:化合物134的合成:化合物134的制备方法同实施例2,不同之处在于采用中间体i-2替换中间体i-1,采用中间体q1替换中间体o1。元素分析结构(分子式c55h43no):理论值c,90.01;h,5.91;n,1.91;测试值:c,90.01;h,5.91;n,1.90。esi-ms(m/z)(m+):理论值为733.33,实测值为733.56。实施例15:化合物137的合成:化合物137的制备方法同实施例2,不同之处在于采用中间体i-2替换中间体i-1,采用中间体t1替换中间体o1。元素分析结构(分子式c58h42n2):理论值c,87.19;h,5.30;n,3.51;测试值:c,87.19;h,5.30;n,3.50。esi-ms(m/z)(m+):理论值为798.32,实测值为798.52。本发明的有机化合物在发光器件中使用,可以作为电子阻挡层材料,也可以作为发光层主体材料使用。对本发明化合物进行热性能、homo能级、循环伏安稳定性的测试,如表7所示。表7注:三线态能级t1是由日立的f4600荧光光谱仪测试,材料的测试条件为2*10-5的甲苯溶液;玻璃化温度tg由示差扫描量热法(dsc,德国耐驰公司dsc204f1示差扫描量热仪)测定,升温速率10℃/min;热失重温度td是在氮气气氛中失重1%的温度,在日本岛津公司的tga-50h热重分析仪上进行测定,氮气流量为20ml/min;最高占据分子轨道homo能级是由电离能量测试系统(ips3)测试,测试为大气环境。循环伏安稳定性是通过循环伏安法观测材料的氧化还原特性来进行鉴定;测试条件:测试样品溶于体积比为2:1的二氯甲烷和乙腈混合溶剂,浓度1mg/ml,电解液是0.1m的四氟硼酸四丁基铵或六氟磷酸四丁基铵的有机溶液。参比电极是ag/ag+电极,对电极为钛板,工作电极为ito电极,循环次数为20次。由上表数据可知,本发明的有机化合物具有不同的homo能级,可应用于不同的功能层,本发明以氧杂蒽为核心的有机化合物具有较高的三线态能级、较高的热稳定性及化学稳定性,使得所制作的含有本发明有机化合物的oled器件效率和寿命均得到提升。以下通过器件实施例1~13和器件比较例1详细说明本发明合成的oled材料在器件中的应用效果。本发明所述器件实施例2~13、器件比较例1与器件实施例1相比所述器件的制作工艺完全相同,并且所采用了相同的基板材料和电极材料,电极材料的膜厚也保持一致,所不同的是器件实施例1~8为使用本发明所述材料作为电子阻挡层应用;器件实施例9~13对器件中的发光层的主体材料做了变换。各实施例所得器件的性能测试结果如表8所示。器件实施例1:如图1所示,一种电致发光器件,其制备步骤包括:a)清洗透明基板层1上的ito阳极层2,分别用去离子水、丙酮、乙醇超声清洗各15分钟,然后在等离子体清洗器中处理2分钟;b)在ito阳极层2上,通过真空蒸镀方式蒸镀空穴注入层材料hat-cn,厚度为10nm,这层作为空穴注入层3;c)在空穴注入层3上,通过真空蒸镀方式蒸镀空穴传输材料npb,厚度为60nm,该层为空穴传输层4;d)在空穴传输层4上,通过真空蒸镀方式蒸镀电子阻挡层材料本发明化合物11,厚度为20nm,该层为电子阻挡层5;e)在电子阻挡层5之上蒸镀发光层6,使用cbp作为主体材料,ir(ppy)3作为掺杂材料,ir(ppy)3和cbp的质量比为10:90,厚度为30nm;f)在发光层6之上,通过真空蒸镀方式蒸镀电子传输材料tpbi,厚度为40nm,这层有机材料作为空穴阻挡/电子传输层7使用;g)在空穴阻挡/电子传输层7之上,真空蒸镀电子注入层lif,厚度为1nm,该层为电子注入层8;h)在电子注入层8之上,真空蒸镀阴极al(100nm),该层为阴极反射电极层9;按上述步骤制作电致发光器件,测量器件的电流效率和寿命,其结果见表8所示。相关材料的分子结构式如下所示:器件实施例2:本实施例与器件实施例1的不同之处在于:电致发光器件的电子阻挡层材料为本发明化合物22。器件实施例3:本实施例与器件实施例1的不同之处在于:电致发光器件的电子阻挡层材料为本发明化合物44。器件实施例4:本实施例与器件实施例1的不同之处在于:电致发光器件的电子阻挡层材料为本发明化合物57。器件实施例5:本实施例与器件实施例1的不同之处在于:电致发光器件的电子阻挡层材料为本发明化合物84。器件实施例6:本实施例与器件实施例1的不同之处在于:电致发光器件的电子阻挡层材料为本发明化合物95。器件实施例7:本实施例与器件实施例1的不同之处在于:电致发光器件的电子阻挡层材料为本发明化合物120。器件实施例8:本实施例与器件实施例1的不同之处在于:电致发光器件的电子阻挡层材料为本发明化合物132。器件实施例9:本实施例与器件实施例1的不同之处在于:电致发光器件的电子阻挡层材料为npb,电致发光器件的发光层主体材料变为本发明化合物47,掺杂材料为ir(ppy)3,ir(ppy)3和化合物47的质量比为10:90。器件实施例10:本实施例与器件实施例1的不同之处在于:电致发光器件的电子阻挡层材料为npb,电致发光器件的发光层主体材料变为本发明化合物70,掺杂材料为ir(ppy)3,ir(ppy)3和化合物70的质量比为10:90。器件实施例11:本实施例与器件实施例1的不同之处在于:电致发光器件的电子阻挡层材料为npb,电致发光器件的发光层主体材料变为本发明化合物107,掺杂材料为ir(ppy)3,ir(ppy)3和化合物107的质量比为10:90。器件实施例12:电致发光器件的电子阻挡层材料为npb,电致发光器件的发光层主体材料变为本发明化合物34和化合物ghn,掺杂材料为ir(ppy)3,化合物34、ghn和ir(ppy)3三者质量比为为60:30:10。器件实施例13:电致发光器件的电子阻挡层材料为npb,电致发光器件的发光层主体材料变为本发明化合物134和化合物ghn,掺杂材料为ir(ppy)3,化合物134、ghn和ir(ppy)3三者质量比为为60:30:10。器件比较例1:本实施例与器件实施例1的不同之处在于:电致发光器件的电子阻挡层材料为npb,电致发光器件的发光层主体材料为公知化合物cbp,掺杂材料为ir(ppy)3,ir(ppy)3和cbp的质量比为10:90,所得电致发光器件的检测数据见表8所示。表8注:寿命测试系统为本发明所有权人与上海大学共同研究的oled器件寿命测试仪。由表9的结果可以看出本发明所述以氧杂蒽为核心的机化合物可应用于oled发光器件制作,并且与器件比较例1相比,无论是效率还是寿命均比已知oled材料获得较大改观,特别是器件的寿命衰减获得较大的提升。进一步的本发明材料制备的的oled器件在高温下能够保持长寿命,将器件实施例1~13和器件比较例1在85℃进行高温驱动寿命测试,所得结果如表9所示。表9器件编号高温lt95寿命hr器件编号高温lt95寿命hr器件实施例125.1器件实施例825.6器件实施例226.4器件实施例926.5器件实施例328.7器件实施例1026.7器件实施例426.9器件实施例1127.8器件实施例529.3器件实施例1237.3器件实施例628.5器件实施例1336.6器件实施例725.7器件比较例10.7从表10的数据可知,器件实施例1~13为本发明材料和已知材料搭配的器件结构,和器件比较例1相比,高温下,本发明提供的oled器件具有很好的驱动寿命。为了比较不同器件在高电流密度下效率衰减的情况,定义效率衰减系数进行表示;它表示驱动电流为100ma/cm2时器件的最大效率μ100与器件的最大效率μmax之差与最大效率μmax之间的比值,值越大,说明器件的效率滚降越严重,反之,说明器件在高电流密度下快速衰降的问题得到了控制。本发明的有机化合物在发光器件中使用,可以作为电子阻挡层材料,也可以作为发光层主体材料使用。对器件实施例1~13和器件比较例1分别进行效率衰减系数的测定,检测结果如表10所示。表10从表10的数据可知,和器件比较例1相比,本发明提供的oled器件在高电流密度下具有较平缓的效率滚降趋势,为产业化提供了良好的前景。进一步的本发明材料制备的oled器件在低温下工作时效率也比较稳定,将器件实施例4、9、12和器件比较例1在-10~80区间℃进行效率测试,所得结果如表11和图2所示。表11从表11和图2的数据可知,器件实施例4、9、12为本发明材料和已知材料搭配的器件结构,和器件比较例1相比,不仅低温效率高,而且在温度升高过程中,效率平稳升高。以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种锌配合物晶体的制造方法与工艺
- 有机化合物及有机光电装置及显示装置的制造方法
- 有机化合物、电荷传输材料、组合物、有机场致发光元件、显示装置及照明装置的制造方法
- 有机化合物、组合物、有机光电装置以及显示装置的制造方法
- 一种有机锡分子印迹聚合物微球,固相萃取柱及其应用的制造方法与工艺
- 一种有机化合物,包含该化合物的有机电致发光器件材料及包含该材料的有机电致发光器件的制造方法与工艺
- 一种有机化合物,包含该化合物的有机电致发光器件材料及包含该材料的有机电致发光器件的制造方法与工艺
- 带偶氮功能基团共价有机化合物作为气体吸附材料的应用的制造方法与工艺
- 有机化合物、有机光电装置及显示装置的制造方法
- 一种手性锌配合物的制造方法与工艺
- 一种有机化合物及其在有机电致发光器件中的应用的制造方法与工艺
- 一种有机化合物,包含该化合物的有机电致发光器件材料及包含该材料的有机电致发光器件的制造方法与工艺
- 一种有机化合物,包含该化合物的有机电致发光器件材料及包含该材料的有机电致发光器件的制造方法与工艺
- 带偶氮功能基团共价有机化合物作为气体吸附材料的应用的制造方法与工艺
- 有机化合物、有机光电装置及显示装置的制造方法
- 液态电极易挥发有机化合物净化装置的制造方法
- 新颖的有机化合物及包含该有机化合物的有机发光元件的制作方法
- 液态电极易挥发有机化合物净化装置的制造方法
- 有机化合物和组合物以及有机光电装置和显示装置的制造方法
- 采用色烯或色满染料、特定的有机化合物、氧化剂、碱剂及金属盐的头发着色方法