一种转录调节蛋白基因ORF2的用途的制作方法
本发明属于生物技术领域和遗传工程领域,涉及一种转录调节蛋白基因orf2的用途,具体涉及从硫化叶菌病毒stsv2(sulfolobustengchongenesisspindle-shapedvirus2)克隆的转录调节蛋白基因orf2,将该基因连接到载体转入到酵母菌中,并对其调节酵母菌生产不饱和脂肪酸的能力进行研究,为多不饱和脂肪酸的大规模生产提供参考。
背景技术
pufas(polyunsaturatedfattyacids,pufas)指一系列含有两个或两个以上非共轭顺式双键的c18-22的多不饱和脂肪酸,包括n-3和n-6两大类。n-3脂肪酸有:α-亚麻酸、dha和epa;n-6脂肪酸有:亚油酸、γ-亚麻酸、二高-γ-亚麻酸和花生四烯酸。pufas(polyunsaturatedfattyacids,pufas)作为一种独特的生物活性物质,在机体内具有稳定细胞膜功能、调控基因表达、维持细胞因子和脂蛋白平衡、减肥、抗心血管病、促进生长发育、抗炎、抗癌、增加动物的产仔率和成活率等生理功能。而且双键愈多,不饱和程度愈高,营养价值也愈高。目前,la、gla和ala主要通过筛选过的植物种子来提取,而aa、epa和dha从海洋鱼油中提取,一些哺乳动物也能提取aa;但是pufas的植物来源受气候和地域的限制,并且植物资源受农药污染的威胁。而鱼油有特殊气味,在提炼过程中易氧化,工艺复杂,尚不能满足市场需求。并且,由于各国老年人口比例的逐渐增加,心脑血管疾病的肆虐,以及人们,日益重视健康的态度,作为药品和保健食品材料的pufas的需求量会愈来愈多。因此,除la以外,目前的pufas资源远远不能满足市场需求。为此近年来人们积极寻求替代的生物资源,如油料作物的遗传改性及低等动植物的综合利用,尤其寻找微生物中的高产油脂菌来生产pufas。日益重视健康的态度,作为药品和保健食品材料的pufas的需求量会愈来愈多。因此,除la以外,目前的pufas资源远远不能满足市场需求。为此近年来人们积极寻求替代的生物资源,如油料作物的遗传改性及低等动植物综合利用,尤其寻找微生物中的高产油脂菌来生产pufas。传统的pufas来源在产量、质量、生产成本以及安全性等方面细胞的问题无法满足市场的大量需求,因此研究开发新的pufas资源已成为热点。
与动植物油生产pufas相比,微生物具有发酵周期短、集约化大规模生产、油脂含量高、培养成本低、不受原料控制、对环境的适应性强、生物转化率高等优点。当前研究主要集中在从诸多微生物中筛选出特种pufas的高产菌株或油脂含量高的菌株,以及利用诱变育种技术、抗性筛选法(takenosetal,2005)、基因工程筛选(maaliamirietal,2007;haoletal,2008)等方法在已有菌株的基础上选育γ-亚麻酸、花生四烯酸、epa、dha等高产菌株。近年来,利用微生物发酵工程中来产不饱和脂肪酸已取得了相当大的进展。
产油酵母细胞中富含多不饱和脂肪酸pufas,产油酵母成分和常见的植物油相类似,而且产油酵母中油脂具有独特与明确的生物化学和物理化学性质,作为生活中植物食用油的替代品以及生产生物柴油的原料,在工业上具有重要的潜在应用价值。除了通过发酵工艺学研究获得高产量油脂外,研究不同条件下提高脂肪酸脱氢酶活性或者基因表达水平来提高细胞中pufas的组成和含量,也已成为该领域的研究热点课题。
转录调节蛋白是一类能够与真核生物基因启动子区域中顺式作用元件发生特异性相互作用的dna结合蛋白,通过它们之间以及与其他相关蛋白之间的相互作用,激活或抑制基因的转录。转录调节蛋白一般由dna结合区、转录调控区(激活区或抑制区)、寡聚化位点和核定位信号4个功能区组成,转录调节蛋白通过这些功能区域相互作用来调控基因的转录表达。其dna结合区带共有的结构主要有:hth(螺旋-转角-螺旋)和hlh(螺旋-环-螺旋)结构、锌指结构以及亮氨酸拉链结构。而硫化叶菌病毒stsv2编码的orf2蛋白是具有典型的whth(wingedhelix-turn-helix)结构域的转录调节蛋白。而目前有研究发现,orf2基因的表达会提高宿主冰岛硫化叶菌(sulfolobusislandicus)e233s的一些内源基因以及病毒自身基因orfs的mrna的转录水平,促进病毒stsv2的增殖。综合冰岛硫化叶菌e233s菌株和病毒基因的转录水平的变化,推测orf2是一个普遍性的促进基因转录的转录调节蛋白。可见,orf2对于细胞生物学过程有着重要的调节作用,但目前尚未有转录调节蛋白orf2促进酵母菌生产多不饱和脂肪酸能力的相关报道。
技术实现要素:
本发明的目的是提供一种转录调节蛋白基因orf2的新用途,即将其应用在常温下促进多不饱和脂肪酸合成中。
本发明所提供转录调节蛋白,名称为orf2,来源于硫化叶菌病毒stsv2,该基因核苷酸序列如seqidno:1所示,该基因序列长为393bp(碱基),该基因编码的氨基酸序列如seqidno:2所示的多肽或其片段,共编码130个氨基酸。
本发明另一目的是提供一种含有转录调节蛋白基因orf2的重组表达载体,是将seqidno:1所示基因直接与酵母表达载体prh2034连接所构建的重组载体prhorf2。
本发明另一目的是提供一种含有转录调节蛋白基因orf2或上述重组表达载体的宿主细胞,该细胞是红冬孢酵母(rhodosporidiumkratochvilovae)ym25235;
含有上述编码基因的表达盒、重组表达载体、转基因细胞系或重组菌也属于本发明的保护范围。
扩增上述所述编码基因全长或其任一片段的引物对也属于本发明的保护范围。
上述蛋白在作为转录因子中的应用也属于本发明的保护范围。
上述蛋白在调节红冬孢酵母ym25235产多不饱和脂肪酸的应用也属于本发明的保护范围。
具体涉及从硫化叶菌病毒stsv2中克隆的转录调节蛋白基因orf2插入prh2034质粒,构建了重组表达质粒prhorf2,使用农杆菌介导法将其转入红冬孢酵母ym25235中进行过表达,获得转基因菌株ym25235/prhorf2,提高了红冬孢酵母ym25235产亚油酸和亚麻酸两种多不饱和脂肪酸的合成水平。
本发明的有益效果:
本发明从硫化叶菌病毒stsv2的dna中分离得到转录调节蛋白基因orf2,该基因全长393bp。本研究表明orf2基因在红冬孢酵母ym25235中的过表达会引起细胞内与多不饱和脂肪酸合成相关基因的mrna转录水平的提高,促进细胞中多不饱和脂肪酸含量增加;本研究结果将有助于通过基因工程手段对微生物进行改造来提高多不饱和脂肪酸含量,对多不饱和脂肪酸的工业化生产提供有良好的应用前景和经济效益,为大规模商业化生产多不饱和脂肪酸奠定基础。
附图说明
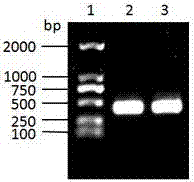
图1为本发明的硫化叶菌病毒stsv2的orf2基因pcr扩增图;其中:1、dna分子量标记dl2000;2-3、orf2基因的pcr产物;
图2为本发明的重组质粒prhorf2的质粒图谱;
图3为本发明的重组质粒prhorf2限制性酶切分析;其中:1、dna分子量标记dl10000;2、空质粒prh2304的ncoi和ecorⅴ双酶切分析;3、重组质粒prhorf2的ncoi和ecorⅴ双酶切分析;4、orf2基因的pcr产物;5、dna分子量标记dl2000;
图4为本发明的orf2基因转化红冬孢酵母ym25235后转基因酵母细胞中orf2基因的mrna转录水平分析;其中:1、dna分子量标记dl2000;2、阴性对照;3、阳性对照orf2基因片段;4-6、从三株转基因酵母菌株总rna中均扩增获得与orf2基因大小相同的目的片段的pcr扩增结果;
图5为本发明的orf2基因转化红冬孢酵母ym25235后转基因酵母细胞总脂肪酸气相色谱分析;其中:a、ym25235/prh2304;b、ym25235/prhorf2。
具体实施方式
下面结合附图和实施例对本发明作进一步详细说明,但本发明保护范围不局限于所述内容,实施例中使用的试剂和方法,如无特殊说明,均采用常规试剂和使用常规方法。
实施例1:病毒stsv2转录调节蛋白orf2基因的克隆
98℃金属浴裂解带有病毒stsv2的e233s菌体悬浮液10min,离心取上清为模板,根据序列设计特异性引物(引物1和引物2)进行pcr扩增;反应所用引物、组份和扩增条件如下:
引物1:orf2-f:5`-ttaccatggccgcacaacccttaact-3`(seqidno:3)
引物2:orf2-r:5`-ttagatatcttattcgttttgagaaatt-3`(seqidno:4);
pcr扩增体系如下(50μl):
pcr扩增条件:94℃预变性3min,再用94℃变性30s,58℃退火30s,72℃延伸30s进行30个循环,最后72℃彻底延伸10min。反应完后取产物2μl,然后在浓度为1%的琼脂糖凝胶中进行电泳分析显示,扩增得到大小约400bp的片段(图1)。用百泰克生物技术有限公司多动能dna纯化回收试剂盒回收目的片段,把回收片段亚克隆到prh2034中,连接产物转化到用cacl2法处理的大肠杆菌dh5α,在含壮观霉素(100ug/ml)的lb固体平板上过夜培养,挑取平板上生长的白色菌落,通过菌落pcr验证阳性克隆。将验证阳性的克隆子接入lb液体培养基(含100ug/ml壮观霉素)中过夜培养,用高纯质粒小量制备试剂盒(离心柱型)(北京百泰克生物技术有限公司)提取质粒,经测序(北京三博远志生物技术有限责任公司)。测序结果显示,获得一段393bp长的序列,命名为orf2,dna序列组成如seqidno:1所示的核苷酸序列。
实施例2:orf2基因过表达载体prhorf2的构建
将扩增获得的orf2片段和表达载体prh2304分别用ncoi和ecorv两个限制性内切酶进行双酶切,电泳回收酶切大片段,并用t4连接酶在16℃连接4h,连接产物转化大肠杆菌hd5α,构建重组表达质粒prhorf2(图2)。通过菌落pcr筛选阳性克隆,然后提取重组质粒,并用ncoi和ecorv对prhorf2进行双酶切验证。结果表明,重组质粒prhorf2经双酶切后产生了400bp和1kb左右的两个条带(图3第3泳道),这两个条带分别与质粒prh2304和orf2基因片段经ncoi和ecorv双酶切后的片段大小一致(图3第2泳道和第4泳道),初步表明重组质粒prhorf2构建成功。将酶切验证正确的质粒送出测序进一步进行验证。测序结果表明,测序所获得的序列与目的序列完全一致。
实施例3:orf2基因表达提高红冬孢酵母ym25235菌株中多不饱和脂肪酸的合成
1、重组质粒prhorf2转农杆菌lba4404
将构建好的重组质粒prhorf2用化学法转化至农杆菌中,涂布至lb平板(含50ug/ml利福平+100ug/ml壮观霉素),28℃培养2d,长出单菌落,并进行菌落pcr验证筛选阳性克隆。
2、重组质粒prhorf2转化红冬孢酵母ym25235菌株
利用农杆菌介导法将前期转化至农杆菌的重组质粒prhorf2转化至红冬孢酵母ym25235中,涂布至ima培养基上的尼龙膜,24℃培养2d后将尼龙膜转移至ypd(300μg/ml头孢噻肟+150μg/ml潮霉素)平板,28℃培养4-5d,长出酵母单菌落,经菌落pcr筛选含有目的orf2基因片段的阳性转基因红冬孢酵母ym25235菌株。进一步接到含150μg/ml潮霉素的50ml液体ypd培养基培养48h,离心收集菌体并用液氮研磨,使用omega试剂盒e.z.n.afungalrnakit提取红冬孢酵母的总rna,取2μg总rna利用反转录试剂盒(takarafirststrandcdnasynthesiskit)进行反转录,合成第一链cdna,然后以cdna为模板进行pcr检测orf2基因在转基因菌株中的是否获得转录表达,结果如图4所示,目的基因orf2在mrna转录水平获得表达,在阳性转基因酵母菌株总rna中均检测到与orf2基因大小相同的目的片段(图4)。这些结果表明prhorf2转化红冬孢酵母ym25235成功而且在红冬孢酵母ym25235中成功获得转录表达。
3、orf2基因转化的红冬孢酵母ym25235转基因菌株的脂肪酸分析
将分别转化了质粒prh2304和重组质粒prhorf2的两株转基因红冬孢酵母ym25235分别在30℃培养48h后,用酸热法提取其多不饱和脂肪酸,以转化质粒prh2304的红冬孢酵母菌株作为对照,进行气相色谱分析相同处理条件下两种质粒转化菌株的脂肪酸含量变化。图5中的a图和b图分别代表空质粒prh2304转化的对照菌株和重组质粒prhorf2转化的过表达菌株的脂肪酸色谱图,由图可以看出,重组质粒prhorf2转化菌株在出峰时间为12min处的亚油酸(c18:2la)值明显增加,其含量占总脂肪酸含量的22.39%(表1),而转化空质粒prh2304的对照菌株中亚油酸含量占总脂肪酸含量的16.97%。因此在相同的处理条件下增加31.94%。在亚油酸含量增加的同时,重组质粒prhorf2转化菌株在出峰时间为14.4min处的α-亚麻酸(c18:3ala)峰值也明显增加,其脂肪酸含量占总脂肪酸含量的5.88%(表1),而对照菌株中α-亚麻酸含量占总脂肪酸含量的3.42%,增加了71.92%。这些结果表明,转录调节蛋白基因orf2的过表达引起红冬孢酵母ym25235菌株中的亚油酸和亚麻酸两种多不饱和脂肪酸的含量增加。
表1:orf2基因转化的红冬孢酵母ym25235菌株细胞中脂肪酸含量
序列表
<110>昆明理工大学
<120>一种转录调节蛋白基因orf2的用途
<160>4
<170>siposequencelisting1.0
<210>1
<211>393
<212>dna
<213>硫化叶菌病毒stsv2(sulfolobustengchongenesisspindle-shapedvirus2)
<400>1
atggccgcacaacccttaactcaaatccccgcgtcaaatgcgggggtaaaagttgatgaa60
ttttttgatgaaaaagaattaattaaaatcgcgagcagattagggcctgtacagaaaaaa120
gtactaaaagcactagcgcagagcggcgggaaaatgatgatgcaacatgactttaggacc180
tgggggcaaaaaactatagcaggcatcgtgggcggcgtaaatgcggaataccgcgcctta240
aacacgagaaaactatgcgaagcgctggagaggaaggggctagtgacaataacgattgaa300
aaatgccctaaccaccctaaatataataaaaaatttgtatatttaacaccaaaaggatat360
aaaatagtagaaataatttctcaaaacgaataa393
<210>2
<211>130
<212>prt
<213>硫化叶菌病毒stsv2(sulfolobustengchongenesisspindle-shapedvirus2)
<400>2
metalaalaglnproleuthrglnileproalaserasnalaglyval
151015
lysvalaspgluphepheaspglulysgluleuilelysilealaser
202530
argleuglyprovalglnlyslysvalleulysalaleualaglnser
354045
glyglylysmetmetmetglnhisasppheargthrtrpglyglnlys
505560
thrilealaglyilevalglyglyvalasnalaglutyrargalaleu
65707580
asnthrarglysleucysglualaleugluarglysglyleuvalthr
859095
ilethrileglulyscysproasnhisprolystyrasnlyslysphe
100105110
valtyrleuthrprolysglytyrlysilevalgluileilesergln
115120125
asnglu
130
<210>3
<211>26
<212>dna
<213>人工序列(artificial)
<400>3
ttaccatggccgcacaacccttaact26
<210>4
<211>28
<212>dna
<213>人工序列(artificial)
<400>4
ttagatatcttattcgttttgagaaatt28
- 还没有人留言评论。精彩留言会获得点赞!