植物愈伤组织的制备方法与流程
本发明涉及基因工程遗传育种学和生物遗传改良技术领域,特别涉及一种植物愈伤组织的制备方法。
背景技术
水稻作为世界上超过一半人口的主食,是最重要的粮食作物之一.在过去的半个多世纪里,水稻育种取得了巨大的成功.水稻的单位产量实现了倍增,部分地方甚至提高至3倍,这为保障世界粮食安全作出了巨大的贡献.但近十几年来水稻的产量停滞不前,这一方面是由于在育种技术上没有新的突破以及遗传多样性在栽培品种中的逐步变窄,另一方面也是因为频繁发生的病虫害以及旱灾等自然灾害使得水稻生产损失惨重.然而,世界人口的持续增长以及社会经济的快速发展导致对粮食的需求不断增加。
针对这些问题,我国学者提出了培育绿色超级稻的设想,围绕水稻抗病虫、抗旱、营养高效利用、优质、高产等五大重要性状,对水稻品种进行全面改良以实现农业的可持续发展.而转基因技术作为一种新兴的育种手段,在实现绿色超级稻目标上将发挥重要作用.
水稻的转基因研究始于20世纪80年代末期,迄今已有大量的转基因水稻研究被报道。
水稻转基因技术始于原生质体培养,1985年首次成功地从水稻原生质体再生完整植株;1988年在粳稻品种中获得第一批转基因水稻植株;1990年从籼稻品种chinsurahboroii中获得第一例转基因籼稻植株;1990年李宝健等用农杆菌感染水稻组织获得转化愈伤组织;1991年利用水稻幼胚作为受体材料,用基因枪法,成功获得转基因植株,并且转化效率明显提高。
从此,幼胚作为转基因受体材料得到广泛研究应用。1993年用农杆菌法在粳稻品种上获得了转基因植株,此后,基因枪轰击法和农杆菌介导法作为最有价值的转化途径广泛用于水稻转基因研究。
利用转基因方法获得的转基因植株及其产生的后代,怎么证明外源基因已转入受体,或稳定遗传。主要分以下几个层次鉴定:1、).外源基因整合的鉴定,主要有southern杂交和pcr法检测阳性。2).外源基因转录水平的鉴定,有northern杂交和rt-pcr(reversetranscribedpcr)检测法。3).外源基因表达蛋白的检测,主要有三种:①生化反应检测法:主要通过酶反应来检测;②免疫学检测法:通过目的蛋白(抗原)与其抗体的特异性结合进行检测,如western杂交;③生物学活性的检测。4).报告基因的酶法检测,常用的报告基因有:gus、nos、ocs等。
当然最后转基因植株必须移栽于大田,进行田间鉴定,不仅对改良性状还要对其它农艺性状进行评价,选育综合性状优良的株系。这样会花费大量的财力和人力,而且会花费较长的时间。
camv35s启动子是指来自花椰菜花叶病毒(camv)的35s启动子。这种启动子在植株被camv感染期间,指导35srna合成,并且使之在许多双子叶植物的组织中高效表达,但它是单子叶植物的一种较弱的启动子。camv35s启动子作为一种组成型启动子在所有组织中都能启动基因的表达,具有持续性,不表现时空特异性;rna和蛋白质表达量也相对恒定。
技术实现要素:
本发明所要解决的技术问题在于,本发明提供了一种基于dsred荧光蛋白基因为报告基因的工程菌株的改造,本发明方法可以在植物转基因初期可以观察到转基因是否成功的一种快捷的报告基因检测方法,为后续的高效率的阳性植株筛选提供了依据。
为解决上述技术问题,本发明提供了一种植物愈伤组织的制备方法,包括以下步骤:
第一步,以含有dsred片段的pgdr质粒为模板,利用引物进行扩增,获得dsred片段;
第二步,以双元载体质粒为模板,扩增获得两端含有两个酶切位点的35s启动子片段;
第三步,将引入两个酶切位点的dsred片段插入到所述双元载体上;
第四步,将引入两个酶切位点的35s启动子连接到第三步已经连接上dsred基因的所述双元载体上;
第五步,将含有35s启动子和dsred基因的双元载体的融合质粒导入到农杆菌中,形成可以用于介导转化植物细胞的工程菌;
第六步,利用上述工程菌转化水稻的愈伤组织;
第七步,通过对第六步中转化的愈伤组织培养后,筛选转基因成功的细胞。
所述方法进一步包括:
第八步,将诱导出的再生苗进行检测。
所述方法进一步包括:
第八步,将诱导出的再生苗通过利用红色荧光扩增和照射进行检测,检测阳性苗和假阳性苗。
所述第五步的进一步包括:将含有35s启动子和dsred基因的双元载体的融合质粒导入到农杆菌中,形成可以用于介导转化植物细胞的工程菌。
所述第五步的进六步进一步包括:
1)诱导:水稻种子去壳消毒后,将成熟胚接种于诱导培养基中,诱导胚性愈伤组织;
2)侵染:将步骤1)所得愈伤组织与胚乳、芽分离,接种于农杆菌悬浮液中侵染,之后晾干待用;
3)共培养:将晾干的愈伤组织转到共培养基中,培养至愈伤组织表面出现菌体;
4)筛选:将共培养后的愈伤组织清洗后接种到筛选培养基中进行抗性筛选,获得抗性愈伤组织;
5)分化:将获得的抗性愈伤组织接种到分化培养基上培养至分化出幼苗;
6)生根:将幼苗接种到生根培养基上生根,并进行pcr检测,选择检测为阳性的植株作为转化得到的粳稻植株。
所述yeb培养基包括:酵母提取物0.8-1.2g/l;蛋白胨4.5-5.0g/l;牛肉膏4.5-5.0g/l;蔗糖4.0-6.0g/l;硫酸镁0.3-0.5g/l;琼脂12-15g/l;ph6.8-7.2;
所述诱导培养基包括:nb;2,4-d1.8-2.0mg/ml;6-ba0.1-0.2mg/ml;琼脂粉10-15g/l。
为解决上述技术问题,本发明还提供了一种利用上述工程菌转化水稻的愈伤组织的方法,包括以下步骤:
1)诱导:水稻种子去壳消毒后,将成熟胚接种于诱导培养基中,诱导胚性愈伤组织;
2)侵染:将步骤1)所得愈伤组织与胚乳、芽分离,接种于农杆菌悬浮液中侵染,之后晾干待用;
3)共培养:将晾干的愈伤组织转到共培养基中,培养至愈伤组织表面出现菌体;
4)筛选:将共培养后的愈伤组织清洗后接种到筛选培养基中进行抗性筛选,获得抗性愈伤组织;
5)分化:将获得的抗性愈伤组织接种到分化培养基上培养至分化出幼苗;
6)生根:将幼苗接种到生根培养基上生根,并进行pcr检测,选择检测为阳性的植株作为转化得到的粳稻植株。
所述yeb培养基包括:酵母提取物0.8-1.2g/l;蛋白胨4.5-5.0g/l;牛肉膏4.5-5.0g/l;蔗糖4.0-6.0g/l;硫酸镁0.3-0.5g/l;琼脂12-15g/l;ph6.8-7.2。
为解决上述技术问题,本发明还提供了如前述任一项所述植物愈伤组织的制备方法在水稻转基因工程中的应用。
为解决上述技术问题,本发明还提供了如前述任一项所述植物愈伤组织的制备方法制备的植物转基因愈伤组织。
本发明有益效果包括:本发明提供了一种基于dsred荧光蛋白基因为报告基因的工程菌株的改造,本发明方法可以在植物转基因初期可以观察到转基因是否成功的一种快捷的报告基因检测方法,为后续的高效率的阳性植株筛选提供了依据。
附图说明
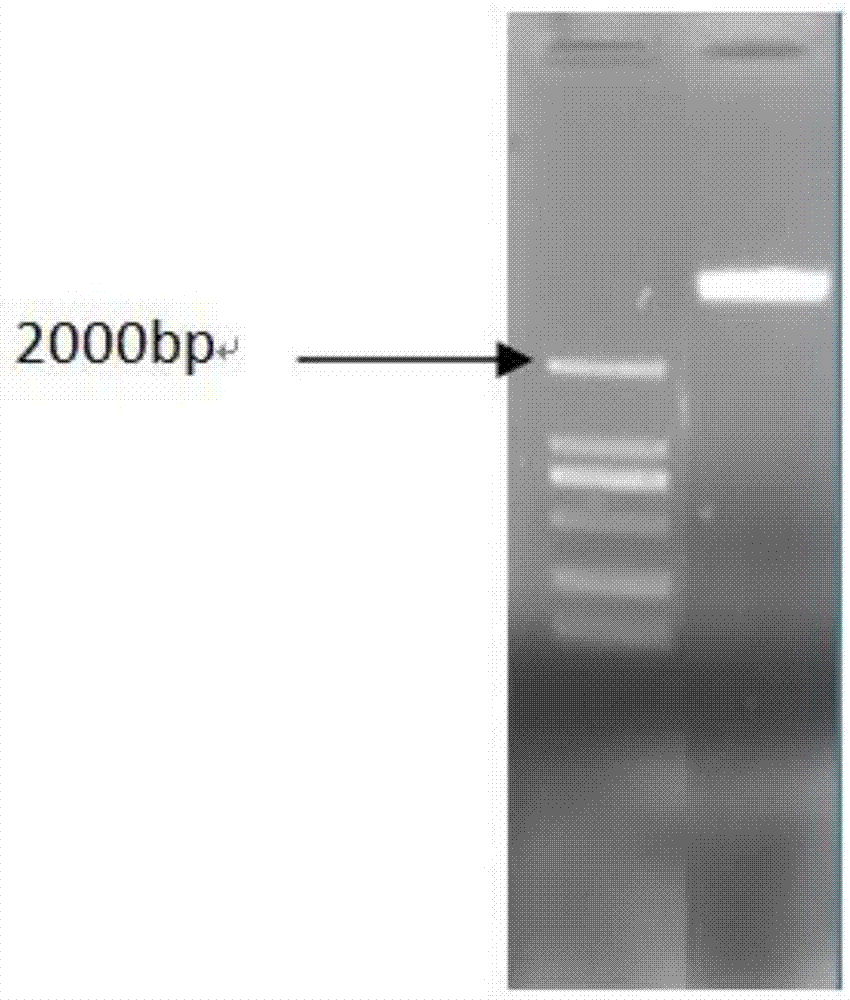
图1为本发明实施例所述dsred基因pcr扩增凝胶电泳检测图;
图2为本发明实施例所述35s启动子pcr扩增凝胶电泳检测图;
图3为本发明实施例所述荧光照射检测转基因细胞图。
具体实施方式
下面结合实施例详述本发明。为使本发明的目的、技术方案及优点更加清楚、明确,以下对本发明进一步详细说明,但本发明并不局限于这些实施例。
为解决上述技术问题,本发明提供了一种植物愈伤组织的制备方法,包括以下步骤:
第一步,以含有dsred片段的pgdr质粒为模板,利用引物进行扩增,获得dsred片段;
第二步,以双元载体质粒为模板,扩增获得两端含有两个酶切位点的35s启动子片段;
第三步,将引入两个酶切位点的dsred片段插入到所述双元载体上;
第四步,将引入两个酶切位点的35s启动子连接到第三步已经连接上dsred基因的所述双元载体上;
第五步,将含有35s启动子和dsred基因的双元载体的融合质粒导入到农杆菌中,形成可以用于介导转化植物细胞的工程菌;
第六步,利用上述工程菌转化水稻的愈伤组织;
第七步,通过对第六步中转化的愈伤组织培养后,筛选转基因成功的细胞。
所述方法进一步包括:
第八步,将诱导出的再生苗进行检测。
所述方法进一步包括:
第八步,将诱导出的再生苗通过利用红色荧光扩增和照射进行检测,检测阳性苗和假阳性苗。
所述第五步的进一步包括:将含有35s启动子和dsred基因的双元载体的融合质粒导入到农杆菌中,形成可以用于介导转化植物细胞的工程菌。
所述第五步的进六步进一步包括:
1)诱导:水稻种子去壳消毒后,将成熟胚接种于诱导培养基中,诱导胚性愈伤组织;
2)侵染:将步骤1)所得愈伤组织与胚乳、芽分离,接种于农杆菌悬浮液中侵染,之后晾干待用;
3)共培养:将晾干的愈伤组织转到共培养基中,培养至愈伤组织表面出现菌体;
4)筛选:将共培养后的愈伤组织清洗后接种到筛选培养基中进行抗性筛选,获得抗性愈伤组织;
5)分化:将获得的抗性愈伤组织接种到分化培养基上培养至分化出幼苗;
6)生根:将幼苗接种到生根培养基上生根,并进行pcr检测,选择检测为阳性的植株作为转化得到的粳稻植株。
所述yeb培养基包括:酵母提取物0.8-1.2g/l;蛋白胨4.5-5.0g/l;牛肉膏4.5-5.0g/l;蔗糖4.0-6.0g/l;硫酸镁0.3-0.5g/l;琼脂12-15g/l;ph6.8-7.2;
所述诱导培养基包括:nb;2,4-d1.8-2.0mg/ml;6-ba0.1-0.2mg/ml;琼脂粉10-15g/l。
为解决上述技术问题,本发明还提供了一种利用上述工程菌转化水稻的愈伤组织的方法,包括以下步骤:
1)诱导:水稻种子去壳消毒后,将成熟胚接种于诱导培养基中,诱导胚性愈伤组织;
2)侵染:将步骤1)所得愈伤组织与胚乳、芽分离,接种于农杆菌悬浮液中侵染,之后晾干待用;
3)共培养:将晾干的愈伤组织转到共培养基中,培养至愈伤组织表面出现菌体;
4)筛选:将共培养后的愈伤组织清洗后接种到筛选培养基中进行抗性筛选,获得抗性愈伤组织;
5)分化:将获得的抗性愈伤组织接种到分化培养基上培养至分化出幼苗;
6)生根:将幼苗接种到生根培养基上生根,并进行pcr检测,选择检测为阳性的植株作为转化得到的粳稻植株。
所述yeb培养基包括:酵母提取物0.8-1.2g/l;蛋白胨4.5-5.0g/l;牛肉膏4.5-5.0g/l;蔗糖4.0-6.0g/l;硫酸镁0.3-0.5g/l;琼脂12-15g/l;ph6.8-7.2。
为解决上述技术问题,本发明还提供了如前述任一项所述植物愈伤组织的制备方法在水稻转基因工程中的应用。
为解决上述技术问题,本发明还提供了如前述任一项所述植物愈伤组织的制备方法制备的植物转基因愈伤组织。
本发明将35s启动子与红色荧光基因(dsred)基因进行连锁后转化水稻成熟胚诱导的愈伤组织,在愈伤组织细胞阶段即可快速从外观上进行转基因成功性进行验证。为实现上述发明目的,本发明采用以下技术方案予以实现:
a、dsred基因的获得;
b、35s启动子的获得;
c、各基因表达元件的连接
各基因表达元件的获取和连接步骤包括:
第一步,以含有dsred片段的pgdr质粒为模板,利用上述引物进行扩增,获得dsred片段。扩增体系如下:
扩增程序:
第二步,以商业化的pcambia1300双元载体质粒为模板,通过利用35s-f5′gggactctagaggatcctggtggc-3′;35s-r5′aagctccgaggaggtttccggata-3′扩增获得35s启动子,获取两端含有kpni和xbai酶切位点的35s启动子片段;扩增体系如下:
扩增程序:
第三步,将引入xbai和bamhi酶切位点的dsred片段插入到pcambia1300双元载体上;
连接体系为:
16℃条件下连个过夜
第四步,将引入kpni和xbai酶切位点的35s启动子连接到第三步已经连接上dsred基因的pcambia1300载体上;
连接体系为:
16℃条件下连个过夜
第五步,将含有35s启动子和dsred基因的pcambia1300载体的融合质粒导入到农杆菌中,形成可以用于介导转化植物细胞的工程菌;
第六步,利用上述工程菌转化水稻的愈伤组织。
其实验操作步骤为:
1)诱导:水稻种子去壳消毒后,将成熟胚接种于诱导培养基中,诱导胚性愈伤组织;
2)侵染:将步骤1)所得愈伤组织与胚乳、芽分离,接种于农杆菌悬浮液中侵染,之后晾干待用;
3)共培养:将晾干的愈伤组织转到共培养基中,培养至愈伤组织表面出现菌体;
4)筛选:将共培养后的愈伤组织清洗后接种到筛选培养基中进行抗性筛选,获得抗性愈伤组织;
5)分化:将获得的抗性愈伤组织接种到分化培养基上培养至分化出幼苗;
6)生根:将幼苗接种到生根培养基上生根,并进行pcr检测,选择检测为阳性的植株作为转化得到的粳稻植株;
所涉培养基的具体配方如下:
yeb培养基:酵母提取物0.8-1.2g/l;蛋白胨4.5-5.0g/l;牛肉膏4.5-5.0g/l;蔗糖4.0-6.0g/l;硫酸镁0.3-0.5g/l;琼脂12-15g/l;ph6.8-7.2;
诱导培养基:nb;2,4-d1.8-2.0mg/ml;6-ba0.1-0.2mg/ml;琼脂粉10-15g/l;
继代培养基:nb;2,4-d1.8-2.0mg/ml;ch0.2-0.3g/l;蔗糖28-30g/l;琼脂粉10-15g/l;
共培养培养基:nb;as100-200umol/l;
筛选培养基:nb;2,4-d1.8-2.0mg/ml;6-ba0.1-0.2mg/ml;hyg20-25mg/l,timentin200-400mg/l,琼脂粉10-15g/l;
分化培养基:nb;pro0.3-0.5g/l;ch0.2-0.3g/l;6-ba1.8-2.0mg/ml;kt0.8-1.0mg/ml;naa0.3-0.5mg/ml,iaa0.4-0.5mg/ml;hyg20-25mg/l;timentin200-400mg/l;蔗糖25-30g/l;琼脂粉10-15g/l;
生根培养基:nb;naa0.4-0.7mg/l;蔗糖25-30g/l;琼脂粉10-15g/l
第七步,通过对第六步中转化的愈伤组织培养7-10天后,利用荧光照射,观察愈伤组织中发荧光的部分,筛选转基因成功的细胞。将发荧光的部分进行用手术刀扣取,转移到新的培养基上,进行培养。
第八步,将诱导出的再生苗通过利用红色荧光扩增和照射进行检测,检测阳性苗和假阳性苗。
其它说明:
1、dsred基因扩增所需引物
dsred-f5′tctagagccatggcctcctccgagaa-3′;
dsred-r5′-ggatccttacaggaacaggtggtggc-3′
2、35s启动子扩增所需引物
35s-f5′gggactctagaggatcctggtggc-3′;
35s-r5′aagctccgaggaggtttccggata-3′
3、dsred基因序列
4、35s启动子序列
表1转基因苗鉴定结果
以上所述,仅是本发明的几个实施例,并非对本发明做任何形式的限制,虽然本发明以较佳实施例揭示如上,然而并非用以限制本发明,任何熟悉本专业的技术人员,在不脱离本发明技术方案的范围内,利用上述揭示的技术内容做出些许的变动或修饰均等同于等效实施案例,均属于本发明技术方案保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!