一种氧化聚蔗糖修饰环氧化物水解酶及应用的制作方法
本发明涉及一种同时提高环氧化物水解酶比酶活和热稳定性的方法,尤其是一种利用聚蔗糖修饰环氧化物水解酶的化学修饰方法。
(二)背景技术
手性环氧化物是一类重要的手性合成砌块,在医药、化工、材料、农药等其领域应用广泛。化学法生产手性环氧化物存在金属催化剂成本高、副产物多、环境污染严重等问题。生物催化法具有选择性高、成本较低、副产物少和绿色环保等优点,具有良好的发展前景和应用价值。
环氧化物水解酶(epoxidehydrolase,eh,ec3.3.2.3)能立体选择性地水解拆分外消旋环氧化合物,从而获得具有光学性质的环氧化物和相应的1,2-二醇。该酶来源广,普遍存在于大自然中,在许多生物体内都能找到,如植物、昆虫、哺乳动物和细菌等。但是,环氧化物水解酶普遍存在活力低、易变性、稳定性差等问题,直接影响到该酶在工业上的应用的生产效率和生产成本。
化学修饰是提高酶稳定性的一种非常有效的方法,糖基的存在会增加蛋白质的刚度,并影响蛋白质的正确折叠及其构象。糖基还会对蛋白质的药理学性质,如生物学活性、免疫原性、受体结合能力等。由于糖类是高度亲水的,可以稳定蛋白质周围的水化层,促进新氢键的形成。另外,通过结合糖类将潜在的切割位点掩藏到结构内部,避免蛋白质水解攻击。由此可见,糖基对提高蛋白质自身的稳定性也有重要作用。近年来,研究者虽然已经发掘了多种能产环氧化物水解酶的微生物,如pseudomonas、rhodococcus、agrobacterium、xanthobacter、chryseomonas、chaetomiumglobosum、cunning-hamella、alentaria、pleurotus、rhodotorula等,环氧化物水解酶也被运用于不对称拆分外消旋环氧氯丙烷来生成手性环氧氯丙烷。
(三)
技术实现要素:
本发明目的是提供一种氧化聚蔗糖修饰环氧化物水解酶及其同时提高环氧化物水解酶相对酶活和热稳定性的应用。
本发明采用的技术方案是:
本发明提供一种氧化聚蔗糖修饰环氧化物水解酶,所述酶按如下方法制备:(1)氧化聚蔗糖:将聚蔗糖溶于0.25mnaio4水溶液中,37℃、150rpm避光反应6h,加入乙二醇终止反应,将反应液在蒸馏水中透析,将透析后的截留液冻干,获得氧化聚蔗糖;所述naio4水溶液体积用量以聚蔗糖质量计为5-50ml/g(优选40ml/g);(2)将氧化聚蔗糖和环氧化物水解酶溶于0.2m、ph8.0、磷酸盐(pbs)缓冲液中,混匀后于0-15℃,600rpm反应3-30h(优选4℃,600rpm下反应16h),蒸馏水透析(透析袋截留分子量为14kda,透析24h,12h换一次透析液),取截留液用体积浓度50%乙醇水溶液沉淀,取沉淀,获得聚蔗糖修饰的环氧化物水解酶;所述氧化聚蔗糖和环氧化物水解酶质量比为0.5-500:1,优选15:1。
进一步,步骤(2)所述环氧化物水解酶酶活为10~1000u/mg,优选200u/mg。
进一步,步骤(1)所述聚蔗糖的分子量为70-700kda,优选400kda。
进一步,步骤(1)所述透析时间为24h,间隔12h更换一次透析液,所述透析袋截留分子量为14000da。
进一步,步骤(2)所述环氧化物水解酶是将含环氧化物水解酶的菌株经发酵培养后的湿菌体分离提取获得的酶液,所述含环氧化物水解酶的菌株包括黑曲霉(aspergillusniger),放射性土壤农杆菌(agrobacteriumradiobacter),粘红酵母菌(rhodotorulaglutinis)及其重组大肠杆菌(escherichiacoli)。
进一步,所述环氧化物水解酶基因的核苷酸序列为seqidno.2所示,编码蛋白的氨基酸序列为seqidno.1所示。
进一步,步骤(2)所述磷酸盐缓冲液体积用量以环氧化物水解酶质量计为0.1~10,优选0.3ml/mg。
进一步,所述环氧化物水解酶按如下方法制备:
(1)湿菌体:
将含环氧化物水解酶基因的菌株(优选黑曲霉cctccm2010275)接种至斜面培养基,在37℃培养12h,获得斜面菌体;所述斜面培养基终浓度组成为:蛋白胨10g/l,酵母提取物5g/l,氯化钠10g/l,琼脂20g/l,溶剂为去离子水,ph值自然;
将斜面菌体接种至种子培养基,在37℃培养10h,获得种子液;所述种子培养基终浓度组成为蛋白胨10g/l,酵母提取物5g/l,氯化钠10g/l,溶剂为去离子水,ph值自然;
将种子液以体积浓度2%的接种量接种至含终浓度50μg/ml卡那霉素的发酵培养基中,在37℃恒温培养至od600等于0.6-0.8后,加入终浓度0.1mm的iptg,在28℃下培养12h,对发酵液进行离心,收集湿菌体。发酵培养基终浓度组成:蛋白胨10g/l,氯化钠10g/l,酵母提取物5g/l,溶剂为去离子水,ph值自然;
(2)环氧化物水解酶的分离纯化
取步骤(1)制备的湿菌体于ph8.0、200mmpbs缓冲液中悬浮,震荡摇匀后置于超声波(功率为300w)下破碎,超声频率1s间歇1s,破碎时间为20min;破碎液于10000r/min,4℃条件下离心10min去除细胞碎片,所得上清液即为粗酶液;将获得的粗酶液用ni-nta进行纯化,先用上样缓冲液(20mmpbs缓冲液,500mmnacl和20mm咪唑,ph8.0)平衡ni-nta柱30min,接着上样粗酶液,然后用上样缓冲液以1ml/min的速度洗脱以除去未吸附的蛋白,最后用洗脱缓冲液(20mmpbs缓冲液,500mmnacl和500mm咪唑,ph8.0)以1ml/min的速度洗脱收集目标蛋白。整个过程中始终保持流速为1ml/min。酶液在20mm,ph8.0,0℃的pbs缓冲液中透析过夜,取截留液冻干,获得纯化的环氧化物水解酶。
本发明还提供一种所述氧化聚蔗糖修饰环氧化物水解酶在拆分环氧氯丙烷中的应用,所述应用方法为:以ph8.0、0.2m的pbs缓冲液为反应介质,以氧化聚蔗糖修饰环氧化物水解酶为催化剂、以外消旋环氧氯丙烷为底物构成反应体系,在温度35℃、转数100rpm下进行反应,反应完全后,将反应液分离纯化,获得r-环氧氯丙烷;所述反应体系中,底物终浓度800mm,催化剂用量为100~1000u/ml,优选350u/ml。
与现有技术相比,本发明有益效果主要体现在:本发明通过聚蔗糖对环氧化物水解酶进行化学修饰,环氧化物水解酶的比活力和热稳定性得到大幅度提高,在光学纯环氧化物的酶法制备应用中前景广阔。该酶生产方法简便,成本较低,具有广阔的工业应用前景。当底物环氧氯丙烷浓度为800mm时,聚蔗糖(400kda)修饰的环氧化物水解酶能将环氧氯丙烷拆分完全,反应30分钟后,(r)-环氧氯丙烷对映体过量值(ee值)可达99%以上;而未修饰的原始酶在此高底物浓度下反应10分钟后即完全失活,最终(r)-环氧氯丙烷ee值小于10%。这说明聚蔗糖修饰提高了环氧化物水解酶对高浓度底物的耐受性和催化活力。
(四)附图说明
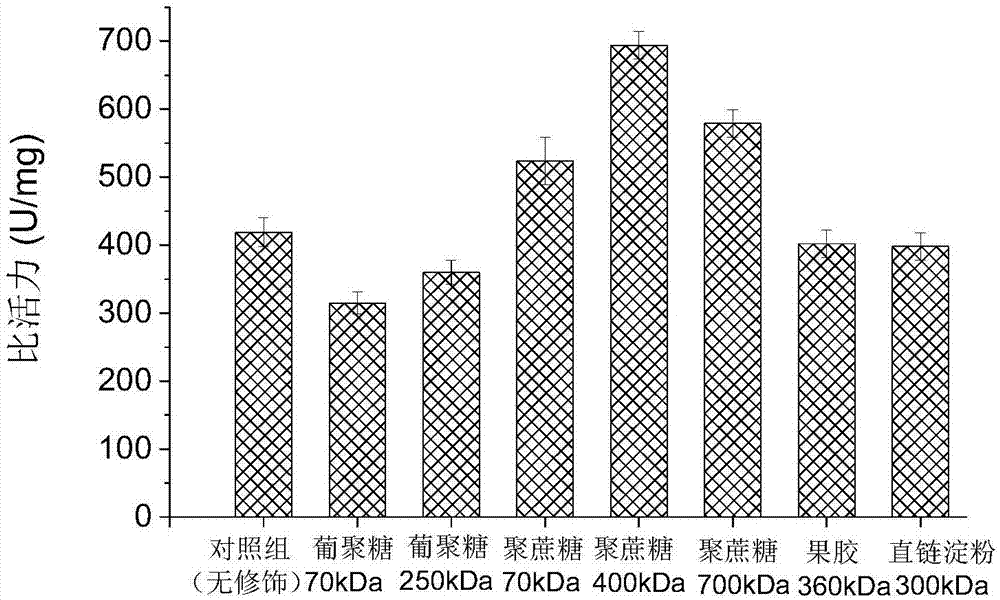
图1不同种类或分子量多糖修饰环氧化物水解酶比活力柱形图。
图2不同种类或分子量多糖修饰环氧化物水解酶的热稳定性柱形图。
图3聚蔗糖(400kda)修饰环氧化物水解酶与原酶的最适温度曲线;▲:修饰酶;●:原酶。
图4聚蔗糖(400kda)修饰环氧化物水解酶与原酶的最适ph曲线;▲:修饰酶;●:原酶。
图5原酶与修饰酶拆分消旋环氧氯丙烷制备r-环氧氯丙烷的效果比较▲:修饰酶;●:原酶。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1环氧化物水解酶的制备
(1)含酶菌体
将源自黑曲霉cctccm2010275(已在专利申请201110350712.2中公开)的环氧化物水解酶(氨基酸序列为seqidno.1所示,基因序列为seqidno.2所示)转入大肠杆菌bl21(de3)/pet-28b,筛选阳性克隆,获得重组大肠杆菌。
将表达黑曲霉cctccm2010275环氧化物水解酶基因的重组大肠杆菌接种至斜面培养基,在37℃培养12h,获得斜面菌体;所述斜面培养基终浓度组成为:蛋白胨10g/l,酵母提取物5g/l,氯化钠10g/l,琼脂20g/l,溶剂为去离子水,ph值自然;
将斜面菌体接种至种子培养基,在37℃培养10h,获得种子液;所述种子培养基终浓度组成为蛋白胨10g/l,酵母提取物5g/l,氯化钠10g/l,溶剂为去离子水,ph值自然;
将种子液以体积浓度2%的接种量接种至含终浓度50μg/ml卡那霉素的发酵培养基中,在37℃恒温培养至od600等于0.6-0.8后,加入终浓度0.1mm的iptg,在28℃下培养12h,对发酵液进行离心,收集湿菌体;发酵培养基终浓度组成:蛋白胨10g/l,氯化钠10g/l,酵母提取物5g/l,溶剂为去离子水,ph值自然。
(2)环氧化物水解酶的分离纯化
取步骤(1)制备的湿菌体于20ml、ph8.0、200mmpbs缓冲液中悬浮,震荡摇匀后置于超声波(功率为300w)下破碎,超声频率1s间歇1s,破碎时间为20min。破碎液于10000r/min,4℃条件下离心10min去除细胞碎片,所得上清液即为粗酶液。将获得的粗酶液用ni-nta进行纯化,先用上样缓冲液(20mmpbs缓冲液,500mmnacl和20mm咪唑,ph8.0)平衡ni-nta柱30min,接着上样粗酶液,然后用上样缓冲液洗脱以除去未吸附的蛋白,最后用洗脱缓冲液(20mmpbs缓冲液,500mmnacl和500mm咪唑,ph8.0)洗脱收集目标蛋白。整个过程中始终保持流速为1ml/min。酶液在20mm,ph8.0,0℃的磷酸盐缓冲液中透析过夜,取截留液冻干,获得纯化的环氧化物水解酶,保藏于20℃备用。
测得纯化的环氧化物水解酶比活力为419u/mg。
(3)环氧化物水解酶酶活和比活力的测定
酶活测定反应体系:取步骤(2)25μl的纯化的环氧化物水解酶酶液(1.0mg/ml,ph8.0的pbs缓冲液)加入到955μl0.2m,ph8.0的pbs缓冲液中,将混合液在40℃下保温10min后加入20μl环氧氯丙烷,反应4min后,加100μl2mh2so4终止反应。从反应液中取适量样品,用四倍体积乙酸乙酯萃取,转速12000rpm,离心2min,然后取离心后获得的乙酸乙酯相稀释适当倍数,加入无水硫酸钠吸水干燥后,进行气相色谱检测。
气相色谱检测条件为:柱温为60℃保持4min,20℃/min升温至160℃,保持1min;前进样口温度为230℃;检测器fid温度为250℃;氮气(n2)流速为54.0ml/min,分流比1:40,保留时间:(s)-ech5.985min,(r)-ech6.095min。
酶活单位(u)定义为在40℃,ph8.0的条件下,每分钟催化1μmol环氧氯丙烷(ech)水解所需的酶量定义为一个酶活单位。
蛋白浓度测定:以0.02m,ph8.0的pbs为空白对照,将收集的酶液稀释10倍,取100μl与5ml考马斯亮蓝试剂混匀,静置2min,以0.02m,ph8.0的磷酸盐缓冲液为空白对照,于波长595nm处测其吸光度。通过测得的吸光值和标准曲线,计算蛋白浓度。
比活力(u/mg)=体积酶活(u/ml)/酶蛋白浓度(mg/ml)
实施例2、聚蔗糖修饰环氧化物水解酶的制备
1、氧化多糖的制备
分别称取1g不同种类或分子量的多糖(葡聚糖(70kda,250kda)、聚蔗糖(70kda,400kda和700kda)、果胶(360kda)和直链淀粉(300kda)),溶于40ml0.25mnaio4水溶液中,37℃下,150rpm避光反应6h,然后加入1.2ml乙二醇终止反应。将反应液在蒸馏水中透析24h(透析袋截留分子量为14000da),12h后更换一次透析液,最后将透析后的截留液冻干,分别获得各种氧化多糖450mg,保藏于4℃备用。
2、环氧化物水解酶的多糖修饰
将150mg步骤1制备的氧化多糖和10mg实施例1制备的环氧化物水解酶溶于3ml、0.2m、ph8.0的pbs缓冲液中,混匀后于4℃,600rpm下反应16h,将反应液在蒸馏水中透析24h(透析袋截留分子量为14kda),12h后更换一次透析液,将透析后的截留液用体积浓度50%乙醇水溶液沉淀,取沉淀,获得多糖修饰的环氧化物水解酶。将沉淀1mg溶于3mlpbs缓冲液(0.2m,ph8.0)中,即为多糖修饰环氧化物水解酶酶液,测定比活力(方法同实施例1),结果见图1。
从图1可以看出,经三种聚蔗糖(70kda,400kda和700kda)修饰的环氧化物水解酶比活力均显著提高,其中分子量为400kda的聚蔗糖修饰效果最佳,环氧化物水解酶比活力从修饰前的419u/mg提高到694u/mg,比活力提高了66%。葡聚糖(250kda)、果胶(360kda)和直链淀粉(300kda)修饰的环氧化物水解酶活性均略有下降。
3、多糖修饰环氧环氧水解酶的稳定性
步骤(2)制备的多糖修饰环氧化物水解酶酶液0.2ml分别在50℃、60℃、70℃的水浴中保温2h,每隔20min取样,立即冰浴10min,测定酶活力(方法同实施例1)。记酶溶液的初始酶活力为100%,以不同时间相应的残余酶活力百分比的对数为纵坐标,时间为横坐标作图,求出不同温度下聚蔗糖修饰环氧化物水解酶的半衰期。半衰期定义为酶在特定温度下,酶活丧失一半的时间为其半衰期,记为t1/2,计算公式如下:
公式(2)中ln2为0.693,t1/2为半衰期,kd为酶的失活速率常数。以实施例1步骤(2)制备的环氧化物水解酶酶液为对照,结果如图2。
从图2可以看出,经聚蔗糖修饰后,环氧化物水解酶的稳定性均显著提高,其中聚蔗糖(400kda)修饰的环氧化物水解酶稳定性最好,相比于原始酶,半衰期提高了268%。
实施例3反应温度和反应ph对聚蔗糖修饰环氧化物水解酶催化活力的影响
a、最适反应温度的测定:
取实施例2步骤2制备的聚蔗糖(400kda)修饰环氧化物水解酶酶液25μl、调ph至8.0,分别置于30、35、40、45、50、55、60℃中保温10min,加100μl2mh2so4终止反应。分别测定不同温度下的酶活(方法同实施例1)。将酶活最高的作为100%,然后计算其它温度下的相对酶活,同时将实施例1步骤(2)制备的纯酶1mg溶解于3ml、0.2m,ph8.0pbs缓冲液制成环氧化物水解酶酶液为对照,结果如图3。
b、最适ph的测定:
取实施例2步骤2制备的聚蔗糖(400kda)修饰环氧化物水解酶酶液25μl、分别调ph至5、6、7、8、9、10、11,在40℃反应4min,加100μl2mh2so4终止反应,分别测定不同ph条件下的酶活(方法同实施例1),将酶活最高的作为100%,然后计算其它ph下的相对酶活,同时将实施例1步骤(2)制备的纯酶1mg溶解于3ml、0.2m,ph8.0pbs缓冲液制成的环氧化物水解酶酶液为对照,结果如图4。
从图3可以看出,环氧化物水解酶原酶反应的最适温度均为40℃,而修饰酶的最适温度范围变宽,为40-45℃。从图4可以看出,修饰酶与原酶的最适反应ph皆为8.0,但修饰酶在ph7.0-9.0之间的酶活基本相同,最适ph的范围较原酶宽。
实施例4原始酶和聚蔗糖修饰环氧化物水解酶催化拆分环氧氯丙烷的效果对比
将实施例2步骤2制备的聚蔗糖(400kda)修饰环氧化物水解酶酶液为转化用酶,以外消旋环氧氯丙烷为底物,进行拆分反应生产r-环氧氯丙烷。具体操作如下:反应于150ml规格的摇瓶中进行,20ml反应体系:15ml、ph8.0、0.2m的pbs缓冲液、反应体系酶活为350u/ml、终浓度为800mm外消旋环氧氯丙烷,温度35℃,转数100rpm,每隔5分钟后取200μl反应液样品于800μl乙酸乙酯中萃取,加10μl2mh2so4终止反应。8000rpm离心5min,取上层萃取液600μl加入少量无水硫酸钠去除可能存在水分,气相色谱(同实施例1)检测r-环氧氯丙烷的浓度。计算不同反应时间r-环氧氯丙烷的对映体过量值(ee值)。同时将实施例1步骤(2)制备的纯酶溶解于0.2m,ph8.0pbs缓冲液制备的环氧化物水解酶酶液(酶活为350u/ml)为对照,结果如图5。
由图5可以看出,当底物环氧氯丙烷浓度为800mm时,聚蔗糖(400kda)修饰的环氧化物水解酶能将环氧氯丙烷拆分完全,反应30分钟后,(r)-环氧氯丙烷ee值可达99%以上;而未修饰的原始酶在此高底物浓度下反应10分钟后即完全失活,最终(r)-环氧氯丙烷ee小于10%。这说明聚蔗糖修饰提高了环氧化物水解酶对高浓度底物的耐受性和催化活力。
序列表
<110>浙江工业大学
<120>一种氧化聚蔗糖修饰环氧化物水解酶及应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>398
<212>prt
<213>黑曲霉(aspergillusniger)
<400>1
metseralaprophealalysleuproserseralaserileserpro
151015
thrprophethrvalserileproaspgluglnleuasnaspleulys
202530
thrleuileargleuserlysilealaproprothrtyrgluasnleu
354045
glnseraspglyargpheglyvalthrserglutrpleusersermet
505560
argglulystrpvalserglupheasptrpargthrpheglualaarg
65707580
metasnserpheproglnphethrthrgluilegluglyleuthrval
859095
hisphealaalaleupheserglnarggluaspalavalproileala
100105110
leuleuhisglytrpproglyasnphevalgluphetyrproileleu
115120125
glnleuphesergluglutyrserprogluthrleuprophehisleu
130135140
ilevalproserleuproglytyrthrpheserserglyproproleu
145150155160
aspargasppheglyleuvalaspilealaargvalvalaspglnleu
165170175
metlysaspleuglypheglyserglytyrvalileglnglyglyasp
180185190
ileglyserphevalglyargvalleuglyvalserpheaspalacys
195200205
lysalavalhisleuasnleucysalametargalaproproglugly
210215220
leuserthrgluserleuthralaalaglulysgluglyvalalaarg
225230235240
metglulysphemetthrasnglyleualatyralaleugluhisser
245250255
thrargproserthrileglyhisvalleuserserserproileala
260265270
leuleualatrpvalglyglulystyrleuglntrpvalaspglupro
275280285
leuproserthrthrileleuglumetvalserleutyrtrpleuthr
290295300
gluserpheproargalailetyrsertyrarggluthrthrprothr
305310315320
alaservalproasnglyalathrmetleuglnasngluleutyrile
325330335
hislyspropheglypheserphepheprolysaspleucysproval
340345350
proargsertrpilealathrthrglyaspleuvalphepheglnasp
355360365
hissergluglyglyhisphealaalaleugluargproarggluleu
370375380
lysalaaspleuthralaphevalgluglnvaltrpglnlys
385390395
<210>2
<211>1197
<212>dna
<213>黑曲霉(aspergillusniger)
<400>2
atgtccgctccgttcgccaagcttccctcctcggccagcatttctcctactcccttcact60
gtctccatccccgatgagcagctgaatgacctgaaaaccctcatccgactatccaaaatc120
gcccctcccacctatgagaacctgcaatcagatggccggtttggcgtcacttccgaatgg180
ctgtcatccatgcgggagaaatgggtctcggaatttgactggcgaacatttgaagctcga240
atgaactctttcccccagtttactacggagattgagggtctcacagtgcactttgctgcc300
ttattttctcagagggaggatgctgtgcccatcgcattgctccatggttggcccggcaac360
ttcgttgaattctacccaatcctccagctattcagcgaggagtactctcctgaaacctta420
cctttccatctaattgttccatcccttcctgggtacaccttctcgtctggtcccccactg480
gacagggatttcggcttggttgacatcgcccgggtcgtagaccagttgatgaaggacctc540
gggttcggcagtggctatgttatccagggaggtgatattggtagttttgtagggcgggtt600
ctgggcgtaagcttcgacgcctgcaaagcggtacatttgaacctatgcgcaatgagagct660
ccccctgaaggcctgtcaacggagagcttgactgcggcggagaaagagggagtcgcgcga720
atggagaaattcatgaccaatggcctagcttatgccctggagcacagtactcggcccagt780
acaatcggccatgtactgtccagcagtccgatcgctttacttgcatgggttggtgagaaa840
tacctccaatgggtggatgaacccctcccttctacgaccattcttgagatggtaagcctg900
tattggctcactgagagttttccacgggctatttattcctaccgtgagactacccccacc960
gcctctgtgcccaacggagcgacgatgctgcagaacgaattatatattcacaaaccattc1020
ggattctcgttcttccccaaggacctttgccccgtgcctcgaagctggattgctaccaca1080
ggagatctagtcttcttccaggatcattcagagggaggacactttgccgcattggagcgt1140
ccacgcgagctcaaggccgatctaacggcatttgtcgagcaggtgtggcagaagtag1197
- 还没有人留言评论。精彩留言会获得点赞!