新的T细胞受体的制作方法
本公开涉及一种新的t细胞受体(tcr),特别是其至少一个互补决定区(cdr);表达所述tcr的t细胞;表达所述tcr的克隆;编码所述tcr的载体;可溶形式的所述tcr;包含所述tcr、所述细胞、所述克隆或所述载体的药物组合物或免疫原性剂或双特异性剂或疫苗;所述tcr或所述细胞或所述克隆或所述载体或药物组合物或免疫原性剂或双特异性剂或疫苗治疗癌症的用途;和一种使用所述tcr、包含所述tcr的所述细胞、所述克隆、所述载体、所述药物组合物、免疫原性剂、双特异性剂或疫苗治疗癌症的方法。
背景
我们已经发现一个有效治疗癌症的新t细胞类别,其通过群体恒定的主要组织相容性复合体类相关蛋白(mr)1识别癌细胞。对这种新t细胞的鉴定源自研究不需要特定人白细胞抗原(hla)的情况下t细胞识别癌细胞的实验。hla基因座高度可变,迄今已经描述超过17,000个不同等位基因。从而,借助hla发挥作用的任何治疗方案仅可能在小部分患者中有效。相反,整个人类群体表达mr1。
已知的mr1限制型t细胞的主要类型称作粘膜相关不变t细胞(mait)。已知mait识别结核分枝杆菌核黄素生物合成过程的中间体。我们自身和其他实验室的最近研究已经显示,还存在其他类型的识别不同mr1结合型配体的mr1限制型t细胞。本文所述的工作显示,我们的新t细胞类别具有借助mr1的靶特异性,但是tcr不结合于mr1本身或不结合于加载有已知感染性配体的mr1,这种t细胞反而识别mr1结合沟内部的癌特异性配体;mr1向tcr呈递癌特异性或癌上调的配体。
从hla对腺癌肺泡基底上皮细胞系a549(信息参见
如已知并且如图12中所示,tcr是二硫键连接的膜锚定的异二聚体蛋白,所述异二聚体蛋白正常情况下由缔合于恒定cd3链分子以形成完整有功能tcr的高度可变性α链(α)和β链(β)组成。表达这种受体的t细胞称作α:β(或αβ)t细胞。
α链和β链含有包含恒定区(c)和可变区(v)的胞外结构域。恒定区临近于细胞膜,后接跨膜区和短胞质尾,而可变区与配体结合。大部分αβt细胞的配体是与mhc分子结合的肽。
tcrα-链和β-链两者的可变结构域各自具有三个可变区,称作互补决定区(cdr)。β-链(hv4)上还存在正常情况下不接触抗原并且因此不视为cdr的额外变异性区域。通常,抗原结合位点由tcrα-链和β-链的cdr环形成。cdr1α和cdr2α由各个vα基因编码,而cdr1β和cdr2β由各个vβ基因编码。tcrα-链的cdr3高变,原因在于潜在的核苷酸添加和v区和连接区接合部附近的移除。tcrβ-链cdr3具有甚至更多的变异能力,因为它还可以包括多样性(d)基因。
cdr3是负责识别已加工抗原的主要cdr,不过还已经显示α链的cdr1与抗原性肽的n端部分相互作用,并且β-链的cdr1与肽的c端部分相互作用。
2015年,约九千五百万人患有癌症。一年出现约一千四百万新病例(不包括除黑素瘤之外的皮肤癌)。它造成约八百八十万人死亡(15.7%)。男性中最常见类型的癌症是肺癌、前列腺癌、结直肠癌和胃癌。女性中,最常见类型的癌症是乳腺癌、结直肠癌、肺癌和宫颈癌。如果除黑素瘤之外,皮肤癌纳入每年总的新发癌症中,它将占约40%病例。在儿童中,急性淋巴母细胞白血病和脑肿瘤最常见,非洲例外,在那里非霍奇金淋巴瘤最常发生。2012年,约165,000名15岁以下儿童经诊断患有癌症。癌症风险随年龄显著增加并且许多癌症在发达国家更常见。发病率随着更多的人长寿并且随着发展中国家中生活方式改变渐增。截至2010年,涉及癌症的财务费用估计为每年1.16万亿美元。随之而来是需要提供治疗或根除这种疾病的更好和更安全方式。公认使用身体天然防御系统杀伤异常组织的免疫治疗比化学干预更安全,但是,为了有效,免疫疗法必须具有癌特异性。另外,发现有效对抗任何类型癌症的免疫治疗将极为有益,因为它不仅适用于患有许多不同类型癌症的诸多个体(即它将具有泛群体适用性),还可能适用于患有多于一种类型癌症的单个个体。另外,鉴定非mhc限制性的免疫治疗也将极为有利,因为这意味着可将它施用于任何个体,无论mhc组织类型是什么。
我们已经在本文鉴定的t细胞具有前述有利特征,因为它们有效对抗任何类型的癌症并且它们没有mhc限制性并且因此具有泛群体适用性,原因在于限制性mr1分子遍在表达。
发明简述
根据本发明的第一方面,提供一种肿瘤特异性t细胞受体(tcr),其特征在于包含(cdr)cayrsavnarlmf(seqidno:1)和/或cassearglaeftdtqyf(seqidno:2)或由其组成的互补决定区。
在本发明的一个优选实施方案中,所述cdr包含(cdr)cayrsavnarlmf(seqidno:1)和/或cassearglaeftdtqyf(seqidno:2)或与之共有至少88%同一性如89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的cdr或由其组成。
本文所述的cdr代表所述tcr的cdr3s并且从而是负责识别已加工抗原或配体的主要cdr。其他cdr(cdr1α、cdr2α、cdr1β和cdr2β)是由种系编码。因此,本发明进一步涉及一种还包括这些其他cdr即cdr1α、cdr2α、cdr1β或cdr2β中一者或者的tcr。
因此,在一个优选的实施方案中,所述tcr包含一个或多个以下互补决定区或由它们组成,包括它们的任何组合:
tsesdyy(cdr1α)seqidno:3
aten(cdr2α)seqidno:4
mghdk(cdr1β)seqidno:5
sygvns(cdr2β)seqidno:6
对肿瘤特异性tcr的提及是在mr1背景下特异性识别肿瘤细胞或肿瘤细胞配体并且在mr1背景下由肿瘤细胞或肿瘤细胞配体激活但不由非肿瘤细胞或非肿瘤细胞配体激活的tcr。
在本发明的一个优选实施方案中,所述tcr是具有α链和β链的αβtcr并且所述α链的所述cdr包含cdr:cayrsavnarlmf(seqidno:1)或与之共有至少88%同一性,如89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的cdr或由其组成;并且所述β链的所述cdr包含cdr:cassearglaeftdtqyf(seqidno:2)或与之共有至少88%同一性,如89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的cdr或由其组成。因此,所述tcr可以包含前述cdr中一者或两者或并且在一个优选的实施方案中包含所述cdr两者。
在又一个优选的实施方案中,所述tcr是非常规的,因为它没有mhc-限制性,它反而在备选性mhc样分子mr1背景下与肿瘤特异性配体结合。迄今,认为mr1限制型αβt细胞完全是粘膜相关的不变t细胞(mait细胞),然而我们在本文中展示,存在不表达maittcrα链的又一类别的mr1限制型t细胞。另外,有利地,这些t细胞及其tcr具有肿瘤特异性(即响应于肿瘤细胞但不响应于非肿瘤细胞),但是,令人惊讶地,能够鉴定任何肿瘤,无论来源或组织类型是什么,并且因此具有泛癌治疗潜力。另外,这些t细胞及其tcr非mhc限制性的事实意味着它们具有泛群体治疗潜力并且因此代表一种极重要的新的癌疗法。
在本发明的又一个优选实施方案中,所述tcrα链包含以下或由以下组成:
或与之具有至少88%同一性如89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。
在本发明的又一个优选实施方案中,所述tcrβ链包含以下或由以下组成:
(上述段落中,加粗和加下划线的文本代表cdr)
在本发明的再一个优选实施方案中,所述tcr包含前述tcrα链和前述tcrβ链。
在再一个优选的实施方案中,所述tcr是可溶性tcr、或stcr,并且从而缺少跨膜结构域及理想地还缺少胞内结构域。
在本发明的又一个优选的实施方案中,所述tcr是嵌合受体的具有本文所述功能的部分。
根据本发明的又一个方面,提供一种t细胞,其表达本发明的所述tcr,理想地,以可溶形式或膜相容性形式表达,即具有跨膜区和胞内区。
根据本发明的再一个方面,提供一种t细胞克隆,其表达本发明的所述tcr,理想地,以可溶形式或膜相容性形式表达,即具有跨膜区和胞内区。优选地,所述克隆是如本文所述的mc.7.g5克隆。
根据本发明的再一个方面,提供一种载体,其编码本发明的所述tcr。
根据本发明的再一个方面,提供一种药物组合物或免疫原性剂或双特异性剂或疫苗,其包含所述tcr或细胞或克隆或载体。
在一个优选的实施方案中,所述药物组合物或免疫原性剂或双特异性剂用来治疗任何癌症,但是理想地治疗结直肠癌、肺癌、肾癌、前列腺癌、膀胱癌、宫颈癌、黑素瘤(皮肤)、骨癌、乳腺癌、卵巢癌和血癌。
根据本发明的再一个方面,提供所述tcr或细胞或克隆或载体治疗癌症的用途。
根据本发明的再一个方面,提供一种治疗癌症的方法,所述方法包括向待治疗的个体施用所述tcr或细胞或克隆或载体。
理想地,所述癌症属于任何类型,但尤其是结直肠癌、肺癌、肾癌、前列腺癌、膀胱癌、宫颈癌、黑素瘤(皮肤)、骨癌、乳腺癌、卵巢癌和血癌。
在本发明的一个优选方法中,所述tcr、细胞克隆或载体是与抗肿瘤剂(如,但不限于,双特异性剂)组合施用。
本文对“双特异性剂”的提及是指双特异性单克隆抗体(bsmab、bsab),所述抗体是可以与两种不同类型抗原同时结合的人工蛋白质。
备选地,所述tcr还可以形成双特异性剂的部分,其中所述双特异性剂包括所述tcr,目的是与其在癌细胞上的配体结合,并且还与结合并且从而活化免疫细胞(如t杀伤细胞)的免疫细胞活化性组分或配体结合。
根据本发明的再一个方面,提供所述tcr或细胞或克隆或载体在制造治疗癌症的药物中的用途。
根据本发明的再一个方面,提供一种用于治疗癌症的组合治疗药,所述组合治疗药包含:
a)所述tcr或细胞或克隆或载体,和
b)又一癌症治疗药,的组合。
在本发明的后续权利要求及其之前的发明详述中,除了其中因明确语言或必要提示而上下文另有要求之外,词“包含”或其变化形式如“包括”或“包含着”按包含的含义使用,即用来指定所述特征的存在,但不妨碍其他特征在本发明的多种实施方案中的存在或其加入。
全部参考文献,包括本说明书中援引的任何专利或专利申请,均通过引用的方式并入。绝不承认任何参考文献构成现有技术。另外,绝不承认任何现有技术构成构成本领域公知常识的部分。
本发明每个方面的优选特征可以是如联系任何其他方面时所描述那样。
本发明的其他特征将从以下实施例变得显而易见。通常而言,本发明扩展至本说明书中公开的特征(包括随附权利要求和附图)中的任何新颖的一者或其任何新颖的组合。因此,除非与之相容,否则联系本发明具体方面、实施方案或实施例所述的特征、整数、特征、化合物或化学部分应理解为适用于本文所述的任何其他方面、实施方案或实施例。
另外,除非另外声明,否则本文公开的任何特征可以由起到相同或相似目的的替代性特征替换。
遍及说明书和本说明书的权利要求,除非上下文另外要求,否则单数涵盖复数。尤其,除非上下文另有要求,否则使用不定冠词的情况下,本说明书应理解为构思了复数以及单数。
附图简述
现在将仅以举例方式参考以下附图描述本发明的实施方案,其中:
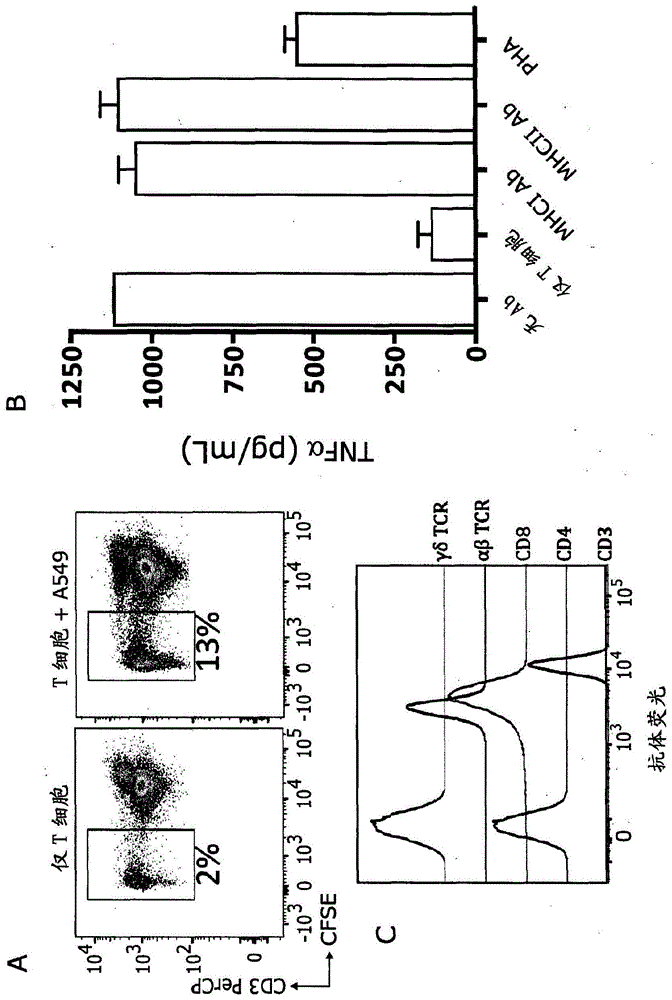
图1显示怎样分离mc.7.g5及其初始表征。a.将t细胞用染料cfse标记并且与a549温育2周。cfse荧光减少代表已经增殖的那些t细胞,从而允许分离a549反应性t细胞。b.基于tnfα的释放,mc.7.g5针对a549细胞的反应性不受mhci或ii类的阻断抗体阻碍。收获来自测定法的上清液供tnfαelisa分析。c.mc.7.g5克隆的抗体表型分型图显示它是γδ-αβ+cd8+(在图16a中重复)。
图2显示mc.7.g5不响应于正常(非)癌细胞。实验比较了来自响应于黑素瘤细胞系mm909.24(mc.7.g5的癌靶)和四种原代(非肿瘤、非永生)细胞系的克隆mc.7.g5的tnfα释放。smc3是平滑肌细胞系;cil-1是纤毛上皮细胞,mcr5是htert转导的成纤维细胞细胞系;hep2是肝细胞细胞系。(图15和图17中还测试了正常细胞系)。
图3显示mc.7.g5tcrα链和β链的序列。
图4显示克隆mc.7.g5响应于广泛类型的肿瘤靶。从t细胞活化测定法收获的上清液显示mc.7.g5响应于一组肿瘤并且检查其tnfα和mip1β产生情况。b.铬释放测定法显示在所示的t细胞对癌细胞比率特异性杀伤癌细胞。a和b为一式两份进行,带误差线。
图5显示依据用来将mr1鉴定为克隆mc.7.g5的配体的全基因组crispr方法的基因捕获。图13中显示mc.7.g5克隆crispr文库筛选的数据。
图6显示克隆mc.7.g5借助mr1显示靶特异性。a.mr1抗体阻断对a549细胞的识别。通过elisa的tnfα和mip1β产生情况。b.mc.7.g5不识别a549c9和黑素瘤mm909.24c4mr1敲除体(crispr/cas9技术)。c.不存在对mr1敲除的a549c9细胞或原代细胞系mrc5的特异性杀伤。还显示对mm909.24wt和a549wt的杀伤。d.这个细胞系中慢病毒转导所致的mr1过量表达略微增强识别。mc.7.g5克隆不识别lcl细胞系pt146,甚至当它经转导以过量表达mr1时也是如此。这种mr1的某些呈递在细胞表面并且可以用mr1抗体(右)检测到。
图7显示克隆mc.7.g5未被四聚体形式的mait配体mr1-5-(2-氧代丙亚基氨基)-6-d-核糖醇基氨基尿嘧啶(mr1-5-op-ru)或未被mr1乙酰基-6-甲酰基蝶呤(ac-6-fp)染色。在平行实验中,mait克隆被mr1-5-op-ru四聚体良好染色。pbmc群体中还存在被mr1-5-op-ru染色的细胞小群体。预期pbmc样品内部将存在可检测的mait细胞。这个结果显示mc.7.g5tcr不结合于mr1本身或不结合于加载有已知感染性配体的mr1,并且表明这种t细胞识别mr1结合沟内部的癌特异性配体。图14e中显示重复的四聚体染色实验,包括采用‘空’mr1的那些试验。
图8显示ac-6-fp和耻垢分枝杆菌感染减少克隆mc.7.g5的识别作用,尽管细胞表面处mr1的表达增强。a549或mm909.24细胞与50μg/mlac-6-fp温育12小时增加了表面处的mr1表达,但是减少被克隆mc.7.g5的识别。耻垢分枝杆菌感染的影响甚至更明显并且实质地降低克隆mc.7.g5的响应,同时充当mait克隆的强力激活物。图14f和g中显示重复的耻垢分枝杆菌实验和ac-6-fp实验。
图9显示用mc.7.g5tcr转导多克隆t细胞(图2中显示)赋予肿瘤识别。图15中显示采用mc.7.g5tcr和患者t细胞的其他实验。
图10是显示克隆mc.7.g5tcr仅识别癌细胞的示意图。识别作用需要mr1并且受已知的非癌mr1配体抑制,表明mr1向mc.7.g5tcr呈递癌特异性或癌上调的配体;
图11是显示已知的mr1配体抑制mc.7.g5tcr识别癌细胞的示意图;
图12显示t细胞受体mrna和蛋白质的结构。mrna结构(顶部)显示对于每条链,在种系中编码cdr1和cdr2。cdr3是t细胞受体(tcr)-α链中v–j连接和tcr-β链中v–d–j连接处连接多样性的产物。cdr3因此高变。遍及该图维持对cdr环采用的颜色代码。灰色着色的区域代表tcr的恒定结构域和可变结构域(不包括高变的cdr环)。底部小图显示预期的蛋白质折叠。tcr采用使互补决定区(cdr)环在分子远端膜处定位的类似三级结构。总共,六个cdr环形成抗原结合位点。
图13.全基因组crispr-cas9文库筛选揭示mr1作为mc.7.g5的候选靶。(a)用来揭示mc.7.g5的配体的方案概览。使用geckov2全基因组crispr/cas9文库a和b作为转导靶细胞系hek293t的慢病毒。mc.7.g5裂解hek293t,后者表达针对与hek293t识别无关的基因的sgrna,因而富集针对为mc.7.g5裂解癌细胞必需的基因的sgrna。用mc.7.g5进行两轮选择并且将选择的文库与未选择的hek293t(无mc.7.g5)比较,以揭示富集的sgrna。(b)与野生型hek293t相比,mc.7.g5对选择后已选定hek293t库的识别大大减少,表明关键基因已经通过全基因组crispr-cas9方法消融。过夜活化和tnfelisa。(c)将mr1鉴定为mc.7.g5识别hek293t的一个关键基因。mageck分析和选择的hek293t细胞中sgrna富集≥2的突出显示(着色)的基因。图14中显示验证mr1作为mc.7.g5的靶。
图14.验证和探索mc.7.g5对mr1的识别。(a-d)mr1是表达mc.7.g5的靶的癌细胞。(a)在mr1阻断性抗体(ab)存在下,对黑素瘤mm909.24的识别减少。使用mhci和iiabs作为阴性对照。过夜活化和tnfelisa。(b)消除来自癌细胞系的mr1表达阻止mc.7.g5介导的识别和杀伤作用。将黑素瘤mm909.24和肺部腺癌a549用sgrna转导以借助cripsrcas9敲除(-/-)mr1基因。过夜活化和tnfelisa。铬释放细胞毒性测定法进行6小时(mm909.24)或18小时(a549)。(c)mr1过量表达(+)改善mc.7.g5对癌细胞的杀伤。慢病毒转导已经显示诱导相对低的mc.7.g5活化的癌细胞系c1r和hela以稳定地过量表达mr1。纳入黑素瘤mm909.24作为阳性对照。将铬释放细胞毒性测定法进行6小时。(d)mr1-/-细胞中mr1的表达恢复mc.7.g5活化。在采用mc.7.g5的过夜活化测定法中使用a549野生型细胞、mr1-/-细胞和带mr1转基因(+)的mr1-/-细胞。tnfelisa。(e和f)mc.7.g5不通过已知的机制识别mr1:(e)mc.7.g5克隆(一种典型mait克隆(识别具有结合的5-op-ru的mr1))和mhci限制型克隆(mel5/13、hlaa2限制型,melana肽elagigiltv)用于以下四聚体的染色:mr1‘空’(在mr1配体不存在的情况下能够再折叠的k43a突变体)、mr15-op-ru和mhci(hlaa2elagigiltv)。使用mhci克隆作为无关mhci四聚体的阳性对照。(f)加载有mait活化性细菌耻垢分枝杆菌的a549减少mc.7.g5对a549的识别。使用来自e的典型mait克隆作为阳性对照。使用a549mr1-/-作为两种克隆的阴性对照。对表面cd107a和胞内tnf染色。仅对克隆设门。(g)外源ac-6-fp(一种已知的mr1结合分子)降低mc.7.g5对黑素瘤mm909.24的识别。使用模拟处理的wt靶和ac-6-fpmr1-/-靶作为对照。左小图:胞内cd107a、tnf和ifnγ的染色,由flowjo分析三重阳性。误差线小于图符号,代表两次实验。右小图:ac-6-fp处理的靶细胞上的mr1表达。
图15.mc.7.g5t细胞受体的转移使患者t细胞重定向以杀伤自体黑素瘤。(a)经mc.7.g5的t细胞受体转导的转移性黑素瘤患者(mm909.11和mm909.24)衍生的t细胞识别自体黑素瘤和非自体黑素瘤。使用未转导的t细胞作为阴性对照。4小时活化后,对表面cd107a和胞内tnf的染色。(b)经mc.7.g5tcr转导的来自患者mm909.11的t细胞杀伤自体黑素瘤和非自体黑素瘤,但不杀伤健康细胞。对比自体黑素瘤、来自患者mm909.24的黑素瘤(野生型和mr1敲除(-/-))和健康细胞系:smc3(平滑肌);cil-1(纤毛上皮);和hep2(肝细胞),采用未转导(-)的和mc.7.g5tcr转导(+)的来自患者mm909.11的t细胞的铬释放细胞毒性测定法。按t细胞对靶细胞比率5:1进行6小时和18小时。
图16.(a)通过流式细胞术的mc.7.g5表型分型。(b)黑素瘤mm909.24的mr1基因座基因组序列,外显子2中具有mr1crispr-cas9所致的双等位基因缺失。(c)用抗mr1抗体(ab)评估的图14a-d中所用靶细胞的mr1表达。(d)mc.7.g5tcr转导和未转导的来自黑素瘤患者mm909.11和mm909.24的t细胞的rcd2染色。
图17.在48小时共温育(‘长期杀伤测定法’)后,mc.7.g5杀伤一系列不同来源的癌细胞系(x-轴)(图解)(a)。这显示mc.7.g5能够杀伤每个细胞系的95-99.9%,因而补充了来自图4中所示的相对较短期的杀伤测定法的数据。按t细胞对靶细胞比率5:1温育和使用计数珠或cfse标记的参考细胞测定的杀伤程度。(b)当共温育7天时,mc.7.g5不杀伤正常细胞。t细胞对靶细胞比率5:1和计数珠用来确立留存的靶细胞的数目。smc3(平滑肌)、hep2(肝细胞)和mrc5(皮肤成纤维细胞)。使用黑素瘤mm909.11作为阳性对照。展示为每1000个计数珠±mc.7.g5的靶细胞(健康细胞或黑素瘤细胞)数目。(c)mc.7.g5敏感地杀伤黑素瘤mm909.24。温育7天和cfse标记的参考细胞用来确立杀伤程度。在相同的测定法中,正常细胞系hep2未遭杀伤。
图18显示cir细胞中突变的k43a(‘空’)mr1过量表达不导致m.7.g5活化(a),即便mr1抗体对cir-k43a高度染色(b)。相反,cir细胞中野生型mr1过量表达诱导mc.7.g5活化。这进一步表明mc.7.g5tcr识别具有结合型载货的mr1并且强化图14e中的数据,显示空k43amr1四聚体不染色mc.7.g5。
发明详述
方法和材料
获得和表征t细胞克隆mc.7.g5
通过标准密度梯度分离从健康供体的血液纯化外周血单个核细胞(pbmc),随后用人腺癌肺泡基底上皮细胞系a549刺激(关于培养条件和背景信息,参阅
mc.7.g5不响应于正常细胞。
健康细胞及其专有培养基从sciencell(carlsbad,ca)获得并且作为他处的材料和方法部分中所述的活化测定法和细胞毒性测定法里的靶细胞使用。smc3(人结肠平滑肌)、cil-1(人无色素睫状上皮)和hep2(人肝细胞)均按96u孔平板的60,000个细胞/孔使用。另外,相同测定法中还使用表达htert以延迟衰老的mrc-5(肺成纤维细胞,
mc.7.g5tcrα链和β链的序列。
使用rneasymicro试剂盒(qiagen)提取rna。根据生产商的说明,使用5’/3’smarter试剂盒(clontech,巴黎,法国)合成cdna。smarter方案使用鼠莫洛尼白血病病毒(mmlv)逆转录酶、3’寡-dt引物和5’寡核苷酸产生旁侧分布有已知通用锚序列的cdna模板。随后使用单一引物对,建立pcr。tcr-β恒定区特异性反向引物(cβ-r1,5’-gagaccctcaggcggctgctc-3’,seqidno:9,eurofinsgenomics,ebersberg,德国)和锚特异性正向引物(clontech)用于以下pcr反应中:2.5μl模板cdna、0.25μl高保真phusiontaq聚合酶,10μl5xphusion缓冲液,0.5μldmso(均来自thermofisherscientific)、1μldntp(各自50mm,lifetechnologies)、1μl每种引物(10μm)和最终反应体积为50μl的无核酸酶的水。随后,取出2.5μl第一pcr产物以建立如上的巢式pcr,使用巢式引物对(cβ-r2,5’-tgtgtggccaggcacaccagtgtg-3,seqidno:10,eurofinsgenomics和来自clontech的锚特异性引物)。对于两种pcr反应,循环条件如下:94℃5分钟,30个以下循环:94℃30秒、63℃30秒、72℃90秒;和最终72℃10分钟。将最终pcr产物加载于1%琼脂糖凝胶上并且用qiaexii凝胶提取试剂盒(qiagen)纯化。将纯化的产物克隆入zero-blunttopo并转化入oneshot化学感受态大肠杆菌(e.coli)细胞供标准测序(二者均来自lifetechnologies)。
克隆mc.7.g5响应于广泛类型的肿瘤靶。
活化测定法如上进行并且还使用铬酸钠(铬51)标记的靶细胞进行细胞毒性测定法(ekeruche-makinde等人,2012)或还进行基于流式细胞术的长期杀伤测定法(参见他处的材料和方法部分中所述)。对于铬释放测定法,用每1x106个细胞30μcicr51(perkinelmer,waltham,ma)标记标记每个细胞系并且配合mc.7.g5每孔使用2000个靶细胞(96u孔平板)以实现所需的t细胞对靶细胞比率。在温育过夜后,收获上清液,与闪烁体混合并使用microbeta计数器读数并且如前述那样计算特异性裂解(ekeruche-makinde等人,2012)。除上述a549hek293t之外,所用癌细胞系的详情如下:细胞系名称(背景和培养信息参见
t细胞克隆
hla-a*0201限制型克隆mel5/13识别来自melana(woodridge等人(2010);lissina等人(2009))的肽eaagigiltv和elagigiltv(位置2处结构不同的l)并且如之前所述培养典型mait克隆(tungatt等人(2014))。
通过全基因组crispr的基因捕获
使用一种全基因组crispr/cas9文库方案(见图5和图14的概览并且最近还得到描述(patel等人,2017))。使用geckov2子文库a和b(adgene质粒,#1000000048,fengzhang博士保藏),全基因组打靶的hek293t用于通过mc.7g.5选择。简而言之,在96孔平底平板中,经嘌呤霉素选择的成功转导的hek293t(moi0.4)与mc.7g.5按1:1的预定比率共温育2-3周。来自已经历两轮mc.7g.5选择而幸存的hek293t的基因组dna用于下一代测序法,以揭示插入的向导rna和因此已经打靶以消除的基因。
克隆mc.7.g5借助mr1显示靶特异性。
使用上文与mhc阻断性ab相同的方案,使用一种抗mr1抗体(图6和图14)(克隆26.5,biolegend)也进行活化测定法。在采用已经如先前所述那样用crispr/cas9技术打靶以消除mr1基因表达的a549细胞和mm909.24细胞的活化测定法(laugel等人,2016)中,使用mc.7.g5。细胞系用于如上文的活化测定法和铬释放测定法中。密码子优化的全长mr1基因作为慢病毒粒子生成并且使用下文对mc.7g.5tcr描述的相似方法,向靶细胞中转导(这种情况下单基因且无大鼠cd2),以产生过量表达mr1(高)的细胞系。使用10μg/ml的mr1ab(如上)和含2%fbs的50μlpbs中每种染液50,000个细胞,评估mr1表达。如上文对a549所述那样实现mm909.24中的mr1敲除(6)。如上文那样用以下细胞系进行活化测定法:mm909.24wt、mm909.24mr1-/-、mm909.24mr1高、pt146wt(b-淋巴母细胞样细胞系)、pt146mr1-/-和pt146mr1高。
克隆mc.7.g5未被四聚体形式的mait配体mr1-5-op-ru或未被mr1-ac-6-fp染色。
从培养物收获mc.7.g5,在pbs+2%fbs中洗涤,随后用50nm蛋白激酶抑制剂(pki)达沙替尼(lissina等人,2009)处理,接着用pe缀合的四聚体标记,所述四聚体用mr1装配,随ac-6-fp或5-op-ru一起再折叠,图6和图14。将四聚体染色的细胞用未缀合的抗peab如先前所述那样(tungatt等人,2015)标记,接着用vivid和抗cd8ab标记。mr1-5-op-ru反应性mait克隆按相同方式染色以用作阳性对照。将细胞对大小设门,随后对vivid-cd8+设门,并且展示为四聚体荧光直方图,数据采集和分析如上文。
ac-6-fp和耻垢分枝杆菌感染减少被克隆mc.7.g5的识别,尽管mr1在细胞表面的表达增强。
在使用已经与50μg/ml(图8)和1、10或100μg/ml(图14)ac-6fp预温育的靶细胞(mm909.24和a549)的活化测定法中,使用mc.7.g5。另外,还使用已经加载了耻垢分枝杆菌的a549细胞。使用已经留下未处理/未加载的靶细胞作为阴性对照,图8和图14。在无抗生素的培养基中,将a549与耻垢分枝杆菌按耻垢分枝杆菌对a549100:1的moi温育2小时,随后在培养瓶中洗细胞,并且随后在r10中培养2小时。将mc.7.g5和一种mait克隆在tnf加工抑制物(tapi)-0(30μm)和抗cd107aab(h4a3,bd)存在下温育4-5小时,随后用抗tnfab(ca2,miltenyibiotec)、抗cd3ab、抗cd8ab和vivid染色。相比cd107a或tnfα,对细胞大小、单个细胞、vivid-cd3+细胞随后对cd8+设门,数据采集和分析如上文。与10μg/ml的ac-6fp或耻垢分枝杆菌温育后,在含2%fbs的50μlpbs中使用每种染液50,000个细胞,还用mr1ab对每种靶细胞染色。
用mc.7.g5tcr转导多克隆t细胞(图2中显示)赋予肿瘤识别作用。
合成自切割性2a序列分隔的密码子优化的全长tcr链(genewiz)并且克隆入第3代慢病毒转移载体pelns(宾夕法尼亚州宾夕法尼亚大学jamesriley博士友好提供)。pelns载体含有借助另一自切割性2a序列与tcr分隔的大鼠cd2(rcd2)标记基因。通过hek293t细胞氯化钙转染法生成慢病毒粒子。将tcr转移载体与包装和包膜质粒pmd2.g、prsv-rev和pmdlg/prre一起共转染。通过超速离心浓缩慢病毒粒子,之后使用5μg/ml聚凝胺(polybrene)转导cd8+t细胞,而cd8+t细胞(miltenyibiotec)提前24小时从健康供体(图9)或黑素瘤患者(图15)通过磁性分离法纯化并且按3:1的珠:t-细胞比率用cd3/cd28珠(dyna珠,lifetechnologies)活化过夜。通过用抗rcd2peab(ox-34,biolegend)富集,随后用抗pe磁珠(miltenyibiotec)富集,选择已经摄取病毒的t细胞。转导后14天,用同种异型饲养细胞扩充t细胞。对于全部功能性实验,mc.7.g5tcr转导的t细胞为>95%rcd2+并且用于功能性分析(图16)。将转导的细胞与靶细胞在30mmtapi-0cd107aab存在下温育4-5小时并且随后用针对tnfα、cd3、cd8的ab染色并且还用针对vivid的ab染色。相比cd107a或tnfα,对细胞大小、单个细胞、vivid-cd3+细胞并且随后对cd8+设门。数据采集和分析如上。如上文所述,来自患者的tcr转导的t细胞也用于铬释放细胞毒性测定法(图15)。
流式细胞术
将细胞用fixablelive/deadviolet染料(lifetechnologies)和以下表面抗体染色:泛αβtcrpe(克隆ip26,biolegend)、泛γδtcr-fitc(克隆rea591,miltenyibiotec)、cd3percp(克隆ucht1,biolegend)、cd4apc(克隆vit4,miltenyibiotec)、cd8pe(克隆bw135/80,miltenyibiotec)、大鼠cd2pe(克隆ox-34,biolegend)和mr1pe(克隆26.5,biolegend)。对于mr1pe染色,根据生产商的说明使用fcblock(miltenyibiotec)。对于四聚体染色,jamierossjohn(莫纳什大学)提供mr1单体并且自制pmhc单体。如前述装配四聚体并用于优化的染色(tungatt等人(2014))。在bdfacscantoii(bdbiosciences)上采集数据并且用flowjo软件(treestar)分析。
mr1敲除和转基因表达
如先前所述生成并使用mr1sgrna和crispr/cas9慢病毒(laugel等人(2016))。将mr1转基因克隆入didiertrono实验室开发的缺少人pgk启动子和gfpcdna的第二代prrl.sin.cppt.pgk-gfp.wpre慢病毒骨架(addgene第12252号),并且如对mr1sgrna所述那样生成慢病毒粒子(laugel等人(2016))。在8μg/ml聚凝胺存在下离心转染靶细胞;37℃500xg2小时(shalem等人(2014))。使用抗pe磁珠,根据生产商的说明(miltenyibiotec)磁力富集抗mr1抗体pe(克隆26.2,biolegend)阳性细胞。
tcr测序和转导
使用对tcr-α恒定区和tcr-β恒定区特异的通用正向引物和反向引物,使用smarterrace试剂盒(clontech)和2步聚合酶链反应,对mc.7.g5tcr自行测序。随后合成密码子优化的tcr(genewiz),全长tcr链由自切割性2a序列分隔(ryan等人1991)。将tcr克隆入第三代pelns慢病毒载体(宾夕法尼亚大学jamesriley友好提供),所述载体含有借助第二2a自切割序列与tcr分隔的rcd2。通过hek293t细胞氯化钙转染法生成慢病毒粒子并通过超速离心浓缩。从til患者mm909.11和mm909.24获得治疗后pbmc并且通过磁力富集法(miltenyibiotec)纯化cd8和cd4t细胞。随后通过与cd3/cd28珠(dyna珠;lifetechnologies)按3:1的珠对t细胞比率温育过夜,活化t细胞。随后在5μg/ml聚凝胺(santacruz生物技术)存在下,用mc.7.g5tcr转导t细胞。根据生产商的说明(miltenyibiotec),用抗rcd2抗体和抗pe磁珠磁力富集已经摄取病毒的t细胞。转导后14天,如前述扩充t细胞(tungatt等人(2014))。对于全部功能性实验,转导的t细胞为>85%rcd2+(图16d)。
全基因组geckov.2筛选
geckov.2文库的慢病毒粒子(fengzhang友好提供质粒(sanjana等人(2014))(addgene质粒#1000000048))。geckov.2文库由靶向19,050个编码蛋白质的基因和1,864种微rna的123,411种单一向导(sg)rna(6种sgrna/基因)(4种sgrna/微rna)组成并且用作转导靶细胞系hek293t的慢病毒。以moi0.4转导4x107个hek-293t细胞以提供每个子文库的100x覆盖率。在嘌呤霉素下选择已经摄取慢病毒的细胞。14天后,冷冻一半文库作为对照。在20iuil-2培养基中,将mc.7.g5按0.25:1的t细胞对hek293t比率添加至剩余的转导hek-293t细胞。14天后,按0.5:1比率再次添加mc.7.g5。7天后,hek293t细胞用于测序。分离来自3x107个hek-293t细胞(未选择的对照和经mc.7.g5选择)的基因组dna(genelute哺乳动物基因组dna微量制备试剂盒,sigmaaldrich)。分离的基因组dna整体(2.5μg/50μl反应)用于后续pcr,以确保捕获全面的文库再现。使用hplc纯化的引物和nebnext高保真pcr主混合物(newenglandbiolabs),如前所述那样进行二步骤pcr(shalem等人(2014))。随后从琼脂糖凝胶分离<300bppcr产物并且在hiseq仪(illumina)上以80循环的读段1(旨在测定sgrna的序列)和8个循环的读段2(旨在鉴定样品特异性条形码)测序。使用mageck分析进行已富集向导物的分析(li等人(2014))。
长期杀伤测定法
对于基于流式的杀伤测定法,将5000-10,000个癌或正常细胞系细胞置于96u孔平板中,并且添加mc.7.g5克隆以得到五个t细胞/靶细胞(实验孔)。将细胞共培养在补充有20iuil-2和25ng/mlil-15的200μl靶细胞培养基中。还单独培养靶细胞(对照孔)、mc.7.g5和csfecir以辅助分析。将细胞温育48小时。对于敏感性测定法,相对于靶细胞滴定mc.7.g5数目并温育7天。除他处的材料和方法部分中所述的细胞系之外,还使用卵巢癌细胞系a2780(ecacc93112519)。在收获之前,向每个孔添加0.1x106个cfse标记(0.1μm)的cir细胞,以允许确立实验孔和对照孔中保留的靶细胞的数目。将细胞用补充有2mmedta的冰冷d-pbs洗涤三次,随后在测定平板中用fixablelive/deadviolet染料(lifetechnologies)染色,随后用cd3percp(克隆ucht1,biolegend)和/或抗trbv25.1apctcr(trbv11arden命名:目录号a66905,beckmancoulter)ab染色,以允许设门排除死细胞和t细胞,留下活靶细胞供分析。使用以下等式计算杀伤百分数:
杀伤%=100-((实验靶细胞事件÷实验珠或cfsecir事件)÷(对照靶细胞事件÷对照珠或cfsecir事件)×100)
采用表达空(k43a)mr1的cir细胞的活化测定法
就野生型mr1而言,用携带k43a突变的mr1(r.reantragoon等人)转导cir细胞。活化测定法和流式细胞术如他处的材料和方法部分中所述那样进行。
结果
克隆表征
1.t细胞克隆mc.7.g5识别a549细胞(图1a)。添加10μg/ml阻断mhc-i和mhc-ii的抗体未阻断识别作用(图1b)。
2.抗体染色和流式细胞术确认,克隆mc.7.g5表达αβtcr并且是cd8+(图1c并且在图16a中重复)。
3.重要地,t细胞克隆mc.7g.5不响应于正常(非)癌细胞系(图2和图17b及c)。当mc.7.g5tcr在原代cd8t细胞中表达时,它不介导对正常细胞的杀伤(图15b)。mc.7.g5克隆不响应于自身或新鲜的外周血单个核细胞(未显示)。将mc.7g.5t细胞克隆从它并未造成明显损伤的正常健康供体分离。我们得出结论,t细胞克隆mc.7g.5是肿瘤特异的。
4.mc.7.g5t细胞克隆表达从具有图3中所示序列的trav38.2/dv8traj31和trbv25.1trbj2.3产生的tcr。mr1限制型克隆mc.7.g5不是mait并且它不表达maittcrα链。
5.mc.7.g5t细胞克隆响应于广泛类型的癌细胞系产生mip1β(图4a)和tnfα(图4a)。mc.7.g5还对许多癌细胞高度有细胞毒性(图4b和图17a),甚至在很低的效应细胞对靶比率时也是如此(图4b和图17c)。mc.7g.5识别受测试的所有类型癌症:血液癌、骨癌、黑素瘤(皮肤)、结肠癌、肾癌、肺癌、宫颈癌、乳腺癌、卵巢癌和前列腺癌。另外,这种细胞毒性有效且敏感:来自长期(48小时)杀伤测定法的数据显示>95%癌细胞系杀伤作用(图17a)和在低t细胞对靶细胞比率时显示该杀伤作用(图17c)。
6.通过创建抵抗克隆mc.7.g5所致裂解作用的靶细胞系,mc.7.g5癌靶的全基因组crispr/cas9文库揭示mr1为mc.7.g5的配体。对这种抗性细胞系中向导rna的测序显示,它们主要靶向涉及代谢和免疫系统的基因。mr1和β2微球蛋白的向导rna高度富集于抵抗mc.7.g5裂解作用的细胞群体中。这些基因立即引起我们的注意,原因在于它们与mait细胞活化的联系(mr1需要β2微球蛋白来折叠)。
7.用抗mr1抗体阻断消除了对a549细胞系的识别(图6a并且在图14中重复)。
6.从这些细胞系敲除mr1时,不识别癌细胞系a549(克隆c9)和mm909.24(克隆c4)(图6b及c和图14)。mm909.24中慢病毒转导所致的mr1过量表达略微增强识别(图6d和图14)。
8.t细胞克隆mc.7.g5不识别lcl细胞系pt146。mc.7.g5还无法识别pt146细胞,甚至这些细胞经表达mr1的慢病毒转导并且在细胞表面显示出某种mr1表达时也是如此。lcl细胞系pt146不表达mc.7.g5t细胞配体。这表明mc.7.g5不响应于mr1本身,反而它总是识别mr1结合沟内部独特的癌特异性配体(图6)。
9.加载ac-6-fp或5-op-ru的mr1四聚体不染色克隆mc.7.g5(图7并且在图14e中重复)。平行测定法中,mr1-5-op-ru四聚体染色maitt细胞克隆。我们得出结论:mc.7.g5不与mait配体结合。这个结果与mc.7.g5不表达典型mait不变的trav1-2α链一致。使用不染色mc.7.g5的‘空’(k43a)mr1四聚体,确证这点。mr1的k43a突变允许mr1在结合型载货不存在的情况下再折叠,图14。类似地,空(k43a)mr1表达不导致mc.7.g5识别作用,即便c1r上mr1的细胞表面表达良好(mr1ab染色右小图)图18。这进一步表明,癌表达的配体与mr1结合对mc.7.g5活化重要。
10.添加10、50或100μg/mlmr1配体ac-6-fp(http://www.rcsb.org/pdb/explore.do?structureid=4pj5)维持12小时大幅度地增强mr1在mm909.24细胞表面的表达(图8和图14g),但是降低克隆mc.7.g5对这些细胞的识别(图8和图14g)。这个发现有力地表明,克隆mc.7.g5识别与mm909.24细胞表面上ac-6-fp不同的mr1结合型配体。对a549细胞观察到相似的结果。a549细胞与ac-6-fp温育减少识别作用,同时增加mr1在表面上的表达。使a549细胞暴露于耻垢分枝杆菌(mycobacteriumsmegmatis)也增强mr1表达。这是预期的,因为已知耻垢分枝杆菌产生mr1配体。这些配体可以被mait细胞识别。在平行实验中,耻垢分枝杆菌感染的a549细胞是mait克隆的良好配体(图8和图14f)。使a549细胞暴露于耻垢分枝杆菌大幅度减少克隆mc.7.g5的识别作用。我们得出结论:克隆mc.7.g5通过mr1结合沟中仅存在于癌细胞上的配体识别癌细胞。
11.使mc.7.g5转导成多克隆性t细胞允许它们识别肿瘤靶(图9)。实际上,经mc.7.g5tcr转导的来自转移性黑素瘤患者mm909.11的cd8t细胞杀伤自体黑素瘤和非自体黑素瘤,但不杀伤正常细胞(图15)。我们得出结论:克隆mc.7.g5的肿瘤识别作用通过mr1分子呈递的配体,借助图3中所示的mc.7.g5t细胞受体发生。
使用以六种不同单一向导(sg)rna靶向人类基因组中每个蛋白质编码基因的geckov.2文库,一个全基因组crispr/cas9方案用来鉴定对mc.7.g5识别靶细胞必需的基因(图13a)。在两轮mc.7.g5选择后,幸存的已转导hek293t细胞显示刺激mc.7.g5的能力减弱,表明涉及其识别过程的关键基因已经消除(图13b)。对抵抗裂解作用的hek293t细胞中crisprsgrna的测序显示,仅6个基因被多于一种富集的sgrna打靶:β2m(五种sgrna)、mr1(二种sgrna)、调节因子x(rfx,五种sgrna)、rfx相关的含有锚蛋白的蛋白质(rfxank,五种sgrna)、rfx相关蛋白(rfxap,三种sgrna)和信号传导子和转录活化物6(stat6,二种sgrna)(图13c)。rfx、rfxank和rfxap是负责反式激活β2m、mhci和mhcii启动子的蛋白质复合体的必需组分。结合β2m和mr1联合以形成已知活化mait和其他mr1限制型t细胞的非多态性稳定抗原呈递分子的事实,这些数据有力地表明,mc.7.g5t细胞通过不变的mr1分子识别癌靶。因此,mr1抗体,而非mhci抗体或mhcii抗体,阻断mc.7.g5对靶细胞的识别(图14a)。crispr介导从a549和黑素瘤mm909.24敲除mr1(图16b中显示缺失突变)免受mc.7.g5介导的识别和裂解作用(图14b)。抗mr1抗体不染色黑素瘤mm909.24,表明需要很低水平的mr1用于靶识别(图16c)。mr1过量表达导致对识别不良的靶hela和c1r的强力识别,并且略微增强对黑素瘤mm909.24的识别(图14c)。向crispr/cas9敲除mr1的a549细胞再引入mr1恢复了mc.7.g5识别作用(图14d),进一步确立癌细胞识别作用依赖mr1的可信度。
已知mr1在细胞表面呈递核黄素合成中的中间体至mait细胞并且认为其在无结合型载货情况下不在细胞表面表达。由含有允许mr1在无结合型配体情况下再折叠的k43a突变的mr1组成的四聚体不染色mc.7.g5。依赖mr1的癌细胞识别作用表明,mc.7.g5可能识别在恶性细胞中特异性表达或上调的mr1结合型代谢物。与这种假设一致,用呈递微生物衍生的t细胞活化物5-op-ru的mr1装配的四聚体不染色mc.7.g5。另外,以mait活化性细菌耻垢分枝杆菌(图14f)或mr1配体乙酰基-6-甲酰基蝶呤(ac-6-fp)(22、23)(图14g)加载时,对靶细胞的识别减少,尽管mr1表面表达增加(图14g)。这些结果表明,mc.7g.5不识别mr1本身,也不借助已知机制识别mr1,而是识别具有对癌细胞特异或与之相关的结合型载货的mr1。
对mc.7.g5的tcr测序揭示了一种新的tcr,其包含与trbv25.1trbj2.3β-链配对的trav38.2/dv8traj31α-链。为了探索靶向癌细胞上mr1的治疗潜力,我们从iv期黑素瘤患者的pbmc纯化t细胞并将它们用mc.7.g5tcr进行慢病毒转导,这导致识别和杀伤自体黑素瘤和非自体黑素瘤(图15),但不杀伤健康细胞(图15b)。杀伤作用对mr1特异,因为mc.7.g5tcr转导的细胞不裂解敲除mr1的黑素瘤(图15b)。我们得出结论:mc.7.g5tcr可以使患者t细胞重定向,以在不需要特定hla的情况下杀伤患者的癌细胞。mr1是癌症免疫疗法的有吸引力的靶,原因在于其非多态性、普遍表达性质。mr1四聚体和配体发现方面的近期进展已经推进这个领域的认识,但仍存在待发现的大量内容。我们在此确认了来自多样组织类型响应于多个癌细胞系的t细胞克隆的癌细胞识别作用。
长期杀伤测定法(图17)显示,mc.7.g5杀伤一系列不同来源的癌细胞系。实际上,mc.7.g5能够杀伤每个细胞系的95-99.9%。另外,mc.7.g5不杀伤健康细胞。
cir细胞中突变的k43a(‘空’)mr1过量表达不导致m.7.g5活化(图18a),即便mr1抗体对cir-k43a染色明显(图18b)。相反,cir细胞中野生型mr1过量表达引起mc.7.g5活化。这表明mc.7.g5tcr识别具有结合型载货的mr1。
当前mr1抗体不能检测癌细胞上mr1的表面低表达,尽管mrna表达可检测。实际上,mc.7.g5识别癌细胞所要求的mr1表面表达水平经常低于抗体染色所要求的阈值,显示mc.7.g5tcr可能能够应答于低拷贝数目的mr1配体,类似于识别pmhc的t细胞。我们的结果还展示了全基因组crispr/cas9筛选作为非常规t细胞配体发现平台的强大力量。实际上,我们还已经使用这项技术找出γδtcr识别癌细胞所要求的严格细胞表面表达的分子,并且我们预计本文采用的方法体系将通过揭示新配体,迅速地彻底改变非常规t细胞领域。
总之,使用全基因组crispr筛选来揭示癌表达的mc.7.g5配体。mr1验证实验显示,a549细胞对mc.7.g5的活化可以被mr1抗体阻断并且该克隆不响应于我们实验室创建的敲除mr1的a549细胞(laugel等人2012)或crispr/cas9介导的黑素瘤靶mm9909.24的mr1敲除。mc.7.g5响应于大部分癌细胞系,但不响应于原代(非肿瘤)细胞。mc.7.g5识别靶癌细胞需要mr1的表达。mr1中的唯一多态性是沉默的(parra-cuadrado等人2000),从而mr1限制型tcr可以响应于来自群体中任何个体的细胞。这使mr1成为过继细胞疗法方案的特别有吸引力的候选物,因为单一产物可以用于全部患者中(guo等人2015)。
结论
mc.7.g5tcr使t细胞识别广泛类型的肿瘤成为可能。识别作用借助群体不变的分子mr1发生。在mr1结合沟中不存在配体的情况下,mr1通常不表达在细胞表面上(chua等人,2011)。与mr1结合的配体表达允许该分子移动至细胞表面,以呈递这种配体(图10)。加入已知的mr1配体减少mc.7.g5t细胞克隆的肿瘤识别作用并且表明mc.7.g5识别mr1背景下的癌细胞特异性配体(图11)(即,其他配体与癌配体竞争结合mr1)。鉴于关于mr1的已知内容,这种配体似乎可能是因肿瘤形成而上调的代谢途径中的中间体。正在进行的实验旨在确定这种配体的性质。
本发明以t细胞克隆mc.7.g5中鉴定的tcr为中心。这种tcr通过保守的mhc相关(mr)1蛋白识别广泛类型的癌细胞。这种tcr不识别非肿瘤细胞。crispr/cas9从肿瘤系敲除mr1或用抗mr1抗体阻断消除tcr识别作用。与结合mr1的已知配体温育减少tcr识别作用,显示t细胞受体(tcr)配体是癌特异性代谢物,所述癌特异性代谢物位于mr1结合沟中或在mr1结合沟中呈递给tcr。mc.7.g5tcr可以用于多种不同的癌症免疫治疗策略中。宽泛的肿瘤识别作用和识别作用的人白细胞抗原(hla)非依赖性开启了令人兴奋的使用这种tcr进行泛癌、泛群体免疫疗法的可能性。
参考文献
chuawj,kims,myersn,huangs,yul,fremontdh,等人(2011)内源mhc相关蛋白1在胞质膜上以活化粘膜相关的不变t细胞的构象瞬时表达(endogenousmhc-relatedprotein1istransientlyexpressedontheplasmamembraneinaconformationthatactivatesmucosal-associatedinvarianttcells).journalofimmunology,186,4744-50.
ekeruche-makinde,j.,m.clement,d.k.cole,e.s.j.edwards,k.ladell,j.j.miles,k.k.matthews,a.fuller,k.a.lloyd,f.madura,g.m.dolton,j.pentier,a.lissina,e.gostick,t.k.baxter,b.m.baker,p.j.rizkallah,d.aprice,l.wooldridgeanda.k.sewell(2012).针对组库优化的细胞受体可以增强抗原靶向(tcellreceptoroptimizedskewingoftherepertoirecanenhanceantigentargeting).journalofbiologicalchemistry,287,37269-81.
guot,chamotok,hiranon.(2015)靶向cd1和mr1的过继t细胞疗法(adoptivetcelltherapytargetingcd1andmr1).frontiersinimmunology.6:247.
laugelb,lloyda,meermeierew,crowthermd,connortr,doltong等人(2016)用crispr/cas9慢病毒系统工程化mr1缺陷的同基因细胞:研究微生物抗原加工和呈递至人mr1限制型t细胞的工具(engineeringofisogeniccellsdeficientformr1withacrispr/cas9lentiviralsystem:toolstostudymicrobialantigenprocessingandpresentationtohumanmr1-restrictedtcells).journalofimmunology,197,971-82.
liw.,h.xu,t.xiao,l.cong,m.i.love,f.zhang,r.a.irizarry,j.s.liu,m.brown,x.s.liu,(2014)mageck使得从基因组级crispr/cas9敲除筛选来强力地鉴定必需基因成为可能(mageckenablesrobustidentificationofessentialgenesfromgenome-scalecrispr/cas9knockoutscreens).genomebiology.15,554.
lissinaa.,k.ladell,a.skowera,m.clement,e.edwards,r.seggwiss,h.vandenberg,e.gostick,k.gallagher,e.jones,j.j.melenhorst,a.j.godkin,m.peakman,d.a.price,a.k.sewell和l.wooldridge(2009)蛋白激酶抑制剂大幅度改进对具有肽mhc四聚体的t细胞的物理检测(proteinkinaseinhibitorssubstantiallyimprovethephysicaldetectionoft-cellswithpeptide-mhctetramers).journalofimmunologicalmethods,340,11-24.
parra-cuadradojf,navarrop,mironesi,setienf,oteom,martinez-navese.对人mhci类相关基因的mr1多态性和鉴定mr1样假基因的研究(astudyonthepolymorphismofhumanmhcclassi-relatedmr1geneandidentificationofanmr1-likepseudogene).tissueantigens.2000;56(2):170-2.
patel,s.j.等人2012鉴定癌症免疫疗法的必需基因(identificationofessentialgenesforcancerimmunotherapy).nature,584,537-542.
r.reantragoon,a.j.corbett,i.g.sakala,n.agherardin,j.b.furness,z.chen,s.b.g.eckle,a.p.uldrich,r.w.birkinshaw,o.patel,l.kostenko,b.meehan,k.kedzierska,l.liu,d.p.fairlie,t.h.hansen,d.i.godfrey,j.rossjohn,j.mccluskey,l.kjer-nielsen,加载抗原的mr1四聚体限定粘膜相关的不变t细胞中的t细胞受体异质性(antigen-loadedmr1tetramersdefinetcellreceptorheterogeneityinmucosal-associatedinvarianttcells).thejournalofexperimentalmedicine.210,2305–2320(2013).
ryanm.d.,a.m.q.king,g.p.thomas,(1991)口蹄疫病毒多聚蛋白剪切过程由位于19个氨基酸序列内部的残基介导(cleavageoffoot-and-mouthdiseaseviruspolyproteinismediatedbyresidueslocatedwithina19aminoacidsequence).journalofgeneralvirology.72,2727–2732.
sanjanan.e.,o.shalem,f.zhang,(2014)用于crispr筛选的改进载体和基因组级文库(improvedvectorsandgenome-widelibrariesforcrisprscreening).naturemethods.11,783–784.
shalem,n.e.sanjana,e.hartenian,x.shi,d.a.scott,t.s.mikkelsen,d.heckl,b.l.ebert,d.e.root,j.g.doench,f.zhang,(2014)人细胞中的基因组级crispr-cas9敲除筛选(genome-scalecrispr-cas9knockoutscreeninginhumancells).science.343,84–87.
theaker,s.m.,c.rius,a.greenshields-watson,a.lloyd,a.trimby,a.fuller,j.j.miles,d.k.cole,m.peakman和a.k.sewellgdolton(2016)t细胞文库允许简单平行生成多重肽特异性人t细胞克隆(t-celllibrariesallowsimpleparallelgenerationofmultiplepeptide-specifichumant-cellclones).journalofimmunologicalmethods430,43-50
tungatt,k.,v.bianchi,m.d.crowther,w.e.powell,a.j.schauenburg,a.trimby,m.donia,a.skowera,j.j.miles,c.j.holland,d.k.cole,a.j.godkin,m.peakman,p.t.straten,i.m.svane,a.k.sewellandg,dolton(2015)肽-mhc多聚体的抗体稳定作用揭示t细胞携带的有功能极低亲和力的tcr(antibodystabilizationofpeptide-mhcmultimersrevealsfunctionalt-cellsbearingextremelylowaffinitytcrs).journalofimmunology194,463-74.
wooldridgel.,m.clement,a.lissina,e.s.j.edwards,k.ladell,j.ekeruche,r.e.hewitt,b.laugel,e.gostick,d.k.cole,r.debets,c.berrevoets,j.j.miles,s.r.burrows,d.a.price,a.k.sewell(2010)具有超级增强cd8结合特性的mhci类分子绕过对相应tcr识别的需要并且非特意性活化ctl(mhcclassimoleculeswithsuperenhancedcd8bindingpropertiesbypasstherequirementforcognatetcrrecognitionandnonspecificallyactivatectls).thejournalofimmunology.184,3357–3366.
wooldridge,l.,j.ekeruche-makinde,h.a.vandenberg,a.skowera,j.j.miles,m.p.tan,g.dolton,m.clement,s.llewellyn-lacey,d.a.price,m.peakman和a.k.sewell(2012)单一自身免疫t细胞受体识别超过一百万种不同的肽(asingleautoimmunet-cellreceptorrecognisesoveramilliondifferentpeptides).journalofbiologicalchemistry,287,1168-77.
- 还没有人留言评论。精彩留言会获得点赞!