一种提取多糖多酚植物总RNA的方法与流程
本发明涉及生物学领域,具体涉及一种提取多糖多酚植物总rna的方法。
背景技术:
rna是基因表达过程中非常重要的生物分子,对其分离纯化是研究基因功能的重要基础之一。高质量的rna对于后续文库构建、rna-seq以及其他的分子生物学分析极其重要。而对于大多数植物组织来说,抽提高质量的rna显得尤为重要,因为绝大多数植物材料富含多糖、多酚、蛋白质以及次级代谢产物。多酚类物质在研磨过程中很容易被氧化,并能结合蛋白质和核酸形成大分子物质;在提取过程中,多糖和多酚类物质可能会导致rna降解,干扰后续的实验应用,而普通的trizol法提取植物总rna的方法不能去除植物中的糖类和酚类。
技术实现要素:
为解决上述问题,本发明提供了一种提取多糖多酚植物总rna的方法,用针对多糖多酚植物的裂解液代替trizol溶液对植物组织进行裂解,并加入水饱和酚减少dna的混入,同时加入β-巯基乙醇降低氧对细胞产生的氧化损伤。
为实现上述目的,本发明采取的技术方案为:
一种提取多糖多酚植物总rna的方法,包括如下步骤:
s1、取适量组织样品用液氮充分研磨3~5次后,取200mg磨碎的组织样品置于2mlep管中,加入1ml多糖多酚植物专用裂解液和50µl的β-巯基乙醇,立即漩涡震荡混匀,室温静置15min,使其充分裂解后,4℃,12000r/min离心10min;
s2、吸取上清液转移至新的2mlep管中,冰上操作,加入等体积氯仿和水饱和酚的混合液(氯仿:水饱和酚=1:1),轻微震荡混匀,室温静置分层5min后,4℃,12000r/min离心10min;
s3、吸取上清液转移至新的2mlep管中,冰上操作,加入200µl氯仿,轻微震荡混匀,室温静置分层,然后4℃,12000r/min离心10min。
s4、吸取上清液转移至新的1.5mlep管中,冰上操作,加入等体积的预冷至-20℃的无水乙醇,-80℃,静置30min,让rna充分析出后,4℃,12000r/min离心10min;
s5、弃上清,加入1ml75%的乙醇,温和震荡洗涤5min后,4℃,12000r/min离心5min;
s6、弃上清,加入1ml无水乙醇,温和震荡洗涤5min后,4℃,12000r/min离心5min,弃上清,风干处理20-30min;
s7、加入由10µldnase和70µlrdd缓冲液混合而成的混合液,混匀,室温静置约15min;
s8、加入200µlrnase-free水,混匀,再加入100µl氯仿,轻轻混匀,室温静置至分层;4℃,12000r/min离心10min;
s9、吸取上清液转移至新的1.5mlep管中,冰上操作,加入1ml预冷至-20℃的无水乙醇,-80℃,静置30min后,4℃,12000r/min离心10min;
s10、弃上清,加入1ml75%乙醇,温和震荡洗涤5min后,4℃,12000r/min离心5min;
s11、弃上清,加入1ml无水乙醇,温和震荡洗涤5min后,4℃,12000r/min离心5min;
s12、弃上清,室温风干,加入20-50µlrnase-free水进行溶解,即得总rna,-80℃存放。
本发明具有以下有益效果:
有效避免了植物中糖类和酚类对总rna的降解,同时能够完全清除rna中混有的蛋白质和dna。本方法所提取的总rna可以满足对microrna以及其靶基因的研究。
附图说明
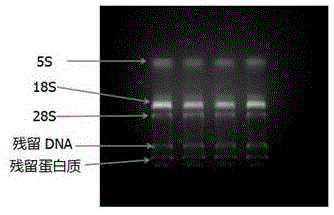
图1为用trizol法提取的多糖多酚类植物的rna琼脂糖胶图。
图2为采用本发明实施例的方法所提取的总rna琼脂糖胶图。
具体实施方式
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。
实施例
一种提取多糖多酚植物总rna的方法,包括如下步骤:
s1、取适量组织样品用液氮充分研磨3~5次后,取约200mg磨碎的组织样品置于2mlep管中,加入1ml多糖多酚植物专用裂解液和50µlβ-巯基乙醇,立即漩涡震荡混匀,室温静置15min,使其充分裂解后,4℃,12000r/min离心10min;
s2、吸取上清液(约900µl)转移至新的2mlep管中,冰上操作,加入等体积氯仿和水饱和酚的混合液(氯仿:水饱和酚=1:1),轻微震荡混匀,室温静置分层5min后,4℃,12000r/min离心10min;
s3、吸取上清液(约800µl)转移至新的2mlep管中,冰上操作,加入200µl氯仿,轻微震荡混匀,室温静置分层,然后4℃,12000r/min离心10min。
s4、吸取上清液(约700µl)转移至新的1.5mlep管中,冰上操作,加入等体积的预冷至-20℃的无水乙醇,-80℃,静置30min~2h,让rna充分析出后,4℃,12000r/min离心10min;
s5、弃上清,加入1ml75%的乙醇,温和震荡洗涤约5min后,4℃,12000r/min离心5min;
s6、弃上清,加入1ml无水乙醇,温和震荡洗涤约5min后,4℃,12000r/min离心5min,弃上清,风干处理约20-30min;
s7、加入由10µldnase和70µlrdd缓冲液混合而成的混合液,混匀,室温静置约15min,如果室温温度较低,适当增加混合液的体积,此步骤是为了去除rna中的dna;
s8、加入200µlrnase-free水,混匀,再加入100µl氯仿,轻轻混匀,室温静置至分层;此步骤是为了去除rna中的dnase;
s9、吸取上清液转移至新的1.5mlep管中,冰上操作,加入1ml预冷至-20℃的无水乙醇,-80℃,静置30min后,4℃,12000r/min离心10min;
s10、弃上清,加入1ml75%乙醇,温和震荡洗涤约5min后,4℃,12000r/min离心5min;
s11、弃上清,加入1ml无水乙醇,温和震荡洗涤约5min后,4℃,12000r/min离心5min;
s12、弃上清,室温风干,加入20-50µlrnase-free水进行溶解,即得总rna,-80℃存放。
对比例
1.将组织样品直接放入无rnase研体中,加入少量液氮,迅速研磨,如此反复3-5次后,取50-100mg组织转移入离心管,加入1mltrizol溶液用电动匀浆器充分匀浆约需1-2分钟,室温放置15min,使其充分裂解;
2.12000rpm离心10min,弃沉淀,加入200ul氯仿,振荡混匀15分钟,室温放置15min,4℃,12000g离心15min;
3.吸取上层水相至另一离心管中,加入0.5ml异丙醇,混匀,室温放置5-10min,4℃12000g离心10min,弃上清,rna沉于管底;
4.加入1ml75%乙醇,温和振荡离心管,悬浮沉淀,4℃8000g离心5min,尽量弃上清,室温晾干或真空干燥5-10min。注:rna样品不要过于干燥,否则很难溶解。5.可用50ulh2o,tebuffer或0.5%sds溶解rna样品,55-60℃,5-10min。注:h2o、te或0.5%sds均须用depc处理并高压。
在提取的rna中,如果18s的条带亮度弱于28s的条带,说明所提取的rna比较完整,没有降解。如图1所示,是用trizol法提取的多糖多酚类植物的rna琼脂糖胶图,从图中可以看出18s条带亮于28s条带,rna降解比较厉害。而且,rna中残留的dna和蛋白质较多。如图2所示,为本实施例所提取的总rna琼脂糖胶图,从图中可以看出,所提取的rna基本上没有降解,而且没有dna和蛋白质的残留。
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变化或修改,这并不影响本发明的实质内容。在不冲突的情况下,本申请的实施例和实施例中的特征可以任意相互组合。
- 还没有人留言评论。精彩留言会获得点赞!