一种在人血浆中筛选的上皮细胞粘附分子EpCAM的核酸适体及其制备方法和应用与流程
本发明属于生物分析和临床医学技术领域,具体涉及一种在人血浆中筛选的上皮细胞粘附分子epcam的核酸适体及其制备方法和应用。本发明具体提供了在人血浆复杂生理环境中能够高特异性识别、高亲和力结合上皮细胞粘附分子epcam的核酸适体与其筛选方法及其在生物分析和临床医学中的应用,并有望作为循环肿瘤细胞检测的分子识别工具而应用于液体活检。
背景技术:
癌症已严重威胁人类生存和健康,成为全球死亡的主要原因。针对癌症的早期诊断和预后评估是提高患者生存率的重要保障。传统的癌症体外检测是组织活检,但是存在着取样困难、侵入性大等不足,难以满足临床需要。目前,针对循环肿瘤细胞(circulatingtumorcells,ctcs)的液体活检尤为受到关注。ctcs是指由实体肿瘤组织脱落并释放进入外周血循环的肿瘤细胞,其可提供肿瘤病灶的基因组变异、细胞形态与功能改变等信息,更能全面反映肿瘤病灶的分子病理信息。与经典组织活检相比,基于ctcs检测的液体活检技术具有侵入性小、无放射性污染、成本低等优势,已成为目前最具发展潜力的肿瘤无创诊断手段之一。大量研究证明,ctcs的检测在肿瘤诊断、动态监测、预后评估等方面具有重大意义。
上皮细胞粘附分子epcam在大部分上皮肿瘤细胞中过表达,在上皮癌变过程中发挥着作用,参与调节细胞粘附、细胞迁移、增殖和分化等功能,是一种腺癌通用肿瘤标志物。利用ctc表面表达的epcam,通过抗原抗体反应来捕获和分选ctcs,在肿瘤诊断、动态监测、预后评估等方面具有重大意义。例如,目前美国食品药物管理局批准的循环肿瘤细胞捕获平台cellsearch就是基于epcam抗体修饰的磁珠来捕获全血中的ctcs,实现ctcs的分离富集。但是由于epcam抗体存在不稳定、易失活、成本高、寿命短以及大尺寸等缺点,导致ctcs的捕获效果不甚理想。因此,需要更小、更稳定和更有效的ctcs标志物的结合配体进行ctcs捕获。
核酸适体,是一种寡核苷酸,通过体外指数富集配体系统进化技术(selex)从人工合成的dna、rna文库中筛选得到,经折叠形成特定的三维或者四维结构后,可与靶标分子,例如与多肽、蛋白质、药物、有机和无机分子甚至全细胞,高亲和性、特异地结合。相比于抗体,核酸适体具有易获得、成本低、纯度高、不易失活、更稳定、非免疫原性和无毒性等特点。且因核酸适体比抗体小10~20倍,因此在相同表面积下可修饰更多的识别分子,从而进一步提高ctcs捕获效率。由于核酸适体具有上述特性以及结构可调等特点,用核酸适体取代传统抗体具有巨大的优势,可实现特异性捕获ctcs,有望获得较高的ctcs捕获效率。
但是,传统核酸适体筛选方法所筛选出的核酸适体,应用于复杂生理环境中捕获循环肿瘤细胞时,易受到反应体系的影响,核酸适体二级、三级结构不稳定,而导致亲和力稳定性不好,难以实现真实样品中ctcs的高效捕获。为实现核酸适体直接用于血液中富集ctcs,需要建立新型高效可用于复杂生理环境的核酸适体筛选方法,筛选针对ctcs标志物上皮细胞粘附分子epcam且在人血浆等复杂生理环境中更稳定、亲和力和选择性更高的核酸适体,实现ctcs特异性识别,提高ctcs捕获效率,对于肿瘤诊断、动态监测、预后评估等都具有重要意义。
技术实现要素:
本发明的目的在于克服现有技术的不足之处,提供了一种在人血浆中筛选的上皮细胞粘附分子epcam的核酸适体及其制备方法和应用,针对当前传统的核酸适体筛选方法所得的核酸适体在复杂生理环境中捕获ctcs时存在的问题,本发明以人血浆模拟复杂生理环境,构建上皮细胞粘附分子epcam的核酸适体的筛选平台;在核酸适体筛选进化过程中,淘汰在复杂生理环境中亲和力差的序列,富集能在复杂生理环境中具有高特异性、高亲和力且稳定性好的核酸适体序列,获得可直接应用于外周血中捕获的核酸适体序列,从而建立新型高效可用于复杂体系的核酸适体筛选方法。最终获得的核酸适体具有易获得、成本低、不易失活、非免疫原性和无毒性等特点,并且利用该条序列实现了epcam蛋白、表达epcam蛋白的肿瘤细胞系的特异性识别,ctcs的捕获;另外,在人血浆中具有高亲和力,确保其在生物分析和临床医学中的应用,并有望作为ctcs检测的分子识别工具而应用于液体活检。
本发明解决其技术问题所采用的技术方案之一是:
一种上皮细胞粘附分子epcam的核酸适体,所述上皮细胞粘附分子epcam的核酸适体包括如seqidno.1至seqidno.7所示的核苷酸序列。
具体为:
seqidno.1,命名为hmj1:
5'-agcgtcgaataccactacagctgggggtttctggggtttttgttggg
gtgggtgttgtgtctaatggagctcgtggtcag-3
seqidno.2,命名为hmj2:
5'-agcgtcgaataccactacaggagctcggggtttgggggttcggggt
cggttcggtttcttctaatggagctcgtggtcag-3'
seqidno.3,命名为hmj3:
5'-agcgtcgaataccactacagctttcggggtcgtgtttggggtgggtc
ttttgggggtttgctaatggagctcgtggtcag-3'
seqidno.4,命名为hmj4:
5'-agcgtcgaataccactacagtgtttgggttggttgggggtgggtttg
ggatttggtgttgctaatggagctcgtggtcag-3'
seqidno.5,命名为hmj5:
5'-agcgtcgaataccactacagtttggctctgggggttgtggagggggt
atgggtgggagtctaatggagctcgtggtcag-3'
seqidno.6,命名为hmj6:
5'-agcgtcgaataccactacaggtattcgagttgcttggggttggtggg
tgggttcctgtctctaatggagctcgtggtcag-3'
seqidno.7,命名为hmj2c:
5'-tcggggtttgggggttcggggtcggttcggtttcttctaatgga-3'
优选地,所述上皮细胞粘附分子epcam的核酸适体为如seqidno.7所示的核苷酸序列hmj2c。
一实施例中:还包括基于上述序列做截短或部分碱基替换的上皮细胞粘附分子epcam的核酸适体。
一实施例中:所述上皮细胞粘附分子epcam的核酸适体具有茎环结构。
本发明解决其技术问题所采用的技术方案之二是:
一种上皮细胞粘附分子epcam的核酸适体的制备方法,包括:
1)相比于传统的在缓冲溶液中进行筛选的筛选方法,不同之处在于,是以人血浆模拟复杂生理环境,构建上皮细胞粘附分子epcam的核酸适体的筛选平台。具体为:首先化学合成如seqidno.8所示的80个碱基的dna初始文库;真核表达融合蛋白his-epcam,通过his与ni的亲和相互作用,将epcam蛋白固定在ni琼脂糖微球(beads)上,得到epcam蛋白琼脂糖微球;接着在人血浆的环境中,以epcam蛋白琼脂糖微球为靶标,以ni琼脂糖微球为反筛(在第三轮筛选之后引入反筛),对dna初始文库进行筛选,得到与epcam蛋白琼脂糖微球特异结合的dna序列;
2)将步骤1)所得与epcam蛋白琼脂糖微球特异结合的dna序列进行聚合酶链式反应(pcr)扩增,pcr扩增产物以链酶亲和素琼脂糖微球为基质进行分离,通过0.1mol/l的naoh碱变性解双链,nap-5column脱盐过滤,纯化,即得用于下一轮筛选的单链dna文库,形成次一级单链dna文库;
3)将步骤2)所得的次一级单链dna文库进行下一轮筛选,重复多轮筛选,在多轮筛选进化过程中,淘汰在人血浆的复杂生理环境中亲和力差的序列,富集能在人血浆的复杂生理环境中具有高特异性、高亲和力且稳定性好的序列,经过多轮筛选后获得富集文库;将富集文库与epcam蛋白进行孵育,洗涤后进行流式细胞术表征;通过流式细胞术可以有效地监测核酸适体筛选富集进程以及epcam蛋白与筛选文库的结合能力;
4)对最终富集文库进行测序,得到与上皮细胞粘附分子epcam特异结合的候选核酸适体序列,通过流式细胞术测定候选核酸适体序列与epcam蛋白、表达epcam蛋白的肿瘤细胞系的结合能力以及解离常数(kd),来表征其结合能力以及特异性,甄定出其中结合能力最佳且稳定性最好的序列;
5)优化甄定好的序列。具体为:在保证核酸适体原有的亲和力和选择性基本不变的前提下,需要尽可能的截短序列,去除不必要的碱基;因为核酸适体的二级结构对靶标的结合起着非常重要的作用,所以先利用nupack对核酸适体进行二级结构的模拟,对核酸适体的碱基组成和空间结构进行分析,再对序列进行截短优化,主要去除序列两端的引物,得到最优序列;
6)表征最优序列。具体为:通过流式细胞术测定最优序列与表达epcam蛋白的肿瘤细胞系的结合能力以及kd,来表征其结合能力以及特异性;另外,利用激光共聚焦显微镜分析方法进一步考察最优序列和表达epcam蛋白的肿瘤细胞系的结合情况。
在步骤1)中,所述的如seqidno.8所示的dna初始文库的两端为固定序列,其中包括中间为40个碱基的随机序列,即为5'-agcgtcgaataccactacag-40nt-ctaatggagctcgtggtcag-3',库容量为1015以上。
在步骤2)中,所述pcr扩增的引物为:
正向引物(如seqidno.9所示):5'-fam-agcgtcgaataccactacag-3';
反向引物(如seqidno.10所示):5'-biotin-ctgaccacgagctccattag-3';
所述pcr扩增产物为5’端带有羧基荧光素(fam)标记、3’端带有生物素标记的双链dna文库。
所述的上皮细胞粘附分子epcam的核酸适体作为与表达epcam蛋白的细胞系的核酸适体。
本发明解决其技术问题所采用的技术方案之三是:
一种上皮细胞粘附分子epcam的核酸适体的应用,但不用于疾病诊断和治疗。
一实施例中:所述应用包括:
1)所述上皮细胞粘附分子epcam的核酸适体在肿瘤细胞的流式分析检测中的应用;
2)所述上皮细胞粘附分子epcam的核酸适体在肿瘤细胞成像中的应用;
3)所述上皮细胞粘附分子epcam的核酸适体在肿瘤组织切片成像中的应用;
4)所述上皮细胞粘附分子epcam的核酸适体在肿瘤相关的活体成像中的应用;
5)所述上皮细胞粘附分子epcam的核酸适体在循环肿瘤细胞捕获中的应用;
6)所述上皮细胞粘附分子epcam的核酸适体在液体活检中的应用。
本技术方案与背景技术相比,它具有如下优点:
1)传统核酸适体筛选方法所筛选出的核酸适体,应用于复杂生理环境中捕获ctcs时,易受到反应体系的影响,核酸适体二级、三级结构不稳定,而导致亲和力稳定性不好,难以实现真实血液样品中ctcs的高效捕获。针对当前传统的核酸适体筛选方法所得的核酸适体在复杂生理环境中捕获ctcs时存在的问题,本发明以人血浆模拟复杂生理环境,构建核酸适体的筛选平台。在核酸适体筛选进化过程中,淘汰在复杂生理环境中亲和力差的序列,富集在复杂生理环境中具有高特异性、高亲和力且稳定性好的核酸适体序列,获得可直接应用于外周血中捕获ctcs的核酸适体序列;
2)相比于传统筛选方法所筛选出的核酸适体,本发明所得的核酸适体序列在人血浆等复杂生理环境中具有更高特异性、更高亲和力且稳定性更好,可直接应用于外周血中捕获ctcs;
3)相比于抗体,本发明筛选获得的核酸适体具有易获得、成本低、不易失活、非免疫原性和无毒性等特点,且因核酸适体比抗体小10~20倍,因此在相同表面积下可修饰更多的识别分子,从而进一步提高ctcs捕获效率;由于核酸适体具有上述特性以及结构可调等特点,用核酸适体取代传统抗体具有巨大的优势,可实现特异性捕获ctcs,有望作为ctcs检测的分子识别工具而应用于液体活检,在生物分析和临床医学中具有广阔的应用前景。
附图说明
下面结合附图和实施例对本发明作进一步说明。
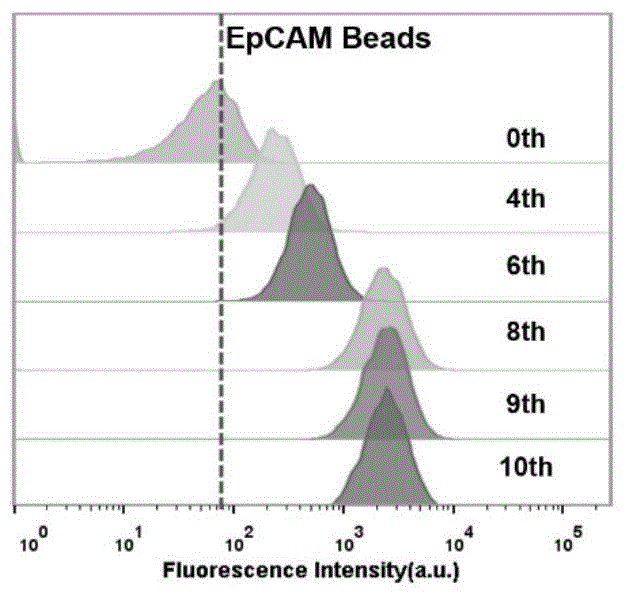
图1为流式细胞术监测核酸适体筛选富集进程以及epcam蛋白琼脂糖微球与筛选文库的结合能力。在图1中,横坐标为荧光强度,0th为dna初始文库,4th,6th,8th,9th,10th分别为第4,第6,第8,第9和第10轮dna富集文库。
图2为流式细胞术监测核酸适体筛选富集进程以及对于ni琼脂糖微球与筛选文库的结合能力。在图2中,横坐标为荧光强度,0th为dna初始文库,4th,6th,8th,9th,10th分别为第4,第6,第8,第9和第10轮dna富集文库。
图3为通过流式细胞术测定第8轮dna富集文库对epcam蛋白的解离常数。在图3中,横坐标为dna富集文库浓度(nmol/l),纵坐标为归一化平均荧光强度。
图4为通过流式细胞术考察测序分析得到的6条核酸适体hmj1,hmj2,hmj3,hmj4,hmj5与hmj6与epcam蛋白的结合能力。在图4中,横坐标为荧光强度。0th为dna初始文库,8th为第8轮dna富集文库,hmj1,hmj2,hmj3,hmj4,hmj5与hmj6分别为6条核酸适体。
图5为通过流式细胞术考察测序分析得到的6条核酸适体hmj1,hmj2,hmj3,hmj4,hmj5与hmj6与ni琼脂糖微球的结合能力。在图5中,横坐标为荧光强度。0th为dna初始文库,8th为第8轮dna富集文库,hmj1,hmj2,hmj3,hmj4,hmj5与hmj6分别为6条核酸适体。
图6为通过流式细胞术考察测序分析得到的6条核酸适体hmj1,hmj2,hmj3,hmj4,hmj5与hmj6针对表达epcam蛋白的肿瘤细胞系sw480的结合能力。在图6中,横坐标为荧光强度。0th为dna初始文库,8th为第8轮dna富集文库,hmj1,hmj2,hmj3,hmj4,hmj5与hmj6分别为6条核酸适体。
图7为通过流式细胞仪测定所得核酸适体hmj2对表达epcam蛋白的肿瘤细胞系sw480的解离常数。在图7中,横坐标为dna浓度(nmol/l),纵坐标为归一化平均荧光强度。
图8为通过流式细胞术考察截短优化得到的核酸适体hmj2c针对epcam蛋白的结合能力。在图8中,横坐标为荧光强度,纵坐标为微球数。曲线a为dna初始文库,曲线b为hmj2核酸适体,曲线c为hmj2c核酸适体。
图9为通过流式细胞术考察截短优化得到的核酸适体hmj2c针对ni琼脂糖微球的结合能力。在图9中,横坐标为荧光强度,纵坐标为微球数。曲线a为dna初始文库,曲线b为hmj2核酸适体,曲线c为hmj2c核酸适体。
图10为通过流式细胞术考察截短优化得到的核酸适体hmj2c与表达epcam蛋白的肿瘤细胞系sw480、mcf-7、katoiii,以及不表达epcam蛋白的肿瘤细胞系k562、ccrf-cem,还有人的血细胞的结合能力。在图10中,横坐标为荧光强度,纵坐标为细胞数。曲线a为随机dna序列,曲线b为hmj2c核酸适体。
图11为通过流式细胞术测定截短优化得到的核酸适体hmj2c对表达epcam蛋白的肿瘤细胞系sw480的解离常数。在图11中,横坐标为dna浓度(nmol/l),纵坐标为归一化平均荧光强度。
图12为通过流式细胞术考察截短优化得到的核酸适体hmj2c与表达epcam蛋白的肿瘤细胞系sw480在不同人血浆中的结合能力。在图12中,横坐标为荧光强度,纵坐标为细胞数。曲线a为随机dna序列,曲线b为hmj2c核酸适体。
具体实施方式
下面通过实施例具体说明本发明的内容:
实施例1人血浆中筛选上皮细胞粘附分子epcam的核酸适体
1)化学合成一个80个碱基的dna初始文库,如seqidno.8所示,dna初始文库的两端为固定序列,其中包括中间为40个碱基的随机序列,即为5'-agcgtcgaataccactacag-40nt-ctaatggagctcgtggtcag-3',库容量为1015以上。取5nmoldna初始文库溶于结合缓冲液(12mmol/lpbs,ph7.4,150mmol/lnacl,5mmol/lkcl,0.55mmol/lmgcl2)中,进行变性处理:95℃10min,冰上5min,然后室温下放置10min;
2)在人血浆的环境中,将处理好的dna初始文库与ni琼脂糖微球于37℃下进行孵育,进行反筛,收集未与ni琼脂糖微球结合的液体;其中,人血浆的制备方法为,将健康人全血在4℃下离心15min,转速为1500rpm,取上清淡黄色液体,即为人血浆;
3)真核表达融合蛋白his-epcam,通过his与ni的亲和相互作用,将epcam蛋白固定在ni琼脂糖微球上,得到epcam蛋白琼脂糖微球epcambeads;再在人血浆的环境中,将步骤2)得到的未与ni琼脂糖微球结合的液体与epcam蛋白琼脂糖微球一起于37℃下孵育40min;
4)去掉未与epcam蛋白琼脂糖微球结合的dna序列,使用结合缓冲液洗涤孵育后的epcam蛋白琼脂糖微球,再将结合了dna的epcam蛋白琼脂糖微球做pcr扩增反应(94℃预变性3min,94℃30s,53℃30s,72℃30s,扩增10个循环,最后72℃延伸5min,正向引物如seqidno.9所示:5'-fam-agcgtcgaataccactacag-3';反向引物如seqidno.10所示:5'-biotin-ctgaccacgagctccattag-3';)
5)pcr扩增反应结束后,产物为3’端带有生物素标记,5’端带有fam标记的双链dna,加入链酶亲和素琼脂糖微球,室温反应30min,然后用0.1mol/lnaoh进行碱变性单链化,经nap-5column脱盐过滤,纯化,即得到用于下一轮筛选的单链dna文库,即次一级单链dna文库;
6)使用200pmol的次一级单链dna文库,重复进行步骤2)~5)的筛选,并在筛选过程中逐步降低文库以及epcam蛋白琼脂糖微球的投入量,并且逐步增加ni琼脂糖微球的投入量以及洗涤次数以增强筛选强度。根据需要,也可以从第三轮开始方引入反筛,即前两轮将步骤1)处理好的dna初始文库在人血浆的环境中,与epcam蛋白琼脂糖微球一起于37℃下孵育40min,随后继续进行步骤4)。这样,在筛选进化过程中,淘汰在人血浆的复杂生理环境中亲和力差的序列,富集能在人血浆的复杂生理环境中具有高特异性、高亲和力且稳定性好的序列,得到富集文库。本实施例之中,共进行10轮筛选,而后通过流式细胞术监测核酸适体筛选富集进程,结果如图1和图2所示,显示从第8轮开始,富集文库与epcam蛋白有比较明显的结合,而与ni琼脂糖微球没有结合,最后对第8轮筛选得到的单链dna富集文库进行测序表征,得到与上皮细胞粘附分子epcam特异结合的核酸适体序列,即如seqidno.1至seqidno.6所示的hmj1,hmj2,hmj3,hmj4,hmj5与hmj6。
实施例2通过流式细胞术考察单链dna富集文库与epcam蛋白的结合能力
首先分别pcr扩增带荧光标记的第0,4,6,8,9,10轮dna富集文库,使用正向引物(seqidno.9):5'-fam-agcgtcgaataccactacag-3'与反向引物(seqidno.10):5'-biotin-ctgaccacgagctccattag-3',94℃预变性3min,94℃30s,53℃30s,72℃30s,扩增10个循环,最后72℃延伸5min;pcr产物为5’端带有fam并且3’端带有生物素的双链dna,加入链酶亲和素琼脂糖微球,室温反应30min,然后用0.1mol/lnaoh进行碱变性单链化,经nap-5column脱盐过滤,纯化,即得到第0,4,6,8,9,10轮单链dna富集文库;
用100μl人血浆配置浓度为200nmol/l的第0,4,6,8,9,10轮单链dna富集文库溶液,分别加入约105个epcam蛋白琼脂糖微球,37℃下孵育40min,去掉未与epcam蛋白琼脂糖微球结合的单链dna,使用结合缓冲液洗涤微球2次,然后把epcam蛋白琼脂糖微球结合重悬在100μl结合缓冲液中。使用bd公司的facsverse流式细胞仪对epcam蛋白琼脂糖微球进行荧光测定。
结果如图1至图2所示,其中图1是人血浆中第0,4,6,8,9,10轮dna富集文库与epcam蛋白琼脂糖微球结合情况(第0轮文库为dna初始文库),图2是人血浆中第0,4,6,8,9,10轮dna富集文库与ni琼脂糖微球结合情况(ni琼脂糖微球为对照筛选靶标)。结果表明第0,4,6,8,9,10轮dna富集文库与epcam蛋白琼脂糖微球有结合,而ni琼脂糖微球没有结合,说明筛选文库有富集,且富集的第8,9,10轮dna富集文库对epcam蛋白具有高亲和力。
实施例3通过流式细胞术测定所得第8轮单链dna富集文库与epcam蛋白的解离常数
首先pcr扩增带荧光标记的第8轮dna富集文库,使用正向引物5'-fam-agcgtcgaataccactacag-3'(seqidno.9):与反向引物(seqidno.10):5'-biotin-ctgaccacgagctccattag-3',pcr产物为5’端带有fam并且3’端带有生物素的双链dna,加入链酶亲和素琼脂糖微球,室温反应30min,然后用0.1mol/lnaoh进行碱变性单链化,经nap-5column脱盐过滤,纯化,即得到第8轮单链dna富集文库;
使用0,5,10,50,75,100nmol/l浓度梯度的第8轮单链dna富集文库与epcam蛋白琼脂糖微球来测定解离常数(kd)。用100μl人血浆配置上述各浓度的第8轮单链dna富集文库溶液,加入约105个epcam蛋白琼脂糖微球,37℃下孵育40min,去掉未与epcam蛋白琼脂糖微球结合的单链dna,使用结合缓冲液洗涤微球2次,而后把epcam蛋白琼脂糖微球重悬在100μl结合缓冲液中。使用bd公司的facsverse流式细胞仪对epcam蛋白琼脂糖微球进行荧光测定,而后用sigmaplot软件作图,计算出所得核酸适体的解离常数。
结果如图3所示,第8轮dna富集文库对epcam蛋白琼脂糖微球的解离常数为kd=63.7±25.9nm,结果表明富集的第8轮dna富集文库对epcam蛋白具有高亲和力,因此可以用于后续测序分析。
实施例4通过流式细胞术考察测序核酸适体与epcam蛋白以及表达epcam蛋白的肿瘤细胞系的结合能力
对第8轮筛选得到的dna富集文库进行测序表征,得到如seqidno.1至seqidno.6所示的hmj1,hmj2,hmj3,hmj4,hmj5与hmj6。继续考察6条序列与epcam蛋白以及表达epcam蛋白的肿瘤细胞系的结合能力。
首先将合成好的带荧光标记的核酸适体,即如seqidno.1至seqidno.6所示的hmj1,hmj2,hmj3,hmj4,hmj5与hmj6,用100μl人血浆配置浓度为200nmol/l的核酸适体溶液,加入约105个epcam蛋白琼脂糖微球或者表达epcam蛋白的肿瘤细胞,37℃下孵育40min,去掉未与epcam蛋白琼脂糖微球或者肿瘤细胞结合的单链dna,使用结合缓冲液洗涤微球或者肿瘤细胞2次,而后把epcam蛋白琼脂糖微球或者肿瘤细胞结合重悬在100μl结合缓冲液中。使用bd公司的facsverse流式细胞仪对epcam蛋白琼脂糖微球或者肿瘤细胞进行荧光测定。
结果如图4至图6所示,其中图4是6条核酸适体与epcam蛋白琼脂糖微球在人血浆中的结合情况,图5是6条核酸适体与ni琼脂糖微球在人血浆中的结合情况,图6是6条核酸适体与表达epcam蛋白的肿瘤细胞系sw480在人血浆中的结合情况,结果表明6条核酸适体均与epcam蛋白琼脂糖微球以及表达epcam蛋白的肿瘤细胞系sw480结合,而不与阴性对照ni琼脂糖微球结合。至此结果表明经过8轮富集,获得6条与epcam蛋白结合力及特异性良好的核酸适体,且即如seqidno.2所示的hmj2核酸适体与epcam蛋白的结合力较其他五条核酸适体要好,所以选择hmj2核酸适体进行下一步的表征分析。
实施例5通过流式细胞术测定hmj2核酸适体与表达epcam蛋白的肿瘤细胞sw480的解离常数
首先将合成好的带荧光标记的核酸适体,即如seqidno.2所示的hmj2,用100μl人血浆配置浓度为0,3,7.5,10,20,30,40,50,75,100,150,200,300nmol/l等浓度梯度的核酸适体溶液,再加入约105个表达epcam蛋白的肿瘤细胞sw480,37℃下孵育40min,去掉未与肿瘤细胞sw480的单链dna,使用结合缓冲液洗涤肿瘤细胞2次,而后把肿瘤细胞重悬在100μl结合缓冲液中。使用bd公司的facsverse流式细胞仪对肿瘤细胞进行荧光测定,并计算出所得核酸适体的解离常数。
结果如图7所示,为如seqidno.2所示的hmj2对表达epcam蛋白的肿瘤细胞系sw480的解离常数,为kd=29.8±6.2nm,结果表明hmj2核酸适体对肿瘤细胞系表达的epcam蛋白具有高亲和力,因此hmj2核酸适体可以用于后续截断优化分析。
实施例6
综上所述,最终选择hmj2核酸适体进行后续截短优化以及实验。具体操作是:先利用nupack对hmj2核酸适体进行二级结构的模拟,对其碱基组成和空间结构进行分析,在保证hmj2核酸适体原有的亲和力和选择性基本不变的前提下,去除不必要的碱基,主要去除序列两端的引物,得到最优核酸适体,如seqidno.7所示的hmj2c。接下来就是考察最优核酸适体hmj2c与epcam蛋白以及表达epcam蛋白的肿瘤细胞系的结合能力、特异性以及亲和力。具体操作与实施例4、5类似。
结果如图8至图12所示,其中图8是hmj2c核酸适体与epcam蛋白琼脂糖微球在人血浆中的结合情况,图9是hmj2c核酸适体与ni琼脂糖微球在人血浆中的结合情况,图10是hmj2c核酸适体与表达epcam蛋白的肿瘤细胞系sw480、mcf-7、katoiii,以及不表达epcam蛋白的肿瘤细胞系k562、ccrf-cem,还有人的血细胞在人血浆中的结合情况。图11是hmj2c核酸适体对表达epcam蛋白的肿瘤细胞系sw480的解离常数。图12是hmj2c核酸适体与表达epcam蛋白的肿瘤细胞系sw480在不同人血浆中的结合情况。结果表明hmj2c核酸适体与epcam蛋白琼脂糖微球以及表达epcam蛋白的肿瘤细胞系sw480、mcf-7、katoiii结合,而不与阴性对照ni琼脂糖微球以及不表达epcam蛋白的肿瘤细胞系k562、ccrf-cem,还有人的血细胞结合。至此结果表明经过hmj2截短优化后的hmj2c核酸适体,与epcam蛋白以及表达epcam蛋白的肿瘤细胞系保持良好结合能力以及特异性,且在不同的人血浆中仍表现出和靶细胞良好的结合能力;另外,hmj2c对表达epcam蛋白的肿瘤细胞系sw480的解离常数为kd=29.8±6.2nm,结果表明hmj2c核酸适体对肿瘤细胞系表达的epcam蛋白仍具有高亲和力。所以,最终获得了一条在人血浆高亲和、高特异性的epcam蛋白的核酸适配体hmj2c。
以上所述,仅为本发明较佳实施例而已,故不能依此限定本发明实施的范围,即依本发明专利范围及说明书内容所作的等效变化与修饰,皆应仍属本发明涵盖的范围内。
序列表
<110>厦门大学
<120>一种在人血浆中筛选的上皮细胞粘附分子epcam的核酸适体及其制备方法和应用
<160>10
<170>siposequencelisting1.0
<210>1
<211>80
<212>dna
<213>人工序列(artificialsequence)
<400>1
agcgtcgaataccactacagctgggggtttctggggtttttgttggggtgggtgttgtgt60
ctaatggagctcgtggtcag80
<210>2
<211>80
<212>dna
<213>人工序列(artificialsequence)
<400>2
agcgtcgaataccactacaggagctcggggtttgggggttcggggtcggttcggtttctt60
ctaatggagctcgtggtcag80
<210>3
<211>80
<212>dna
<213>人工序列(artificialsequence)
<400>3
agcgtcgaataccactacagctttcggggtcgtgtttggggtgggtcttttgggggtttg60
ctaatggagctcgtggtcag80
<210>4
<211>80
<212>dna
<213>人工序列(artificialsequence)
<400>4
agcgtcgaataccactacagtgtttgggttggttgggggtgggtttgggatttggtgttg60
ctaatggagctcgtggtcag80
<210>5
<211>79
<212>dna
<213>人工序列(artificialsequence)
<400>5
agcgtcgaataccactacagtttggctctgggggttgtggagggggtatgggtgggagtc60
taatggagctcgtggtcag79
<210>6
<211>80
<212>dna
<213>人工序列(artificialsequence)
<400>6
agcgtcgaataccactacaggtattcgagttgcttggggttggtgggtgggttcctgtct60
ctaatggagctcgtggtcag80
<210>7
<211>44
<212>dna
<213>人工序列(artificialsequence)
<400>7
tcggggtttgggggttcggggtcggttcggtttcttctaatgga44
<210>8
<211>80
<212>dna
<213>人工序列(artificialsequence)
<400>8
agcgtcgaataccactacagnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnn60
ctaatggagctcgtggtcag80
<210>9
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>9
agcgtcgaataccactacag20
<210>10
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>10
ctgaccacgagctccattag20
- 还没有人留言评论。精彩留言会获得点赞!