一种近玫色锁掷酵母菌株及其在生产乳糖酶中的应用的制作方法
本发明涉及微生物领域,尤其是涉及一种近玫色锁掷酵母菌株及其在生产乳糖酶中的应用。
背景技术:
乳糖酶又称β-半乳糖苷酶,或称β-D-半乳糖苷半乳糖水解酶,是哺乳动物小肠黏膜微绒毛膜表面上存在的一种双糖酶。乳汁中的乳糖经乳糖酶水解,产物葡萄糖是人体各部分代谢的能量来源,半乳糖则是人大脑和黏膜组织代谢所必须的结构糖,是婴儿大脑发育的必要物质。当乳糖酶缺乏,乳糖不能被分解吸收,则会造成乳糖不耐受症及乳糖吸收不良。即乳糖酶缺乏症。
因乳糖酶对生物体具有特殊重要性及催化活性,其具有广阔的应用前景。食品工业利用乳糖酶制成低糖乳制品,有效解决乳糖不耐受的问题;还可用于果蔬的催熟软化;乳糖酶还可用于医药领域作为消化类药物治疗婴儿消化不良症,调节肠道正常菌群等。
来源于微生物的乳糖酶目前已被广泛研究及并应用到实践生产,美国等国家已把一些曲霉菌及酵母菌产生的乳糖酶正式用于食品添加剂。在国内也有诸多单一的乳糖酶制品,用于治疗乳糖不耐受等问题。利用微生物生产乳糖酶,合适的发酵培养条件是提高乳糖酶产量的关键。酶的产生和活性受到不同参数的影响,如菌株类型、培养条件(温度、pH、接种量、培养时间)、无机盐离子以及培养基中碳源和氮源的比例等。在本试验中,通过定性试验发现试验菌株具有乳糖酶酶活力,故通过优化培养条件,来提高乳糖酶产量,以便用于工业化生产。
技术实现要素:
基于此,本发明的一个目的在于,提供一种新的近玫色锁掷酵母类真菌,其属于近玫色锁掷酵母属。
本发明采用的技术方案如下:
一种近玫色锁掷酵母菌株,保藏于中国典型培养物保藏中心,保藏编号为CCTCC NO:M2019119。
本发明所述的近玫色锁掷酵母菌株具有生长繁殖速度快和所产乳糖酶酶活力高的特点,具备高效分解乳糖的能力。
本发明的另一个目的在于提供所述的近玫色锁掷酵母菌株在乳糖酶生产中的应用。
进一步地,所述的近玫色锁掷酵母菌株的培养方法包括以下步骤:
S1接种:所述近玫色锁掷酵母菌株以1.0×105~7.0×106个/ml接种浓度、0.5%~5%接种量接种于培养基中;
S2培养:将接种有所述近玫色锁掷酵母菌株的培养基,于28℃,恒温培养12~72小时。
进一步地,所述培养基包括以下重量份的原料:胰蛋白胨20份、酵母粉15份、葡萄糖20份、无菌水1000份。
进一步地,步骤S1中的接种浓度为6.55×106。
进一步地,步骤S1中的接种量为4%。
进一步地,步骤S2中的培养时长为54小时。
进一步地,步骤S2中,于28℃培养时,以180rpm速度摇动。
进一步地,所述乳糖酶的生产包括以下步骤:
S1接种:所述近玫色锁掷酵母菌株以~6.55×106接种浓度、0.5%~5%接种量接种于培养基中;
S2培养:将接种有所述近玫色锁掷酵母菌株的培养基,于28℃,恒温培养12~72小时;
S3离心:培养结束后,离心去除沉淀,留取上清液。所述上清液为含有本发明所述的近玫色锁掷酵母菌株所产乳糖酶的液体。
相对于现有技术,本发明所述近玫色锁掷酵母菌株在生产乳糖酶的过程中,具有更加宽泛的pH适应范围和温度适应范围,有利于适应工业操作。
为了更好地理解和实施,下面结合附图详细说明本发明。
附图说明
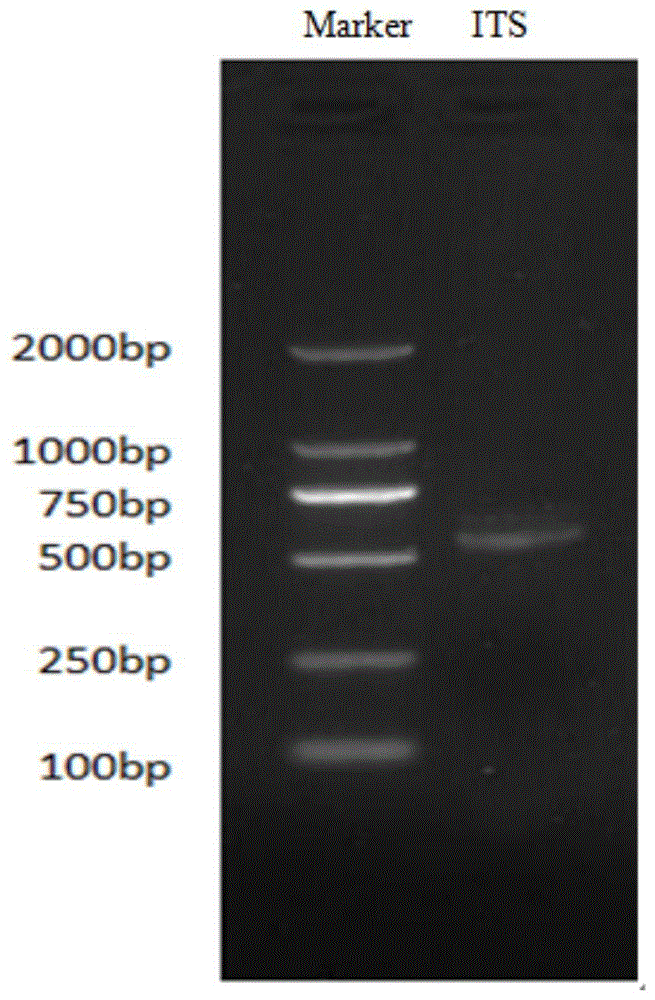
图1为本发明所述的近玫色锁掷酵母菌株ITS序列的PCR扩增核酸电泳图;
图2为基于本发明所述的近玫色锁掷酵母菌株与相似菌种的ITS序列条形码构建的进化树;
图3为本发明所述的近玫色锁掷酵母菌株与近玫色锁掷酵母属菌株Sporidioboluspararoseus strain AUMC 7791(JQ425362.1)的ITS序列比对图;
图4为不同时长培养本发明所述的近玫色锁掷酵母菌株与所得乳糖酶的酶活关系图;
图5为不同接种量培养本发明所述的近玫色锁掷酵母菌株与所得乳糖酶的酶活关系图;
图6为不同温度培养本发明所述的近玫色锁掷酵母菌株与所得乳糖酶的酶活关系图;
图7为不同碳源培养本发明所述的近玫色锁掷酵母菌株与所得乳糖酶的酶活关系图;
图8为不同氮源培养本发明所述的近玫色锁掷酵母菌株与所得乳糖酶的酶活关系图;
图9为不同pH培养本发明所述的近玫色锁掷酵母菌株与所得乳糖酶的酶活关系图;
图10为本发明所述的近玫色锁掷酵母菌株培养48h的形态图染色图谱;
图11为本发明所述的近玫色锁掷酵母菌株染色图谱。
具体实施方式
本发明所述的近玫色锁掷酵母菌株,命名为XWSP1,于2019年3月19日保藏于中国典型培养物保藏中心(地址:中国湖北省武汉市武汉大学校内中国典型培养物保藏中心),保藏编号为CCTCC NO:M2019119。
实施例一:分离纯化方法
本发明所述的近玫色锁掷酵母菌株的分离纯化方法,步骤如下:
S1:称取10g的土壤样品,所述土壤样品来自广州徐闻农垦丰收农场;然后,于超净工作台中,向土壤样品中添加90ml无菌水,置于振荡器上振荡60min,使土样均匀地分散在稀释液中成为土壤悬液;待土壤分散后,吸取100ul土壤悬液到900ul无菌水中得到10倍稀释液,然后依次稀释10倍,得到100倍和1000倍稀释液,整个过程在超净工作台中进行。
S2:取100ul的10倍稀释液、100倍稀释液和1000倍稀释液分别涂布于三个PDA固体培养板,然后将培养板置于培养箱28℃恒温培养2~3天,培养板上长出菌斑。
S3:培养结束后,根据菌落生长情况从适当稀释梯度平板一一挑取形状、颜色、大小等不同的单菌斑进行平板划线,分离出本发明所述的近玫色锁掷酵母菌株。本发明所述的近玫色锁掷酵母菌株于PDA固体培养基上培养48h的形态特征为:菌落表面油状、呈浅红色、且向上突起(如附图10所示);本发明所述的近玫色锁掷酵母菌株经草酸铵结晶紫染色后单菌落呈紫色椭圆形(如附图11所示)。
S4:从PDA平板上挑取已纯化培养的菌株,接种于内含200ml YPD液体培养基的500ml锥形瓶中,在28℃,180rpm恒温摇床培养条件下培养72h,制得种子液;
所述PDA固体培养基配方为:马铃薯200份、葡萄糖20份、琼脂12份、MgSO4 3份、KH2PO41.5份、无菌水1000份;配制方法为:准确称取200份马铃薯,切成小块,放入自来水中煮沸20min,经冷却后用400目纱布过滤获得马铃薯汁,再准确添加各组分,最后用自来水定容,分装至锥形瓶,置于灭菌锅内121℃、101KPa高压蒸汽灭菌20min,待灭菌锅温度降至70℃以下,压力恢复至0KPa时取出,于超净台上倒入培养皿中,每个培养皿约倒入10ml培养基,冷却凝固后,将固体培养板于4℃保存。
所述YPD液体培养基配方为:胰蛋白胨20份、酵母粉15份、葡萄糖20份、无菌水1000份。分装至锥形瓶,置于灭菌锅内121℃、101KPa高压蒸汽灭菌20min,待灭菌锅温度降至70℃以下,压力恢复至0KPa时取出,保存备用。
实施例二:培养方法
S1接种:将实施例一所得的种子液以106接种浓度、2%接种量接种于内含300ml PDA液体培养基的1000ml锥形瓶中;
S2培养:将接种有所述近玫色锁掷酵母菌株的培养基,于28℃,180rpm恒温摇床条件下培养72h,制得本发明所述的近玫色锁掷酵母菌菌液。
由于本发明所述的近玫色锁掷酵母菌在生长过程中,能够分泌乳糖酶到细胞外部,即分泌乳糖酶到培养液中。因此,S2中所得的近玫色锁掷酵母菌菌液离心沉淀掉菌体,留取的上清液即为含有乳糖酶的液体,简称粗酶液。可见,对本发明所述近玫色锁掷酵母菌菌液的培养方法,加上离心留上清操作,即为利用本发明所述近玫色锁掷酵母菌生产乳糖酶的方法。
所述YPD液体培养基配方为:胰蛋白胨20份、酵母粉15份、葡萄糖20份、无菌水1000份。分装至锥形瓶,置于灭菌锅内121℃、101KPa高压蒸汽灭菌20min,待灭菌锅温度降至70℃以下,压力恢复至0KPa时取出,保存备用。
实施例三:PCR扩增ITS序列并测序
S1:取基因组DNA
首先,取实施例一中所述的种子液200ml于无菌的2ml离心管中,12000rpm离心2min,弃上清保留沉淀;然后,用2%CTAB缓冲液重悬沉淀,并加入20ul蛋白酶K(20mg/ml),置于振荡器上振荡20~30s,55℃水浴4h以上或过夜(间隔半小时振荡一次);接着,将经蛋白酶K消化后的抽提液从水浴锅中取出,室温下冷却,加入600ul氯仿,振荡混匀后12000rpm离心10min,获得上清液;接下来,将上清液倒入新的1.5ml离心管中,加入300ul室温保存的100%异戊醇溶液混匀,上下颠倒混匀后置于4℃冰箱保存一个小时以上,12000rpm离心10min,弃上清,获得DNA沉淀;最后,DNA沉淀用70%乙醇300ul洗涤1~2次,然后将离心管倒置,让其自然晾干,用30ul~50ul ddH2O溶解DNA沉淀,得到基因组DNA,4℃冰箱中保存过夜后,-20℃保存备用。
S2:PCR扩增ITS序列
以步骤S1所得基因组DNA为模板,ITS1和ITS4为引物进行PCR扩增,PCR反应体系(50ul)如下:
PCR反应程序为:94℃预变性5min;94℃变性30s、55℃复性30s、72℃延伸1min,变性、复性和延伸的过程反复循环30次;72℃再延伸10min,4℃保存PCR扩增产物。
所述上游引物ITS1的序列为:TCCGTAGGTGAACCTGCGG
所述下游引物ITS4的序列为:TCCTCCGCTTATTGATATGC
S3:PCR产物进行核酸电泳
取5ul步骤S2所得的PCR产物点样后于120V电压下进行核酸电泳30min。电泳结果如附图1所示,以本发明所述的近玫色锁掷酵母菌株的基因组DNA为模板扩增出的ITS片段条带单一且亮度高,且ITS序列长度约为600bp。
S4:ITS序列进行测序
步骤S2所得的PCR产物经纯化回收后,取30ul纯化产物送广州擎科生物技术有限公司进行序列双向测通测定,测序结果显示本发明所述近玫色锁掷酵母菌株的ITS序列长度为610bp,具体序列如下所示:
实施例四:构建系统进化树
将实施例三所得的本发明所述近玫色锁掷酵母菌株的ITS序列输入NCBI中,进行BLAST比对,并基于条形码ITS区段序列构建NJ系统进化树。如附图2所示,根据系统进化树本发明所得的菌株,与近玫色锁掷酵母属菌株的ITS条形码数据库中大部分序列高度相似但不存在完全重合,也没有唯一邻近的物种序列。因此可知,本发明所得的菌株在分类上属于近玫色锁掷酵母属(Sporidioboluspararoseus),且为一个新种。
实施例五:近源物种比对
将实施例三所得的本发明所述近玫色锁掷酵母菌株的ITS序列输入NCBI中,与近玫色锁掷酵母属菌株Sporidioboluspararoseusstrain AUMC 7791(JQ425362.1)的ITS序列进行比对,比对结果如附图3所示,本发明所述近玫色锁掷酵母菌株的ITS序列与Sporidioboluspararoseusstrain AUMC 7791的ITS序列同源性很高达到99%但并不完全相同,两者之间存在12个碱基的差异。进一步看出,本发明所得的菌株在分类上属于近玫色锁掷酵母属Sporidioboluspararoseus,且为近玫色锁掷酵母属的一个新的菌种,暂时命名为XWSP1。
实施例六:生产乳糖酶的方法
S1接种:将实施例一所得的种子液以106接种浓度、2%接种量接种于内含300ml PDA液体培养基的1000ml锥形瓶中;
S2培养:将接种有所述近玫色锁掷酵母菌的培养基,于28℃,180rpm恒温摇床条件下培养72h,制得本发明所述的近玫色锁掷酵母菌菌液。
S3离心:培养结束后,离心去除沉淀,留取上清液。
所述上清液即为含有本发明所述的近玫色锁掷酵母菌株所产的乳糖酶的液体,简称粗酶液。
其中,所述YPD液体培养基的配方和配制方式见实施例一。
实施例七:筛选产最佳酶活状态纤维素酶的菌株培养条件
(1)筛选最优培养时长
S1:取实施例一所得的菌株种子液以6.55×106接种浓度,以2%接种量接种于内含300mlYPD液体培养基的1000ml锥形瓶中,,在28℃,180rpm摇床条件下恒温振荡培养,分别于6h、12h、18h、24h、30h、36h、42h、48h、54h、60h、66h、72h吸取10ml菌液,置于4℃冰箱保存;
S2:从4℃冰箱中取出各时间段的菌液,12000rpm离心2min获得粗酶液,采用吉斯特-布洛卡兹法以邻硝基苯基-β-D-吡喃半乳糖苷(ONPG)为底物,检测不同培养时间所得的粗酶液的乳糖酶酶活。
S3:吉斯特-布洛卡兹法具体步骤如下:
a.ONPG底物溶液(2.5g/L)配制:将250.0mg邻硝基苯基-β-D-吡喃半乳糖苷(ONPG)溶解在约80mL反应缓冲液中,接着转移到100mL的容量瓶中,用反应缓冲液定容,摇匀,最早在用前2h制备。
b.碳酸钠终止溶液配制:将50g碳酸钠(Na2CO3)和37.2gEDTA二钠溶解在大约900mL的水中,定容至1000mL。
c.邻硝基苯酚标准储备液配制:称取139.0mg的邻硝基苯酚,用10mL 96%的乙醇溶解后,转移至1000mL的容量瓶中,用水定容并摇匀。
d.取0.5ml粗酶液及2ml ONPG底物溶液分别于37℃条件下预热10min。
e.将0.5ml粗酶液加入加入到以预热完毕的ONPG底物溶液中,混匀,37℃水浴30min。
f.水浴完毕后,取出,向其中加入0.5ml1mol/L碳酸钠溶液(已预冷)终止反应,紫外可见分光光度计420nm处测定吸光度值。得到吸光度值根据邻硝基苯酚(ONP)标准曲线得到对应的邻硝基苯酚(ONP)浓度,从而计算出乳糖酶的酶活力。
g.一个乳糖酶酶活力单位(U)定义为:标准条件下,每分钟催化生成1umol邻硝基苯酚(ONP)所需的酶量定义为一个乳糖酶酶活力单位(U)(Ghosh et al.2012)。
h.酶活力计算公式:
U/mL=(V1.N.c)/(V2.t)
注:c:根据标准曲线计算出的ONPG浓度(mmol/L);N:为粗酶液稀释倍数;
V1:反应总体积(ml);V2:粗酶液体积(ml);t:反应时间(min)
检测结果如附图4所示,本发明所述的近玫色锁掷酵母菌株具有明显的产乳糖酶能力,且其产酶能力与菌株的培养时间呈正相关,随着培养时间的增加,其所产乳糖酶的酶活明显提高。当培养时间为54h时,酶活达到峰值,为19U/L。故培养时间54h为是本发明所述的近玫色锁掷酵母菌株酶解乳糖能力最佳的培养时间。
(2)筛选最优接种量
S1:取实施例一所得的菌株种子液以6.55×106接种浓度,分别以0.5%、1%、2%、3%、4%、5%接种量接种于内含300mlYPD液体培养基的1000ml锥形瓶中,在28℃,180rpm摇床条件下恒温振荡培养54小时后,吸取10ml菌液,12000rpm离心2min获得粗酶液;
S2:采用吉斯特-布洛卡兹法以邻硝基苯基-β-D-吡喃半乳糖苷(ONPG)为底物,检测不同接种量所得的粗酶液的乳糖酶酶活。
检测结果如附图5所示,当接种量为4%时,本发明所述的近玫色锁掷酵母菌株生产的纤维素酶的酶活最高,达到50U/L;当接种量小于4%时,乳糖酶酶活明显降低;当接种量大于4%时,乳糖酶酶活力有所降低。故接种量为4%是本发明所述的近玫色锁掷酵母菌株酶解乳糖能力最佳的接种量。
(3)筛选最优培养温度
S1:取实施例一所得的菌株种子液以6.55×106接种浓度,以4%接种量接种于内含300mlYPD液体培养基的1000ml锥形瓶中,分别在18℃、23℃、28℃、33℃、38℃,180rpm摇床条件下恒温振荡培养54小时后,吸取10ml菌液,12000rpm离心2min获得粗酶液;
S2:采用吉斯特-布洛卡兹法以邻硝基苯基-β-D-吡喃半乳糖苷(ONPG)为底物,检测不同培养温度所得的粗酶液的乳糖酶酶活。
检测结果如附图6所示,本发明所述的近玫色锁掷酵母菌株在28℃培养条件下具有最高酶活,达到50U/L。温度高于28℃后,酶活逐渐下降;温度低于28℃之前,酶活呈逐步上升的趋势。
(4)筛选最优碳源
S1:取实施例一所得的菌株种子液以6.55×106接种浓度,以4%接种量接种于内含300ml不同碳源的YPD液体培养基的1000ml锥形瓶中,在28℃、180rpm摇床条件下恒温振荡培养54小时后,吸取10ml菌液,12000rpm离心2min获得粗酶液;
S2:采用吉斯特-布洛卡兹法以邻硝基苯基-β-D-吡喃半乳糖苷(ONPG)为底物,检测不同培养温度所得的粗酶液的乳糖酶酶活。
S3:所述不同碳源的YPD培养基配方:碳源(可溶性淀粉、蔗糖、半乳糖、乳糖、葡萄糖、果糖)20份、胰蛋白胨20份、酵母粉15份、无菌水1000份。分装至锥形瓶,置于灭菌锅内121℃、101KPa高压蒸汽灭菌20min,待灭菌锅温度降至70℃以下,压力恢复至0KPa时取出,保存备用。
检测结果如附图7所示,本发明所述的近玫色锁掷酵母菌株以半乳糖为碳源时具有最高酶活,达到100U/L。与其他五种碳源相比,酶活力明显提高。
(5)筛选最优氮源
S1:取实施例一所得的菌株种子液以6.55×106接种浓度,以4%接种量接种于内含300ml不同氮源的YPD液体培养基的1000ml锥形瓶中,在28℃、180rpm摇床条件下恒温振荡培养54小时后,吸取10ml菌液,12000rpm离心2min获得粗酶液;
S2:采用吉斯特-布洛卡兹法以邻硝基苯基-β-D-吡喃半乳糖苷(ONPG)为底物,检测不同培养温度所得的粗酶液的乳糖酶酶活。
S3:所述不同氮源的YPD培养基配方:半乳糖20份、氮源(蛋白胨、蛋白胨:酵母粉=2:5、蛋白胨:酵母粉=1:1、蛋白胨:酵母粉=3:4、蛋白胨:酵母粉=5:2、酵母粉)20份、无菌水1000份。分装至锥形瓶,置于灭菌锅内121℃、101KPa高压蒸汽灭菌20min,待灭菌锅温度降至70℃以下,压力恢复至0KPa时取出,保存备用。
检测结果如附图8所示,本发明所述的近玫色锁掷酵母菌株以半乳糖为碳源时具有最高酶活,达到1986U/L。与其他五种氮源相比,酶活力明显提高。与筛选最优温度时相比,乳糖酶酶活力提高了104.5倍,可见氮源对乳糖酶的产生具有极大影响。
(6)筛选最优培养基起始pH
S1:取实施例一所得的菌株种子液以6.55×106接种浓度,以4%接种量接种于内含300ml不同pH的YPD液体培养基的1000ml锥形瓶中,在28℃、180rpm摇床条件下恒温振荡培养54小时后,吸取10ml菌液,12000rpm离心2min获得粗酶液;
S2:采用吉斯特-布洛卡兹法以邻硝基苯基-β-D-吡喃半乳糖苷(ONPG)为底物,检测不同培养温度所得的粗酶液的乳糖酶酶活。
S3:所述不同pH的YPD培养基配方:半乳糖20份、氮源(蛋白胨:酵母粉=3:4)20份、无菌水1000份,然后分别把培养基的pH调节至5、5.5、6.0、6.5、7.0、7.5、8.0,分装至锥形瓶,置于灭菌锅内121℃、101KPa高压蒸汽灭菌20min,待灭菌锅温度降至70℃以下,压力恢复至0KPa时取出,保存备用。
检测结果如附图9所示,阳性对照为源叶生物公司生产的β-半乳糖苷酶/GAL标准品,其标准酶活力为110u/mg,本实验所配置β-半乳糖苷酶溶液浓度为0.2mg/ml。由附图9可知,本发明所述的近玫色锁掷酵母菌株以半乳糖为碳源、蛋白胨:酵母粉=3:4为氮源时,培养基pH为7.0时,具有最高酶活,达到2151U/L,与阳性对照相比,差异显著。
通过实施例七对本发明菌株进行培养条件优化。培养条件优化前,本发明菌株乳糖酶酶活力仅为19U/L;培养条件优化后,本发明菌株乳糖酶酶活力高达2151U/L;优化后与优化前相比,本发明菌株乳糖酶酶活力提高了约113倍,可见培养条件对本发明菌株的乳糖酶酶活力起到很大作用。
序 列 表
<110> 华南农业大学
<120> 一种近玫色锁掷酵母菌株及其在生产乳糖酶中的应用
<160> 13
<170> PatentIn version 3.1
<210> 1
<211> 610
<212> DNA
<213> 人工序列
<220>
<223> 本发明所述的近玫色锁掷酵母菌株的ITS序列
<400> 1
ccttccgtaa gggggggacc tgcggaagga tcattattga aaacaagggt gtccaattta 60
acttggaacc caaacttctc aattctaact ttgtgcatct gtattaatgg cgagcaactt 120
cggttgtgag ccttcactta caaaacacta gtctatgaat gtaaaatttt tataacaaat 180
aaaaactttc aacaacggat ctcttggctc tcgcatcgat gaagaacgca gcgaaatgcg 240
atacgtaatg tgaattgcag aattcagtga atcatcgaat ctttgaacgc atcttgcgct 300
ctctggtatt ccggagagca tgtctgtttg agtgtcatga attcttcaac ccaatctttt 360
cttgtaatcg attggtgttt ggattctgag cgttgctggc gtttgcctag ctcgttcgta 420
atacattagc atccctaata caagtttgga ttgacttggc gtaatagact attcgctaag 480
gattcggtgg aaacatcgag ccaacttcat taaggaagct cctaatttaa aagtctacct 540
tttgattaga tctcaaatca ggcaggatta cccgctgaac ttaagcatat caataaaggc 600
cggaggaaaa 610
<210> 2
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 上游引物ITS1
<400> 2
tccgtaggtgaacctgcgg
<210> 3
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 下游引物ITS4
<400> 3
tcctccgcttattgatatgc
- 还没有人留言评论。精彩留言会获得点赞!