扩增造血干细胞的组合物、扩增方法、药物组合物和用途与流程
本发明涉及生物医药领域。具体地,本发明涉及组合物在扩增造血干细胞中的用途。
背景技术:
造血干细胞移植技术是临床上治疗白血病、淋巴瘤、再生障碍性贫血、地中海贫血等多种血液类疾病和免疫系统疾病的常用且有效治疗手段。造血干细胞通常有三个来源:骨髓、外周血和脐带血。与骨髓和外周血造血干细胞相比,脐带血造血干细胞获取方便、来源丰富、对供者无损伤无副作用,因此成为造血干细胞移植供体的一大重要来源。
目前,脐带血造血干细胞移植技术的瓶颈在于其细胞含量少,一份脐带血中所含的造血干细胞及祖细胞数量不足以快速恢复成人患者的免疫系统,造成机会性感染致死率的增高。目前暂行的策略是双份脐带血移植,即一位患者清髓后先后接受两份脐带血的移植,但这增加了供体的hla配型匹配难度,因此,亟需扩增脐带血造血干细胞的方法,以获得足量的可供移植的造血干细胞。
因此,如何在体外有效获得足量的造血干细胞成为了一大科学难题,未来若能突破这个技术瓶颈,将会书写干细胞临床应用的新篇章。
当前,限制造血干细胞临床应用的最重要的因素是hsc数量不足。解决这个难题大致有三种策略:(1)通过ipsc或esc直接分化获得具有功能的hscs;(2)通过细胞重编程获得hscs;(3)体外扩增已有的hscs。由于前面两种方法涉及到的技术难度过大,而且对临床应用造成额外的风险,导致迟迟无法进行临床研究。体外扩增造血干细胞成为了解决这一难题的重要方法。
体外扩增造血干细胞具有诸多优势,主要归纳为以下三个特点:(1)扩增的细胞同质性高,癌变风险低;(2)扩增hsc的操作时间相对较短,避免引入更多外源不利因素;(3)起始细胞是造血干/祖细胞,一般不存在致瘤风险,临床应用更加安全。
扩增hscs的研究总结起来大致可以分为两类:(1)利用基因操作手段,比如引入外源转录因子或微小rna,扩增hscs;(2)采用化学小分子扩增hscs。近些年,随着化学小分子技术的不断进步,小分子化合物已经广泛应用于干细胞研究领域。利用小分子药物扩增hscs具有很多明显的优势:低毒性、易洗脱、临床使用更加安全。但是也存在明显的不足,其中最令人担忧的就是小分子化合物作用靶点不够明确,可能会存在安全隐患,例如小分子的脱靶效应,因此临床上仍然缺乏安全有效且靶点明确的扩增造血干细胞的化学小分子组合方案。
综上,目前利用化学小分子化合物组合以体外扩增造血干细胞的技术方案仍有待研究。
技术实现要素:
本发明旨在至少在一定程度上解决现有技术中存在的技术问题。为此,本发明通过高通量筛选平台,找到一些化学小分子化合物组合,其不仅可以使造血干细胞在体外高效扩增,有效维持造血干细胞的蛋白表型和基因表达谱,而且能够提高造血干细胞的体内重建功能和重建效率,具有重大的科学研究、临床研究和应用价值。
在本发明的一个方面,本发明提出了一种用于扩增造血干细胞的组合物。根据本发明的实施例,所述组合物由jnk-in-8、雷帕霉素和y27632组成。
jnk-in-8为jnk信号通路抑制剂,通过抑制c-jun磷酸化和基因转录来实现调控jnk信号通路的作用;雷帕霉素(rapamycin)为mtor信号通路抑制剂,可用于抗衰老和抑制肿瘤生长;y27632为rock1抑制剂,可用于抗衰老,对维持干细胞的活力有明显提升作用。
发明人采用高通量筛选以便获得高效扩增造血干细胞的化合物,发现jnk-in-8、雷帕霉素和y27632这3个小分子化合物之间具有相互配合、增效的作用,可以高效扩增造血干细胞,有效维持造血干细胞的蛋白表型和基因表达谱,而且能够提高造血干细胞的体内重建功能和重建效率,具有重大的科学研究、临床研究和应用价值。
在本发明的另一方面,本发明提出了一种用于扩增造血干细胞的培养基。根据本发明的实施例,所述培养基包括:基础培养基;以及前面所述的用于扩增造血干细胞的组合物。由此,利用根据本发明实施例的培养基可以高效扩增造血干细胞,有效维持造血干细胞的蛋白表型和基因表达谱,提高造血干细胞的体内重建功能和重建效率,具有重大的科学研究、临床研究和应用价值。
根据本发明的实施例,上述培养基还可以具有下列附加技术特征:
根据本发明的实施例,所述jnk-in-8的浓度为1~5μm,所述雷帕霉素的浓度为1~20nm,所述y27632的浓度为1~20μm。根据本发明的具体实施例,jnk-in-8、雷帕霉素和y27632的浓度分别为2μm、10nm、10μm或3.5μm、15nm、7μm或1.5μm、8nm、15μm。根据本发明的具体实施例,所述jnk-in-8的浓度为1~3μm,所述雷帕霉素的浓度为6~15nm,所述y27632的浓度为5~15μm。发明人经过大量实验获得上述较优浓度,由此,均可以进一步提高扩增效率。
根据本发明的实施例,所述基础培养基选自含有flt3配体、血小板生成素(tpo)、干细胞生长因子(scf)以及低密度脂蛋白(ldl)的stemspansfem培养基。由此,向stemspansfem培养基中加入上述因子,可以进一步提高扩增效率。
根据本发明的实施例,所述flt3配体的浓度为60~100ng/ml,所述血小板生成素的浓度为20~50ng/ml,所述干细胞因子的浓度为60~100ng/ml,所述低密度脂蛋白的浓度为5~20μg/ml。根据本发明的具体实施例,flt3配体、血小板生成素、干细胞因子和低密度脂蛋白的浓度分别为100ng/ml、50ng/ml、100ng/ml、10μg/ml或者80ng/ml、30ng/ml、80ng/ml、15μg/ml或者90ng/ml、40ng/ml、90ng/ml、6μg/ml。根据本发明的具体实施例,所述flt3配体的浓度为80~100ng/ml,所述血小板生成素的浓度为40~50ng/ml,所述干细胞因子的浓度为80~100ng/ml,所述低密度脂蛋白的浓度为5~15μg/ml。发明人经过大量实验优化各组分的浓度,由此,均可以进一步提高扩增效率。
根据本发明的实施例,本发明提出了jnk-in-8、雷帕霉素和y27632在制备组合物或培养基中的用途,所述组合物或培养基用于扩增造血干细胞。
在本发明的又一方面,本发明提出了一种扩增造血干细胞的方法。根据本发明的实施例,所述方法包括:采用前面所述的组合物抑制造血干细胞的下列代谢通路:jnk信号通路、mtor信号通路和rock信号通路。发明人分别对能够抑制jnk信号通路、mtor信号通路和rock信号通路的众多小分子物质进行高通量筛选分析,发现jnk-in-8(jnk信号通路抑制剂)、雷帕霉素(mtor信号通路抑制剂)和y27632(rock信号通路抑制剂)3因子联合使用可以高效扩增造血干细胞,有效维持造血干细胞的蛋白表型和基因表达谱,而且能够提高造血干细胞的体内重建功能和重建效率,操作简便,具有广泛的应用前景。
根据本发明的实施例,所述方法包括:将cd34+细胞培养于前面所述用于扩增造血干细胞的培养基中。由此,可以进一步提高扩增效率,有效维持造血干细胞的蛋白表型和基因表达谱,而且能够提高造血干细胞的体内重建功能和重建效率,操作简便,具有广泛的应用前景。
根据本发明的实施例,所述cd34+细胞来源于骨髓、肝脏、脾脏、外周血或脐带血。
在本发明的又一方面,本发明提出了一种用于扩增造血干细胞的试剂盒。根据本发明的实施例,所述试剂盒包括:前面所述的用于扩增造血干细胞的组合物或前面所述的培养基。由此,利用根据本发明实施例的试剂盒可以高效扩增造血干细胞,有效维持造血干细胞的蛋白表型和基因表达谱,而且能够提高造血干细胞的体内重建功能和重建效率,具有重大的科学研究、临床研究和应用价值。
在本发明的又一方面,本发明提出了前面所述的组合物在制备抑制剂中的用途。根据本发明的实施例,所述抑制剂用于扩增造血干细胞,抑制造血干细胞的下列代谢通路:jnk信号通路、mtor信号通路和rock信号通路。如前所述,jnk-in-8、雷帕霉素和y27632可以有效地抑制jnk信号通路、mtor信号通路和/或rock信号通路,从而高效扩增造血干细胞,有效维持造血干细胞的蛋白表型和基因表达谱,而且能够提高造血干细胞的体内重建功能和重建效率,具有重大的科学研究、临床研究和应用价值。
在本发明的又一方面,本发明提出了一种药物组合物。根据本发明的实施例,所述药物组合物包括:前面所述的组合物或者前面所述的培养基。如前所述,根据本发明实施例的药物组合物可以高效扩增造血干细胞,直接或者间接将该组合物或者该培养基作为药物组合物给药至机体内(动物或细胞),起到扩增造血干细胞的目的,也可以将利用前面所述扩增造血干细胞的方法所获得的造血干细胞施加于机体内,其具有较好的体内重建功能和重建效率,可以广泛地用于血液系统疾病以及自身免疫疾病的治疗中,具有重大的科学研究、临床研究和应用价值。
根据本发明的实施例,本发明的药物组合物可与常规治疗方法和/或疗法相结合使用,或者可与常规治疗方法和/或疗法分开使用。当本发明的药物组合物在采用与其它药物的联合疗法中给药时,它们可序贯地或同时地给予个体。或者,本发明的药物组合物还可以包含药学上可接受的载体或药学上可接受的赋形剂以及本领域已知的其它治疗药或预防药的组合。
在本文中所使用的术语“给药”指将预定量的物质通过某种适合的方式引入病人。本发明的间充质干细胞可以通过任何常见的途径被给药,只要它可以到达预期的组织。给药的各种方式是可以预期的,包括腹膜,静脉,肌肉,皮下,皮层,口服,局部,鼻腔,肺部和直肠,但是本发明不限于这些已举例的给药方式。
在本发明的又一方面,本发明提出了一种筛选药物的方法。根据本发明的实施例,所述方法包括:将候选药物与cd34+细胞进行培养;测定培养前后细胞内jnk信号通路、mtor信号通路和rock信号通路是否被抑制和/或培养后细胞是否扩增和/或培养前后细胞内代表造血干细胞功能的表面蛋白是否一致;当培养后所述jnk信号通路、mtor信号通路和rock信号通路被抑制和/或培养后细胞扩增和/或培养前后细胞内代表造血干细胞功能的表面蛋白一致,是所述候选药物为目标药物的指示,所述目标药物为前面所述的组合物或者前面所述的培养基。如前所述,根据本发明实施例的组合物能够抑制上述三条代谢通路,从而起到扩增造血干细胞的效果。同时,在扩增后可以有效维持造血干细胞的蛋白表型和基因表达谱。因此,通过采用根据本发明实施例的筛选药物的方法,可以有效地筛选出本发明的组合物或者含有其的培养基或者药物,具有重大的科学研究、临床研究和应用价值。
需要说明的是,“培养前后细胞内代表造血干细胞功能的表面蛋白是否一致”里面所描述的“一致”应作广义理解,由于代表造血干细胞功能的表面蛋白较多,所有表面蛋白在培养前后有至少80%、85%、90%、95%、99%或100%相同均可认定为“一致”。
在本发明的又一方面,本发明提出了jnk-in-8、雷帕霉素和y27632在扩增造血干细胞中的用途。如前所述,jnk-in-8、雷帕霉素和y27632可以高效扩增造血干细胞,有效维持造血干细胞的蛋白表型和基因表达谱,而且能够提高造血干细胞的体内重建功能和重建效率,具有重大的科学研究、临床研究和应用价值。
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,为描述方便,图中3f为包含了jnk-in-8、雷帕霉素和y27632三个小分子的实验组,其中:
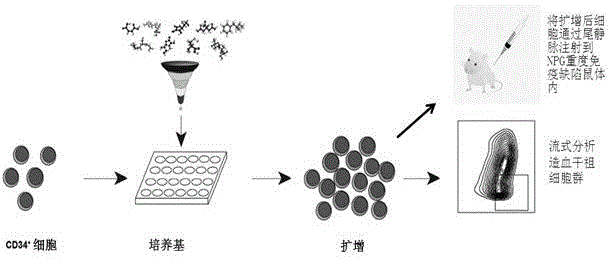
图1显示了根据本发明实施例的扩增造血干细胞的工艺流程示意图;
图2显示了根据本发明实施例的dmso组cd34+细胞培养第7天后的流式细胞分析图;
图3显示了根据本发明实施例的3f组cd34+细胞培养第7天后的流式细胞分析图;
图4显示了根据本发明实施例的cd34+细胞培养第7天后的流式细胞分析图;
图5显示了根据本发明实施例的造血干细胞在含有不同小分子化合物的培养基中培养后的细胞分析图(对照组为dmso条件,**p<0.01,****p<0.0001);
图6显示了根据本发明实施例的造血干细胞重建20周后造血干细胞扩增结果分析示意图。
具体实施方式
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1
在该实施例中,按照下列方法扩增造血干细胞:
操作流程参见图1,具体步骤如下:
1、脐带血分离cd34+细胞
1)脐带血的采集
在手术室无菌环境中采集胎儿脐带中血液,保存于加有抗凝剂的血袋,暂时存放于4℃微环境中,于24小时内送达实验室使用。
2)分离脐带血中的单核细胞
a)在无菌实验台中,将脐带血转移到提前准备好的无菌培养瓶里,按照血液:磷酸盐缓冲溶液=1.2的体积加入磷酸盐缓冲液,混匀;
b)将稀释的脐带血贴壁缓慢加入盛有15ml人淋巴分离液的50ml离心管中,注意缓慢加入,保持两液面界面清晰,不能打破血液和淋巴分离液之间的液面平衡;
c)在室温下,1500转/分钟离心20分钟;
d)离心结束后,液面分为三层,最上层是血浆/组织匀浆层,最下面是红细胞,中间层是分离液,在血浆层与分离液层之间是一层薄而致密的白膜,即单核细胞层(包括了淋巴细胞和单核细胞)。小心吸取白膜层细胞到另一个50ml离心管中;
e)用pbs等比稀释到50ml体积,颠倒混匀;
f)在室温下,以1600转/分钟离心10分钟;
g)弃上清,用pbs重悬备用。
3)磁珠分选法分离cd34+细胞
a)按照一定比例,将人cd34磁珠与脐带血中分离的单核细胞混合,吹匀,放到4℃冰箱中静置30分钟,同时将磁珠分选所需要的设备放到超净台中,用紫外光照射除菌;
b)加入10mlpbs混匀,1600转/分钟离心5分钟;
c)弃上清,用含有0.5%bsa的pbs重悬,准备过吸附柱;
d)用含有0.5%bsa的pbs润洗吸附柱,然后加入单核细胞悬液,等待其完全通过吸附柱;
e)用1ml含有0.5%bsa的pbs清洗吸附柱,重复3遍;
f)将吸附柱转移到15ml离心管中,再往吸附柱滤膜上加入1ml含有0.5%bsa的pbs,将吸附在滤膜上的携带有cd34磁珠的细胞冲洗到离心管中;
g)离心,弃上清,加入培养基重悬cd34+细胞。
4)流式分析所得单核细胞中cd34+所占比例
a)将所得携带有cd34磁珠的细胞取出一小部分到1.5ml离心管中;
b)加入相应的表面蛋白抗体,静置于4℃冰箱中;
c)30分钟后取出,加入1mlpbs;
d)1600转/分钟,离心3分钟;
e)弃上清,用200μl预冷的pbs重悬,即可用流式细胞分析仪检测分析所得细胞的表型。
2、cd34+细胞培养方法
1)用含有scf(100ng/ml)、flt-3l(100ng/ml)、tpo(50ng/ml)、ldl(10μg/ml)的stemspansfem培养基(stemcell品牌)重悬cd34+细胞,加入6孔低贴附板中,控制细胞密度为1×106颗/ml以下,
其中,实验组为在上述培养基中加入2μmjnk-in-8、10nmrapamycin、10μmy27632后培养所得的造血干细胞(简称3f组),对照组为用等体积的dmso代替实验组中的3个因子后培养所得的造血干细胞(简称dmso组),fresh组为未经过体外培养的从脐带血中新鲜分离的cd34+细胞;
2)将cd34+细胞放到37℃,5%co2的细胞培养箱中培养;
3)每2天,进行半量更换培养基,保证细胞密度为1×106颗/ml以下;
4)培养一段时间后,检测细胞表型变化,并计算细胞数量。
细胞培养第7天的流式检测图参见图2和图3。可以看出,采用jnk-in-8、rapamycin和y27632三个因子可以有效地扩增造血干细胞,获得的造血干细胞生存状态良好且代表造血干细胞功能的表面蛋白一直可以维持。相比于dmso培养基,cd34+cd45ra-cd38-cd90+细胞可以在3因子培养基中高效扩增(图4)。
实施例2
在该实施例中,研究不同小分子化合物对于造血干细胞扩增的影响,具体培养方式按照实施例1进行,区别在于培养基中加入不同类型的小分子化合物。
图5比较了培养基中加入不同因子对于造血干细胞扩增效率的影响。其中,j为jnk-in-8,y为y27632,r为rapamycin,n为nad,v为丙戊酸,jy为同时添加jnk-in-8和y27632,ru为同时添加rapamycin和um171,yr为同时添加y27632和rapamycin,yu为同时添加y27632和um171,jyr为同时添加jnk-in-8、rapamycin和y27632,jru为同时添加jnk-in-8、rapamycin和um171,yru为同时添加y27632、rapamycin和um171。
结果可以看出,相比于单独添加jnk-in-8、y27632和rapamycin或者是其他因子而言,同时添加jnk-in-8、y27632和rapamycin这3个因子,cd34+cd45ra-标记的造血干祖细胞的扩增效率最高。
将扩增7天后细胞通过尾静脉注射到npg重度免疫缺陷鼠体内移植20周,采用极限稀释法计算经过3因子培养的造血干细胞的扩增倍数,图6的左图显示3f培养条件扩增的细胞中造血干细胞的比例相比于dmso和fresh组都要高,3f条件培养7天后的细胞中,平均每486颗细胞中,就有1颗造血干细胞,而在dmso对照组中,平均4882颗细胞里面,才有1颗造血干细胞,在fresh对照组中,平均每3909颗细胞中,有一颗造血干细胞,所以据此统计数据来看,3f培养条件将fresh原代cd34+细胞中的造血干细胞数量扩增了9倍左右。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!