一种含有丁酸梭菌和乳酸片球菌的复合制剂及其制备方法和应用与流程
本发明属于水产养殖领域,具体涉及一种含有丁酸梭菌和乳酸片球菌的复合制剂及其制备方法和应用。
背景技术:
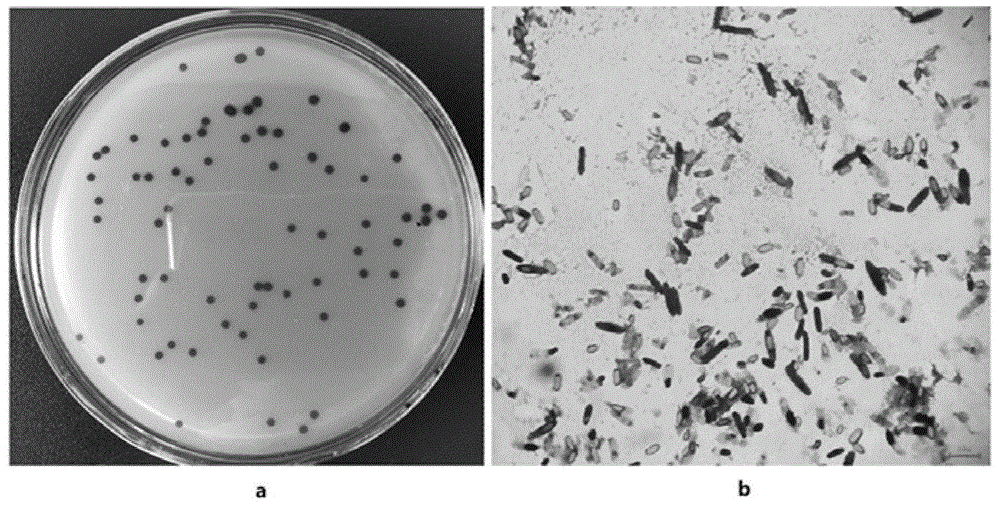
:丁酸梭菌(clostridiumbutyricum)和乳酸片球菌(pediococcusacidilactici)是环境和动物肠道常见的革兰氏阳性菌,丁酸梭菌菌体可在肠道粘附占位,抑制病原菌;乳酸片球菌繁殖代谢中可以产生乳酸片球菌素和l-乳酸等益生物质,在肠道菌群平衡调节中起到重要作用。而目前由这两种参与制备的微生物菌剂主要遇到的问题是固体产品生产成本仍偏高,限制了使用频率;而液体产品因保存不稳定,造成不能大规模应用。因此,研发一种可以高效规模化生产、在运输和保存中稳定性高的产品,对厌氧菌在水产养殖中的应用具有非常重要的意义。技术实现要素:本发明提供了一种含有丁酸梭菌和乳酸片球菌的复合制剂及其制备方法和应用,所述复合制剂通过培养条件摸索,具有很好的稳定性,便于储藏,且能够很好的提高水产动物生长性能。为实现上述发明目的,本发明通过下述技术方案予以实现:本发明提供了一种含有丁酸梭菌和乳酸片球菌的复合制剂,所述复合制剂包括菌含量为5-6×108cfu/ml的丁酸梭菌和菌含量为5.0-6.0×109cfu/ml的乳酸片球菌。进一步的,所述丁酸梭菌采用的是保藏编号为cgmccno.14499的丁酸梭菌gbw-n1。进一步的,所述复合制剂具有很好的稳定性。本发明还提供了所述的复合制剂的制备方法,所述制备方法的具体步骤如下:(1)将丁酸梭菌、乳酸片球菌分别在种子培养基中进行活化培养,得到丁酸梭菌种子液、乳酸片球菌种子液;(2)先将所述丁酸梭菌种子液接种到发酵罐中,37℃在发酵培养基中发酵4-5h后,再将所述乳酸片球菌种子液接种到发酵罐中,37℃共培养16-22h,得到所述复合制剂,灌装备用。进一步的,所述丁酸梭菌种子液的接种量为2%;所述乳酸片球菌种子液的接种量为2%。进一步的,所述发酵培养基的配方为胰蛋白胨6~12g/l、牛肉膏5~10g/l、酵母膏5~15g/l、葡萄糖20~30g/l、磷酸氢二钾2~5g/l、硫酸镁0.1~0.3g/l、乙酸钠1~3g/l、半胱氨酸盐酸盐0.5~1g/l,碳酸钙10~20g/l,ph6.8~7.0。进一步的,所述步骤(2)中发酵的条件:高纯氮气控制罐体压力为0.05mpa,转速为80-100r/min,采用氢氧化钠溶液或氨水控制发酵培养基的ph≥6.0。本发明还提供了所述的复合制剂在用于制备提高水产动物生长性能的微生物制剂中的应用。进一步的,在应用时,将所述复合制剂以20-30ml/kg饲料的用量拌服在水产动物的养殖饲料中,连续饲喂30天以上。进一步的,所述复合制剂能够增加水产动物的增重率和成活率,并降低饵料系数。进一步的,所述复合制剂能够增加水产动物肠道绒毛数量、上皮细胞密度和血清中的碱性磷酸酶含量。进一步的,所述复合制剂能够明显降低弧菌数量。进一步的,所述水产动物包括南美白对虾。与现有技术相比,本发明方法的优点和技术效果是:本发明将对动物无毒害的丁酸梭菌和乳酸片球菌通过错时接种培养的方法制得复合菌剂,发酵过程中的培养基成分和ph均是通过精心的实验设计和验证的,有利于共培养时生长较弱的丁酸梭菌的生长,使其在22h内获得较高的菌数。所述的复合制剂不仅在南美白对虾养殖中能够提高其增重率、成活率和血清中碱性磷酸酶含量,还可以降低饵料系数、起到很好的抑菌效果,且该复合制剂稳定性佳,能够长期保存,因此其兼顾了生产、保存和应用效果,解决了丁酸梭菌和乳酸片球菌在水产养殖中推广中遇到的成本和稳定性问题,另外,复合菌剂比两者单独发酵再混合缩短了50%以上的培养周期,也解决了克服了产品的染菌、胀瓶等问题。附图说明图1为丁酸梭菌gbw-n1在tsc培养基上的菌落、菌体与芽孢图。图2为丁酸梭菌和乳酸片球菌共培养12h结晶紫染色100×10倍镜检。图3为丁酸梭菌和乳酸片球菌共培养的复合制剂的产品外观。图4为复合制剂带透气盖的塑料包装外观。图5为南美白对虾养殖的循环水养殖系统。图6为南美白对虾拖便和断肠情况图。图7为南美白对虾血清中酶活检测情况。图8为南美白对虾中肠组织切片。图9为南美白对虾肠道的菌群结构。具体实施方式结合以下具体实例对本发明的技术方案作进一步详细的说明。实施例1一、丁酸梭菌gbw-n1的筛选、分离与鉴定1、丁酸梭菌gbw-n1的分离筛选与纯化将采集样品培养的菌悬液,梯度稀释后涂布于胰胨-亚硫酸盐-环丝氨酸琼脂(tsc)培养基上,多次分离纯化后得到单菌落,命名为gbw-n1,保存。所述菌株gbw-n1的在tsc固体培养基上培养24h的菌落图1所示,其菌落图如1a,圆形,黑色,表面光滑,中间略凸起,边缘不整齐;所述菌株gbw-n1在tsc液体培养基上培养48h的菌体图1b所示,菌体呈杆状,1.1-1.2μm×2.1-3.6μm,单个排列,革兰氏阳性,芽胞呈梭状,中生,胞囊膨大。2、丁酸梭菌gbw-n1的分子鉴定以所述的菌株gbw-n1的dna为模板,使用16srrna通用引物进行扩增,扩增片段进行序列测定,将得到的菌株gbw-n1的16srdna测序结果与genbank中的序列进行比对分析,结果显示,菌株gbw-n11与clostridiumbutyricum同源性最高,因此确定该菌株gbw-n1为丁酸梭菌。3、丁酸梭菌gbw-n1的菌种保藏将筛选到的菌株gbw-n1进行菌种保藏,所述丁酸梭菌gbw-n1的保藏单位:中国微生物菌种保藏管理委员会普通微生物中心(cgmcc);地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所;保藏日期:2017年08月07日;丁酸梭菌clostridiumbutyricum的保藏编号为cgmccno.14499。4、丁酸梭菌gbw-n1的菌株特性丁酸梭菌gbw-n1在ph值6~8的范围内均能生长,而最适的生长ph值为7.1-7.5;在溶氧含量1~5mg/l范围内都能正常生长,而最适的生长溶解氧浓度在2-4mg/l;能够产生尿素酶、β-葡萄糖苷酶和甘油,能够降解或分解动力-硝酸盐、西蒙式枸橼酸盐和半固体琼脂;在30~45℃温度范围内均能正常生长繁殖,而最适的生长温度在35~38℃。丁酸梭菌gbw-n1为厌氧菌,可在厌氧环境中萌发增殖,并发挥产酶、产酸、抑菌等益生功能。二、丁酸梭菌种子液的制备将丁酸梭菌gbw-n1单菌落接种于装有rcm培养基的克氏瓶中,37℃培养3d,用0.8%生理盐水将菌苔刮洗下作为种子液,后续使用。丁酸梭菌种子液的浓度为490万cfu/ml,用于后续试验。三、乳酸片球菌种子液的制备挑取培养在mrs固体培养基上的乳酸片球菌(pediococcusacidilactici)单菌落,接种于mrs液体培养基中,37℃扩大培养16h作为种子液,后续使用。乳酸片球菌种子液的浓度为23亿cfu/ml,用于后续试验。下述实施例中使用的丁酸梭菌均为丁酸梭菌gbw-n1。实施例2:丁酸梭菌和乳酸片球菌共培养摇瓶条件摸索试验1:配置220mlmrs培养基于250ml蜀牛螺口瓶中,分3组,共培养组:接种1%丁酸梭菌种子液以及1%乳酸片球菌种子液;对照组1(ck1):仅接种1%乳酸片球菌种子液;对照组2(ck2):仅接种1%丁酸梭菌种子液,三组均放37℃培养箱静置培养20~28h。结果(表1)表明,采用乳酸菌通用培养基mrs对乳酸片球菌与丁酸梭菌共培养,乳酸片球菌生长优势优于丁酸梭菌,共培养时丁酸梭菌含量小于单独培养时菌含量的0.3%,此原因在于乳酸片球菌生长较快造成了培养基ph的降低,进而使培养基ph低于丁酸梭菌的最适生长ph(4.0-9.8),最终抑制了丁酸梭菌的生长。表1试验1中不同处理组活菌含量试验2:配置220mlmrs培养基于250ml蜀牛螺口瓶中,分为共培养组1:先接种1%丁酸梭菌种子液,培养7h后接种1%乳酸片球菌种子液;共培养组2:先接种2%丁酸梭菌种子液,培养7h后接种1%乳酸片球菌种子液;对照组1(ck1):仅接种1%乳酸片球菌种子液;对照组2(ck2):仅接种1%丁酸梭菌种子液;对照组2(ck3):仅接种2%丁酸梭菌种子液;均置于37℃培养箱静置培养20h。试验2采取了分时间段接种,即先培养丁酸梭菌后培养乳酸片球菌,以及增加丁酸梭菌的接种比例的方式,但共培养后丁酸梭菌的菌含量仍然很低(表2),说明在mrs培养基共同培养丁酸梭菌和乳酸片球菌时,即使延迟7h接种乳酸片球菌,丁酸梭菌也很难增殖到较高菌含量,可能是与厌氧环境和mrs培养基营养成分有关。表2试验2中不同处理组活菌含量试验3:根据丁酸梭菌营养特点设置不同配方培养基进行单菌培养,分别配制3种培养基220ml于250ml螺口瓶中,按5%体积比分别接入丁酸梭菌种子液和乳酸片球菌种子液,置于37℃培养34h,每隔6h摇晃一下螺口瓶,使底部的碳酸钙混合均匀,维持培养基ph的稳定。三种培养基的配方为:培养基1:胰蛋白胨10g/l、牛肉膏5g/l、酵母膏5g/l、葡萄糖20g/l、磷酸二氢钾2g/l、硫酸镁1g/l、乙酸钠3g/l、碳酸氢钠1g/l、半胱氨酸盐酸盐1g/l、碳酸钙5g/l,ph7.0。培养基2:胰蛋白胨10g/l、牛肉膏3g/l、酵母膏5g/l、葡萄糖20g/l、氯化钠2g/l、硫酸铵1g/l、磷酸氢二钾4g/l、硫酸亚铁1g/l、硫酸镁0.5g/l、硫酸锰0.2g/l、碳酸氢钠1g/l、碳酸钙5g/l、半胱氨酸盐酸盐0.5g/l、吐温.800.2ml/l,ph7.0。培养基3:胰蛋白胨8g/l、牛肉膏5g/l、酵母膏5g/l、葡萄糖15g/l、磷酸氢二钾5g/l、硫酸镁0.1g/l、乙酸钠1g/l、半胱氨酸盐酸盐1g/l,碳酸钙10g/l,ph7.0。结果表明(表3),丁酸梭菌在培养基1、培养基3中培养34h后的菌量与初始菌量相比扩增了近391倍以及434倍,在培养基2中扩增10倍左右。乳酸片球菌在培养基1中菌量没有增长略有降低,在培养基2中菌量扩增6倍左右,在培养基3中扩增16倍。表3试验3中不同处理组活菌含量试验4:选择培养基1和培养基3作为共培养的培养基进行试验,分别配制两种培养基220ml于250ml螺口瓶中,对照组1(ck1):按5%接种比例接入丁酸梭菌种子液;对照组2(ck2):按5%接种比例接入乳酸片球菌种子液;共培养组:按5%接种比例接种丁酸梭菌种子液和乳酸片球菌种子液的混合液(两者比例1:1);三组均置于37℃培养34h,每隔6h摇晃一下螺口瓶,使底部的碳酸钙混合均匀,维持培养基ph稳定。结果表明(表4):丁酸梭菌纯培养更适合采用培养基1培养,菌量为0.99亿cfu/ml,乳酸片球菌纯培养更适合采用培养基3,菌量为9.9亿cfu/ml。但共培养时,丁酸梭菌和乳酸片球菌的菌量都有所降低,综合两种菌菌量情况,采用3号作为两株菌共培养的培养基。表4试验4中不同处理组活菌含量试验5:采用培养基3继续优化两者的接种量,接种量的设计见表5:表5接种量设计分组丁酸梭菌接种量乳酸片球菌接种量a组2%2%b组3%3%c组5%5%配制220ml培养基3于250ml螺口瓶中,按上述试验分组进行接种,置于37℃培养34h,每隔6h摇晃一下螺口瓶,使底部的碳酸钙混合均匀,维持培养基ph稳定。通过调整乳酸片球菌和丁酸梭菌接种体积比,结果(表6)表明,当乳酸片球菌和丁酸梭菌接种菌量接种体积比均为2%时,二者共培养的丁酸梭菌与乳酸片球菌菌量能够达到一个最高量,因此确定乳酸菌片球菌和丁酸梭菌的接种量为2%。表6试验5中不同处理组活菌含量综上所述,丁酸梭菌和乳酸片球菌摇瓶共培养时,选用的培养基配方为胰蛋白胨8g/l、牛肉膏5g/l、酵母膏5g/l、葡萄糖15g/l、磷酸氢二钾5g/l、硫酸镁0.1g/l、乙酸钠1g/l、半胱氨酸盐酸盐1g/l,碳酸钙10g/l,ph7.0;丁酸梭菌种子液和乳酸片球菌种子液的接种量为2%。实施例3:丁酸梭菌和乳酸片球菌共培养50l发酵罐摸索螺口瓶中培养过程中无法精准控制ph,且不能氮气保压,无法形成严格的厌氧环境,对丁酸梭菌有一定影响,只能初步确定共培养的发酵培养基。为了进一步优化工艺,在50l发酵罐中继续开展优化试验。试验1:将丁酸梭菌gbw-n1单菌落接种于装有rcm培养基的克氏瓶中,37℃培养3d,用0.8%生理盐水将菌苔刮洗下作为种子液;挑取乳酸片球菌单菌落,接种于mrs液体培养基中,37℃扩大培养16h作为种子液。发酵培养基的配方为胰蛋白胨8g/l、牛肉膏5g/l、酵母膏5g/l、葡萄糖15g/l、磷酸氢二钾5g/l、硫酸镁0.1g/l、乙酸钠1g/l、半胱氨酸盐酸盐1g/l,碳酸钙10g/l。发酵罐装液量30l,培养基ph调节至7.0,121℃高压灭菌30min,冷却至37℃,开始接种,先接种丁酸梭菌种子液后,8h后再接种乳酸片球菌种子液,丁酸梭菌种子液和乳酸片球菌种子液的接种量各2%,转速80r/min,充高纯氮气保压0.05mpa,过程中流加氨水控ph≥6.0,每2h测定一次发酵液ph,并进行镜检;8h后每隔2h测定还原糖含量和活菌含量,停罐标准为镜检观察到芽孢脱落率≥50%。结果(表7)表明:20h停罐后丁酸梭菌菌含量为6.3亿cfu/ml,而乳酸片球菌停罐菌含量仅为0.35亿cfu/ml,这主要是因为乳酸片球菌接种后第8h还原糖含量仅为8.36mg/ml,碳源不足以供乳酸片球菌生长,并且丁酸梭菌产孢后停控ph对其菌量产孢并没有影响。表7试验1发酵过程各参数跟踪试验2:发酵培养基为试验1的培养基去除碳酸钠,采用氢氧化钠控ph≥6.0,芽孢率为50%时停控ph,先接种丁酸梭菌,4h后接种乳酸片球菌,其他条件与上述试验1完全一致。试验结果(表8)表明,共培养丁酸梭菌菌量较高,可达7.75亿cfu/ml,但此时芽孢率仅为30%,当联合发酵16h时,丁酸梭菌的芽孢率为95%,几乎100%脱落,因此依据菌量以及芽孢状态,发酵周期可以缩短为16h。另外,乳酸片球菌最高菌量为5.95亿cfu/ml。再将最后的发酵液灌装于1l可乐瓶中,室温放置2d,发现胀瓶严重,说明发酵液稳定性较差。表8试验2发酵过程各参数跟踪试验3:培养基和培养条件同上述试验2。分两批进行共培养,一批次:先接种丁酸梭菌,4h后接种乳酸片球菌,另一批次:先接种丁酸梭菌,6h后接种乳酸片球菌。发酵结束后,两批次间丁酸梭菌以及乳酸片球菌的菌含量稍有差异,间隔4h接种菌量(丁酸梭菌为5.4亿cfu/ml,乳酸片球菌为55亿cfu/ml)均高于间隔6h菌量(丁酸梭菌为3.2亿cfu/ml,乳酸片球菌为45亿cfu/ml)。试验4:培养基同上述试验3,发酵规模提升至6吨,装液量为60%。先采用150l发酵罐分别制作丁酸梭菌和乳酸片球菌种子液,丁酸梭菌和乳酸片球菌种子液分别培养16h,均按2%接种量转接,先接种丁酸梭菌后接种乳酸片球菌,间隔时间为4h;转速100r/min,充高纯氮气保压0.05mpa,过程中流加氢氧化钠溶液控ph≥6.0,停罐标准为镜检观察到芽孢脱落率≥50%。结束发酵时,丁酸梭菌的菌含量为6.0亿cfu/ml,乳酸片球菌的菌含量为60亿cfu/ml。发酵结束得到的发酵液为土黄色(图3),之后于无尘车间自动灌装机灌装于带透气盖的塑料瓶中(图4),360天货架期内稳定性良好。综上所述,丁酸梭菌和乳酸片球菌在发酵罐中共培养时,先以2%的接种量将丁酸梭菌种子液接种到发酵罐中,37℃发酵4h后再以2%的接种量将乳酸片球菌种子液接种到发酵罐中,37℃进行共培养16~22h,发酵过程中采用氢氧化钠溶液或氨水控制ph≥6.0,高纯氮气控制罐体压力为0.05mpa,80-100r/min发酵。通过该步骤制得的复合菌剂,丁酸梭菌含量为5×108~6×108cfu/ml,其芽孢率>90%,脱落率>50%;乳酸片球菌菌含量为5.0×109~6.0×109cfu/ml,该复合菌剂具有很好的稳定性,便于储藏。实施例4:丁酸梭菌和乳酸片球菌共培养的复合制剂在南美白对虾养殖中的应用在循环水养殖系统(图5),以400尾体长为4~5cm的南美白对虾为研究对象,分成2组,每组4个重复,每个重复20尾虾,对照组饲喂饲料,试验组饲料拌服含有20ml/kg实施例3制备的复合菌剂的饲料,试验周期为30d。每天观察对虾拖便情况以及死亡情况,记录摄食量;在养殖试验结束后,测定每缸对虾总重,计算增重率、成活率、饵料系数;并通过高通量测序分析肠道微生物多样性,通过he染色切片分析中肠组织变化,取血清测定非特异性指标变化。结果表明:试验组饲料拌服20ml/kg的复合菌剂,使虾肠道更清晰、虾体更饱满,无拖便现象产生,而对照组有断肠和拖便现象(图6);试验组30天增重率比对照组提高8.2%,成活率提高13.6%,饵料系数降低0.08(表9);血清中碱性磷酸酶akp含量显著提升(图7)。he结果(图8)显示,对虾的中肠上皮细胞排列更紧密、绒毛数量增多,绒毛高度/隐窝深度值升高。高通量分析(图9)显示,随着复合菌剂的使用,弧菌在总菌群中的占比明显降低,说明该复合菌剂具有很好的抑菌效果,能够恢复并提高南美白对虾的肠道功能,肠道微生物菌群结构,降低肠炎发生概率。表9对照组与试验组生长指标差异以上实施例仅用以说明本发明的技术方案,而非对其进行限制;尽管参照前述实施例对本发明进行了详细的说明,对于本领域的普通技术人员来说,依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或替换,并不使相应技术方案的本质脱离本发明所要求保护的技术方案的精神和范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1