一种用于气体分离的分子筛及其制备和应用的制作方法
本发明涉及一种用于气体分离的RHO分子筛吸附剂及其制备方法,尤其涉及一种含阳离子交换改性的RHO分子筛吸附剂,可高效吸附空气中的氮气和氧气,属于气体分离吸附剂领域。本发明还涉及该合成方法下合成的高硅铝比RHO分子筛在气体分离方面尤其是氮氧分离和氧氩分离方面的应用。
背景技术:
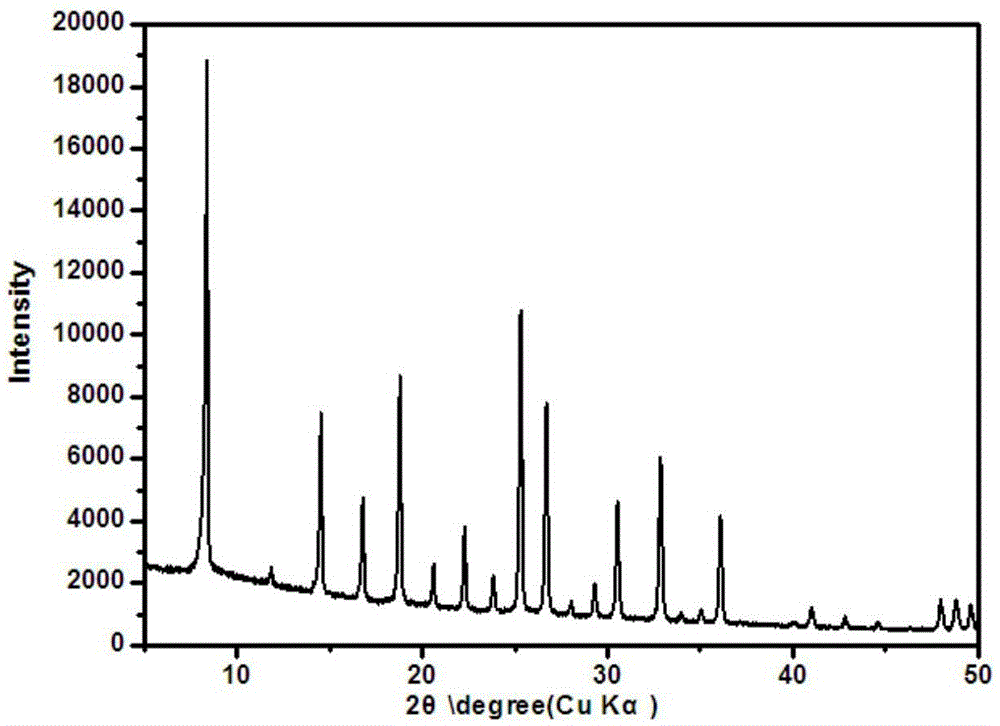
:氮气和氧气作为世界第二、第三大化工产品,广泛应用于冶炼工艺、化工工业、国防工业以及极限作业中。传统的空气分离方法是深冷分离法,此方法将空气中组分冷却到其正常沸点附近,然后通过精馏塔进行分离。该方法的优点是可以制备高纯度的O2、N2、Ar等,但是空气中组分沸点十分接近,需要大量的精馏塔板,因而其设备投资大、能耗大,只适合炼钢等大规模运用空气产品的场合。对应的沸石分子筛主要运用于小规模场合,沸石分子筛-变压吸附(PSA)联用技术因其低设备投资、低操作费用而逐渐成为小规模制氮氧制备的主流技术。沸石分子筛的基本结构是由Si原子或者Al原子为中心的正四面体通过氧桥连接而成的环结构。目前应用于空气分离较多的沸石分子筛吸附剂是Li离子交换的X型分子筛,专利US4859217提出Li离子含量在95%以上,二氧化硅与三氧化二铝的摩尔比(SAR)在2-2.5的X型分子筛对N2/O2吸附分离具有高选择性,尤其是SAR值为2,Li离子交换量为99%的LiX型分子筛,其在室温及常压条件下N2和O2的分离系数可达10.9,吸附过程和脱附过程N2吸附量的差值(负荷差)可达4.09%,且在相同Li离子交换量下,SAR值为2的LiX比SAR值为3的LiX的N2吸附容量、选择性均要高。专利US5152813报道了一种Li离子和二价阳离子二元混合交换的X型分子筛,其分子筛制造成本更低;专利US6780806报道了一种含有1%Ag离子的Li、Na离子混合交换的X型分子筛,其N2吸附量在1%Ag添加量时有显著增大。Mendes和Ferreira等人同样将Ag、Li离子混合交换的X型分子筛用于空气分离,吸附曲线和穿透测试表明该种分子筛在25℃,1bar的条件下具有良好的空气吸附分离特性,其N2/O2吸附分离因子为4.98,O2/Ar吸附分离因子为1.14(Ind.Eng.Chem.Res.2014,53,15508-15516)。然而Li离子交换的X型分子筛使用的最佳条件需要达到近于100%的Li离子交换,如此高的离子交换程度较难实现,而且Li离子成本较高,过高的交换量会提高分子筛制造成本。并且,这种X型分子筛由于SAR比较低,耐水性能较差,在使用过程中需要前置除水装置,增加了设备投资及运行成本。碳分子筛是一种兼具活性炭和分子筛某些特性的碳基新型吸附剂,其孔结构以微孔为主,孔径分布在0.3nm-1nm之间。碳分子筛对空气的吸附分离是利用N2、O2和Ar的分子直径不同(N2为O2为Ar为),因而在吸附过程中向碳分子筛内的微孔扩散时的速度不同来实现,即为速度型分离。但当达到平衡时,碳分子筛对空气吸附分离就不再具有明显的选择性。RHO分子筛是一种小孔分子筛,该种分子筛由截头八面体或α笼通过双八元环连接形成,属于体心立方晶系,主孔道由八元环构成,孔道尺寸即具有八元环孔口,较大笼仓。专利US3904738最早报道了一种具有独特晶体结构和吸附特性的小孔RHO分子筛的合成方法,其SAR值在5-7之间。专利JP2004506509同样采用上述方法合成一种Li+交换-RHO分子筛(SAR值为6),其和碳分子筛相比,不论是N2/O2的吸附选择性还是吸附区间均有明显的优势,在常温、常压下,该种Li-RHO的吸附量高达0.3mmolO2/g吸附剂。但由于这种RHO分子筛的SAR值较低,存在骨架结构易变,对温度、水汽、CO2敏感等问题,很难进行工业化应用。高SAR值的RHO分子筛由于骨架交联度较高,因而具有较高的水热稳定性,能有效解决传统沸石分子筛对温度、水汽、CO2敏感等问题。通常来说,引入大分子有机模板剂会使分子筛的硅铝比提高(J.chem.soc.,1961,971-982.)。这是由于大分子有机物相比无机离子体积更大,形成的有机-无机杂化物种总电荷密度更低,因而所需骨架负电荷即所需Al原子数量更少(分子筛内一个AlO2单元引入一个负电荷)。Chatelain等人采用冠醚作为有机模板剂,合成了SAR值为9的高硅铝比均相RHO分子筛,在高温水热条件下进行XRD测试发现,冠醚作为模板剂合成的RHO分子筛骨架结构未发生流动,而传统RHO分子筛在400-500℃之间发生相变(MicroporousMat.,1995,4,231-238.)。Palomino和Corma等人采用同样方法合成SAR值为9的RHO分子筛,但是发现合成的RHO分子筛在200-500kPaCO2分压下发生结构性相变(Chem.Comm.2012,48,215-217.)。因此,目前需要一种硅铝比更高,稳定性更好的空气分离吸附剂。技术实现要素:下面将对本发明的发明目的、实施要点、合成过程以及具体实施方式进行详细阐述:本发明的目的在于提供一种用于气体分离的高硅铝比RHO分子筛吸附剂及其制备方法,尤其涉及一种含一价阳离子交换改性的RHO分子筛吸附剂,其在氮氧分离中可优先大量吸附氮气,在氧氩分离中可优先大量吸附氧气。为实现上述目的,本发明采用冠醚作为水热体系的模板剂,通过优化分子筛合成的初始凝胶的组分,以及选择合适的合成条件,成功合成高硅铝比RHO分子筛,并进一步采用一价元素离子对所合成的RHO分子筛进行改性,得到具有高SAR值,同时优先吸附氮气和氧气的分子筛,十分适合作为气体分离的吸附剂,尤其是空气中的氮氧分离以及氧氩分离的吸附剂。1、本发明的技术方案为一种用于气体分离的分子筛,其化学组成摩尔比为X2O3:mYO2:nM2O,X为三价元素;Y:四价元素;M:一价元素或者一价阳离子;m≥5,n为大于0至小于等于2.5之间,并且X线衍射测定时,至少在下记4个晶面间距(d)内具有的特征峰;第一晶面间距(d)10.6±0.2,第二晶面间距(d)6.1±0.2,第三晶面间距(d)5.3±0.2,第四晶面间距(d)4.7±0.2。2、本发明所述的分子筛具有国际分子筛学会(IZA)认定的RHO分子筛构型。其特征通过X射线衍射测定加以确认。然而在实际测定过程中,由于测定的环境、晶体生长的方向、晶体内的元素组成、吸附的物质以及晶体的缺陷情况不同,因而实际测得的各个峰的位置以及各个峰的峰强度和IZA规定的各个峰的位置以及峰强度存在一定差别。3、X射线衍射测定光源并不限于CuKα,CoKα、MoKα、AgKα也可用作物相分析的光源。测试的原料形态可以是粉末、乳液或者固体颗粒。4、本发明所述的分子筛采用大分子有机模板剂合成,因此水热反应完成后合成的分子筛前驱体需要加热煅烧除去大分子模板剂。5、上述RHO分子筛吸附剂化学组成中四价元素Y的氧化物和三价元素X的氧化物的比值m≥5,优选m≥10,更优选m≥15。当上述四价元素Y为硅元素,三价元素X为铝元素时,得到的m=SiO2/Al2O3用SAR值表示。6、上述RHO分子筛吸附剂经由核磁共振光谱测定,-115ppm~-95ppm之间的峰面积占-120ppm~-80ppm之间的峰面积的70%以上,优选80%以上,更优选90%以上。【分子筛的合成方法】本发明提供一种具有RHO分子筛构型的气体吸附剂,可有效应用于气体尤其是氮氧吸附分离和氧氩吸附分离,合成方法为水热法,具体步骤如下:(a)在反应釜中依次加入模板剂、无机碱、去离子水,在加热搅拌使其充分溶解混合均匀后,取一定量的上层清液,加入上述分子筛组成中的三价元素、四价元素的原料,搅拌陈化后得到初始凝胶,转移到反应釜内经水热合成反应后,得到权利要求1所述的分子筛的前驱体;(b)将步骤(a)反应完成后的分子筛前驱体过滤、洗涤、干燥,然后加热活化去除分子筛前驱体中的有机物,得到焙烧基质;(c)将步骤(b)得到的焙烧基质与含有一价元素的混合液按照一定质量比混合,在一定温度下离子交换数次,每次离子交换时间为数小时;一价元素的盐溶液中含有一种或一种以上的一价元素的离子。(d)将步骤(c)得到的用金属元素离子交换后的分子筛在空气中煅烧,煅烧完成后冷却,取出后放置在干燥皿中保存。(e)根据需要,步骤(c)以及步骤(d)可重复进行数次,以达到最佳一价元素或者一价阳离子负载量。步骤(c)重复实施过程中,一价元素的种类可以不同。<分子筛合成原料>步骤(a)所述的RHO分子筛吸附剂化学组成中的Y为某种四价元素,包括但不限于Si、Ge、Sn,Ti等元素中的一种或二种以上,优选为Si,Ti,更优选Si。所述的硅源包括硅溶胶、硅凝胶、活性二氧化硅或正硅酸酯中的一种或者几种的混合物。步骤(a)所述的RHO分子筛吸附剂化学组成中的X为某种三价元素,包括但不限于B、Al、Ga等元素中的一种或二种以上,优选为Al,B,更优选Al。所述的铝源包括铝盐、活性氧化铝、烷氧基铝、假勃母石或拟薄水铝石中的一种或者几种的混合物。步骤(a)所述的RHO分子筛吸附剂化学组成中的模板剂为某种大分子环状化合物,其组成中包括但不限于O、S、Se等供电子元素,优选为O,S,更优选O。所述的大分子模板剂包括12-冠醚-4、15-冠醚-5、18-冠醚-6或24-冠醚-8中的一种或者几种的混合物。步骤(d)所述的RHO分子筛吸附剂化学组成中的M为某种阳离子,包括但不限于一价阳离子,二价阳离子,三价阳离子,优选为一价阳离子。所述的一价阳离子来源包括H、Li、Na、K、Cs、Ag等元素或者NH4+离子中的一种或二种以上的氧化物、无机盐、有机盐中的一种或者任意几种的混合物。<初始凝胶的调配>本发明步骤(a)中初始凝胶的调配过程受溶解顺序、溶解条件的影响。通常是先把模板剂溶解在水中,然后加入无机碱混合,上述过程中水/模板剂质量比范围选择0.1-10,优选1.0-5.0。混合液在室温下即存在一定程度的溶解。通常混合温度选择50℃以上,优选60℃以上;溶解的上限温度在200℃以下,优选150℃以下,更优选100℃以下。得到上述冠醚和无机碱的水溶液后,取一部分上层清液和权利要求1中的四价元素Y及三价元素X一起加入反应釜中,经搅拌陈化后得到初始凝胶。陈化时间选择12-80h,优选24-60h。陈化温度选择0-100℃,优选10-60℃。另选地,上述初始凝胶的溶解顺序为先将冠醚溶解在1/3水中,然后加入无机碱混合,混合温度优选50℃以上,100℃以下,得到上述冠醚和无机碱的水溶液后,取一部分上层清液。用剩下2/3的水溶解权利要求1中的三价元素X,然后加入得到的上层清液,搅拌30min,然后加入权利要求1中的四价元素Y,经搅拌陈化后得到初始凝胶,陈化时间优选24-60h,陈化温度优选10-60℃。<水热合成>在步骤(a)水热合成过程中,将上述初始凝胶连同反应釜一起移入耐压容器中,拧紧后在回转反应炉中用热空气加热反应,或者静置于烘箱内在一定温度下反应。水热合成的反应温度通常控制在90℃以上,优选120℃以上,更优选140℃以上;反应上限温度控制在300℃以下,优选250℃以下,更优选220℃以下。反应时间通常控制在48h以上,优选72h以上,更优选120h以上;反应时间上限通常控制在720h以下,优选240h以下,更优选144h以下。<水热合成后处理>在步骤(b)中的过滤、洗涤、干燥过程中,干燥过程温度选择60-200℃,优选80-100℃.干燥时间选择12-36h,优选12-24h。干燥后的分子筛需要加热煅烧除去分子筛内部的模板剂才具有吸附、催化性能,煅烧温度选择400-800℃,优选500-600℃。煅烧时间选择0.5-24h,优选1-24h,更优选3-10h。步骤(c)得到的焙烧基质与含有一价元素或者一价阳离子的混合液按照1:2-10的质量比混合,优选1:5-10的质量比,更优选1:8-10的质量比。一价元素或者一价阳离子的盐溶液质量浓度通常选择10%~80%,优选20%~50%。离子交换次数选择1-10次,优选4-6次,每次离子交换时间为1h。步骤(d)得到的离子交换后分子筛煅烧温度选择400-800℃,优选450-600℃。煅烧时间选择3-12h,优选5-9h。实际使用中的RHO分子筛吸附剂为原粉状态或造粒后的成型状态。【本发明的用途】本发明所述RHO分子筛可以应用于含氮气和氧气的混合气中氮气和氧气的分离。相比较传统RHO分子筛,其可以优先大量吸附氮气。另选地,所述RHO分子筛可以应用于含氧气和氩气的混合气中氧气和氩气的分离,相比较传统RHO分子筛,其可以优先大量吸附氧气。所述的RHO分子筛吸附分离气体可以在77~373K下操作,优选为273-303K。所述的RHO分子筛吸附分离气体可以在下-0.1MPa~10MPa下操作。【本发明的优点】(1)本发明中的高硅铝比RHO分子筛可以避免传统低硅铝比沸石分子筛骨架结构易变,对阳离子、温度和水合程度特别敏感的问题,因而空气进入吸附塔前不需要严格除湿,使得流程简化,投资和操作费用降低。(2)本发明中的RHO分子筛硅铝比高,用于平衡骨架电荷的Ag、Na离子用量少,而目前用于离子交换的Li、Ag的成本均较高且用量大,因而采用本发明中性能最优的Ag-RHO和Na-RHO分子筛有利于降低分子筛制造成本。(3)本发明中的高硅铝比RHO分子筛极性小、疏水性强,可以避免在吸附剂制造中出现掉粉率高等状况。附图说明表1是实施例1中Na,Cs-RHO-1的特征晶面间距表2是实施例1中Na,Cs-RHO-2的特征晶面间距(煅烧后)表3是实施例4中Na,Cs-RHO-3的特征晶面间距表4是实施例4中Na,Cs-RHO-4的特征晶面间距(煅烧后)表5是对比例1中Na,Cs-RHO-5的特征晶面间距表6是对比例1中Na,Cs-RHO-6的特征晶面间距(煅烧后)图1是实施例1中Na,Cs-RHO-1的XRD测试结果示意图图2是实施例1中Na,Cs-RHO-2的XRD测试结果示意图(煅烧后)图3是实施例1,实施例4,对比例1,对比例2中四个样品的29Si核磁共振光谱示意图图4是实施例1中Na-RHO-2对氮气、氧气和氩气的吸附曲线(常温下)图5是实施例2中Li,Na-RHO-2对氮气和氩气的吸附曲线(临界条件)图6是实施例3中Ag-RHO-2对氮气、氧气和氩气的吸附曲线(常温下)图7是实施例3中Ag-RHO-2对氮气和氩气的吸附曲线(临界条件)图8是实施例4中Na,Cs-RHO-3的XRD测试结果示意图图9是实施例4中Na,Cs-RHO-4的XRD测试结果示意图(煅烧后)图10是实施例4中Na-RHO-4对氮气、氧气和氩气的吸附曲线(常温下)图11是实施例5中Li,Na-RHO-4对氮气和氩气的吸附曲线(临界条件)图12是实施例3中Ag-RHO-4对氮气、氧气和氩气的吸附曲线(常温下)图13是实施例3中Ag-RHO-4对氮气和氩气的吸附曲线(临界条件)图14是对比例1中Na,Cs-RHO-5的XRD测试结果示意图图15是对比例1中Na,Cs-RHO-6的XRD测试结果示意图(煅烧后)图16是对比例1中Li,Na-RHO-6对氮气和氩气的吸附曲线(临界条件)图17是对比例1中Li,Na-RHO-6对氮气和氧气的吸附曲线(常温下)。具体实施方式下面通过实施例详述本发明,但本发明并不局限于这些实施例。【仪器表征】<X射线衍射测定>X射线衍射测定仪器为PanalyticalX’PertPRO,检测光源CuKα,管电压为40kV,管电流为40mA,检测角度范围为5-50°,检测时间为10min。本发明通过X射线衍射测定合成的分子筛的物相结构,将研磨后的样品粉末加入玻璃平板上的方孔内,然后将玻璃平板插入测角仪的轴线位置,在CuKα光源照射下,探头以2θ/min速度旋转。此外,光源并不限于CuKα,CoKα、MoKα、AgKα也可用作物相分析的光源。测试的原料形态可以是粉末、乳液或者固体颗粒。<电感耦合等离子光谱测定>电感耦合等离子光谱(ICP)测定采用PerkinElmerOptima8x00。本发明通过电感耦合等离子光谱测定合成分子筛中的四价元素Y、三价元素X以及一价元素或者一价阳离子M的含量。将标准样品稀释后作出浓度梯度吸收曲线。将样品用氢氟酸溶解后加水稀释,然后通过吸收峰强测定样品中各个元素的浓度。<核磁共振光谱测定>核磁共振光谱(NMR)测定采用BrukerAvanceIII500。本发明通过29Si核磁共振光谱测定当四价元素Y为硅时合成的分子筛内的硅环境。采用的频率为99.36MHz,扫描的范围为-350-146ppm。当三价元素X为铝时,29Si核磁共振光谱可以确认铝元素在分子筛内和硅的配位情况,从而确认骨架的SAR值,同时校正电感耦合等离子光谱测定的硅元素和铝元素之比。<气体吸附测定>气体吸附测定采用QuantachromeAutosorb-iQ2。本发明通过气体吸附测定来测试气体吸附选择性。N2/O2在293K下测定,取~500mg样品放入样品管中,然后置于20℃恒温水浴中,吸附压力为0-1bar。N2/Ar在临界温度下测定吸附选择性,取~50mg样品放入样品管中,然后分别置于液氮和液氩中,吸附压力为0-1bar。所有的样品在吸附前均在400-600℃下煅烧6h以上。【实施例】<实施例1>将21.2g18-冠醚-6(冠醚质量百分含量>98%)加入14g水中溶解,然后依次加入2.9gNaOH(NaOH质量百分含量>96%),8.0gCsOH(50%aqueous,CsOH质量百分含量>99%),在80℃下加热溶解3h得到冠醚和碱的混合液。取0.7gNaAlO2(Al2O3质量百分含量41%)在7.8g水溶解后转移到反应釜中,取8.1g上述冠醚和碱的混合液的上层清液加入反应釜内,然后一边搅拌一边在上述混合物中加入8.45gLudoxAS-40(SiO2质量百分含量40%),在室温下陈化24h后得到初始凝胶。将凝胶混合物移入耐压容器密封,在140℃反应温度及自生压力下动态晶化144h。水热反应结束后,将反应液冷却、过滤、洗涤得到结晶产物。将得到的晶体在100℃干燥12h后得到粉末状产物Na,Cs-RHO-1。得到的产物用XRD做物相分析,Na,Cs-RHO-1中特征峰所在处的晶面间距见表1,XRD测试结果的示意图见图1,表明合成的分子筛具有IZA认定的RHO分子筛构型。将得到的样品Na,Cs-RHO-1在马弗炉中550℃煅烧6h后得到粉末状产物Na,Cs-RHO-2。得到的产物用XRD做物相分析,Na,Cs-RHO-2中特征峰所在处的晶面间距见表2,XRD测试结果的示意图见图2,表明合成的分子筛具有IZA认定的RHO分子筛构型。采用ICP对上述样品做元素组成分析,分析结果表明Na,Cs-RHO-2的SAR值为13.7。采用29Si核磁共振光谱测定当四价元素Y为硅时合成的分子筛内的硅环境,经计算得Na,Cs-RHO-2分子筛SAR值为15.8,-115ppm~-95ppm之间的峰面积占-120ppm~-80ppm之间的峰面积的98.9%。29Si核磁共振光谱测定结果示意图见图3。将5g得到的Na,Cs-RHO-2与6mol/L的氯化铵溶液(5ml/g分子筛)在80℃下接触4次,每次1h,每次接触之间过滤、干燥,得到NH4-RHO-1。随后将获得的NH4-RHO-1与20%的硝酸钠溶液(10ml/g分子筛)在90℃下接触3次,每次2h,每次接触之间过滤、干燥得到分子筛粉末Na-RHO-1。将得到的上述分子筛粉末放在空气中煅烧:以1℃/min的速率加热到450℃,在450℃维持10min,然后继续以1℃/min的速率加热到500℃,然后在500℃维持5h,然后冷却至100℃得到Na-RHO-2。干燥的样品取出后放置在干燥皿中保存。将上述Na-RHO-2用于N2/O2/Ar吸附分离。样品的吸附等温线在Quantachrome公司的Autosorb-iQ2上进行测定。吸附的气体为N2(99.99%)、O2(99.99%)。为了避免分子筛中物理吸附的水对吸附结果的影响,样品在Autosorb-iQ2中进行脱水处理,在极低真空度下(0.005mmHg以下),以1℃/min的速率加热到100℃,在100℃维持30min,然后继续以1℃/min的速率加热到200℃,在200℃维持6h。用恒温水浴(精度0.01℃)控制气体吸附的温度,吸附温度为293K,N2、O2及Ar的吸附等温线见图4。常压下,Na-RHO-2对N2、O2和Ar的吸附量分别为0.264mmol,0.186mmol和0.160mmol,由此计算得到N2/O2和O2/Ar吸附选择性分别为:α(N2/O2)=1.42,α(O2/Ar)=1.16。<表1>Na,Cs-RHO-1的特征晶面间距晶面间距(d)110.53026.09335.27344.71954.30963.98873.51983.338<表2>Na,Cs-RHO-2的特征晶面间距(煅烧后)晶面间距(d)110.54626.08835.27344.71654.30663.98673.51783.337<实施例2>将实施例1中得到的Na-RHO-1(2g)与20%的硝酸锂溶液(10ml/g分子筛)在90℃下接触3次,每次2h,每次接触之间过滤、干燥得到分子筛粉末Li,Na-RHO-1。将得到的上述分子筛粉末放在空气中煅烧:以1℃/min的速率加热到450℃,在450℃维持10min,然后继续以1℃/min的速率加热到500℃,然后在500℃维持5h,然后冷却至100℃得到Li,Na-RHO-2。干燥的样品取出后放置在干燥皿中保存。将上述Li,Na-RHO-2用于N2/Ar吸附分离。样品的吸附等温线在Quantachrome公司的Autosorb-iQ2上进行测定。吸附的气体为N2(99.99%)、Ar(99.99%)。为了避免分子筛中物理吸附的水对吸附结果的影响,样品在Autosorb-iQ2中进行脱水处理,在极低真空度下(0.005mmHg以下),以1℃/min的速率加热到100℃,在100℃维持30min,然后继续以1℃/min的速率加热到200℃,在200℃维持6h。用液氩控制气体吸附的温度,吸附温度为87K,N2和Ar的吸附等温线见图5。常压下,Li,Na-RHO-2对N2和Ar的吸附量分别为8.687mmol和11.05mmol,由此计算得到Ar/N2吸附选择性为:Ar/N2=1.27。<实施例3>将实施例1中得到的NH4-RHO-1放在马弗炉中煅烧,以1.6℃/min的速率加热到600℃,然后在600℃维持6h,然后冷却至100℃得到H-RHO-1。将上述H-RHO-1与20%的硝酸银溶液(10ml/g分子筛)在室温下接触3次,每次2h,每次接触之间过滤、干燥得到分子筛粉末Ag-RHO-1。将得到的上述分子筛粉末放在空气中煅烧:以1℃/min的速率加热到450℃,在450℃维持10min,然后继续以1℃/min的速率加热到500℃,然后在500℃维持5h,然后冷却至100℃得到Ag-RHO-2。干燥的样品取出后放置在干燥皿中保存。将上述Ag-RHO-2用于N2/O2/Ar吸附分离。样品的吸附等温线在Quantachrome公司的Autosorb-iQ2上进行测定。吸附的气体为N2(99.99%)、O2(99.99%)。为了避免分子筛中物理吸附的水对吸附结果的影响,样品在Autosorb-iQ2中进行脱水处理,在极低真空度下(0.005mmHg以下),以1℃/min的速率加热到100℃,在100℃维持30min,然后继续以1℃/min的速率加热到200℃,在200℃维持6h。用恒温水浴(精度0.01℃)控制气体吸附的温度,吸附温度为293K,N2、O2及Ar的吸附等温线见图6。常压下,Ag-RHO-2对N2、O2和Ar的吸附量分别为0.452mmol,0.291mmol和0.295mmol,由此计算得到N2/O2和O2/Ar吸附选择性分别为:α(N2/O2)=1.55,α(O2/Ar)=0.986。将上述Ag-RHO-2用于N2/Ar吸附分离。样品的吸附等温线在Quantachrome公司的Autosorb-iQ2上进行测定。吸附的气体为N2(99.99%)、Ar(99.99%)。为了避免分子筛中物理吸附的水对吸附结果的影响,样品在Autosorb-iQ2中进行脱水处理,在极低真空度下(0.005mmHg以下),以1℃/min的速率加热到100℃,在100℃维持30min,然后继续以1℃/min的速率加热到200℃,在200℃维持6h。用液氩控制气体吸附的温度,吸附温度为87K,N2和Ar的吸附等温线见图7。常压下,Ag-RHO-2对N2和Ar的吸附量分别为11.27mmol和13.95mmol,由此计算得到Ar/N2吸附选择性为:Ar/N2=1.24。<实施例4>将21.2g18-冠醚-6(冠醚质量百分含量>98%)加入24g水中溶解,然后依次加入2.9gNaOH(NaOH质量百分含量>96%),8.0gCsOH(50%aqueous,CsOH质量百分含量>99%),在80℃下加热溶解3h得到冠醚和碱的混合液。取0.7gNaAlO2(Al2O3质量百分含量41%)在7.8g水溶解后转移到反应釜中,取约14.6g上述冠醚和碱的混合液的上层清液加入反应釜内,然后一边搅拌一边在上述混合物中加入12.65gLudoxAS-40(SiO2质量百分含量40%),在室温下陈化24h后得到初始凝胶。将凝胶混合物移入耐压容器密封,在140℃反应温度及自生压力下动态晶化144h。水热反应结束后,将反应液冷却、过滤、洗涤得到结晶产物。将得到的晶体在100℃干燥12h后得到粉末状产物Na,Cs-RHO-3。得到的产物用XRD做物相分析,Na,Cs-RHO-3中特征峰所在处的晶面间距见表3,XRD测试结果的示意图见图8,表明合成的分子筛具有IZA认定的RHO分子筛构型。将得到的样品Na,Cs-RHO-3在马弗炉中550℃煅烧6h后得到粉末状产物Na,Cs-RHO-4。得到的产物用XRD做物相分析,Na,Cs-RHO-4中特征峰所在处的晶面间距见表4,XRD测试结果的示意图见图9,表明合成的分子筛具有IZA认定的RHO分子筛构型。采用ICP对上述样品做元素组成分析,分析结果表明Na,Cs-RHO-4的SAR值为14.2。采用29Si核磁共振光谱测定当四价元素Y为硅时合成的分子筛内的硅环境,经计算得Na,Cs-RHO-4分子筛SAR值为10.2,-115ppm~-95ppm之间的峰面积占-120ppm~-80ppm之间的峰面积的92.1%。29Si核磁共振光谱测定结果示意图见图3。将5g得到的Na,Cs-RHO-4与6mol/L的氯化铵溶液(5ml/g分子筛)在80℃下接触4次,每次1h,每次接触之间过滤、干燥,得到NH4-RHO-2。随后将获得的NH4-RHO-2与20%的硝酸钠溶液(10ml/g分子筛)在90℃下接触3次,每次2h,每次接触之间过滤、干燥得到分子筛粉末Na-RHO-3。将得到的上述分子筛粉末放在空气中煅烧:以1℃/min的速率加热到450℃,在450℃维持10min,然后继续以1℃/min的速率加热到500℃,然后在500℃维持5h,然后冷却至100℃得到Na-RHO-4。干燥的样品取出后放置在干燥皿中保存。将上述Na-RHO-4用于N2/O2/Ar吸附分离。样品的吸附等温线在Quantachrome公司的Autosorb-iQ2上进行测定。吸附的气体为N2(99.99%)、O2(99.99%)。为了避免分子筛中物理吸附的水对吸附结果的影响,样品在Autosorb-iQ2中进行脱水处理,在极低真空度下(0.005mmHg以下),以1℃/min的速率加热到100℃,在100℃维持30min,然后继续以1℃/min的速率加热到200℃,在200℃维持6h。用恒温水浴(精度0.01℃)控制气体吸附的温度,吸附温度为293K,N2、O2及Ar的吸附等温线见图10。常压下,Na-RHO-4对N2、O2和Ar的吸附量分别为0.304mmol,0.274mmol和0.184mmol,由此计算得到N2/O2和O2/Ar吸附选择性分别为:α(N2/O2)=1.11,α(O2/Ar)=1.49。<表3>Na,Cs-RHO-3的特征晶面间距晶面间距(d)110.51426.08235.26944.71654.30663.98873.51783.337<表4>Na,Cs-RHO-4的特征晶面间距(煅烧后)晶面间距(d)110.49726.07135.26144.70954.29863.97973.51283.330<实施例5>将实施例4中得到的Na-RHO-3(2g)与20%的硝酸锂溶液(10ml/g分子筛)在90℃下接触3次,每次2h,每次接触之间过滤、干燥得到分子筛粉末Li,Na-RHO-3。将得到的上述分子筛粉末放在空气中煅烧:以1℃/min的速率加热到450℃,在450℃维持10min,然后继续以1℃/min的速率加热到500℃,然后在500℃维持5h,然后冷却至100℃得到Li,Na-RHO-4。干燥的样品取出后放置在干燥皿中保存。将上述Li,Na-RHO-4用于N2/Ar吸附分离。样品的吸附等温线在Quantachrome公司的Autosorb-iQ2上进行测定。吸附的气体为N2(99.99%)、Ar(99.99%)。为了避免分子筛中物理吸附的水对吸附结果的影响,样品在Autosorb-iQ2中进行脱水处理,在极低真空度下(0.005mmHg以下),以1℃/min的速率加热到100℃,在100℃维持30min,然后继续以1℃/min的速率加热到200℃,在200℃维持6h。用液氩控制气体吸附的温度,吸附温度为87K,N2和Ar的吸附等温线见图11。常压下,Li,Na-RHO-4对N2和Ar的吸附量分别为9.953mmol和4.628mmol,由此计算得到N2/Ar吸附选择性为:N2/Ar=2.15。<实施例6>将实施例4中得到的NH4-RHO-2放在马弗炉中煅烧,以1.6℃/min的速率加热到600℃,然后在600℃维持6h,然后冷却至100℃得到H-RHO-2。将上述H-RHO-2与20%的硝酸银溶液(10ml/g分子筛)在室温下接触3次,每次2h,每次接触之间过滤、干燥得到分子筛粉末Ag-RHO-3。将得到的上述分子筛粉末放在空气中煅烧:以1℃/min的速率加热到450℃,在450℃维持10min,然后继续以1℃/min的速率加热到500℃,然后在500℃维持5h,然后冷却至100℃得到Ag-RHO-4。干燥的样品取出后放置在干燥皿中保存。将上述Ag-RHO-4用于N2/O2/Ar吸附分离。样品的吸附等温线在Quantachrome公司的Autosorb-iQ2上进行测定。吸附的气体为N2(99.99%)、O2(99.99%)。为了避免分子筛中物理吸附的水对吸附结果的影响,样品在Autosorb-iQ2中进行脱水处理,在极低真空度下(0.005mmHg以下),以1℃/min的速率加热到100℃,在100℃维持30min,然后继续以1℃/min的速率加热到200℃,在200℃维持6h。用恒温水浴(精度0.01℃)控制气体吸附的温度,吸附温度为293K,N2和O2的吸附等温线见图12。Ag-RHO-4对N2、O2和Ar的吸附量分别为0.223mmol,0.209mmol和0.178mmol,由此计算得到N2/O2和O2/Ar吸附选择性分别为:α(N2/O2)=1.07,α(O2/Ar)=1.17。将上述Ag-RHO-4用于N2/Ar吸附分离。样品的吸附等温线在Quantachrome公司的Autosorb-iQ2上进行测定。吸附的气体为N2(99.99%)、Ar(99.99%)。为了避免分子筛中物理吸附的水对吸附结果的影响,样品在Autosorb-iQ2中进行脱水处理,在极低真空度下(0.005mmHg以下),以1℃/min的速率加热到100℃,在100℃维持30min,然后继续以1℃/min的速率加热到200℃,在200℃维持6h。用液氩控制气体吸附的温度,吸附温度为87K,N2和Ar的吸附等温线见图13。常压下,Ag-RHO-4对N2和Ar的吸附量分别为6.360mmol和7.564mmol,由此计算得到Ar/N2吸附选择性为:Ar/N2=1.19。<对比例1>对比例1中的分子筛采用文献方法合成(Journalofcolloidandinterfacescience,2012,376(1),28-33)。将2.6g18冠6醚(冠醚质量百分含量>98%),1.3gNaOH(NaOH质量百分含量>96%),2.0gCsOH固体(CsOH质量百分含量>99%),5.0gNaAlO2(Al2O3质量百分含量41%)加入18.0g水中溶解,在80℃下加热溶解3h得到冠醚和碱的混合液。将上述冠醚和碱的混合液加入反应釜内,然后一边搅拌一边在上述混合物中加入30.0gLudoxAS-40(SiO2质量百分含量40%),在室温下陈化24h后得到初始凝胶。将凝胶混合物移入耐压容器密封,在110℃反应温度及自生压力下静置反应96h得到产物。水热反应结束后,将反应液冷却、过滤、洗涤得到结晶产物。将得到的晶体在100℃干燥12h后得到粉末状产物Na,Cs-RHO-5。得到的产物用XRD做物相分析,Na,Cs-RHO-5中特征峰所在处的晶面间距见表5,XRD测试结果的示意图见图14,表明合成的分子筛具有IZA认定的RHO分子筛构型。将得到的样品Na,Cs-RHO-5在马弗炉中550℃煅烧6h后得到粉末状产物Na,Cs-RHO-6。得到的产物用XRD做物相分析,Na,Cs-RHO-6中特征峰所在处的晶面间距见表6,XRD测试结果的示意图见图15,表明合成的分子筛具有IZA认定的RHO分子筛构型。采用ICP对上述样品做元素组成分析,分析结果表明Na,Cs-RHO-6的的SAR值为5.7。采用29Si核磁共振光谱测定当四价元素Y为硅时合成的分子筛内的硅环境,经计算得Na,Cs-RHO-6分子筛SAR值为3.9,-115ppm~-95ppm之间的峰面积占-120ppm~-80ppm之间的峰面积的67.6%。29Si核磁共振光谱测定结果示意图见图3。将5g得到的Na,Cs-RHO-6与6mol/L的氯化铵溶液(5ml/g分子筛)在80℃下接触4次,每次1h,每次接触之间过滤、干燥,得到NH4-RHO-3。随后将获得的NH4-RHO-3与20%的硝酸钠溶液(10ml/g分子筛)在90℃下接触3次,每次2h,每次接触之间过滤、干燥得到分子筛粉末Na-RHO-5。将Na-RHO-5(2g)与20%的硝酸锂溶液(10ml/g分子筛)在90℃下接触3次,每次2h,每次接触之间过滤、干燥得到分子筛粉末Li,Na-RHO-5。将得到的上述分子筛粉末放在空气中煅烧:以1℃/min的速率加热到450℃,在450℃维持10min,然后继续以1℃/min的速率加热到500℃,然后在500℃维持5h,然后冷却至100℃得到Li,Na-RHO-6。干燥的样品取出后放置在干燥皿中保存。将上述Li,Na-RHO-6用于N2/Ar吸附分离。样品的吸附等温线在Quantachrome公司的Autosorb-iQ2上进行测定。吸附的气体为N2(99.99%)、Ar(99.99%)。为了避免分子筛中物理吸附的水对吸附结果的影响,样品在Autosorb-iQ2中进行脱水处理,在极低真空度下(0.005mmHg以下),以1℃/min的速率加热到100℃,在100℃维持30min,然后继续以1℃/min的速率加热到200℃,在200℃维持6h。用液氩控制气体吸附的温度,吸附温度为87K,N2和Ar的吸附等温线见图16。常压下,Li,Na-RHO-6对N2和Ar的吸附量分别为0.959mmol和3.338mmol,由此计算得到Ar/N2吸附选择性为:Ar/N2=3.48。将上述Li,Na-RHO-6用于N2/O2吸附分离。样品的吸附等温线在Quantachrome公司的Autosorb-iQ2上进行测定。吸附的气体为N2(99.99%)、O2(99.99%)。为了避免分子筛中物理吸附的水对吸附结果的影响,样品在Autosorb-iQ2中进行脱水处理,在极低真空度下(0.005mmHg以下),以1℃/min的速率加热到100℃,在100℃维持30min,然后继续以1℃/min的速率加热到200℃,在200℃维持6h。用恒温水浴(精度0.01℃)控制气体吸附的温度,吸附温度为293K,N2和O2的吸附等温线见图17。常压下,Li,Na-RHO-6对N2和O2的吸附量分别为0.124mmol和0.154mmol,由此计算得到O2/N2吸附选择性为:O2/N2=1.24。<表5>Na,Cs-RHO-5的特征晶面间距晶面间距(d)110.30727.06135.96544.98254.21964.08073.90783.44693.270<表6>Na,Cs-RHO-6的特征晶面间距(煅烧后)晶面间距(d)110.57927.06236.12045.30554.74564.08273.75483.54093.359和Li交换X型分子筛等优先吸附氮气的传统分子筛相比,本发明的分子筛四价元素Y含量更高,受水蒸气腐蚀作用的影响更小;和传统RHO分子筛相比,本发明的分子筛可以在氮氧分离中优先大量吸附氮气,在氧氩分离中优先大量吸附氧气。应用于空气分离过程时,本发明的分子筛同时具有高稳定性和高分离性能,因而可以保证PSA分离空气过程的生产效率。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1