包括基本仪器和可拆卸盒的用于生物化学分析的系统和方法与流程
本申请要求特此通过引用被全部并入本文的2014年5月27日提交的美国申请号62/003,264的优先权。
背景
本身请的实施方式通常涉及用于进行生物化学反应的系统和方法,且更特别地涉及其中基本仪器与可拆卸盒交互作用以进行反应以用于样品制备或生物化学分析中的至少一个的系统和方法。
各种生物化学协议涉及在支撑表面上或在指定反应室内执行大量受控反应。可进行受控反应以分析生物样品或制备生物样品用于随后的分析。分析可识别或揭露在反应中涉及的化学品的特性。例如,在循环阵列测序化验(例如合成测序(SBS))中,DNA特征(例如模板核酸)的密集阵列通过酶操纵的迭代循环被测序。在每个循环之后,图像可被捕获并随后与其它图像一起被分析以确定一系列DNA特征。在另一生物化学化验中,具有可识别的标记(例如荧光标记)的未知分析物可暴露于已知探针的阵列,所述探针具有在阵列内的预定地址。观察出现在探针和未知分析物之间的化学反应可帮助识别或揭露分析物的特性。
存在对自动执行化验例如上面所述的化验的系统的一般要求,其中系统需要由用户进行的较少的工作或用户的参与。目前,大部分平台要求用户在将生物样品装入系统内用于分析之前单独地制备生物样品。用户将一个或多个生物样品装入系统内、选择化验用于由系统执行并在预定的一段时间例如一天或更少时间内有来自分析的结果可能是合乎需要的。今天使用的至少一些系统不能够执行某些协议,例如全基因组测序,其提供具有足够水平的质量并在某个成本范围内的数据。
简要描述
在实施方式中,提供包括具有盒壳体的可拆卸盒的系统。可拆卸盒还包括布置在盒壳体内的流体网络。流体网络配置成接收并流体地引导生物样品以进行样品分析或样品制备中的至少一个。可拆卸盒还包括流量控制阀,其可操作地耦合到流体网络且相对于流体网络是可移动的以控制流经其的生物样品的流量。盒壳体包括界定可拆卸盒的外部并允许对流量控制阀的操作的接近的壳体侧。系统还包括基本仪器,其具有配置成可分离地接合可拆卸盒的壳体侧的控制侧。壳体侧和控制侧共同界定系统界面。基本仪器包括通过系统界面来接合流量控制阀的阀致动器。可拆卸盒还包括由可拆卸盒或基本仪器中的至少一个保持的检测组件。检测组件包括成像检测器和与流体网络流体连通的反应室。成像检测器配置成检测在反应室内的指定反应。
在实施方式中,提供对核酸测序的方法。该方法包括提供可拆卸盒,其具有盒壳体、布置在盒壳体内的流体网络和可操作地耦合到流体网络并相对于流体网络可移动的流量控制阀。盒壳体包括界定可拆卸盒的外部的壳体侧。该方法还包括使可拆卸盒接触到基本仪器。可拆卸盒的壳体侧可分离地接合基本仪器的控制侧以共同界定系统界面。基本仪器包括通过系统界面来接合流量控制阀的阀致动器。该方法还包括流体地引导生物样品流经盒的流体网络以在盒中进行样品分析或样品制备中的至少一个。生物样品被引导以流到反应室内,其中通过在流量控制阀上的阀致动器的作用来控制生物样品的流量。该方法还包括使用被定向到反应室的成像检测器来检测生物样品,其中检测组件由可拆卸盒或基本仪器中的至少一个保持。
在实施方式中,提供包括具有样品口的盒壳体的可拆卸盒,样品口对盒壳体的外部开放并配置成接收生物样品。盒壳体具有电触头的阵列和暴露于外部的机械接口装置。盒壳体配置成可移除地耦合到基本仪器。可拆卸盒还可包括具有多个通道、反应室和存储模块的流体网络。存储模块包括用于存储试剂的多个储器。流体网络配置成将试剂从储器引导到反应室,其中机械接口装置相对于流体网络可移动以控制穿过流体网络的流体的流量。系统还包括布置在盒壳体内并定位成检测在反应室内的指定反应的成像设备。成像设备电耦合到电触头的阵列用于与基本仪器通信。机械接口装置可配置成当可拆卸盒耦合到基本仪器时由基本仪器移动。
在实施方式中,提供包括具有样品口的盒壳体的可拆卸盒,样品口对盒壳体的外部开放并配置成接收生物样品。可拆卸盒还可包括布置在盒壳体内的可旋转阀。可旋转阀具有流体侧和在流体侧处敞开的多个阀口。可旋转阀具有在阀口之间延伸的至少一个流动通道,其中可旋转阀在不同的旋转位置之间可旋转。可拆卸盒还可包括微流体主体,该微流体主体具有可滑动地耦合到可旋转阀的流体侧的主体侧。微流体主体可至少部分地界定包括与样品口流体连通的样品通道的流体网络。样品通道具有对微流体主体的主体侧敞开的网络口。流体网络还可包括配置成保持试剂的储器。储器与对微流体主体的流体侧敞开的储器口流体连通。流体网络还包括与流体网络的反应室流体连通的进料通道。进料通道具有对微流体主体的主体侧敞开的进料口。可旋转阀配置成在第一和第二旋转位置之间旋转。当可旋转阀在第一旋转位置上时,网络口通过可旋转阀流体地耦合到进料口。当可旋转阀在第二旋转位置上时,储器口通过可旋转阀流体地耦合到进料口。
在实施方式中,提供包括具有样品口的盒壳体的可拆卸盒,样品口对盒壳体的外部开放并配置成接收生物样品。盒壳体可包括配置成面向并可移除地耦合到基本仪器的相配侧。可拆卸盒还包括布置在壳体内的流体网络。流体网络包括与样品口流体连通的样品通道。可拆卸盒还包括具有配置成在第一和第二位置之间移动的柔性构件的通道阀。柔性构件当在第一位置上时阻止穿过样品通道的流动,并当在第二位置上时允许穿过样品通道的流动。盒壳体的相配侧包括将通道阀暴露于盒壳体的外部的进入开口。进入开口配置成接纳基本仪器的阀致动器,其用于在第一和第二位置之间移动柔性构件。
在实施方式中,提供包括具有相配侧的系统壳体的基本仪器,相配侧配置成接合可拆卸盒。基本仪器还包括旋转电机,其配置成接合可拆卸盒的可旋转阀。基本仪器还包括配置成接合可拆卸盒的通道阀的阀致动器和配置成电耦合到可拆卸盒的电触头的阵列。基本仪器还包括配置成控制旋转电机和阀致动器以执行在可拆卸盒内的测定协议的系统控制器。系统控制器配置成通过电触头的阵列从可拆卸盒接收成像数据。可选地,基本仪器包括用于加热可拆卸盒的一部分的热块。
在实施方式中,提供包括具有样品口的盒壳体的可拆卸盒,样品口对盒壳体的外部开放并配置成接收生物样品。盒壳体包括配置成面向并可移除地耦合到基本仪器的相配侧。可拆卸盒还包括布置在盒壳体内的微流体主体。微流体主体具有主体侧并包括流体网络。流体网络具有多个分立通道和在阀接纳区域处的在所述主体侧处敞开的相应口。可拆卸盒还包括布置在盒壳体内的可旋转阀。可旋转阀具有流体侧和在多个阀口之间延伸的至少一个流动通道。阀口对流体侧敞开。流体侧可旋转地耦合到微流体主体的主体侧的阀接纳区域,其中可旋转阀在不同的旋转位置之间可移动以流体地耦合分立通道。可旋转阀具有机械接口装置,其沿着相配侧是可接近的并配置成接合基本仪器,使得可旋转阀由基本仪器控制。
在实施方式中,提供包括具有样品口的盒壳体的可拆卸盒,样品口对盒壳体的外部开放并配置成接收生物样品。盒壳体包括配置成可移除地耦合到基本仪器的相配侧。可拆卸盒还包括布置在盒壳体内并包括多个堆叠的印刷电路板(PCB)层的微流体结构。PCB层包括当PCB层被堆叠时界定通道和反应室的流体层。PCB层还包括布线层。可移除盒还包括CMOS成像器,其配置成安装到微流体结构并电耦合到导电布线层。CMOS成像器定向成检测在反应室内的指定反应。
附图的简要描述
图1A是配置成进行生物化学分析或样品制备中的至少一个的根据实施方式形成的系统的示意图。
图1B是示出进行用于样品制备或样品分析中的至少一个的指定反应的方法的流程图。
图2是配置成进行生物化学分析或样品制备中的至少一个的根据实施方式形成的系统的示意图。
图3是包括基本仪器和可拆卸盒的根据实施方式形成的系统的侧视图。
图4是包括基本仪器和可拆卸盒的根据实施方式形成的系统的顶视图。
图5是示出具有第一位置的流量控制阀的根据实施方式形成的系统的一部分的横截面视图。
图6是示出具有第二位置的流量控制阀的图5的系统的一部分的横截面视图。
图7是示出具有第一位置的流量控制阀的根据实施方式形成的系统的一部分的横截面视图。
图8是示出具有第二位置的流量控制阀的图5的系统的一部分的横截面视图。
图9是示出具有第一位置的流量控制阀的根据实施方式形成的系统的一部分的横截面视图。
图10是示出具有第二位置的流量控制阀的图5的系统的一部分的横截面视图。
图11是根据实施方式形成的可拆卸盒的被暴露部分的透视图。
图12是可与图11的可拆卸盒一起使用的可旋转阀的横截面。
图13示出可使用可旋转阀流体地互连的端口的布置。
图14示出使用用于CMOS技术的单片集成和指状流体器件的柔性印刷电路板(PCB)和卷到卷(R2R)印刷电子器件的方法的例子的流程图。
图15示出具有可使用图16的方法来层压并粘合在一起的某些层的流体叠层的例子的分解图。
图16示出可使用图14的方法集成到微流体盒的流体层内的CMOS设备的例子的透视图。
图17A、17B、18、19和20示出结构的侧视图并示出使用图14的方法将CMOS设备附接到柔性PCB的过程的例子。
图21示出使用图14的方法形成的结构的例子的侧视图,其中流体层和CMOS设备一起集成在微流体盒中。
图22A和22B示出膜片阀的例子的透视图,其中膜片阀可集成到流体层内。
图23A和23B示出分别在打开和闭合状态中的膜片阀的横截面视图。
图24示出包括集成在一起的CMOS技术和指状流体器件的微流体盒的例子的示意图。
图25和26示出微流体盒组件的透视图,微流体盒组件是在图24中所示的集成微流体盒的物理例示。
图27A和27B示出安装在图25和26中所示的微流体盒组件中的流体组件的例子的透视图。
图28A和28B分别示出可被安装在图27A和27B中所示的流体组件中的加热器迹线的例子的平面图和横截面视图。
图29、30、31、32、33A和33B示出图25的微流体盒组件的各种其它视图,其示出其中的更多细节。
图34到42示出图25的微流体盒组件的解构的过程,作为揭露其中的内部部件的手段。
图43示出图25的微流体盒组件的一部分的透明透视图并示出其中的各种试剂流体储器和其样品装入口。
图44示出图25的微流体盒组件的一部分的另一透明透视图并进一步示出其中的流体通道。
图45示出图25的微流体盒组件的横截面视图,其示出其中的更多细节。
图46A、46B、47A、47B和48示出图25的微流体盒组件的壳体的各种视图,其示出其中的更多细节。
图49、50、41A、41B和52示出图25的微流体盒组件的底板的各种视图,其示出其中的更多细节。
图53A和53B示出微流体盒组件的流体组件的其它透视图,其示出其中的更多细节。
图54A、54B和54C示出说明微流体盒组件的流体组件的柔性PCB加热器的更多细节的其它视图。
图55A和55B分别示出在图15和图27中所示的流体层的进口/出口层的透视图和平面图。
图56A和56B分别示出在图15和图27中所示的流体层的流体通道层的透视图和平面图。
图57A和57B分别示出在图15和图27中所示的流体层的柔性PCB层的透视图和平面图。
图58A和58B分别示出在图15和图27中所示的流体层的测序室底层的透视图和平面图。
图59A和59B分别示出在图15和图27中所示的流体层的测序室层的透视图和平面图。
图60A和60B分别示出在图15和图27中所示的膜层和流体层的测序室顶层的透视图和平面图。
图61A和61B示出使用微流体盒组件来执行测序所需的多路PCR和下游混合的方法的例子的流程图。
图62示出CMOS流动池的例子的侧视图,其中多达大约100%的生物传感器活性区域是对试剂输送和照明可接近的。
图63示出在图49中所示的CMOS流动池的一个例示的例子的分解图。
图64和65分别示出当被完全组装时在图63中示出的CMOS流动池的透视图和侧视图。
图66示出在图63、64和65中所示的CMOS流动池的流动池盖的例子的透视图。
图67、68、69和70示出提供在CMOS流动池中的延伸平坦表面的过程的例子,流动池盖可安装在该延伸平坦表面上。
图71A、71B、71C和71D示出提供在CMOS流动池中的延伸平坦表面的过程的另一例子,流动池盖可安装在延伸平坦表面上。
图72、73、74和75示出提供在CMOS流动池中的延伸平坦表面的过程的又一例子,流动池盖可安装在延伸平坦表面上。
详细描述
在本文阐述的实施方式可用于执行指定反应,以用于样品制备和/或生物化学分析。术语“生物化学分析”可包括生物分析或化学分析中的至少一个。图1A是配置成进行生物化学分析和/或样品制备的系统100的示意图。系统100包括基本仪器102和配置成可分离地接合基本仪器102的可拆卸盒104。基本仪器102和可拆卸盒104可配置成与彼此交互作用以将生物样品运输到系统100内的不同位置,进行包括生物样品的指定反应以便制备生物样品用于随后的分析,并可选地使用生物样品检测一个或多个事件。事件可指示与生物样品的指定反应。在一些实施方式中,可拆卸盒104类似于集成微流体盒1100(在图24中示出)或微流体盒组件1200(在图25和26中示出)。
虽然下文参考如图1A所示的基本仪器102和可拆卸盒104,应理解,基本仪器102和可拆卸盒104只示出系统100的一个示例性实施方式,以及其它实施方式存在。例如,基本仪器102和可拆卸盒104包括共同执行用于制备生物样品和/或分析生物样品的多个操作的各种部件和特征。在所示实施方式中,基本仪器102和可拆卸盒104中的每个能够执行某些功能。然而应理解,基本仪器102和可拆卸盒104可执行不同的功能和/或可共享这样的功能。例如在所示实施方式中,可拆卸盒104配置成使用成像设备来检测指定反应。在可选的实施方式中,基本仪器102可包括成像设备。作为另一例子,在所示实施方式中,基本仪器102是不提供、接收液体或与可拆卸盒104交换液体的“干”仪器。在可选的实施方式中,基本仪器102可向可拆卸盒104提供例如随后由可拆卸盒104消耗(例如在指定反应中使用)的试剂或其它液体。
如在本文使用的,生物样品可包括一种或多种生物或化学物质,例如核苷、核酸、多核苷酸、寡核苷酸、蛋白质、酶、多肽、抗体、抗原、配体、受体、多糖、碳水化合物、聚磷酸盐、纳米孔、细胞器、脂质层、细胞、组织、有机体和/或在生物学上活性的化学化合物,例如前面提到的物质的类似物或拟似物。在一些实例中,生物样品可包括全血、淋巴液、血清、浆、汗、眼泪、唾液、痰、脑脊液、羊水、精液、阴道分泌物、浆液、关节液、心包液、腹膜液、胸膜液、漏出液、渗出液、囊液、胆汁、尿液胃液、小肠液、粪便样品、包含单个或多个细胞的液体、包含细胞器的液体、流体化的组织、流体化的有机体、包含多细胞有机体的液体、生物拭样和生物洗液。
在一些实施方式中,生物样品可包括添加的材料,例如水、去离子水、盐溶液、酸溶液、碱溶液、洗涤剂溶液和/或pH缓冲液。添加的材料还可包括在指定测定协议期间被使用以进行生物化学反应的试剂。例如,添加的液体可包括材料以与生物样品进行多个聚合酶链反应(PCR)循环。
然而应理解,被分析的生物样品可以在与被装入系统100内的生物样品不同的形式或状态中。例如,被装入系统100内的生物样品可包括随后被处理(例如经由分离或扩增过程)以提供所制备的核酸的全血或唾液。所制备的核酸可接着由系统100分析(例如由PCR量化或由SBS测序)。相应地,当术语“生物样品”在描述第一操作例如PCR时被使用以及当描述随后的第二操作例如测序时被再次使用时,应理解,在第二操作中的生物样品可在第一操作之前或期间关于生物样品被修改。例如,可在从在前一扩增步骤(例如PCR)中扩增的模板核酸产生的扩增子核酸上执行测序步骤(例如SBS)。在这种情况下,扩增子是模板的拷贝,且扩增子以比模板的数量更高的数量存在。
在一些实施方式中,系统100可基于由用户提供的物质(例如全血或唾液)来自动准备用于生物化学分析的样品。然而,在其它实施方式中,系统100可分析生物样品,其部分地或预先被制备用于由用户分析。例如,用户可提供包括已经从全血分离和/或扩增的核酸的溶液。
如在本文使用的,“指定反应”包括在感兴趣分析物的化学、电、物理或光学特性(或质量)中的至少一个中的变化。在特定的实施方式中,指定反应是连带的结合事件(例如荧光地标记的生物分子与感兴趣分析物的合并)。指定反应可以是分离的结合事件(例如荧光地标记的生物分子从感兴趣分析物的释放)。指定反应可以是化学变换、化学变化或化学交互作用。指定反应也可以是在电特性中的变化。例如,指定反应可以是在溶液内的离子浓度中的变化。示例性反应包括但不限于化学反应,例如还原、氧化、添加、消除、重新布置、酯化、酰胺化、醚化、环化或置换;结合交互作用,其中第一化学品结合到第二化学品;离解反应,其中两种或多种化学品彼此分离;发荧光;发冷光;生物发光;化学发光;以及生物反应,例如核酸复制、核酸扩增、核酸杂化、核酸络合物形成、磷酸化、酶促作用、受体结合或配体结合。指定反应也可以是质子的添加或消除,例如其可被检测为在周围溶液或环境的pH中的变化。额外的指定反应可以是检测越过膜(例如天然或合成双层膜)的离子的流动,例如当离子流经膜时,电流被中断且中断可被检测到。带电标签的场感测也可用作热感测和在本领域中已知的其它分析感测技术。
在特定的实施方式中,指定反应包括荧光地标记的分子到分析物的合并。分析物可以是寡核苷酸,且荧光地标记的分子可以是核苷酸。当激发光指向具有标记的核苷酸的寡核苷酸且荧光团发射可检测的荧光信号时,可检测到指定反应。在可选的实施方式中,所检测的荧光是化学发光或生物发光的结果。指定反应也可例如通过将供体荧光团带到极接近受体荧光团来增加荧光(或)共振能量转移(FRET),通过分离供体和受体荧光团来降低FRET,通过分离猝灭剂与荧光团来增加荧光或通过使猝灭剂与荧光团位于一个地方来减少荧光。
如在本文使用的,“反应组分”包括可用于得到指定反应的任何物质。例如,反应组分包括试剂、催化剂例如酶、用于反应的反应物、样品、反应的产物、其它生物分子、盐、金属辅因子、螯合剂和pH缓冲溶液(例如氢化缓冲液)。反应组分可单独地在溶液中或组合地在一个或多个混合物中被输送到在流体网络中的各种位置。例如,反应组分可被输送到反应室,其中生物样品是固定的。反应组分可直接或间接地与生物样品交互作用。在一些实施方式中,可拆卸盒104被预先装有执行指定测定协议所必需的一种或多种反应组分。预先装入可在盒104由用户接收(例如在消费者的设施处)之前出现在一个位置(例如制造设施)处。
在一些实施方式中,基本仪器102可配置成每活动期与可拆卸盒104交互作用。在活动期之后,可拆卸盒104可以用另一可拆卸盒104代替。在其它实施方式中,基本仪器102可配置成每活动期与一个可拆卸盒104交互作用。如在本文使用的,术语“活动期”包括执行样品制备和/或生物化学分析协议中的至少一个。样品制备可包括分离、隔离、修改和/或放大生物样品的一个或多个组分,使得所制备的生物样品适合于分析。在一些实施方式中,活动期可包括连续的活动,其中多个受控反应被进行,直到(a)指定数量的反应被进行,(b)指定数量的事件被检测到,(c)系统时间的指定时期消逝,(d)信噪比下降到指定阈值;(e)目标组分被识别出;(f)系统故障或失灵被检测到和/或(g)用于进行反应的一个或多个资源被耗尽为止。可选地,活动期可包括在一段时间(例如分钟、小时、天、星期)期间暂停系统活动,以及以后完成活动期,直到(a)-(g)中的至少一个出现为止。
测定协议可包括用于进行指定反应、检测指定反应和/或分析指定反应的一序列操作。共同地,可拆卸盒104和基本仪器102可包括执行不同的操作所必需的部件。测定协议的操作可包括流体操作、热控制操作、检测操作和/或机械操作。流体操作包括控制穿过系统100的流体(例如液体或气体)的流量,其可由基本仪器102和/或由可拆卸盒104启动。例如,流体操作可包括控制泵以将生物样品或反应组分的流引入检测区内。热控制操作可包括控制系统100的指定部分的温度。作为例子,热控制操作可包括升高或降低包括生物样品的液体被存储于的聚合酶链反应(PCR)区的温度。检测操作可包括控制检测器的激活或监控检测器的活动以检测生物样品的预定特性、数量或特征。作为一个例子,检测操作可包括捕获包括生物样品的指定区域的图像,以检测来自指定区域的荧光发射。检测操作可包括控制光源以照亮生物样品或控制检测器以观察生物样品。机械操作可包括控制指定组分的运动或位置。例如,机械操作可包括控制电机以移动在基本仪器102中的阀控制部件,其可操作地接合在可拆卸盒104中的可旋转阀。在一些情况下,不同操作的组合可同时出现。例如,当泵控制穿过检测区的流体的流动时,检测器可捕获检测区的图像。在一些情况下,针对不同的生物样品的不同操作可同时出现。例如,第一生物样品可经历扩增(例如PCR),而第二生物样品可经历检测。
如在本文使用的“液体”是相对不可压缩的物质,并具有流动和符合保持物质的容器或通道的形状的能力。液体可以是基于水成的并包括展示将液体保持在一起的表面张力的有极分子。液体也可包括无极分子,例如在基于油的或非水成物质中。应理解,对在本申请中的液体的提及可包括由两种或多种液体的组合形成的液体。例如,单独的试剂溶液可稍后组合以进行指定反应。
可拆卸盒104配置成可分离地接合或可移除地耦合到基本仪器102。如在本文使用的,当术语“可分离地接合”或“可移除地耦合”(或类似术语)用于描述在可移除盒和基本仪器之间的关系时,该术语意欲意指在可拆卸盒和基本仪器之间的连接是容易分离的,而不破坏基本仪器。相应地,可拆卸盒可以用电气方式可分离地接合到基本仪器,使得基本仪器的电触头不被破坏。可拆卸盒可以用机械方式可分离地接合到基本仪器,使得保持可拆卸盒的基本仪器的特征不被破坏。可拆卸盒可以用流体方式可分离地接合到基本仪器,使得基本仪器的端口不被破坏。例如基本仪器不被考虑为“被破坏”,如果只需要对部件的简单调节(或重新对准)或简单更换(例如更换喷嘴)。当部件可从彼此分离而没有在分离部件时花费过度的努力或相当大数量的时间时,部件(例如可拆卸盒104和基本仪器102)是可容易分离的。在一些实施方式中,可拆卸盒104和基本仪器102是可容易分离的,而不破坏可拆卸盒104或基本仪器102。
在一些实施方式中,可拆卸盒104可在与基本仪器102的活动期期间永久地被修改或部分地被损坏。例如,保持液体的容器可包括箔盖,其被刺穿以允许液体流经系统100。在这样的实施方式中,箔盖可被损坏,使得用另一容器更换损坏的容器可能是必要的。在特定的实施方式中,可拆卸盒104是一次性盒,以便在单次使用之后更换并可选地丢弃可拆卸盒104。
在其它实施方式中,可拆卸盒104可在与基本仪器102接合时在多于一个活动期期间被使用,和/或可从基本仪器102移除,重新被装有试剂,并重新接合到基本仪器102以进行额外的指定反应。相应地,可拆卸盒104可在一些情况下被整修,使得同一可拆卸盒104可与不同的消耗品一起被使用(例如反应组分和生物样品)。在从位于消费者的设施处的基本仪器移除盒之后,可在制造设施处执行整修。
如图1A所示,可拆卸盒104包括流体网络106,其可保持并引导穿过其的流体(例如液体或气体)。流体网络106包括能够存储流体和/或允许流体流经其的多个互连的流体元件。流体元件的非限制性例子包括通道、通道的端口、腔、存储模块、存储模块的储器、反应室、废物储器、检测室、用于反应和检测的多用室等。流体元件可以用指定方式流体地耦合到彼此,使得系统100能够执行样品制备和/或分析。
如在本文使用的,术语“流体地耦合”(或类似的术语)指连接在一起的两个空间区,使得液体或气体可在这两个空间区之间被引导。在一些情况下,流体耦合允许流体在这两个空间区之间来回被引导。在其它情况下,流体耦合是单向的,使得只有在这两个空间区之间的流动的一个方向。例如,化验储器可与通道流体地耦合,使得液体可从化验储器被运输到通道。然而在一些实施方式中,将通道中的流体引导回到化验储器也许不是可能的。在特定的实施方式中,流体网络106配置成接收生物样品并引导生物样品通过样品制备和/或样品分析。流体网络106可将生物样品和其它反应组分引导到废物储器。
一个或多个实施方式可包括将生物样品(例如模板核酸)保留在指定位置处,其中生物样品被分析。如在本文使用的,术语“保留”当关于生物样品被使用时包括实质上将生物样品附接到表面或将生物样品限制在指定空间内。如在本文使用的,术语“固定的”当关于生物样品被使用时包括实质上将生物样品附接到在固体支持架中或上的表面。固定可包括在分子级将生物样品附接到表面。例如,生物样品可使用包括非共价交互作用(例如静电力、范德瓦尔斯力和疏水界面的脱水)的吸收技术和共价结合技术(其中官能团或交联剂便于将生物样品附接到表面)来固定到衬底的表面。将生物样品固定到衬底的表面可基于衬底的表面的特性、携带生物样品的液体介质和生物样品本身的特性。在一些情况下,衬底表面可被功能化(例如化学地或物理地被改性)以便于将生物样品固定到衬底表面。衬底表面可首先被改性以具有被结合到表面的官能团。官能团可接着结合到生物样品以将生物样品固定到在其上。在一些情况下,生物样品可经由凝胶固定到表面,例如,如在美国专利公布号2011/0059865 A1和2014/0079923 A1中所述的,其中每个专利通过引用被全部并入本文。
在一些实施方式中,核酸可固定到表面并使用桥扩增而被扩增。例如在美国专利号5,641,658、WO 07/010251、美国专利号6,090,592、美国专利公布号2002/0055100 A1、美国专利号7,115,400、美国专利公布号2004/0096853 A1、美国专利公布号2004/0002090 A1、美国专利公布号2007/0128624 A1和美国专利公布号2008/0009420 A1中描述了有用的桥扩增方法,每个文件被全部并入本文。用于扩增在表面上的核酸的另一有用的方法是例如使用在下面更详细阐述的方法的滚环扩增(RCA)。在一些实施方式中,核酸可附接到表面并使用一个或多个引物对被扩增。例如,引物之一可以在溶液中,且另一引物可固定在表面上(例如5'-附着)。作为例子,核酸分子可杂化到在表面上的引物之一,后面是固定引物的延伸以产生核酸的第一拷贝。在溶液中的引物然后杂化到核酸的第一拷贝,核酸可使用核酸的第一拷贝作为模板来延伸。可选地,在核酸的第一拷贝产生之后,有机核酸分子可杂化到在表面上的第二固定引物,并可同时或在溶液中的引物被延伸之后延伸。在任何实施方式中,使用固定引物和在溶液中的引物的延伸(例如扩增)的重复循环提供核酸的多个拷贝。在一些实施方式中,生物样品可与配置成在生物样品的扩增(例如PCR)期间使用的反应组分一起被限制在预定空间内。
在所示实施方式中,可拆卸盒104包括具有多个壳体侧111-114的盒壳体110。壳体侧111-114包括非相配侧111-113和相配侧114。相配侧114配置成接合基本仪器102。在所示实施方式中,盒壳体110形成实质上整体的结构。在可选的实施方式中,盒壳体110可由一个或多个子部件构造,子部件由系统100的用户组合。在可拆卸盒104可分离地接合到基本仪器102之前或在子部件之一可分离地接合到基本仪器102之后,可组合子部件。例如,存储模块150可由第一子壳体(未示出)保持,且可拆卸盒104的其余部分(例如流体网络和成像设备)可包括第二子壳体(未示出)。第一和第二子壳体可组合以形成盒壳体110。
流体网络106由盒壳体110保持并包括对非相配侧112敞开的多个样品口116。在可选的实施方式中,样品口116可位于沿着非相配侧111或113处或可位于沿着相配侧114处。每个样品口116配置成接收生物样品。仅作为例子,生物样品可以是全血或唾液。在一些实施方式中,生物样品可以是核酸和用于进行PCR的其它材料(例如试剂、缓冲液等)。虽然在图1A中示出三个样品口116,实施方式可以只包括一个样品口、两个样品口或多于三个样品口。
流体网络106还包括对相配侧114敞开并暴露于盒壳体110的外部的流体耦合口118。流体耦合口118配置成流体地耦合到基本仪器102的系统泵119。流体耦合口118与泵通道133流体连通,泵通道133是流体网络106的部分。在系统100的操作期间,系统泵119配置成提供用于引起流体穿过泵通道133并穿过流体网络106的其余部分的流动的负压力。例如,系统泵119可引起生物样品从样品口116到样品制备区132的流动,其中生物样品可被准备好用于随后的分析。系统泵119可引起生物样品从样品制备区132到反应室126的流动,其中检测操作被进行以得到生物样品的数据(例如成像数据)。系统泵119也可引起流体从存储模块150的储器151、152到反应室126的流动。在检测操作被进行之后,系统泵119可引起流体到废物储器128内的流动。
除了流体网络106以外,可拆卸盒104还可包括可由基本仪器102控制的一个或多个机械接口装置117。例如,可拆卸盒104可包括具有可操作地耦合到流体网络106的多个流量控制阀121-123的阀组件120。每个流量控制阀121-123可代表由基本仪器102控制的机械接口装置117。例如,流量控制阀121-123可结合系统泵119的选择性激活来由基本仪器102选择性地激活或控制,以控制在流体网络106内的流体的流量。
例如,在所示实施方式中,流体网络106包括紧接着在样品口116的下游并与样品口116流体连通的样品通道131。在图1A中只示出单个样品通道131,但可选的实施方式可包括多个样品通道131。样品通道131可包括样品制备区132。阀组件120包括一对通道阀121、122。通道阀121、122可由基本仪器102选择性地激活以阻碍或阻止流体穿过样品通道131流动。在特定的实施方式中,通道阀121、122可被激活以形成将指定体积的液体保留在样品通道131的样品制备区132内的密封。在样品制备区132内的指定体积可包括生物样品。
阀组件120还可包括可移动阀123。可移动阀123可类似于可旋转阀组件1410(在图27A、27B中示出)。可移动阀123具有可包括在相应的端口之间延伸的至少一个流动通道140的阀主体138。阀主体138能够在不同的位置之间移动以使端口与流体网络106的相应端口对准。例如,可移动阀123的位置可确定流入反应室126内的流体的类型。在第一位置上,可移动阀123可与样品通道131的相应口对准以向反应室126提供生物样品。在第二位置上,可移动阀123可与储器通道161、162的一个或多个相应口对准,储器通道161、162分别与存储模块150的储器151、152流体连通。每个储器151、152配置成存储可用于进行指定反应的反应组分。储器通道161、162分别位于储器151、152的下游并与储器151、152流体连通。在一些实施方式中,可移动阀123可单独地移动到不同的位置以与储器通道的相应口对准。
在所示实施方式中,可移动阀123是配置成绕着轴142旋转的可旋转阀。相应地,可移动阀123在下文中被称为可旋转阀123。然而应理解,可选的实施方式可包括不旋转到不同的位置的可移动阀。在这样的实施方式中,可移动阀可在一个或多个线性方向上滑动以对准相应的端口。在本文阐述的可旋转阀和线性运动阀可类似于在于2013年3月15日提交的国际申请号PCT/US2013/032309中所述的装置,该国际申请通过引用被全部并入本文。
在一些实施方式中,生物样品由基本仪器102的光源158照亮。可选地,光源158可与可拆卸盒104合并在一起。例如,生物样品可包括一个或多个荧光团,其当被具有适当波长的光激发时提供光发射。在所示实施方式中,可拆卸盒104具有光路154。光路154配置成允许来自基本仪器102的光源158的照明光156入射在反应室126内的生物样品上。因此,反应室可具有一个或多个光学地透明的侧面或窗口。光路154可包括将照明光156主动引导到反应室126的一个或多个光学元件,例如透镜、反射器、光纤线路等。在示例性实施方式中,光源158可以是发光二极管(LED)。然而在可选的实施方式中,光源158可包括其它类型的光产生设备,例如激光器或灯。
在一些实施方式中,检测组件108包括成像检测器109和反应室126。成像检测器109配置成检测在反应室126内的指定反应。成像检测器109可类似于CMOS图像传感器262(在图40中示出)。在一些实施方式中,成像检测器109可相对于反应室126被定位以检测来自反应室126的光信号(例如吸收、反射/折射或光发射)。成像检测器109可包括一个或多个成像设备,例如电荷耦合设备(CCD)摄像机或互补金属氧化物半导体(CMOS)成像器。在一些实施方式中,成像检测器109可检测从化学发光发射的光信号。在又一些其它实施方式中,检测组件108可以不限于成像应用。例如,检测组件108可以是检测液体的电特性的一个或多个电极。
如在本文阐述的,基本仪器102配置成可操作地接合可拆卸盒104并控制在可拆卸盒104内的各种操作以进行指定反应和/或得到生物样品的数据。为此目的,相配侧114配置成允许或容许基本仪器102控制可拆卸盒104的一个或多个部件的操作。例如,相配侧114可包括允许阀121-123由基本仪器102控制的多个进入开口171-173。相配侧114也可包括配置成接纳基本仪器102的热块206的进入开口174。进入开口174沿着样品通道131延伸。如所示,进入开口171-174对相配侧114敞开。
基本仪器102具有配置成可分离地接合可拆卸盒104的相配侧114的控制侧202。可拆卸盒104的相配侧114和基本仪器102的控制侧202共同界定系统界面204。系统界面204表示在可拆卸盒104和基本仪器102之间的公共边界,基本仪器102和可拆卸盒104通过该公共边界可操作地被接合。更具体地,基本仪器102和可拆卸盒104沿着系统界面204可操作地被接合,使得基本仪器102可通过相配侧114控制可拆卸盒104的各种特征。例如,基本仪器102可具有控制可拆卸盒104的相应部件的一个或多个可控制的部件。
在一些实施方式中,基本仪器102和可拆卸盒104可操作地被接合,使得基本仪器102和可拆卸盒104在系统界面204处使用通过系统界面204建立的电耦合、热耦合、光耦合、阀耦合或流体耦合中的至少一个固定到彼此。在所示实施方式中,基本仪器102和可拆卸盒104配置成具有电耦合、热耦合、阀耦合和光耦合。更具体地,基本仪器102和可拆卸盒104可通过电耦合来传递数据和/或电功率。基本仪器102和可拆卸盒104可通过热耦合将热能输送到彼此和/或从彼此输送,且基本仪器102和可拆卸盒104可通过光耦合传递光信号(例如照明光)。
在所示实施方式中,系统界面204是单侧界面204。例如,控制侧202和壳体侧114通常是平面的并面向相反的方向。系统界面204是单侧的,使得可拆卸盒104和基本仪器102只通过相配侧114和控制侧202可操作地耦合到彼此。在可选的实施方式中,系统界面可以是多侧界面。例如,可拆卸盒的至少2、3、4或5个侧面可以是配置成与基本仪器耦合的相配侧。多个侧面可以是平面的,并可布置成彼此正交或相对(例如围绕矩形体积的全部或部分)。
为了控制可拆卸盒104的操作,基本仪器102可包括配置成可操作地接合流量控制阀121-123的阀致动器211-213、配置成从样品制备区132提供和/或移除热能的热块206以及电触头209的触头阵列208。基本仪器102还可包括沿着控制侧202定位的光源158。基本仪器102还可包括具有沿着控制侧202定位的控制口210的系统泵119。
系统100还可包括锁定机构176。在所示实施方式中,锁定机构176包括配置成接合可拆卸盒104的弹簧锁接合元件178的可旋转弹簧锁177。可选地,可拆卸盒104可包括可旋转弹簧锁177,且基本仪器102可包括弹簧锁接合元件178。当可拆卸盒104安装到基本仪器102时,弹簧锁177可旋转并接合锁定接合元件176。由锁定机构176产生的凸轮系统效应可将可拆卸盒104推动或驱动到基本仪器102以将可拆卸盒104固定到其。
基本仪器102可包括配置成接收用于进行指定测定协议的用户输入和/或配置成将关于化验的信息传递给用户的用户界面125。用户界面125可与基本仪器102合并。例如,用户界面125可包括触摸屏,其附接到基本仪器102的壳体并配置成识别来自用户的触摸和触摸相对于在触摸屏上显示的信息的位置。可选地,用户界面125可相对于基本仪器102被远程地定位。
基本仪器102还可包括配置成控制阀致动器211-213、热块206、触头阵列208、光源158或系统泵119中的至少一个操作的系统控制器220。系统控制器220在概念上被示为一系列电路模块,但可利用专用硬件板、DSP、处理器等的任何组合来实现。可选地,系统控制器220可利用具有单个处理器或多个处理器的现货供应的PC来实现,功能操作分布在处理器之间。作为另一选项,下面所述的电路模块可利用混合配置来实现,其中利用专用硬件来执行某些模块化功能,而利用现货供应的PC等来执行其余模块化功能。
系统控制器220可包括配置成控制基本仪器102和/或可拆卸盒104的某些部件的操作的多个电路模块221-224。例如,电路模块221可以是配置成控制穿过流体网络106的流体的流量的流量控制模块221。流量控制模块221可以可操作地耦合到阀致动器211-213和系统泵119。流量控制模块221可选择性地激活阀致动器211-213和系统泵119以引起穿过一个或多个路径的流体的流动和/或阻止穿过一个或多个路径的流体的流动。
仅作为例子,阀致动器213可以可旋转地接合可旋转阀123。阀致动器213可包括配置成驱动(例如旋转)阀致动器213的旋转电机214。流量控制阀221可激活阀致动器213以将可旋转阀123移动到第一旋转位置。在可旋转阀123在第一旋转位置上的情况下,流量控制模块221可激活系统泵219,从而将生物样品从样品制备区132取出并放入反应室126内。流量控制模块221可接着激活阀致动器213以将可旋转阀123移动到第二旋转位置。在可旋转阀123在第二旋转位置上的情况下,流量控制模块221可激活系统泵219,从而将反应组分中的一个或多个从相应的储器取出并放入反应室126内。在一些实施方式中,系统泵219可配置成提供正压力,使得流体在相反的方向上被主动泵送。这样的操作可用于将多个液体添加到公共储器内,从而混合在储器内的液体。相应地,流体耦合口118可允许流体(例如气体)离开盒壳体110或可将流体接纳到盒壳体110内。
系统控制器220还可包括热控制模块222。热控制模块222可控制热块206以提供和/或移除来自样品制备区132的热能。在一个特定的例子中,热块206可根据PCR协议来增加和/或降低由在样品通道131中的生物样品经历的温度。虽然未示出,系统100可包括相邻于样品制备区132定位的额外热设备。例如,可拆卸盒104可包括类似于柔性PCB加热器1412的热设备(在图27A、27B中示出)。
系统控制器220还可包括配置成控制检测组件108以得到关于生物样的数据的检测模块223。检测模块223可通过触头阵列208控制检测组件108的操作。例如,检测组件108可沿着相配侧114通信地接合到电触头196的触头阵列194。在一些实施方式中,电触头196可以是能够重新定位到相配侧114和能够从其重新定位的柔性触头(例如pogo触头或接触梁)。电触头196暴露于盒壳体的外部且电耦合到检测组件108。电触头196可被称为输入/输出(I/O)触头。当基本仪器102和可拆卸盒104可操作地被接合时,检测模块223可控制检测组件108以在预定时间或在预定时间段期间得到数据。作为例子,当生物样品具有附接到其的荧光团时,检测模块223可控制检测组件108以捕获反应室126的图像。可得到多个图像。
可选地,系统控制器220包括配置成分析数据以向系统100的用户提供至少部分结果的分析模块224。例如,分析模块224可分析由成像检测器109提供的成像数据。分析可包括识别生物样品的核酸的序列。
系统控制器220和/或电路模块221-224可包括一个或多个基于逻辑的设备,包括一个或多个微控制器、处理器、精简指令集计算机(RISC)、专用集成电路(ASIC)、现场可编程门阵列(FPGA)、逻辑电路和能够执行本文所述的功能的其它电路。在示例性实施方式中,系统控制器220和/或电路模块221-224执行存储在其中的一组指令,以便执行一个或多个测定协议。存储元件可以呈在基本仪器102和/或可拆卸盒104内的信息源或物理存储器元件的形式。由化验系统100执行的协议可以是执行例如DNA或RNA的定量分析、蛋白质分析、DNA测序(例如合成测序(SBS))、样品制备和/或用于测序的片段库的制备。
这组指令可包括指示系统100执行特定的操作例如本文所述的各种实施方式的方法和过程的各种命令。这组指令可以在软件程序的形式中。如在本文使用的,术语“软件”和“固件”是可互换的,并包括存储在存储器——包括RAM存储器、ROM存储器、EPROM存储器、EEPROM存储器和非易失性RAM(NVRAM)存储器——中用于由计算机执行的任何计算机程序。上面的存储器类型仅仅是示例性的,且因此不限于可用于计算机程序的存储的存储器的类型。
软件可以在各种形式例如系统软件或应用软件中。此外,软件可以在单独程序的集合或在较大程序内的程序模块或程序模块的一部分的形式中。软件还可包括在面向对象的编程的形式中的模块化编程。在得到检测数据之后,检测数据可由系统100自动处理,响应于用户输入而被处理,或响应于由另一处理机器作出的请求(例如通过通信链路的远程请求)而被处理。
系统控制器220可经由通信链路连接到系统100的其它部件或子系统,通信链路可以是硬连线的或无线的。系统控制器220也可通信地连接到装置外系统或服务器。系统控制器220可从用户接口(未示出)接收用户输入或命令。用户接口可包括键盘、鼠标、触摸屏面板和/或语音识别系统等。
系统控制器220可用来提供处理能力,例如存储、解释和/或执行软件指令以及控制系统100的总体操作。系统控制器220可被配置和/或编程以控制各种部件的数据和/或功率方面。虽然系统控制器220在图1A中被表示为单个结构,应理解,系统控制器220可包括在不同的位置处分布在整个系统100中的多个单独的部件(例如处理器)。在一些实施方式中,一个或多个部件可与基本仪器集成在一起,且一个或多个部件可相对于基本仪器被远程地定位。
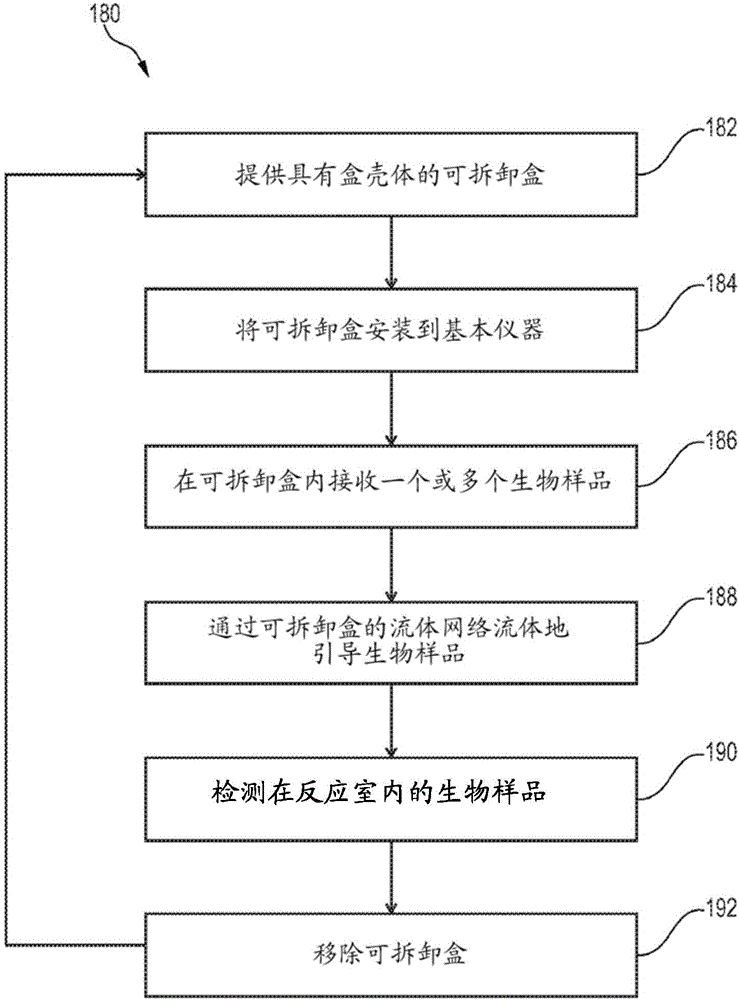
图1B是示出进行用于样品制备或样品分析中的至少一个的指定反应的方法180的流程图。在特定的实施方式中,方法180可包括测序核酸。方法180可使用在本文讨论的各种实施方式(例如系统和/或方法)的结构或方面。在各种实施方式中,某些步骤可被省略或添加,某些步骤可被组合,某些步骤可同时被执行,某些步骤可并行地被执行,某些步骤可分成多个步骤,某些步骤可以按不同的顺序被执行,或某些步骤或步骤的系列可以用迭代的方式被重新执行。
例如,方法180可包括在182提供具有盒壳体的可拆卸盒。可拆卸盒可包括布置在盒壳体内的流体网络。可拆卸盒还可包括可操作地耦合到流体网络且相对于流体网络可移动的流量控制阀。流量控制阀可以是例如通道阀或可移动阀,例如可旋转阀。盒壳体可包括界定可移动盒的外部的壳体侧。
方法180还可包括在184将可拆卸盒安装(例如接触)到基本仪器。可拆卸盒的壳体侧可以可分离地接合基本仪器的控制侧以共同界定系统界面。基本仪器包括通过系统界面来接合流量控制阀的阀致动器。例如,阀致动器可包括离开控制侧并沿着可拆卸盒的壳体侧插入进入开口内的细长主体。可选地,阀致动器直接接合流量控制阀的一部分。
在186,一个或多个生物样品可由可拆卸盒接纳。例如,用户可使用吸移管来将生物样品添加到与流体网络流体连通的样品口。在186的接纳可出现于在184的接触之前或之后。方法180可包括在188流体地引导生物样品流经可拆卸盒的流体网络以进行在盒中的样品分析或样品制备中的至少一个。例如,生物样品可被引导到流体网络的样品制备区,其中生物样品的流量由在流量控制阀上的阀致动器的行动控制。生物样品可经历扩增过程,例如PCR,同时生物样品在样品制备区内被密封。作为另一例子,可引导生物样品流到反应室内,其中生物样品的流量由在流量控制阀上的阀致动器的行动控制。
可选地,在190,方法180包括使用成像检测器来检测被引导到反应室的生物样品。检测组件可由可拆卸盒或基本仪器中的至少一个保持。例如,检测组件可被合并在可拆卸盒内。基本仪器可以电耦合到检测组件以控制检测组件的操作。可选地,在186流体地引导生物样品和/或在190使生物样品成像可根据预定的计划表或顺序重复多次。
在一些实施方式中,方法180包括在192从基本仪器移除可拆卸盒。在测定协议完成之后,可从基本仪器移除可拆卸盒。在一些情况下,可拆卸盒可被重新填充或整修。例如,可拆卸盒被消毒和/或杀菌,且用过的存储模块可由新的存储模块代替。方法1800可接着返回到182,其中另一可拆卸盒在184相对于同一基本模块被提供和安装。以与第一可拆卸盒类似的方式,第二可拆卸盒的壳体侧可可分离地接合基本仪器的控制侧以共同界定系统界面。
图2是配置成进行生物化学分析或样品制备中的至少一个的系统300的示意图。系统300可包括与系统100(图1A)相同或相似的特征。例如,系统300包括基本仪器302和配置成可分离地接合基本仪器302的可拆卸盒304。基本仪器302和可拆卸盒304可具有分别与基本仪器102和可拆卸盒104(在图1A中示出)相似的特征。如图2所示,基本仪器302具有包括仪器侧306和对仪器侧306敞开的盒接纳槽308的仪器壳体303。在一些实施方式中,仪器侧306可代表相对于重力的基本仪器302的顶部,并部分地形成仪器壳体303的外部。在所示实施方式中,盒接纳槽308由仪器壳体303的内部对接侧或控制侧311-313界定。控制侧311和313彼此相对,且控制侧312在控制侧311、313之间延伸。控制侧312可以面对到盒接纳槽308的开口316。
可拆卸盒304依尺寸被制造并成形为布置在盒接纳槽308内,并可操作地接合基本仪器302。如所示,可拆卸盒304包括具有壳体侧321-324的盒壳体320。壳体侧321-323配置成可操作地接合对接侧或控制侧
311-313,使得基本仪器302和可拆卸盒304建立电耦合、热耦合、光耦合和/或流体耦合中的至少一个。因此,壳体侧321-323在下文中被称为相配侧321-323。壳体侧324不可操作地接合基本仪器302。相应地,壳体侧324可被称为非相配侧324。
类似于可拆卸盒104(图1A),可拆卸盒304包括用于控制在可拆卸盒304内的操作以进行指定反应的多个特征和部件。例如,可拆卸盒304具有对非相配侧324敞开并配置成接纳一个或多个生物样品的样品口330。可选地,样品口330可对相配侧321-323之一敞开。在这样的实施方式中,在可拆卸盒304被装入盒接纳槽308内之前,生物样品可布置在样品口330内。
可拆卸盒304还可包括具有样品制备区334的流体网络332。流体网络332可包括或流体地互连可拆卸盒304的多个其它部件,例如存储模块336、可移动阀338、具有成像检测器342的检测组件340和废物储器344。可选地,可拆卸盒304还可包括光路346和触头阵列348。可拆卸盒304的部件可类似于上面关于可拆卸盒304所述的部件。
基本仪器302可具有可操作地接合可拆卸盒304以进行指定反应的相应部件。例如,基本仪器302可包括热块350、阀致动器352、光源356、触头阵列358和系统泵360。当可拆卸盒304被装入盒接纳槽308内时或在可拆卸盒304被装入盒接纳槽308之后,可拆卸盒304和基本仪器302可彼此接合。更具体地,当可拆卸盒304可操作地被装入基本仪器302时,热块350可位于接近样品制备区334处,阀致动器352可以可操作地接合可移动阀338,光源356可通信地耦合到光路346,触头阵列358可以电气地接合触头阵列348,且系统泵360可连通地接合流体网络332。相应地,可拆卸盒304可以用与可拆卸盒104由基本仪器102控制类似的方式由基本仪器302控制。
基本仪器302可配置成基于控制侧311-313或相配侧321-323来允许可拆卸盒304自由地插入盒接纳槽308内而不损坏部件。例如,基本仪器302的一个或多个部件朝着可拆卸盒304偏置或朝着可拆卸盒304移动。在一些实施方式中,热块350和阀致动器352固定到部件支持架362。在可拆卸盒304布置在盒接纳槽308内之后,部件支持架362可朝着相配侧321偏置或朝着相配侧321移动。以类似的方式,系统泵360可固定到部件支持架364。在可拆卸盒304布置在盒接纳槽308内之后,部件支持架364可朝着相配侧323偏置或朝着相配侧323移动。
部件支持架362、364可由系统控制器370自动激活。例如,系统控制器370可确定可拆卸盒304被装入或已经装入到盒接纳槽308内。系统控制器370可接着激活驱动机构或多个机构以朝着相配侧321、323驱动部件支持架362、364。可选地,部件支持架362、364可以可操作地链接到一个或多个操作员控制的机构,其一旦由系统300的用户激活就可分别朝着相配侧321、323驱动部件支持架362、364。相应地,基本仪器302可配置成允许可拆卸盒304自由地前进(例如没有实质性钩住或踢碰)到盒接纳槽308内。
本文阐述的实施方式包括其中可拆卸盒和基本仪器可形成多侧的系统界面的系统。例如,每个相配侧321-323可操作地接合界定盒接纳槽308的相应的控制侧。相配侧321-323和相应的控制侧311-313共同界定系统界面,其可被称为多侧界面。这样的实施方式对使由可拆卸盒304经历的力平衡可以是合乎需要的。例如,热块350和阀致动器352可在第一方向(如由箭头指示的)上施加力374。系统泵360在相反的第二方向(如由箭头指示的)上施加力376。在触头阵列348、358之间的交互作用也可提供力376的一部分。
在一些实施方式中,至少一个力374、376便于提供在相应的部件之间的密切接触。例如,力374可提供在热块350和样品制备区334之间的密切接触以实现样品制备区334的热控制。同样,力374可允许阀致动器352和可移动阀338适当地接合彼此,使得阀致动器352可选择性地控制可移动阀338。力376可实现在触头阵列348、358的相应电触头之间的密切接触。
图3和4示出包括具有相应的基本仪器和可拆卸盒的不同系统,且特别是示出可由一个或多个实施方式利用的不同多侧界面。例如,图3是包括基本仪器402和可拆卸盒404的系统400的端视图。基本仪器402包括依尺寸被制造并成形为接纳可拆卸盒404的开放侧凹部406。如所示,开放侧凹部406由相对于彼此朝向相垂直的方向的第一和第二控制侧411、412形成。更具体地,第一和第二控制侧411、412形成L形凹部。第一和第二控制侧411、412可操作地分别接合可拆卸盒404的第一和第二相配侧413、414。多侧界面415在第一控制侧411和第一相配侧413与第二控制侧412和第二相配侧414之间共同形成。更具体地,可沿着第一和第二相配侧413、414中的每个建立阀耦合、流体耦合、电耦合、光耦合或热耦合中的至少一个。
图4是包括基本仪器422和可拆卸盒424的系统420的自顶向下视图。基本仪器422包括盒接纳槽426,其可与盒接纳槽308(图2)类似或相同。盒接纳槽426依尺寸被制造和成形以接纳可拆卸盒424。如所示,盒接纳槽426由控制侧431-434形成。控制侧431、433彼此相对,且控制侧432、434彼此相对。控制侧431-434分别可操作地接合可拆卸盒424的相配侧441-444。多侧界面427在可拆卸盒424的相应侧和基本仪器422之间共同形成。
图5-12示出不同的阀控机构,基本仪器可通过阀控机构来控制(例如调节)穿过可拆卸盒的流体网络的流量。图5-12中的每个示出系统的横截面,其中阀耦合通过系统界面在基本仪器和可拆卸盒之间建立。图5-12中的每个示出通道阀,其中基本仪器可激活通道阀以打开并闭合相应的通道。例如,图5和6示出可类似于上面所述的系统例如系统100(图1A)、300(图2)、400(图3)、420(图4)的系统500的一部分。
图5和6示出具有沿着系统界面506可操作地接合的基本仪器502和可拆卸盒504的系统500的一部分的横截面。如所示,可拆卸盒504具有盒壳体508和由盒壳体508保持的微流体主体510。在所示实施方式中,微流体主体510包括并排堆叠的多个层521-523。层521-523可以是印刷电路板(PCB)层,例如下面关于图14-75所述的那些层。一个或多个层521-523可被蚀刻,使得当层5212-523并排堆叠时,微流体主体510形成样品通道526。样品通道526是流体网络例如流体网络106(图1A)的一部分,并包括阀或内腔528。
可拆卸盒504包括配置成调节穿过样品通道526的流体的流量的通道阀530。例如,通道阀530可允许最大净空,使得流体可以不受阻地流动。通道阀530还可阻碍流体穿过其流动。如在本文使用的,术语“阻碍”可包括减慢流体的流动或完全阻止流体的流动。如所示,样品通道530包括与阀腔528流体连通的第一和第二口532、534。流体配置成穿过第一口532流到阀腔528内并穿过第二口534流出阀腔528。在所示实施方式中,通道阀530构成柔性膜,其能够在第一和第二条件之间弯曲。柔性膜在图5中处于第一条件中,在图6中处于第二条件。在特定的实施方式中,柔性膜是柔性层,例如膜层918(在图23A、23B中示出)。柔性层配置成被推到阀腔528内以阻止流体穿过其流动。在可选的实施方式中,通道阀530可以是能够在不同的条件或位置之间移动以调节流体的流量的物理元件。
还示出,基本仪器502包括配置成激活通道阀530的阀致动器540。例如,阀致动器540可使柔性膜在第一和第二条件之间弯曲。阀致动器540包括穿过系统界面506延伸的细长主体542,例如柱或棒。更具体地,细长主体542离开基本仪器502的控制侧544。可拆卸盒504具有接纳阀致动器540的进入开口546。进入开口546对可拆卸盒504的相配侧548敞开。如所示,细长主体542远离控制侧544突出并进入相配侧548的进入开口546内。进入开口546允许阀致动器540直接接合通道阀530,其在所示实施方式中是柔性膜。在图5中,阀致动器540在第一状态或位置中。在图6中,阀致动器540在第二状态或位置中。在第二位置上,法致动器540朝着通道阀530移动了一段距离并与通道阀530接合。阀致动器540可使通道阀530变形,使得通道阀530覆盖第一口532。因此,穿过第一口532的流体流被通道阀530阻挡。
在一些实施方式中,系统500可具有与在图5和6中所示的通道阀530类似或相同的第一和第二通道阀,其中第一通道阀相对于流体网络的样品制备区(未示出)在上游,且第二通道阀相对于样品制备区在下游。因此,第一和第二通道阀可将可包含生物样品的流体有效地密封在样品制备区内。具有生物样品的流体可接着被加热以使流体受到扩增协议,例如PCR协议。
图7和8示出具有沿着系统界面556可操作地接合的基本仪器552和可拆卸盒554的系统550的一部分的横截面。基本仪器552和可拆卸盒554可类似于分别在图5和6中所示的基本仪器502和可拆卸盒504。基本仪器552具有带有细长主体592例如喷嘴的阀致动器590,细长主体592离开基本仪器552的控制侧594并被插入可拆卸盒554的相配侧598的进入开口596内。阀致动器590穿过系统界面556延伸。可选地,基本仪器552可包括围绕细长主体592并密封进入开口596以提供封闭室的密封构件595,例如O形环。在示例性实施方式中,可拆卸盒554包括由阀致动器590气动地激活的通道阀580,其可以是柔性膜。更具体地,阀致动器590配置成提供流体(例如空气)以增加在封闭室内的压力,从而使通道阀580变形。当通道阀580变形时,通道阀可覆盖样品通道576的第一口582,从而阻止穿过样品通道576的流动。
图9-10示出类似于系统500和550的系统600。更具体地,图9-10示出具有沿着系统界面606可操作地接合的基本仪器602和可拆卸盒604的系统600。可拆卸盒604包括由基本仪器602的阀致动器640可旋转地接合的可移动阀630。可移动阀630是平面主体,其被成形为当在第一旋转位置(在图9中示出)上时允许穿过样品通道626的流动而当在第二旋转位置(在图10中示出)上时阻止穿过样品通道626的流动。更具体地,可移动阀630当在第二旋转位置上时可覆盖口632。
图11是具有微流体主体702和可旋转阀704的可拆卸盒700的被暴露部分的透视图。可拆卸盒700可类似于可拆卸盒104(图1)和本文所述的其它可拆卸盒。可旋转阀704可类似于可移动阀123(图1)。可旋转阀704配置成可旋转地安装到微流体主体702的主体侧或表面706。可旋转阀704具有配置成当绕着轴710旋转时可滑动地接合主体侧706的流体侧708。流体主体702可包括具有多个样品通道763、764、多个储器通道765和进料通道766的流体网络760。通道763-766是分立通道。例如,通道763-766能够基于可旋转阀704的旋转位置而断开。
通道763-766具有对主体侧706敞开的相应口。在所示实施方式中,四个样品通道763与单个样品通道764流体连通。因此,样品通道763可被称为通道部分,且样品通道764可被称为公共样品通道。每个样品通道763可操作地耦合到一对通道阀761、762。通道阀761、762可类似于本文所述的通道阀,例如通道阀530。当在相应的闭合位置上时,通道阀761、762可密封包含相应的生物样品的液体。在一些实施方式中,样品通道763相邻于热控制区域770而延伸。当生物样品被密封在相应的样品通道763中时,加热元件(未示出)和热块(未示出)可定位成相邻于热控制区域770。加热元件和热块可协调以增加和/或降低在样品通道763内的生物样品所经历的温度。在这样的实施方式中,样品通道763可构成样品制备区。
进料通道766与反应室716流体连通,且储器通道765可与存储模块(未示出)的相应储器(未示出)流体连通。样品通道764具有网络口721,进料通道766具有进料口722,以及储器通道765具有相应的储器口723。网络口721、进料口722和储器口723对主体侧706敞开。储器口723通过相应的储器通道765与相应的模块口724流体连通。如所示,模块口724可位于远离进料口722或轴710沿着主体侧706的各种位置处。模块口724配置成流体地耦合到储器(未示出)。模块口724可具有基于储器的尺寸的位置。
在所示实施方式中,微流体主体702具有直接互连到可旋转阀704的总共15个通道。更具体地,只有一个样品通道764和只有一个进料通道766但13个储器通道765可直接互连(流体地)到可旋转阀704。在其它实施方式中,微流体主体702可包括与可旋转阀704直接互连的多个样品通道764和/或多个进料通道766。每个样品通道763可流体地耦合到配置成从用户接收生物样品的相应的样品口(未示出)。
流体侧708配置成在阀接纳区域728处可滑动地接合主体侧706。可旋转阀704依尺寸被制造和成形为使得流体侧708沿着主体侧706覆盖阀接纳区域728和一个或多个口721-723。可旋转阀704包括配置成将进料口722流体地互连到一个或多个口721、723的流动通道744(在图12中示出)。可旋转阀704可基于可旋转阀704的位置和配置来阻止穿过一个或多个口的流动并允许通过一个或多个其它口的流动。
图12示出可与阀致动器730可操作地接合的可旋转阀704的横截面。更具体地,可旋转阀704包括具有流体侧708和操作侧734的阀主体732。操作侧734可包括配置成接合阀致动器730的机械接口装置736。在所示实施方式中,机械接口装置736包括与轴710重合的平面主体或鳍片。阀致动器730包括配置成接纳机械接口装置736的槽738,使得阀致动器730可操作地接合可旋转阀704。更具体地,阀致动器730可接合可旋转阀704,使得阀致动器730能够绕着轴710旋转可旋转阀704。
流体侧708包括多个阀口740、742和在阀口740、742之间延伸的流动通道到744。流体侧708在阀接纳区域728处可滑动地接合到主体表面706。在所示实施方式中,可旋转阀704包括仅仅两个阀口740、742和仅仅一个流动通道744。在其它实施方式中,可旋转阀704可包括多于两个阀口和/或多于一个流动通道。
如图12所示,进料口722与阀口740流体地对准和耦合,且阀口742与网络口721流体地对准和耦合。基于可旋转阀704的旋转位置,阀口742也可流体地耦合到部件口723之一。如上面提到的,可旋转阀704配置成绕着轴710旋转。在一些实施方式中,进料口722和阀口740定位成使得进料口722和阀口740与轴710对准。更具体地,轴710穿过进料口722和阀口740中的每个延伸。
当阀致动器730可操作地接合到可旋转阀704时,阀致动器730可在逆着主体侧706的方向上施加致动器力748。在这样的实施方式中,致动器力748可足以密封在阀口740、742之间的流动通道744并密封储器口723和/或网络口721。
相应地,可旋转阀704可在第一旋转位置处流体地耦合进料口722和网络口721,并在第二旋转位置处流体地耦合进料口722和相应的储器口723。当可旋转阀704在不同的旋转位置之间旋转时,可旋转阀704有效地改变流体网络的流径。
流体可穿过流动通道744在任一方向上流动。例如,系统泵(未示出)例如系统泵119(图1)可与进料口722流体连通。系统泵可产生吸力,其拉流体穿过网络口721(或相应的储器口723)并接着进入流动通道744内并接着穿过进料口722。可选地,系统泵可提供使流体在流动通道744内移动的正压力,使得流体流经进料口722接着进入流动通道744并接着穿过网络口721(或相应的储器口723)。
图13是示出网络口721、进料口722和储器口723的主体侧706的自顶向下视图。在两个不同的旋转位置上表示流动通道744。储器口723可包括储器口723A-723D。每个储器口723A-723D通过相应的储器通道765(图10)流体地耦合到相应的储器。更具体地,储器口723A流体地耦合到氢化缓冲器,储器口723B流体地耦合到核苷酸溶液,储器口723C流体地耦合到洗液,以及储器口723D流体地耦合到裂解液。如上所述,基于可旋转阀704(图11)的旋转位置,流动通道744可将进料口722流体地耦合到样品通道763、764或相应的储器。
表1示出合成测序(SBS)协议的各种状态,但应理解,其它测定协议可被实现。在阶段1,流动通道744具有流体地耦合网络口721和进料口722的旋转位置。在阶段1,通道阀(未示出)可选择性地被激活以将第二、第三和第四生物样品密封在相应的样品制备区内,但允许第一生物样品穿过网络口721流动。相应地,在阶段1,系统泵可施加将第一生物样品拉到流动通道744内的吸力。在阶段2,可旋转阀704旋转到第二旋转位置,同时第一生物样品存储在流动通道744内,使得流动通道744流体地耦合储器口723A和进料口722。在第二旋转位置上,系统泵可提供推第一生物样品穿过储器口723A并进入氢化缓冲器储器内的正位移力。
在阶段3,可旋转阀704旋转回到第一旋转位置,且通道阀选择性地被激活,使得第二生物样品可被拉到流动通道744内。在阶段4,可旋转阀704旋转回到第二旋转位置,同时第一生物样品存储在流动通道744内,且第二生物样品被添加到具有第一生物样品的氢化缓冲器。在阶段5-8期间,第三和第四生物样品从相应的样品制备区被移除并添加到氢化缓冲器。相应地,四个生物样品可存储在具有氢化缓冲器的单个储器内。反应可对生物样品和氢化缓冲液出现,氢化缓冲液使生物样品准备用于SBS测序。
在阶段9,组合的生物样品/氢化缓冲液被引出而穿过储器口723A、穿过流动通道744、穿过进料口722并进入反应室(未示出)内。生物样品可固定到界定反应室的表面。例如,可形成包括生物样品的簇。阶段10-13代表测序循环。在阶段10,可旋转阀704可以在第三旋转位置处,使得核苷酸溶液可被引出而穿过流动通道744并进入反应室内。在这样的时间,可将碱基掺入到相应的生物样品(例如模板核酸)内。在阶段11,可旋转阀704可以在第四旋转位置处,使得洗液可流经反应室并远离反应室传送核苷酸溶液。在阶段11之后,反应室可由成像检测器成像。从簇发射的光的颜色可用于识别由簇合并的碱基。在阶段12,可旋转阀704可在第四旋转位置处,使得裂解液可流经反应室,且荧光团(以及如果存在,可逆终止剂部分)可从簇移除。在阶段13,可旋转阀704可再次在第三旋转位置处,且洗液可流经反应室以移除裂解液。阶段10-13可重复,直到测序结束为止和/或直到试剂被耗尽为止。
表1
可结合美国临时专利申请号61/951,462(律师档案号IP-1210-PRV296PRV2)(在下文中的“’462申请”)的主题来使用上面提到的实施方式,该临时专利通过引用被全部并入本文。下面提供’462申请的至少一部分。
可结合各种核酸测序技术来使用本文所述的方法。特别可适用的技术是这些技术,其中核酸附着在阵列中的固定位置处,使得它们的相对位置不改变,以及其中阵列重复地被检测或成像。下面的实施方式是特别可适用的:图像在例如与用于区分开一个核苷酸碱基类型与另一核苷酸碱基类型的不同标记重合的不同颜色通道中被得到。在一些实施方式中,确定目标核酸的核苷酸序列的过程可以是自动化过程。优选的实施方式包括合成测序(“SBS”)技术。
“合成测序(“SBS”)技术”通常涉及对照模板链通过核苷酸的重复添加的初生核酸链的酶延伸。在SBS的传统方法中,单核苷酸单体可在每次输送中在存在多聚酶的情况下被提供到目标核苷酸。然而在本文所述的方法中,多于一种类型的核苷酸单体可在输送中在存在多聚酶的情况下被提供到目标核酸。
SBS可利用具有终止剂部分的核苷酸单体或缺乏任何终止剂部分的核苷酸单体。利用缺乏终止剂的核苷酸单体的方法包括例如焦磷酸测序和使用伽马-磷酸盐标记的核苷酸的测序,如在下面更详细阐述的。在使用缺乏终止剂的核苷酸单体的方法中,在每次循环中添加的核苷酸的数量通常是可变的并取决于模板序列和核苷酸输送的模式。对于利用具有终止剂部分的核苷酸单体的SBS技术,终止剂在所使用测序条件下可以实际上是不可逆的,如对利用双脱氧核苷酸的传统Sanger测序情况就是这样,或终止剂可以是可逆的,如对由Solexa(现在的Illumina有限公司)开发的测序方法情况就是这样。
SBS技术可利用具有标记部分的核苷酸单体或缺乏标记部分的核苷酸单体。相应地,可基于标记的特性例如标记的荧光性、核苷酸单体的特性例如分子量或电荷、核苷酸的掺入的副产物例如质子或焦碳酸盐的释放等来检测掺入事件。在两个或多个不同的核苷酸存在于测序试剂中的实施方式中,不同的核苷酸可彼此区分开,或可选地,两个或多个不同的标记可以在所使用的检测技术下是不可区别的。例如,存在于测序试剂中的不同的核苷酸可具有不同的标记,且它们可使用如由Solexa(现在的Illumina有限公司)开发的测序方法例示的适当的光学器件而被区分开。
在另一示例性类型的SBS中,循环测序由包含例如可裂解的或光可漂白的染料标记的可逆终止剂核苷酸的逐步添加来完成,如例如在国际专利公布号WO 04/018497和美国专利7,057,026中所述的,这两个专利的公开通过引用被并入本文。这个方法由Illumina有限公司商业化,且也在国际专利公布号WO 91/06678和国际专利公布号WO 07/123,744中被描述,每个专利通过引用被并入本文。荧光地标记的终止剂(其中终止可以是可逆的,且荧光标记可被裂解)的可用性便于有效的循环可逆终止(CRT)测序。多聚酶也可被共同设计以有效地合并这些修改的核苷酸并从这些修改的核苷酸延伸。
优选地,在基于可逆终止剂的测序实施方式中,标记在SBS反应条件下实质上不抑制延伸。然而,检测标记可例如通过裂解或降解而可移除。可在标记合并到阵列式核酸特征内之后捕获图像。在特定的实施方式中,每个循环涉及四种不同的核苷酸类型到阵列的同时输送,且每个核苷酸类型具有在频谱上不同的标记。四个图像可接着被得到,每个使用为四个不同的标记之一选择的检测通道。可选地,可顺序地添加不同的核苷酸类型,且可在每个添加步骤之间得到阵列的图像。在这样的实施方式中,每个图像将显示掺入了特定类型的核苷酸的核酸特征。由于每个特征的不同的序列内容,在不同的图像中存在或缺乏不同的特征。然而,特征的相对位置将在图像中保持不变。从这样的可逆终止剂-SBS方法得到的图像可以如在本文阐述的被存储、处理和/或分析。在图像捕获步骤之后,标记可被移除且可逆终止剂部分可被移除,用于核苷酸添加和检测的随后循环。标记在它们在特定的循环中被检测到之后和在随后的循环之前的移除可提供减小背景信号和在循环之间的串扰的优点。下面阐述有用的标记和移除方法的例子。
在特定的实施方式中,一些或所有核苷酸单体可包括可逆终止剂。在这样的实施方式中,可逆终止剂/可裂解荧光体可包括经由3'酯键链接到核酸部分的荧光体(Metzker,Genome Res.15:1767-1776(2005),其通过引用被并入本文)。其它方法使终止剂化学品与荧光标记的裂解分离(Ruparel等人,Proc Natl Acad Sci USA 102:5932-7(2005),其通过引用被全部并入本文)。Ruparel等人描述了使用小3'烯丙基族来阻止延伸但可容易通过简短处理使用钯催化剂来解封锁的可逆终止剂的发展。荧光团经由光可裂解交联剂被附接到碱基,光可裂解交联剂可容易通过对长波长UV光的30秒暴露被裂解。因此,二硫化物还原或光裂解可用作可裂解的交联剂。可逆终止的另一方法是在将大量的染料放置在dNTP上之后保证的天然终止剂的使用。在dNTP上的带电大量染料的存在可通过空间和/或静电阻碍来充当有效的终止剂。一个掺入事件的存在防止进一步的掺入,除非染料被移除。染料的裂解移除了荧光体并有效地使终止反转。在美国专利7,427,673和美国专利7,057,026中描述了修改的核苷酸的例子,这些专利的公开通过引用被全部并入本文。
在美国专利公布号2007/0166705、美国专利公布号2006/0188901、美国专利7,057,026、美国专利公布号2006/0240439、美国专利公布号2006/0281109、国际专利公布号WO 05/065814、美国专利公布号2005/0100900、国际专利公布号WO 06/064199、国际专利公布号WO07/010,251、美国专利公布号2012/0270305和美国专利公布号2013/0260372中描述了可与本文所述的方法和系统一起被利用的额外的示例性SBS系统和方法。
一些实施方式可利用使用少于四个不同的标记的四个不同的核苷酸的检测。例如,可利用在美国专利号2013/0079232的合并的材料中所述的方法和系统来执行SBS。作为第一例子,一对核苷酸类型可在同一波长处被检测到,但基于这对的一个成员的与另一成员比较的在强度中的差异或基于对这对的一个成员的变化(例如经由化学修改、光化学修改或物理修改)而被区分,与对该对的另一成员检测到的信号比较,该变化使表观信号出现或消失。作为第二例子,四个不同的核苷酸类型中的三个可在特定的条件之下被检测到,而第四“暗状态”核苷酸类型缺乏在那些条件下可检测或在那些条件下最低限度地被检测(例如由于背景荧光的最少检测等)的标记。前三个核苷酸类型到核酸内的掺入可基于它们的相应信号的存在来被确定,以及第四核苷酸类型到核酸内的掺入可基于任何信号的缺乏或最少检测来被确定。作为第三例子,一个核苷酸类型可包括在两个不同的通道中检测的标记,而其它核苷酸类型在不多于一个通道中被检测。前面提到的三个示例性配置不被考虑为相互排他的,且可在各种组合中被使用。组合所有三个例子的示例性实施方式是基于荧光的SBS方法,其使用在第一通道中检测的第一核苷酸类型(例如具有当由第一激发波长激发时在第一通道中检测到的标记的dATP)、在第二通道中检测的第二核苷酸类型(例如具有当由第二激发波长激发时在第二通道中检测到的标记的dCTP)、在第一和第二通道中检测的第三核苷酸类型(例如具有当由第一和/或第二激发波长激发时在这两个通道中检测到的至少一个标记的dTTP)以及缺乏在任一通道中没有或最低限度地检测的第四核苷酸类型(例如没有标记的dGTP)。
此外,如在美国专利公布号2013/0079232的并入的资料中所述的,可使用单个通道来得到测序数据。在这样的所谓的单染料测序方法中,第一核苷酸类型被标记出,但标记在第一图像产生之后被移除,且第二核苷酸类型只在第一图像产生之后被标记。第三核苷酸类型将它的标记保持在第一和第二图像中,且第四核苷酸类型将它的标记保持在这两个图像中。
一些实施方式可通过络合物形成来利用测序。这样的技术利用DNA连接酶来掺入寡核苷酸并识别这样的寡核苷酸的掺入。寡核苷酸一般具有与寡核苷酸杂化到的序列中的特定核苷酸的同一性关联的不同的标记。如同其它SBS方法一样,可在核酸特征的阵列的处理之后使用所标记的测序试剂得到图像。每个图像将显示具有特定类型的掺入的标记的核酸特征。由于每个特征的不同序列内容,在不同的图像中存在或缺乏不同的特征,但特征的相对位置将在图像中保持不变。从基于络合物形成的测序方法得到的图像可以如在本文阐述的被存储、处理和/或分析。在美国专利6,969,488、美国专利6,172,218和美国专利6,306,597中描述了可与本文所述的方法和系统一起被利用的示例性测序系统和方法。
一些实施方式可利用纳米孔测序(Deamer,D.W.&Akeson,M."Nanopores and nucleic acids:prospects for ultrarapid sequencing."Trends Biotechnol.18,147-151(2000);Deamer,D.和D.Branton,"Characterization of nucleic acids by nanopore analysis".Acc.Chem.Res.35:817-825(2002);Li,J,M.Gershow,D.Stein,E.Brandin和J.A.Golovchenko,"DNA molecules and configurations in a solid-state nanopore microscope"Nat.Mater.2:611-615(2003),这些文献的公开通过引用被全部并入本文)。在这样的实施方式中,目标核酸经过纳米孔。纳米孔可以是合成孔或生物膜蛋白质,例如α溶血素。当目标核酸经过纳米孔时,可通过测量在孔的电导率中的波动来识别每个碱基对。(美国专利7,001,792;Soni,G.V.&Meller,"A.Progress toward ultrafast DNA sequencing using solid-state nanopores."Clin.Chem.53,1996-2001(2007);Healy,K."Nanopore-based single-molecule DNA analysis."Nanomed.2,459-481(2007);Cockroft,S.L.,Chu,J.,Amorin,M.&Ghadiri,M.R."A single-molecule nanopore device detects DNA polymerase activity with single-nucleotide resolution."J.Am.Chem.Soc.130,818-820(2008),这些文献的公开通过引用被全部并入本文)。在其它实施方式中,核酸内切酶可与纳米孔耦合,使得通过核酸内切酶从核酸的端部顺序地释放的核苷酸在它们穿过纳米孔时被检测到。可基于不同的碱基部分或基于所添加的部分来区分开每个核苷酸。从纳米孔测序得到的数据可以如在本文阐述的被存储、处理和/或分析。特别是,可根据在本文阐述的光学图像和其它图像的示例性处理来将数据处理为图像。
一些实施方式可利用涉及DNA多聚酶活动的实时监控的方法。可通过如例如在美国专利7,329,492和美国专利7,211,414中所述的(其中每个专利通过引用被并入本文)在荧光团承载的多聚酶和伽马磷酸盐标记的核苷酸之间的荧光共振能量传递(FRET)交互作用来检测核苷酸掺入,或可使用如例如在美国专利7,315,019(其通过引用被并入本文)中所述的零模波导并使用如例如在美国专利7,405,281和美国专利公布号2008/0108082(其中每个专利通过引用被并入本文)中所述的荧光核苷酸类似物和工程多聚酶来检测核苷酸掺入。照明可被限制到在表面束缚的多聚酶周围的仄升标度体积,使得荧光地标记的核苷酸的掺入可在低背景的情况下被观察到(Levene,M.J.等人的"Zero-mode waveguides for single-molecule analysis at high concentrations."Science 299,682-686(2003);Lundquist,P.M.等人"Parallel confocal detection of single molecules in real time."Opt.Lett.33,1026-1028(2008);Korlach,J.等人的"Selective aluminum passivation for targeted immobilization of single DNA polymerase molecules in zero-mode waveguide nano structures."Proc.Natl.Acad.Sci.USA 105,1176-1181(2008),其中每个文献的公开通过引用被全部并入本文)。从这样的方法得到的图像可以如在本文阐述的被存储、处理和分析。
一些SBS实施方式包括当将核苷酸掺入到延伸产物内时释放的质子的检测。例如,基于所释放的质子的检测的测序可使用在市场上从Ion Torrent(Guilford,CT,a Life Technologies subsidiary)可买到的电气检测器和相关技术或在美国专利公布号2009/0026082、美国专利公布号2009/0127589、美国专利公布号2010/0137143或美国专利公布号2010/0282617中所述的测序方法和系统,每个专利通过引用被并入本文。
可有利地在许多格式中执行上述SBS方法,使得多个不同的目标核酸同时被操纵。在特定的实施方式中,不同的目标核酸可在普通反应容器中或在特定衬底的表面上被处理。这允许测序试剂的方便输送、未反应的试剂的移除和以多路方式对掺入事件的检测。在使用表面结合的目标核酸的实施方式中,目标核酸可以在阵列格式中。在阵列格式中,目标核酸可以一般以在空间上可区分的方式结合到表面。可通过直接共价结合、附接到珠或其它粒子或结合到多聚酶或附接到表面的其它分子来结合目标核酸。阵列可包括每个部位(也被称为特征)处的目标核酸的单个拷贝,或具有相同序列的多个拷贝可存在于每个部位或特征处。可通过如在下面进一步描述的扩增方法例如桥扩增或乳化PCR来产生多个拷贝。
在本文阐述的方法可使用具有在各种密度中的任一个——包括至少大约10个特征/cm2、100个特征/cm2、500个特征/cm2、1,000个特征/cm2、5,000个特征/cm2、10,000个特征/cm2、50,000个特征/cm2、100,000个特征/cm2、1,000,000个特征/cm2、5,000,000个特征/cm2或更高处的特征的阵列。在本文所述的方法和装置可包括具有至少足以在这些例示的密度中的一个或多个下解析单独的特征的分辨率的检测部件或设备。
在本文阐述的方法的优点是,它们提供多个目标核酸的并行的快速和有效检测。相应地,本公开提供能够使用在本领域中已知的技术例如上面例示的技术来制备并检测核酸的集成系统。因此,本公开的集成系统可包括能够将扩增试剂和/或测序试剂输送到一个或多个固定的DNA片段的流体部件,该系统包括部件例如泵、阀、储器、流体线路等。可在用于目标核酸的检测的集成系统中配置和/或使用流动池。例如在美国专利公布号2010/0111768 A1和美国专利申请号13/273,666中描述了示例性流动池,每个专利通过引用被并入本文。如对流动池例示的,集成系统的一个或多个流体部件可用于扩增方法并用于检测方法。取核酸测序实施方式作为例子,集成系统的一个或多个流体部件可用于在本文阐述的扩增方法并用于在测序方法例如在上面例示的测序方法中的测序试剂的输送。可选地,集成系统可包括单独的流体系统以执行扩增方法并执行检测方法。能够创建扩增的核酸并且还确定核酸的序列的集成测序系统的例子非限制性地包括MiSeqTM或NextSeqTM平台(Illumina,有限公司,San Diego,CA)或在美国专利申请公布号2012/0270305 A1或2013/0260372 A1中所述的设备,每个专利通过引用被并入本文。
“活动检测器”意指能够检测指示特定的反应或过程的活动的任何设备或部件。活动检测器可能能够检测在预定的体积或区域内的预定事件、特性、数量或特性。例如,活动检测器可能能够捕获预定体积或区域的图像。活动检测器可能能够检测在溶液的预定体积内或沿着预定区域的离子浓度。示例性活动检测器包括:电荷耦合器件(CCD)(例如CCD摄像机);光电倍增管(PMT);分子特征化设备或检测器,例如与纳米孔一起使用的那些;微电路布置,例如在通过引用被全部并入本文的美国专利号7,595,883中所述的那些微电路布置;以及具有场效应晶体管(FET)——包括化学上敏感的场效应晶体管(chemFET)、离子敏感的场效应晶体管(ISFET)和/或金属氧化物半导体场效应晶体管(MOSFET)——的CMOS制造的传感器。例如在国际专利公布号WO2012/058095中描述了示例性活动检测器。
术语“生物传感器”包括具有多个反应位置的任何结构。生物传感器可包括固态成像设备(例如CCD或CMOS成像器)和可选地安装到其的流动池。流动池可包括与反应位置流体连通的至少一个流动通道。作为一个特定的例子,生物传感器配置成流体地和电气地耦合到生物化验系统。生物化验系统可根据预定协议(例如合成测序)将反应物输送到反应位置并执行多个成像事件。例如,生物化验系统可引导溶液沿着反应位置流动。至少一个溶液可包括具有相同或不同的荧光标记的四种类型的核苷酸。核苷酸可结合到位于反应位置处的相应寡核苷酸。生物化验系统可接着使用激发光源(例如固态光源,例如发光二极管或LED)来照亮反应位置。激发光可具有一个或多个预定波长,包括一定范围的波长。激发的荧光标记提供可由光检测器检测的发射信号。
在一个方面中,固态成像器包括CMOS图像传感器,其包括配置成检测发射信号的光检测器的阵列。在一些实施方式中,每个光检测器具有单个像素,且像素与由滤波器壁界定的检测路径之比可以实质上为一比一。例如在美国专利申请号13/833,619中描述了示例性生物传感器。
“检测表面”意指包括光检测器的任何表面。检测器可基于任何适当的技术,例如包括电荷耦合器件(CCD)或互补金属氧化物半导体(CMOS)的那些技术。在特定的实施方式中,具有单质子雪崩二极管(CMOS-SPAD)的CMOS成像器可例如用于使用荧光寿命成像(FLIM)来区分荧光团。在美国专利公布号2008/0037008 A1、Giraud等人的“Biomedical Optics Express 1:1302-1308(2010)”或Stoppa等人的“IEEE European Solid-State Device Conference(ESSCIRC),Athens,Greece,IEEE,pp.204-207(2009)”中描述了可用于FLIM的示例性基于CMOS的系统,每个专利通过引用被全部并入本文。可被使用的其它有用的检测设备包括例如在美国专利7,329,860和美国专利公布号2010/0111768中描述的设备,每个专利通过引用被全部并入本文。
此外,将认识到,如在本领域中已知的其它信号检测设备可用于检测在本文阐述的方法中产生的信号。例如,用于检测检测焦磷酸盐或质子的检测器是特别有用的。可使用检测器例如在市场上从454Life Sciences(Branford,Conn.,a Roche Company)可买到的或在美国专利公布号2005/0244870中所述的检测器来检测焦磷酸盐释放,该专利通过引用被全部并入本文。用于基于质子释放来检测引物延伸的示例性系统包括在市场上从Ion Torrent(Guilford,Conn.,a ThermoFisher subsidiary)可买到的或在美国专利公布号2009/0026082、2009/0127589、2010/0137143和2010/0282617中所述的系统,每个专利通过引用被全部并入本文。例如在通过引用被全部并入本文的美国专利公布号2013/0116128A1中描述了示例性检测表面和检测器。
“测序模块”意指适合于测序应用的CMOS芯片。模块可包括表面,其包括用于核酸附着和由疏水区围绕的扩增的亲水区的衬底。例如,可使用具有亲水补片的动态焊盘,例如上面所述的动态焊盘。可选地或此外,包括在亲水状态中的一些焊盘同时围绕在疏水状态中的焊盘的一堆动态焊盘可形成由疏水区围绕的亲水区。用于核酸附着的表面将可选地包括多个隔离区,使得每个隔离区包含优选地从用于测序的一个核酸分子得到的多个核酸分子。例如,亲水区可包括凝胶。亲水区可以是平滑的、有纹理的、多孔的、非多孔的等。疏水区优选地位于亲水区之间。试剂通过任何数量的力越过表面移动。
本文所述的主题在一个或多个实施方式中包括一次性微流体盒和制造并使用其的方法。制造一次性集成微流体盒的方法可选地利用柔性印刷电路板(PCB)和卷到卷(R2R)印刷电子器件,用于CMOS技术和指状流体器件的单片集成。也就是说,一次性集成微流体盒包括流体层的叠层,其中CMOS传感器被集成,都被安装在壳体中。相应地,常规注塑成型流体学装置可与柔性PCB技术集成在一起。使用适合于在R2R印刷电子学过程中使用的材料来形成流体层。此外,流体层包括多聚酶链反应(PCR)区以及试剂混合和分布区。流体层还包括一组膜片阀,PCR区可由膜片阀完全封锁。
使用一次性集成微流体盒的方法包括执行测序所需的多路PCR和下游混合。
本文所述的实施方式包括CMOS流动池,其中生物传感器活性区域的大部分或多达大约100%对试剂输送和照明是可接近的。
图14示出使用用于CMOS技术的单片集成和指状流体器件的柔性印刷电路板(PCB)和卷到卷(R2R)印刷电子器件的方法100的例子的流程图。也就是说,使用方法100,多层层压流体器件可与柔性PCB技术(见图15)集成在一起。此外,使用利用方法100形成的结构,常规注塑成型流体学可与柔性PCB技术(见图26到45)集成在一起。方法100可包括但不限于下面的步骤。
在步骤110,流体层被形成并接着被层压和粘合在一起。例如,图15示出可在这个步骤中被层压并粘合在一起的一组流体层200的分解图。在这个例子中,流体层200按顺序包括进口/出口层210、流体通道层220、柔性PCB层260、测序室底层280、测序室层250和与测序室顶层290共面的膜片层240。进口/出口层210、流体通道层220、柔性PCB层260、测序室底层280、测序室层250、膜片层240和测序室顶层290适合于使用R2R印刷电子学过程来形成。
进口/出口层210可由例如聚碳酸酯、聚甲基丙烯酸甲酯(PMMA)、环烯烃共聚物(COC)和/或聚酰亚胺形成。进口/出口层210在一个例子中可以是从大约25μm到大约1000μm厚,或在另一例子中是大约250μm厚。在进口/出口层210中提供开口(或孔)的布置。开口(或孔)提供可用作例如各种液体供应储器(未示出)的进料口和/或出料口的流体路径。下面参考图55A和55B在本文示出并描述进口/出口层210的更多细节。
流体通道层220可由例如聚碳酸酯、PMMA、COC和/或聚酰亚胺形成。流体通道层220在一个例子中可以是从大约25μm到大约1000μm厚,或在另一例子中是大约250μm厚。在流体通道层220中提供流体通道的布置。流体通道提供沿着流体通道层220从一个目的地达到另一目的地的流体路径。因为流体通道层220夹在进口/出口层210和柔性PCB层260之间,流体可由在底部上的进口/出口层210和由在顶部上的柔性PCB层260限制在流体通道内。在一个例子中,流体通道层220用于执行测序所需的PCR和下游混合。下面参考图56A和56B在本文示出并描述流体通道层220的更多细节。
柔性PCB层260可由例如聚碳酸酯、PMMA、COC和/或聚酰亚胺形成。柔性PCB层260在一个例子中可以是从大约30μm到大约300μm厚,或在另一例子中是大约200μm厚。在柔性PCB层260中提供开口(或孔)的布置。开口(或孔)提供可用作用于控制流体通道层220的流体通道中的液体的流量的膜片阀的入口和/或出口的流体路径。下面参考图57A和57B在本文示出并描述柔性PCB层260的更多细节。
测序室底层280可由例如聚碳酸酯、PMMA、COC和/或聚酰亚胺形成。测序室底层280在一个例子中可以是从大约25μm到大约1000μm厚,或在另一例子中是大约250μm厚。在测序室底层280中提供开口的布置,用于形成在流体层200的叠层内的膜片阀。测序室底层280还包括定位成接近测序室层250的测序室的CMOS设备,例如CMOS图像传感器262。测序室底层280与CMOS设备共面并充当到测序室层250的测序室的入口/出口的流体连接层。下面可参考图58A和58B在本文示出并描述测序室底层280的更多细节。
测序室层250可由例如聚碳酸酯、PMMA、COC和/或聚酰亚胺形成。测序室层250在一个例子中可以是从大约50μm到大约300μm厚,或在另一例子中是大约100μm厚。在测序室层250中提供开口的布置,用于形成在流体层200的叠层内的膜片阀。测序室层250还包括测序室。下面参考图59A和59B在本文示出并描述测序室层250的更多细节。
膜片层240可由例如硅酮弹性体形成。膜片层240在一个例子中可以是从大约25μm到大约1000μm厚,或在另一例子中是大约250μm厚。膜片层240用作用于打开和闭合在流体层200的叠层内的膜片阀的弹性膜,其中膜片阀按顺序由柔性PCB层260、测序室底层280、测序室层250和膜片层240的组合创建。下面参考图22A、22B、23A和23B在本文示出并描述膜片阀的更多细节。下面参考图60A和60B在本文示出并描述膜片层240的更多细节。
测序室顶层290可由具有良好的光学特性的低自发荧光材料例如COC形成。测序室顶层290在一个例子中可以是从大约25μm到大约1000μm厚,或在另一例子中是大约250μm厚。测序室顶层290用于覆盖在测序室层250中的测序室。下面参考图60A和60B在本文示出并描述测序室顶层290的更多细节。
现在再次参考图14,在步骤115,CMOS设备附接到柔性PCB。例如,CMOS图像传感器262(见图15)附接到流体层200的测序室底层280。图16示出CMOS图像传感器262的例子的透视图。在一个例子中,CMOS图像传感器262是大约9200μm长、大约8000μm宽和大约800-1000μm厚;且可具有大约50个I/O焊盘。CMOS图像传感器262可包括像素阵列。在一个例子中,像素阵列是4384x 3292个像素,具有大约7272μm x 5761μm的总尺寸。将理解,CMOS晶片可具有宽范围的尺寸和I/O焊盘计数。例如,矩形晶片(例如看起来长瘦的非正方形尺寸)可以与指状流体器件一起被使用以在任何给定的分析协议中只利用晶片的部分。
继续步骤115,图17A、17B、18、19和20示出结构400的侧视图,其示出将CMOS设备附接到柔性PCB的过程的例子。结构400是多层结构。现在参考图17A,结构400的最初形成以柔性PCB开始。例如,柔性PCB按顺序包括聚酰亚胺层410、PCB加热器层412、聚酰亚胺层414、PCB布线层416和聚酰亚胺层418。也就是说,图17示出具有PCB加热器层和PCB布线层——也可以叫卷箔——的柔性PCB。
接着并现在参考图17B,低温各向同性导电粘合剂(低温ICA)420分配在聚酰亚胺层418的顶上。
接着并现在参考图18,CMOS设备例如CMOS图像传感器262放置在卷箔上;也就是说,在低温ICA 420的顶上。在一个例子中,使用公知的拾取和放置过程将CMOS图像传感器262放置在低温ICA 420的顶上。图18示出CMOS图像传感器262的I/O焊盘422与低温ICA 420接触,并从而电连接到PCB布线层416。也存在其它附着选项,包括但不限于受控塌陷/倒装芯片焊接、引线接合等。图18还示出CMOS图像传感器262包括背离聚酰亚胺层418的生物层424。保护膜426可放置在生物层424的顶上,直到准备好使用为止。
接着并现在参考图19,在柔性PCB的聚酰亚胺层418的顶上提供一组流体层428。也就是说,提供与CMOS表面共面的层压聚碳酸酯膜。流体层428的例子是在图15中所示的流体层200。
接着并现在参考图20,通过将底部填充环氧树脂粘合剂430分配在CMOS图像传感器262周围来完成在卷箔上的CMOS图像传感器262的倒装芯片焊接。
现在再次参考图14,在步骤120,执行包括集成在一起的流体层和CMOS设备的微流体盒的最后组装。例如,图21示出微流体盒800的例子的侧视图。微流体盒800包括流体部分810和CMOS部分812,其基于在图20中所示的结构400。最后组装步骤可包括例如分配(印刷)底部填充环氧树脂粘合剂430,移除保护膜426,在CMOS部分812处层压低温非导电粘合剂814(例如UV或热非导电粘合剂),将低自发荧光环烯烃共聚物(COC)层816层压到微流体盒800的CMOS部分812,以及在流体部分810的两侧上层压柔性PCB加热器818。在形成微流体盒800的过程中,使用自对准工艺流程使得CMOS设备和流体层的表面彼此齐平很重要。
流体路径穿过微流体盒800形成。也就是说,样品入口820设置在流体部分810的输入端处,且出口822设置在CMOS部分812的下游。样品入口820给PCR室824供料。然后PCR室824给试剂分配区826供料。然后试剂分配区826给测序室828供料。CMOS图像传感器262的生物层424朝着测序室828定向。然后测序室828给出口822供料。此外,微流体盒800包括某些膜片阀830,其控制进出PCR室824的液体的流量。
图22A和22B示出膜片阀830的例子的透视图,其中膜片阀可集成到例如流体层200内。现在参考图22A,其为膜片阀830的透视图。在这个例子中,膜片阀830按顺序包括底层910、流体通道层912和储器层914。底层910、流体通道层912和储器层914可由例如聚碳酸酯、PMMA、COC和/或聚酰亚胺形成。储器层914具有创建在储器层914中的小储器916的凹进区。膜片层918越过储器916拉伸。储器916具有入口920和出口922,其提供到相应的流体通道924的流径。为了更好地显示储器916以及入口920和出口922的特征,图22B示出没有覆盖储器916的膜片层918的膜片阀830。膜片层918由柔性和可拉伸的弹性体膜材料(例如硅酮弹性体)形成。
图23A和23B每个示出沿着图22A的线A-A截取的膜片阀830的横截面视图。致动器例如致动器1010可用于打开和闭合膜片阀830。例如,图23A示出在打开状态中的膜片阀830,其中致动器1010不与膜片层918接合。相反,图23B示出在闭合状态中的膜片阀830,其中致动器1010与膜片层918接合。也就是说,致动器1010的顶端用于逆着出口922推膜片层918的中心部分并从而阻止液体穿过其流动。膜片阀830(即膜片阀242、244和246)可使用例如机械或空气致动例如螺线管或气动泵被启动。
图24示出包括集成在一起的CMOS技术和指状流体器件的微流体盒1100的例子的示意图。也就是说,微流体盒1100包括流体地和操作地连接到四个样品供应品1110(例如样品供应品1110a、1110b、1110c、1110d)、十三个试剂供应品1112(例如试剂供应品1112a-1112m)和出口泵1114的流体层200。流体层200包括PCR区270和试剂混合和分配区275。PCR区270包括例如四个PCR通道222(例如PCR通道222a、222b、222c、222d)。PCR通道222a、222b、222c和222d的入口分别由样品供应品1110a、1110b、1110c和1110d供料。因为微流体盒1100包括由四个样品供应品1110供料的四个PCR通道222,微流体盒1100配置成用于4X样品多路技术。
使用四个膜片阀242来控制四个PCR通道222的输入。也就是说,分别使用膜片阀242a、242b、242c和242d来控制PCR通道222a、222b、222c和222d的输入。类似地,使用四个膜片阀244来控制四个PCR通道222的输出。也就是说,分别使用膜片阀244a、244b、244c和244d来控制PCR通道222a、222b、222c和222d的输出。四个PCR通道222的输出给公共PCR输出通道224供料,公共PCR输出通道224接着给试剂混合和分配区275供料。在流体层200中的膜片阀242和膜片阀244的存在允许PCR区270被完全封锁。
试剂混合和分配区275包括13个试剂通道226(例如试剂通道226a-226m)的布置。此外,13个试剂通道226a-226m分别经由13个试剂供应品1112a-1112m被供料。可旋转阀组件(未示出)用于将某个PCR通道222流体地连接到某个试剂供应品1112。在这么做时,可创建某个PCR混合。可旋转阀组件(未示出)也用于将某个PCR混合流体地连接到测序进料通道228,其给测序室258的入口供料。此外,CMOS图像传感器262位于测序室258处。
测序出口通道230设置在测序室258的出口处。出口泵1114流体地和操作地连接到测序出口通道230。出口泵1114用于提供正或负压,以便在沿着流体层200的流径的任何方向上移动液体。此外,沿着测序出口通道230的长度提供一系列三个膜片阀246。可根据在图22A、22B、23A和23C中示出和描述的膜片阀830来实现膜片阀242、244和246。
在测序出口通道230处的三个膜片阀246可代替或结合出口泵1114来被用作泵。因此在一个实施方式中,微流体盒1100只包括出口泵1114,且三个膜片阀246被省略。在另一实施方式中,微流体盒1100只包括三个膜片阀246,且出口泵1114被省略。在又一实施方式中,微流体盒1100包括出口泵1114和三个膜片阀246。在再一实施方式中,微流体盒1100包括任何其它类型的泵送机构来代替出口泵1114和/或三个膜片阀246。下面参考图25到60B在本文示出并描述实现微流体盒1100的例子的更多细节。
图25和26示出微流体盒组件1200的透视图,微流体组件是在图24中所示的集成微流体盒1100的物理例示的一个例子。微流体盒组件1200是与柔性PCB技术集成在一起的常规注塑成型流体器件的例子。在这个例子中,微流体盒组件1200是包括紧固在底板1212的顶上的壳体1210的多隔间微流体盒。壳体1210和底板1212可例如由模塑料形成并经由螺丝(见图32)紧固在一起。微流体盒组件1200的总高度可例如从大约12mm到大约100mm。微流体盒组件1200的总长度可例如从大约100mm到大约200mm。微流体盒组件1200的总宽度可例如从大约100mm到大约200mm。
在壳体1210的内部是在图27A和27B中所示的流体组件1400。也就是说,图27A和27B示出安装在图25和28中所示的微流体盒组件1200中的流体组件1400的例子的透视图。流体组件1400基于图24所示的集成微流体盒1100。也就是说,流体组件1400包括在图15和24中所示和所述的流体层200。流体组件1400还包括相对于在流体层200的试剂混合和分配区275中的十三个试剂通道226a-226m布置的可旋转阀组件1410。流体层200的长度可例如从大约100mm到大约200mm。流体层200的宽度可例如从大约100mm到大约200mm。
此外,流体组件1400包括缠绕在流体层200的PCR区270的两侧周围的柔性PCB加热器1412。两个单独受控的加热器迹线设置在柔性PCB加热器1412中,以便在PCB区270的一侧上有一个加热器迹线和在PCB区270的另一侧上有另一加热器迹线。柔性PCB加热器1412是图21所示的微流体盒800的柔性PCB加热器818的例子。下面参考图28A到28B在本文示出并描述加热器迹线的例子的更多细节。下面参考54A、54B和54C在本文示出并描述柔性PCB加热器1412的例子的更多细节。
现在再次参考图25和26,微流体盒组件1200的壳体1210还包括实质上与流体层200的四个PCR通道222(例如PCR通道222a、222b、222c、222d)对准的四个样品装入口1214(例如样品装入口1214a、1214b、1214c、1214d)。微流体盒组件1200的壳体1210还包括给流体层200的13个试剂通道226(例如试剂通道226a-226m)供料的13个试剂储器1216。13个试剂储器1216可以是相同的尺寸或不同的。例如,试剂储器1216可保持范围从大约0.001ml到大约0.150ml的液体的体积。
微流体盒组件1200的壳体1210还包括由测序出口通道230供料的废物储器1218。废物储器1218可保持例如范围从大约25ml到大约100ml的液体的体积。图26示出试剂储器1216和废物储器1218可被覆盖并使用例如箔密封物1220被密封。
图28A和28B分别示出可被安装在图27A和27B中所示的流体组件1400中的加热器迹线1500的例子的平面图和横截面视图。也就是说,图28A示出具有蛇形类型的布局的加热器迹线1500的例子的平面图。图28B示出包括加热器迹线1500的流体组件1400的柔性PCB加热器1412的一侧的横截面视图。柔性PCB加热器1412是按顺序包括例如单侧柔性铜层1510、粘合剂层1512、介电层1514、铜加热器层1516(其中加热器迹线1500被图案化)和层1518的多层结构。铜加热器层1516示出沿着图28A的线A-A截取的加热器迹线1500的横截面。
图29、30、31、32、33A和33B示出图25的微流体盒组件1200的各种其它视图,其示出其中的更多细节。也就是说,图29示出微流体盒组件1200的壳体1210侧的透视图,而图30示出平面图,这两个图都示出13个试剂储器1216和废物储器1218的配置的更多细节。图31示出安装有箔密封物1220的微流体盒组件1200的壳体1210侧的平面图。箔密封物1220具有开口,使得四个样品装入口1214保持被暴露且是可接近的。
图32示出微流体盒组件1200的壳体1212侧的透视图。图33A示出微流体盒组件1200的底板1212侧的平面图。图33B示出微流体盒组件1200的侧视图。图32、33A和33B示出底板1212的更多细节。也就是说,底板1212包括用于揭露流体组件1400的流体层200的PCR区270的部分的开口1222和开口1224。通过开口1224示出的是用于接触流体组件1400的柔性PCB加热器1412的一组I/O焊盘1226。
沿着开口1222的一个边缘的是用于接近并启动流体组件1400的流体层200的四个膜片阀242的四个开口1228。也就是说,开口1228a实质上与膜片阀242a对准。开口1228b实质上与膜片阀242b对准。开口1228c实质上与膜片阀242c对准。开口1228d实质上与膜片阀242d对准。
沿着开口1222的相对边缘的是用于接近并启动流体组件1400的流体层200的四个膜片阀244的四个开口1230。也就是说,开口1230a实质上与膜片阀244a对准。开口1230b实质上与膜片阀244b对准。开口1230c实质上与膜片阀244c对准。开口1230d实质上与膜片阀244d对准。
此外,底板1212包括用于接近并启动流体组件1400的流体层200的四个膜片阀246的开口1232。底板1212还包括在测序室258处的开口1234。底板1212的一个角具有斜角1236,其用于将微流体盒组件1200定向在微流体系统(未示出)的仪器层面中。图32和33A还示出用于将底板1212紧固到壳体1210的四个螺丝1238。此外,可旋转阀组件1410相对于流体组件1400的流体层200的试剂混合和分配区275被示出。可旋转阀组件1410包括具有把手部分1240的旋钮,用户或装置可通过把手部分1240来旋转流量控制器部分1242(见图35)。
以微流体盒组件1200将底板1212侧定向为面向上开始,图34到42本质上示出微流体盒组件1200的逐步解构,作为揭露其中的内部部件的放置和安装的手段。首先,图34示出微流体盒组件1200,底板1212被移除以揭露流体组件1400。在这么做时,流体层200的柔性PCB层260侧是可见的。此外,柔性PCB加热器1412的一侧是可见的。还揭露出在流体层200和底板1212之间的隔板1244。在图34中,膜片阀242、244和246是可见的。
现在参考图35,可旋转阀组件1410的把手部分1240被移除,使得流量控制器部分1242现在是可见的。把手部分1240的下侧(未示出)设计成与流量控制器1242接合,使得流量控制器部分1242可旋转以引导液体的流穿过13个试剂通道226之一。
现在参考图36,可旋转阀组件1410的流量控制器部分1242被移除,使得与流体层200的PCR输出通道224、试剂通道226和测序进料通道228相关的流体路径是可见的。
现在参考图37,流体层200被示为具有透明度,使得流体路径在微流体盒组件1200内是可见的。
现在参考图38,流体层200被移除且柔性PCB加热器1412被示为单独地在壳体1210内。现在参考图39,柔性PCB加热器1412被移除,且流体层200被示为单独地在壳体1210内。
现在参考图40,流体层200和柔性PCB加热器1412从壳体1210被移除。在这个视图中,与样品装入口1214、13个试剂储器1216和废物储器1218相关的在壳体1210中的流径是可见的。例如,壳体1210包括对样品装入口1214的开口1246、对13个试剂储器1216的开口1248和对废物储器1218的开口1250。图40还示出用于接纳螺丝1238的四个螺纹孔1252。此外,图40示出CMOS图像传感器262和覆盖CMOS图像传感器262的保护盖1254的一部分。现在参考图41,CMOS图像传感器262被移除,使得保护盖1254是完全可见的。现在参考图42,保护盖1254被移除,示出与CMOS图像传感器262相关的在壳体1210中的净空区1256。
图43示出微流体盒组件1200的壳体1210的透明透视图,以便示出开口相对于样品装入口1214、试剂储器1216和废物储器1218的位置。也就是说,在这个视图中,我们可看到开口1246相对于样品装入口1214的位置、开口1248相对于试剂储器1216的位置和开口1250相对于废物储器1218的位置。
图44示出微流体盒组件1200的壳体1210的透明透视图,各种流体通道叠置在其上。也就是说,在这个视图中,我们可看到各种流体通道相对于样品装入口1214、试剂储器1216和废物储器1218的位置。图45示出图25的微流体盒组件1200的横截面视图,其示出其中的更多细节。
图46A、46B、47A、47B和48示出图25的微流体盒组件1200的壳体1210的各种视图,其示出其中的更多细节。也就是说,图46A和46B分别示出壳体1210的平面图和侧视图。在一个例子中,壳体1210在高度上是从大约12mm到大约100mm,在长度上是从大约100mm到大约200mm,在宽度上是从大约100mm到大约200mm。图47A示出未安装有箔密封物1220的壳体1210的透视图。图47B示出安装有箔密封物1220的壳体1210的透视图。虽然图46A、46B、47A和47B示出壳体1210的外部,图48示出壳体1210的内部的平面图。
图49、50、51A、51B和52示出图25的微流体盒组件1200的底板1212的各种视图,其示出其中的更多细节。也就是说,图49和50分别示出底板1212的外部和内部的透视图。图41A示出底板1212的外部的平面图,而图41B示出底板1212的侧视图。图49、50、51A、38B和39示出底板1212,其进一步包括用于接纳螺丝1238的四个孔1258、用于接纳可旋转阀组件1410的把手部分1240和流量控制器部分1242的具有在中心处的开口1262的凹进区1260。
图53A和53B示出微流体盒组件1200的流体组件1400的其它透视图,其示出其中的更多细节。也就是说,图53A和53B每个示出流体组件1400的透视图。图53A示出没有柔性PCB加热器1412的流体组件1400,而图53B示出安装有柔性PCB加热器1412的流体组件1400。此外,在流体层200的一个边缘上和在PCR区270内具有凹口1414。凹口1414设计成接纳柔性PCB加热器1412。
图54A、54B和54C示出说明微流体盒组件1200的流体组件1400的柔性PCB加热器1412的更多细节的其它视图。也就是说,图54A和54B分别示出柔性PCB加热器1412的每侧的透视图,而图54C示出柔性PCB加热器1412的侧视图。柔性PCB加热器1412包括都使用柔性PCB技术形成的U形卷绕面板1416和侧延伸面板1418。U形卷绕面板1416包括面板1420和面板1422,每个面板具有在其中图案化的加热器迹线1500,即加热器迹线1500a和1500b。在图28A和28B中示出加热器迹线1500的例子。在面板1420和面板1422之间的空间设置成使得柔性PCB加热器1412可被压入配合到流体层200的PCR区270上并配合到凹口1414内,如图53B所示。图54B和41C还示出I/O焊盘1226,其提供到两个加热器迹线1500以及到CMOS图像传感器262的电连接。
侧延伸面板1418从在U形卷绕面板1416中的弯头附近的面板1420延伸。侧延伸面板1418设计成朝着CMOS图像传感器262延伸。如图53B所示,最远离U形卷绕面板1416的侧延伸面板1418的端部被成形为靠着CMOS图像传感器262配合。侧延伸面板1418的目的是提供与在刚性或柔性PCB的顶上组装的CMOS图像传感器262的电连接。
图55A和55B分别示出在图15和图27中所示的流体层200的进口/出口层210的透视图和平面图。再次,进口/出口层210可由例如聚碳酸酯或适合于用在R2R过程上的任何其它材料形成。进口/出口层210提供在微流体盒组件1200的流体层200和壳体1210之间的界面。也就是说,进口/出口层210提供从壳体1210的样品装入口1214、13个试剂储器1216和废物储器1218到流体层200的流体通道层220的流体路径。例如,进口/出口层210包括实质上与在壳体1210中的样品装入口1214的开口1246对准的一组开口212。进口/出口层210包括实质上与在壳体1210中的试剂储器1216的开口1248对准的一组开口214。进口/出口层210还包括实质上与在壳体1210中的废物储器1218的开口1250对准的一组开口216。
图56A和56B分别示出在图15和图27中所示的流体层200的流体通道层220的透视图和平面图。再次,流体通道层220可由例如聚碳酸酯或适合于用在R2R过程上的任何其它材料形成。流体通道层220是流体层200中在其处所有液体的流动被促进的层。也就是说,所有PCR和测序操作发生在流体通道层220处。PCR操作发生在PCR区270处的PCR通道222中。PCR输出通道224给试剂混合和分配区275供料。试剂分配使用在试剂混合和分配区275处的试剂通道226而发生。13个试剂通道226被图案化以给可旋转阀组件1410供料。测序进料通道228给在图58A和58B中所示的测序室层250的测序室258的入口供料。然后,测序出口通道230流体地连接到测序室258的出口。
图57A和57B分别示出在图15和图27中所示的流体层200的柔性PCB层260的透视图和平面图。再次,柔性PCB层260可由例如聚碳酸酯或适合于用在R2R过程上的任何其它材料形成。柔性PCB层260包括与膜片阀242的入口/出口关联的一组开口(或孔)264。柔性PCB层260还包括与膜片阀244的入口/出口关联的一组开口(或孔)266。如果膜片阀246存在,则柔性PCB层260包括与膜片阀246的入口/出口关联的一组开口(或孔)267。此外,柔性PCB层260包括实质上与可旋转阀组件1410对准并提供到可旋转阀组件1410的流体路径的一组开口268。
图58A和58B分别示出在图15和图27中所示的流体层200的测序室底层280的透视图和平面图。再次,测序室底层280可由例如聚碳酸酯或适合于用在R2R过程上的任何其它材料形成。测序室底层280包括用于形成在流体层200的叠层内的膜片阀242的一组开口282。测序室底层280包括用于形成在流体层200的叠层内的膜片阀244的一组开口284。如果膜片层246存在,则测序室底层280包括用于形成在流体层200的叠层内的膜片阀246的一组开口286。此外,测序室底层280包括实质上与可旋转阀组件1410对准并提供到可旋转阀组件1410的流体路径的一组开口288。此外,测序室底层280包括流体地耦合到测序室层250的测序室258的一对开口289。
测序室底层280是CMOS技术被集成的流体层200的层。也就是说,CMOS图像传感器262安装在测序室底层280上。CMOS图像传感器262的位置实质上相应于测序室层250的测序室258的位置。
图59A和59B分别示出在图15和图27中所示的流体层200的测序室层250的透视图和平面图。再次,测序室层250可由例如聚碳酸酯或适合于用在R2R过程上的任何其它材料形成。测序室层250是流体层200的测序操作出现于的层;即使用测序室258。
测序室层250包括用于形成在流体层200的叠层内的膜片阀242的一组开口252。测序室层250还包括用于形成在流体层200的叠层内的膜片阀244的一组开口254。如果膜片阀246存在,则测序室层250包括用于形成在流体层200的叠层内的膜片阀246的一组开口255。此外,测序室层250包括实质上与可旋转阀组件1410对准并提供到可旋转阀组件1410的流体路径的一组开口256。
图60A和60B分别示出在图15和图27中所示的流体层200的膜片层240和测序室顶层290的透视图和平面图。膜片层240可由例如硅酮弹性体形成,而测序室顶层290可由例如COC形成。膜片层240用作用于打开和闭合在流体层200的叠层内的膜片阀242、244和246的弹性膜片,其中膜片阀242、244和246按顺序由柔性PCB层260、测序室底层280、测序室层250和膜片层240的组合创建。图60A和60B还示出用于覆盖测序室层250的测序室258的测序室顶层290。
图61A和61B示出使用微流体盒组件1200来执行测序所需的多路PCR和下游混合的方法4800的例子的流程图。因为微流体盒组件1200基于图24所示的微流体盒1100,微流体盒组件1200配置成用于4X样品多路技术。此外,在方法4800中,13个试剂储器1216是指定试剂储器1216a、1216b、1216c、1216d、1216e、1216f、1216g、1216h、1216i、1216j、1216k、12161和1216m。此外,方法4800利用出口泵1114,其流体地连接到微流体盒组件1200。出口泵1114位于测序室258的下游。出口泵1114能够提供正压力和负压力(即真空压力)。方法4800包括但不限于下面的步骤。
在步骤4810,提供被准备好使用的微流体盒组件1200。也就是说,微流体盒组件1200设置有被装有期望液体的它的一个或多个储器。例如,试剂储器1216可被填充有相同或不同的试剂液体。在一个例子中,所有试剂储器1216a-m被填充有氢化缓冲液(HT1)。方法4800继续进行到步骤4815。
在步骤4815,所有膜片阀被闭合,且接着样品/PCR MIX被装入。“PCR MIX”意指被优化用于在用于扩增DNA模板的常规PCR中使用的PCR Master Mix。在这个步骤中,膜片阀242a和244a被闭合,膜片阀242b和244b被闭合,膜片阀242c和244c被闭合,以及膜片阀242d和244d被闭合。以这种方式,PCR通道222a、222b、222c和222d都完全被封锁。然后,第一样品液体与PCR MIX(在下文中被称为样品/PCR_MIX1)混合并被装入样品装入口1214a内。第二样品液体与PCR MIX(在下文中被称为样品/PCR_MIX2)混合并被装入样品装入口1214b内。第三样品液体与PCR MIX(在下文中被称为样品/PCR_MIX3)混合并被装入样品装入口1214c内。第四样品液体与PCR MIX(在下文中被称为样品/PCR_MIX4)混合并被装入样品装入口1214d内。在这个步骤完成时,样品/PCR MIX的体积位于每个样品装入口1214中并为处理做好准备。方法4800继续进行到步骤4820。
在步骤4820,第一样品的膜片阀被打开。然后,第一样品被拉到PCR区内。然后,第一样品的膜片阀被闭合。例如,PCR通道222a的膜片阀242a和244a被打开。然后,使用出口泵1114,样品/PCR_MIX1被拉到PCR通道222a内。然后,PCR通道222a的膜片阀242a和244a被闭合,其中样品/PCR_MIX1的体积现在被密封在PCR通道222a的内部。方法4800继续进行到步骤4825。
在决定步骤4825,确定另一样品是否等待被装入PCR区内,即PCR区270内。如果是,则方法4800继续进行到步骤4830。如果否,则方法4800继续进行到步骤4835。
在步骤4830,下一样品的膜片阀被打开。然后,下一样品被拉到PCR区内。然后,下一样品的膜片阀被闭合。在一个例子中,PCR通道222b的膜片阀242b和244b被打开。然后,使用出口泵1114,样品/PCR_MIX2被拉到PCR通道222b内。然后,PCR通道222b的膜片阀242b和244b被闭合,其中样品/PCR_MIX2的体积现在被密封在PCR通道222b的内部。
在另一例子中,PCR通道222c的膜片阀242c和244c被打开。然后,使用出口泵1114,样品/PCR_MIX3被拉到PCR通道222c内。然后,PCR通道222c的膜片阀242c和244c被闭合,其中样品/PCR_MIX3的体积现在被密封在PCR通道222c的内部。
在又一例子中,PCR通道222d的膜片阀242d和244d被打开。然后,使用出口泵1114,样品/PCR_MIX4被拉到PCR通道222d内。然后,PCR通道222d的膜片阀242d和244d被闭合,其中样品/PCR_MIX4的体积现在被密封在PCR通道222d的内部。
方法4800返回到步骤4825。
在步骤4835,使用在PCR通道222a中的样品/PCR_MIX1、在PCR通道222b中的样品/PCR_MIX2、在PCR通道222c中的样品/PCR_MIX3以及在PCR通道222d中的样品/PCR_MIX4,PCR操作被执行。当PCR操作完成时,样品/PCR_MIX1现在被称为PCR_MIX1,样品/PCR_MIX2现在被称为PCR_MIX2,样品/PCR_MIX3现在被称为PCR MIX3,以及样品/PCR_MIX4现在被称为PCR MIX4。方法4800继续进行到步骤4840。
在步骤4840,可旋转阀旋转到第一PRC MIX位置。例如,通过旋转可旋转阀组件1410的把手部分1240,可旋转阀组件1410的位置被设置到保持PCR_MIX1的PCR通道222a。方法4800继续进行到步骤4845。
在步骤4845,第一PCR MIX的膜片阀被打开。然后,第一PCR MIX穿过可旋转阀被拉到CMOS设备。然后,第一PCR MIX的膜片阀被闭合。例如,PCR通道222a的膜片阀242a和244a被打开。然后,使用出口泵1114,PCR_MIX1被拉出PCR通道222a进入PCR输出通道224内,并穿过可旋转阀组件1410。然后,膜片阀242a和244a被闭合。方法4800继续进行到步骤4850。
在步骤4850,可旋转阀旋转到氢化缓冲器(HT1)位置,意指到保持HT1的试剂储器1216。在方法4800中,至少一个试剂储器1216保持HT1的体积。作为例子,试剂储器1216k保持HT1的体积。因此,通过旋转可旋转阀组件1410的把手部分1240,可旋转阀组件1410的位置现在被设置到保持HT1的试剂储器1216k。方法4800继续进行到步骤4855。
在步骤4855,第一PCR MIX被推到HT1储器内。例如,使用出口泵1114,PCR_MIX1穿过可旋转阀组件1410被推动并进入试剂储器1216k内并与其中的HT1混合。方法4800继续进行到步骤4860。
在决定步骤4860,确定另一PCR MIX是否等待与HT1混合。如果是,则方法4800继续进行到步骤4865。如果否,则方法4800继续进行到步骤4885。
在步骤4865,可旋转阀旋转到下一PRC MIX位置。在一个例子中,通过旋转可旋转阀组件1410的把手部分1240,可旋转阀组件1410的位置被设置到保持PCR_MIX2的PCR通道222b。在另一例子中,通过旋转可旋转阀组件1410的把手部分1240,可旋转阀组件1410的位置被设置到保持PCR_MIX3的PCR通道222c。在又一例子中,通过旋转可旋转阀组件1410的把手部分1240,可旋转阀组件1410的位置被设置到保持PCR_MIX4的PCR通道222d。方法4800继续进行到步骤4870。
在步骤4870,下一PCR MIX的膜片阀被打开。然后,下一PCR MIX穿过可旋转阀被拉到CMOS设备。然后,下一PCR MIX的膜片阀被闭合。在一个例子中,PCR通道222b的膜片阀242b和244b被打开。然后,使用出口泵1114,PCR_MIX2被拉出PCR通道222b进入PCR输出通道224内,并穿过可旋转阀组件1410。然后,膜片阀242b和244b被闭合。在另一例子中,PCR通道222c的膜片阀242c和244c被打开。然后,使用出口泵1114,PCR_MIX3被拉出PCR通道222c进入PCR输出通道224内,并穿过可旋转阀组件1410。然后,膜片阀242c和244c被闭合。在又一例子中,PCR通道222d的膜片阀242d和244d被打开。然后,使用出口泵1114,PCR_MIX4被拉出PCR通道222d进入PCR输出通道224内,并穿过可旋转阀组件1410。然后,膜片阀242d和244d被闭合。方法4800继续进行到步骤4875。
在步骤4875,可旋转阀旋转到HT1位置。例如,通过旋转可旋转阀组件1410的把手部分1240,可旋转阀组件1410的位置返回到保持HT1的试剂储器1216k。方法4800继续进行到步骤4880。
在步骤4880,下一PCR MIX被推到HT1储器内。在一个例子中,使用出口泵1114,PCR_MIX2穿过可旋转阀组件1410被推动并进入试剂储器1216k内并与其中的HT1混合。在另一例子中,使用出口泵1114,PCR_MIX3穿过可旋转阀组件1410被推动并进入试剂储器1216k内并与其中的HT1混合。在又一例子中,使用出口泵1114,PCR_MIX4穿过可旋转阀组件1410被推动并进入试剂储器1216k内并与其中的HT1混合。方法4800返回到步骤4860。
在步骤4885,将来自HT1储器的混合物推到测序室内,并执行群集/测序方法。例如,使用现在保持HT1、PCR_MIX1、PCR_MIX2、PCR_MIX3和PCR_MLX4的混合物的试剂储器1216k,这个混合物被拉出试剂储器1216k,然后沿着测序供料通道228被拉并进入测序室258内。然后,使用CMOS图像传感器262,执行群集/测序方法。方法4800结束。
一个或多个实施方式可包括具有可接近的生物传感器活性区域的CMOS流动池。例如,CMOS流动池可被设计为单次使用可消耗品。相应地,CMOS流动池是小和廉价的设备可能是有益的。在小CMOS流动池中,使用能够尽可能多的生物传感器活性区域很重要。然而,当前CMOS流动池设计不允许生物传感器活性区域的100%利用。因此,需要新方法来提供在CMOS流动池中的生物传感器活性区域的增加的利用。在本文阐述的实施方式可包括CMOS流动池,其中大部分或多达大约100%的生物传感器活性区域对试剂输送和照明是可接近的,如下面参考图62到75在本文所示和所述的。
图62示出CMOS流动池4900的例子的侧视图,其中大部分或多达大约100%的生物传感器活性区域对试剂输送和照明是可接近的。CMOS流动池4900包括PCB衬底4910,其例如是柔性PCB衬底。在PCB衬底4910顶上的是CMOS生物传感器设备4920。CMOS生物传感器设备4920是具有在其上的生物层的CMOS图像传感器。也在PCB衬底4910的顶上并围绕CMOS生物传感器设备4920的是层压膜4930。层压膜4930可例如由环氧树脂、聚酰亚胺或其它塑料膜、硅、双马来酰亚胺三嗪树脂(BT)衬底等形成。可使用柔性PCB技术来形成PCB衬底4910和层压膜4930。也可通过用机器加工在PCB衬底中的腔来创建平面化表面。
层压膜4930的目的是提供在CMOS生物传感器设备4920的周边周围的延伸表面,其实质上与CMOS生物传感器设备4920的顶部在同一平面上。在一个例子中,如果CMOS生物传感器设备4920的晶片厚度是大约100μm,则层压膜4930的厚度是大约100μm+大约5μm。
在PCB衬底4910和层压膜4930之间的细长间隙形成在CMOS生物传感器设备4920的周边周围的沟槽或通道4950。沟槽或通道4950的宽度可以是例如从大约100μm到大约1000μm。沟槽或通道4950被填充有填充材料4952,以便形成跨越CMOS生物传感器设备4920和层压膜4930的实质上连续的平坦表面。填充材料4952是不干扰在CMOS生物传感器设备4920的顶上发生的反应的材料。填充材料4952可以是例如紫外(UV)固化的环氧树脂、热固化的环氧树脂等。
在CMOS生物传感器设备4920和层压膜4930的顶上的是流动池盖4940,流动通道4942集成在流动池盖4940中。此外,流动池盖4940包括提供对流动通道4942的入口/出口的第一口4944和第二口4946。流动池盖4940由在光学上透明的且具有低或没有在用于分析检测的光谱的部分中的自发荧光的材料例如但不限于环烯烃共聚物(COC)形成。流动池盖4940的总厚度可以是例如从大约300μm到大约1000μm。结合区域存在于流动通道4942的外部,用于将流动池盖4940粘合到层压膜4930。粘合可以是经由低自发荧光粘合剂。
因为实质上连续的平坦表面跨越CMOS生物传感器设备4920和层压膜4930而存在,在流动池盖4940内的流动通道4942可依尺寸被制造成跨越整个CMOS生物传感器设备4920;也就是说,它可跨越生物传感器活性区域的大约100%。在一个例子中,如果CMOS生物传感器设备4920的晶片尺寸是大约8mm x 9mm,则活性区域是大约7mm x 8mm。然而,CMOS生物传感器设备4920的晶片尺寸范围可以高到例如大约25mm x 25mm,具有成比例地更大的活性区域。
图62示出例如填充流动通道4942的试剂流体4954。化学反应发生在流动通道4942中的试剂流体4954中,流动通道4942在CMOS生物传感器设备4920的顶上。当通过流动池盖4940被照亮时,CMOS生物传感器设备4920用于感测发生在流动通道4942中的化学反应。通过PCB衬底4910提供电连接(未示出),用于从CMOS生物传感器设备4920获取信号。在CMOS流动池4900中,CMOS生物传感器设备4920的生物传感器活性区域的大约100%对试剂输送和照明是可接近的。
图63示出在图62中所示的CMOS流动池4900的一个例示的例子的分解图。图63示出CMOS生物传感器设备4920包括活性区域4922。在活性区域4922之外的CMOS生物传感器设备4920的任何部分是非活性区域4924。CMOS生物传感器设备4920可使用例如倒装芯片技术来附接到PCB衬底4910。此外,层压膜4930包括开口或窗口4932,其当靠着PCB衬底4910被层压时依尺寸被制造成用于接纳CMOS生物传感器设备4920。在将层压膜4930层压到PCB衬底4910之前在层压膜4930中提供开口或窗口4932。当流动池盖4940粘合到层压膜4930时,流动通道4942实质上与CMOS生物传感器设备4920对准,且它的区域超出CMOS生物传感器设备4920的区域延伸。在图63中,流动池盖4940被示为透明的。图64和65分别示出当被完全组装时在图63中示出的CMOS流动池4900的透视图和侧视图。
图66示出在图63、64和65中所示的CMOS流动池4900的流动池盖4940的例子的透视图。也就是说,图66示出在图63、64和65中示出的CMOS流动池4900的流动池盖4940的顶部和底部透视图。在这个例子中,第一口4944和第二口4946的直径可以是大约750μm。此外,流动通道4942的深度或高度可以是大约100μm。
图67、68、69和70示出提供在CMOS流动池中的延伸平坦表面的过程的例子,流动池盖可安装在该延伸平坦表面上。
在第一步骤中且现在参考图67,层压膜4930和CMOS生物传感器设备4920设置在PCB衬底4910的顶上。沟槽或通道4950存在于CMOS生物传感器设备4920的周边周围。沟槽或通道4950存在,因为在层压膜4930中的开口或窗口4932稍微大于CMOS生物传感器设备4920。
在下一步骤中且现在参考图68,使用例如具有用于靠着沟槽或通道4950紧密配合的光学上透明的弹性体4960来密封沟槽或通道4950的上侧。弹性体4960是光学上透明的,使得UV光可穿过其。弹性体4960的目的是封住沟槽或通道4950的顶部,为填充作准备。
在下一步骤中且现在参考图69,使用在PCB衬底4910中的一对穿孔4916,沟槽或通道4950被填充有填充材料4952,例如UV固化的环氧树脂,其为弹性体4960是在光学上透明的原因。
在下一步骤中且现在参考图70,一旦填充材料4952被固化,弹性体4960就被移除,且实质上连续的平坦表面现在存在于流动池中,用于接纳流动池盖,例如流动池盖4940。
图71A、71B、71C和71D示出提供在CMOS流动池中的延伸平坦表面的过程的另一例子,流动池盖可安装在该延伸平坦表面上。
在第一步骤中且现在参考图71A,CMOS生物传感器设备4920设置在PCB衬底4910的顶上。
在下一步骤中且现在参考图71B,模具5510(例如蛤壳型模具)设置在CMOS生物传感器设备4920和PCB衬底4910周围。模具5510提供在PCB衬底4910的顶上和在CMOS生物传感器设备4920的周边周围的空间或空隙5512。
在下一步骤中且现在参考图71C,使用例如低压注塑成型过程或反应注塑成型过程,在模具5510中的空间或空隙5512被填充有填充材料4952,例如UV固化的或热固化的环氧树脂。
在下一步骤中且现在参考图71D,一旦填充材料4952被固化,模具5510就被移除,且实质上连续的平坦表面现在存在于流动池中,用于接纳流动池盖,例如流动池盖4940。
图72、73、74和75示出提供在CMOS流动池中的延伸平坦表面的过程的又一例子,流动池盖可安装在该延伸平坦表面上。
在第一步骤中且现在参考图72,CMOS生物传感器设备4920设置在PCB衬底4910的顶上。此外,机械材料片5910设置在PCB衬底4910的顶上并在CMOS生物传感器设备4920的一端处。类似地,机械材料片5912设置在PCB衬底4910的顶上并在CMOS生物传感器设备4920的另一端处。机械材料片5910和5912可以是例如空白硅、玻璃或塑料。沟槽或通道5914在机械材料片5910和CMOS生物传感器设备4920之间。另一沟槽或通道5914在机械材料片5912和CMOS生物传感器设备4920之间。
在下一步骤中且现在参考图73,一组阻挡部5916设置在沟槽或通道5914的端部处。例如,阻挡部5916a和5916b阻挡一个沟槽或通道5914的端部,而阻挡部5916c和5916d阻挡另一沟槽或通道5914的端部,为填充作准备。
在下一步骤中且现在参考图74,沟槽或通道5914被填充有填充材料4952,例如UV固化的或热固化的环氧树脂。填充材料4952被保持在阻挡部5916a和5916b之间以及在阻挡部5916c和5916d之间。
在下一步骤中且现在参考图75,一旦填充材料4952被固化,实质上连续的平坦表面就现在存在于流动池中,用于接纳流动池盖,例如流动池盖4940。
将认识到,本公开的各种方面可被体现为方法、系统、计算机可读介质和/或计算机程序产品。本公开的方面可采取硬件实施方式、软件实施方式(包括固件、常驻软件、微代码等)、或组合软件和硬件方面的实施方式的形式,这些实施方式都可在本文被称为“电路”、“模块”或“系统”。此外,本公开的方法可采取在计算机可用存储介质上的计算机程序产品的形式,计算机可用存储介质具有体现在介质中的计算机可用程序代码。
任何适当的计算机可用介质可用于本公开的软件方面。计算机可用或计算机可读介质可以是例如但不限于电子、磁性、光学、电磁、红外或半导体系统、装置、设备或传播介质。计算机可读介质可包括临时和/或非临时实施方式。计算机可读介质的更特定的例子(非详尽列表)将包括下列项中的一些或全部:具有一个或多个电线的电连接、便携式计算机磁盘、硬盘、随机存取存储器(RAM)、只读存储器(ROM)、可擦除可编程只读存储器(EPROM或闪存)、光纤、便携式光盘只读存储器(CD-ROM)、光学存储设备、传输介质例如支持互联网或内联网的传输介质或磁性存储设备。注意,计算机可用或计算机可读介质可以甚至是纸或另一适当的介质,其上印刷程序,因为程序可经由例如纸或其它介质的光学扫描被电子地捕获,接着被编译、解释或否则以适当的方式被处理——如果必要,且接着被存储在计算机存储器中。在这个文档的上下文中,计算机可用或计算机可读介质可以是可包含、存储、传递、传播或输送程序用于由或结合指令执行系统、装置或设备使用的任何介质。
可以用面向对象的编程语言例如Java、Smalltalk、C++等来写用于执行在本文阐述的方法和装置的操作的程序代码。然而,也可以用常规过程编程语言例如“C”编程语言或类似的编程语言来写用于执行在本文阐述的方法和装置的操作的程序代码。程序代码可由处理器、专用集成电路(ASIC)或执行程序代码的其它部件执行。程序代码可简单地被称为软件应用,其存储在存储器(例如上面讨论地计算机可读介质)中。程序代码可使处理器(或任何处理器控制的设备)产生图形用户界面(“GUI”)。图形用户界面可在视觉上在显示设备上产生,然而图形用户界面也可具有可听得见的特征。然而,程序代码可在任何处理器控制的设备例如计算机、服务器、个人数字助理、电话、电视机或利用处理器和/或数字信号处理器的任何处理器控制的设备中操作。
程序代码可在本地和/或远程地执行。程序代码例如可完全或部分地存储在处理器控制的设备的本地存储器中。然而,程序代码也可至少部分地远程地被存储、访问和下载到处理器控制的设备。用户的计算机例如可全部执行程序代码或仅仅部分地执行程序代码。程序代码可以是至少部分地在用户的计算机上和/或部分在远程计算机上或全部在远程计算机或服务器上执行的独立软件封装。在后一情形中,远程计算机可通过通信网络连接到用户的计算机。
可应用在本文阐述的方法和装置而不考虑联网环境。通信网络可以是在射频域和/或互联网协议(IP)域中操作的电缆网络。通信网络然而也可包括分布式计算网络,例如互联网(有时可选地被称为“广域网”)、内联网、局域网(LAN)和/或广域网(WAN)。通信网络可包括同轴电缆、铜线、光纤线路和/或混合-同轴线路。通信网络可甚至包括利用电磁频谱的任何部分的无线部分和任何信令标准(例如标准的IEEE 802系列、GSM/CDMA/TDMA或任何蜂窝标准和/或ISM频段)。通信网络可甚至包括电源线部分,其中信号经有电气布线被传递。在本文阐述的方法和装置可应用于任何无线/有线通信网络,而不考虑物理部件、物理配置或通信标准。
参考各种方法和方法步骤描述了本公开的某些方面。将理解,每个方法步骤可由程序代码和/或由机器指令实现。程序代码和/或机器指令可创建用于实现在方法中指定的功能/行动的模块。
程序代码也可存储在计算机可读存储器中,计算机可读存储器可指导处理器、计算机或其它可编程数据处理装置以特定的方式起作用,使得存储在计算机可读存储器中的程序代码产生或转换包括实现方法步骤的各种方面的指令模块的制品。
程序代码也可被装到计算机或另一可编程数据处理装置上以使一系列操作步骤被执行以产生处理器/计算机实现的过程,使得程序代码提供用于实现在本公开的方法中规定的各种功能/行动的步骤。
在实施方式中,提供包括具有盒壳体的可拆卸盒的系统。可拆卸盒还包括布置在盒壳体内的流体网络。流体网络配置成接收并流体地引导生物样品以进行样品分析或样品制备中的至少一个。可拆卸盒还包括流量控制阀,其可操作地耦合到流体网络且相对于流体网络是可移动的以控制流经其的生物样品的流量。盒壳体包括界定可拆卸盒的外部并允许对流量控制阀的操作的接近的壳体侧。系统还包括具有配置成可分离地接合可拆卸盒的壳体侧的控制侧的基本仪器。壳体侧和控制侧共同界定系统界面。基本仪器包括通过系统界面来接合流量控制阀的阀致动器。可拆卸盒还包括由可拆卸盒或基本仪器中的至少一个保持的检测组件。检测组件包括成像检测器和与流体网络流体连通的反应室。成像检测器配置成检测在反应室内的指定反应。
在一个方面中,在本文阐述的基本仪器的控制侧和在本文阐述的可拆卸盒的壳体侧通常是平面的并面向彼此。系统界面可以是单侧的,其中基本仪器和可拆卸盒只通过壳体侧和控制侧可操作地耦合到彼此。可选地,基本仪器和可拆卸盒可以可操作地被耦合,使得基本仪器和可拆卸盒在系统界面处使用通过系统界面建立的流体耦合、电耦合或热耦合中的至少一个固定到彼此。
在另一方面中,在本文阐述的基本仪器的控制侧可代表相对于重力的基本仪器的顶部,使得可拆卸盒位于基本仪器上并由基本仪器支撑。
在另一方面中,在本文阐述的基本仪器的阀致动器可包括穿过壳体侧延伸并进入盒壳体内的细长致动器主体。
在另一方面中,在本文阐述的可拆卸盒的流量控制阀可包括穿过控制侧延伸并进入基本仪器内的细长致动器主体。
在另一方面中,在本文阐述的基本仪器可具有在相对于控制侧的相反方向上面向的仪器侧。基本仪器可具有在控制侧和仪器侧之间延伸的仪器尺寸。基本仪器和可拆卸盒可具有大于仪器尺寸的组合尺寸。
在另一方面中,可拆卸盒和基本仪器中的每个可包括电触头的触头阵列。触头阵列可以在系统界面处电耦合到彼此。
在另一方面中,在本文阐述的可拆卸盒的壳体侧可以是第一壳体侧,且盒壳体还可包括第二壳体侧。第一和第二壳体侧朝向不同的方向。系统界面是多侧界面,其中基本仪器和可拆卸盒沿着第一和第二壳体侧可操作地耦合到彼此。
可选地,在本文阐述的可拆卸盒的第一和第二壳体侧可通常垂直于彼此。基本仪器可具有包括第一和第二控制侧的仪器壳体,第一和第二控制侧朝向相垂直的方向并形成基本仪器的敞开侧凹部。可拆卸盒的至少一部分可布置在敞开侧凹部内,使得第一和第二壳体侧接合第一和第二控制侧。
在一个方面中,在本文阐述的基本仪器的阀致动器可包括穿过在第一壳体侧和第一控制侧之间的系统界面延伸的细长主体。第二壳体侧和第二控制侧可包括电触头的相应触头阵列。触头阵列可以沿着系统界面电耦合到彼此。
在另一方面中,在本文阐述的可拆卸盒的第一和第二壳体侧朝向通常相反的方向。基本仪器可具有仪器侧和对仪器侧敞开的盒接纳槽。可拆卸盒可布置在盒接纳槽内。
在另一方面中,可拆卸盒和基本仪器沿着第一壳体侧流体地被耦合并沿着第二壳体侧电气地被耦合。可选地,基本仪器包括锁定机构,其接合第一壳体侧或第二壳体侧中的至少一个以将可拆卸盒保持在基本仪器内。
在另一方面中,可拆卸盒和基本仪器中的每个可包括流动口。流动口在系统界面处流体地耦合到彼此。
在另一方面中,在本文阐述的系统可包括附接到可拆卸盒或基本仪器中的至少一个的锁定机构。锁定机构配置成可移除地将盒壳体固定到基本仪器。
在另一方面中,在本文所述的系统的成像检测器可由基本仪器保持,且反应室可由可拆卸盒保持。
在另一方面中,在本文阐述的可拆卸盒的流量控制阀可包括配置成控制穿过流体网络的生物样品的流量的柔性膜。柔性膜可在第一和第二条件之间由阀致动器弯曲。
在另一方面中,在本文阐述的可拆卸盒的盒壳体的壳体侧可包括穿过其的接纳阀致动器的进入开口。
在另一方面中,在本文阐述的基本仪器的流量控制阀可包括配置成控制穿过流体网络的流体的流量的可旋转阀。可旋转阀可由阀致动器旋转。
在另一方面中,在本文阐述的基本仪器可包括热块,且盒壳体的流体网络可包括样品通道,其中对生物样品的指定反应出现。壳体侧可包括沿着样品通道延伸并配置成接纳用于改变样品通道的温度的热块的进入开口。
在另一方面中,在本文阐述的可拆卸盒的流体网络可包括多个通道和存储模块。存储模块可包括用于存储用于样品制备或样品分析中的至少一个的试剂的多个储器。
在另一方面中,在本文阐述的基本仪器包括具有配置成控制阀致动器的操作以控制穿过流体网络的生物样品的流量的阀控制模块的系统控制器。
在实施方式中,提供对核酸测序的方法。该方法包括提供可拆卸盒,其具有盒壳体、布置在盒壳体内的流体网络和可操作地耦合到流体网络并相对于流体网络可移动的流量控制阀。盒壳体包括界定可拆卸盒的外部的壳体侧。该方法还包括使可拆卸盒接触到基本仪器。可拆卸盒的壳体侧可分离地接合基本仪器的控制侧以共同界定系统界面。基本仪器包括通过系统界面来接合流量控制阀的阀致动器。该方法还包括流体地引导生物样品流经盒的流体网络以在盒中进行样品分析或样品制备中的至少一个。生物样品被引导以流到反应室内,其中通过在流量控制阀上的阀致动器的作用来控制生物样品的流量。该方法还包括使用被定向到反应室的成像检测器来检测生物样品,其中检测组件由可拆卸盒或基本仪器中的至少一个保持。
在一个方面中,在本文阐述的方法还可包括从基本仪器移除可拆卸盒。可通过使第二可拆卸盒与基本仪器在功能上相配来更换可拆卸盒。几个可拆卸盒可顺序地与基本仪器相配,用于在与基本仪器相配的同时进行制备和/或分析样品并接着从基本仪器被移除。
相应地,该方法可包括使第二可拆卸盒与基本仪器接触,其中第二可拆卸盒的壳体侧可分离地接合基本仪器的控制侧以共同界定系统界面。
在另一方面中,在本文阐述的方法包括从基本仪器移除可拆卸盒。可选地,该方法包括使第二可拆卸盒与基本仪器接触,其中第二可拆卸盒的壳体侧可分离地接合基本仪器的控制侧以共同界定系统界面。
在本文阐述的方法的另一方面中,流体地引导生物样品并对生物样品成像的操作在单个可拆卸盒中依次重复多次。
在另一方面中,在本文阐述的方法包括将生物样品密封在流体网络的样品制备区内,以及当生物样品被密封在流体网络的样品制备区内使生物样品扩增。
在另一方面中,在本文阐述的方法中使用的流量控制阀包括具有在两个阀口之间延伸的至少一个流动通道的可移动阀,阀致动器配置成在不同的位置之间移动该可移动阀。
在另一方面中,当生物样品流经流动通道并被引导到反应室内时,在本文阐述的方法中使用的可移动阀在样品位置上,该方法还包括将可移动阀移动到组分位置以及使试剂流经流动通道进入反应室内,试剂与在反应室内的生物样品起反应。
在本文阐述的方法的另一方面中,组分位置包括多个组分位置,该方法还包括根据预定的顺序在组分位置之间移动可移动阀以使不同的试剂流到反应室内。
在另一方面中,在本文阐述的方法中使用的生物样品包括核酸,且预定顺序是根据合成测序(SBS)协议。
在另一方面中,在本文阐述的方法中使用的流动池包括反应室。生物样品固定到流动池的一个或多个表面。
在实施方式中,提供包括具有样品口的盒壳体的可拆卸盒,样品口对盒壳体的外部开放并配置成接收生物样品。盒壳体具有电触头的阵列和暴露于外部的机械接口装置。盒壳体配置成可移除地耦合到基本仪器。可拆卸盒还可包括具有多个通道、反应室和存储模块的流体网络。存储模块包括用于存储试剂的多个储器。流体网络配置成将试剂从储器引导到反应室,其中机械接口装置相对于流体网络可移动以控制穿过流体网络的流体的流量。系统还包括布置在盒壳体内并定位成检测在反应室内的指定反应的成像设备。成像设备电耦合到电触头的阵列用于与基本仪器通信。机械接口装置可配置成当可拆卸盒耦合到基本仪器时由基本仪器移动。
在一个方面中,在本文阐述的可拆卸盒的机械接口装置可包括配置成控制穿过流体网络的通道之一的流体的流量的通道阀。
在另一方面中,在本文阐述的可拆卸盒的盒壳体可包括允许接近机械接口装置的进入开口。可选地,机械接口装置包括可旋转阀。
在另一方面中,在本文阐述的可拆卸盒的盒壳体可包括暴露于外部的进入开口,以及通道包括与样品口流体连通的样品通道。进入开口可沿着样品通道延伸,并可配置成接纳用于控制样品通道的温度的热块。
在另一方面中,在本文阐述的可拆卸盒的盒壳体可包括暴露于外部并与流体网络流体连通的流体耦合口。流体耦合口配置成接合仪器口以接收穿过其的流体。
在另一方面中,在本文阐述的可拆卸盒的盒壳体可包括面向相反的方向的第一和第二壳体侧。第一壳体侧可包括电触头的阵列。第二壳体侧可包括机械接口装置。
在另一方面中,可拆卸盒还包括附接到盒壳体的锁定机构。锁定机构可配置成将盒壳体可移除地固定到基本仪器。
在实施方式中,提供包括具有样品口的盒壳体的可拆卸盒,样品口对盒壳体的外部开放并配置成接收生物样品。可拆卸盒还可包括布置在盒壳体内的可旋转阀。可旋转阀具有流体侧和在流体侧处敞开的多个阀口。可旋转阀具有在阀口之间延伸的至少一个流动通道,其中可旋转阀在不同的旋转位置之间可旋转。可拆卸盒还可包括微流体主体,其具有可滑动地耦合到可旋转阀的流体侧的主体侧。微流体主体可至少部分地界定包括与样品口流体连通的样品通道的流体网络。样品通道具有对微流体主体的主体侧敞开的网络口。流体网络还可包括配置成保持试剂的储器。储器与对微流体主体的流体侧敞开的储器口流体连通。流体网络还包括与流体网络的反应室流体连通的进料通道。进料通道具有对微流体主体的主体侧敞开的进料口。可旋转阀配置成在第一和第二旋转位置之间旋转。当可旋转阀在第一旋转位置上时,网络口通过可旋转阀流体地耦合到进料口。当可旋转阀在第二旋转位置上时,储器口通过可旋转阀流体地耦合到进料口。
在一个方面中,在本文阐述的可拆卸盒的盒壳体可具有配置成接合基本仪器的外部侧。可旋转阀可包括在外部侧处可接近并配置成接合基本仪器的机械接口装置。
在另一方面中,在第一旋转位置上的可旋转阀可配置成当吸力将样品液体拉到进料口时在本文阐述的可拆卸盒中接收样品液体。在第二旋转位置上的可旋转阀可配置成当移动力远离进料口将样品流体推到储器内时允许样品液体移动到储器内。
在另一方面中,在本文阐述的可拆卸盒的可旋转阀绕着轴旋转。进料口可与轴对准。
在实施方式中,提供包括具有样品口的盒壳体的可拆卸盒,样品口对盒壳体的外部开放并配置成接收生物样品。盒壳体可包括配置成面向并可移除地耦合到基本仪器的相配侧。可拆卸盒还包括布置在壳体内的流体网络。流体网络包括与样品口流体连通的样品通道。可拆卸盒还包括具有配置成在第一和第二位置之间移动的柔性构件的通道阀。柔性构件当在第一位置上时阻止穿过样品通道的流动,并当在第二位置上时允许穿过样品通道的流动。盒壳体的相配侧包括将通道阀暴露于盒壳体的外部的进入开口。进入开口配置成接纳用于在第一和第二位置之间移动柔性构件的基本仪器的阀致动器。
在另一方面中,在本文阐述的可拆卸盒的柔性构件可包括覆盖流体网络的内腔的柔性层。柔性层可配置成被推到腔内以阻止穿过其的流动。
在另一方面中,可拆卸盒还包括布置在盒壳体内的可旋转阀。可旋转阀配置成在不同的位置之间旋转以改变流体网络的流径。可旋转阀可包括沿着相配侧可接近的机械接口装置。
在一个方面中,在本文阐述的可拆卸盒的流体网络可包括与样品通道流体连通的网络口、与反应室流体连通的进料口和与配置成存储试剂的储器流体连通的储器口。可拆卸盒还可包括布置在盒壳体内的可旋转阀。可旋转阀可在第一旋转位置上时流体地耦合进料口和网络口并在第二旋转位置上时流体地耦合进料口和储器口。
在另一方面中,在本文阐述的可拆卸盒的相配侧可以是第一相配侧,且可拆卸盒可包括第二相配侧。第一和第二相配侧面向相反的方向。第二相配侧配置成机械地、流体地或热地接合仪器。
在实施方式中,提供包括具有相配侧的系统壳体的基本仪器,相配侧配置成接合可拆卸盒。基本仪器还包括配置成接合可拆卸盒的可旋转阀的旋转电机。基本仪器还包括配置成接合可拆卸盒的通道阀的阀致动器和配置成电耦合到可拆卸盒的电触头的阵列。基本仪器还包括配置成控制旋转电机和阀致动器以执行在可拆卸盒内的测定协议的系统控制器。系统控制器配置成通过电触头的阵列从可拆卸盒接收成像数据。可选地,基本仪器包括用于加热可拆卸盒的一部分的热块。
在实施方式中,提供包括具有样品口的盒壳体的可拆卸盒,样品口对盒壳体的外部开放并配置成接收生物样品。盒壳体包括配置成面向并可移除地耦合到基本仪器的相配侧。可拆卸盒还包括布置在盒壳体内的微流体主体。微流体主体具有主体侧并包括流体网络。流体网络具有多个分立通道和在阀接纳区域处的主体侧处敞开的相应口。可拆卸盒还包括布置在盒壳体内的可旋转阀。可旋转阀具有流体侧和在多个阀口之间延伸的至少一个流动通道。阀口对流体侧敞开。流体侧可旋转地耦合到微流体主体的主体侧的阀接纳区域,其中可旋转阀在不同的旋转位置之间可移动以流体地耦合分立通道。可旋转阀具有机械接口装置,其沿着相配侧是可接近的并配置成接合基本仪器,使得可旋转阀由基本仪器控制。
在实施方式中,提供包括具有样品口的盒壳体的可拆卸盒,样品口对盒壳体的外部开放并配置成接收生物样品。盒壳体包括配置成可移除地耦合到基本仪器的相配侧。可拆卸盒还包括布置在盒壳体内并包括多个堆叠的印刷电路板(PCB)层的微流体结构。PCB层包括当PCB层被堆叠时界定通道和反应室的流体层。PCB层还包括布线层。可移除盒还包括CMOS成像器,其配置成安装到微流体结构并电耦合到导电布线层。CMOS成像器定向成检测在反应室内的指定反应。
在一个方面中,可拆卸盒包括暴露于盒壳体的外部的输入/输出(I/O)触头。I/O触头可以电耦合到CMOS成像器。
在一个方面中,在本文阐述的可拆卸盒的微流体结构包括通道阀,其中通道阀的至少一部分由PCB层界定。通道阀配置成被启动以阻止和允许穿过通道之一的流动。
如在本文使用的,以单数形式列举并以词“a”或“an”开始的元件或步骤应被理解为不排除所述元件或步骤的复数,除非这样的排除被明确地规定。此外,对“一个实施方式”的提及并没有被规定为被解释为排除也合并所列举的特征的额外实施方式的存在。而且,除非明确相反地规定,“包括”或“具有”带有特定特性的一个元件或多个元件的实施方式可包括额外的元件,而不管它们是否具有那个特性。
应注意,在各种可选的实施方式中,可修改所示实施方式的部件的特定布置(例如数量、类型、放置等)。在各种实施方式中,可使用不同数量的给定模块或单元,可使用不同类型的给定模块或单元,可添加给定模块或单元,或可省略给定模块或单元。
应理解,上述描述被规定为是例证性的而不是限制性的。例如,上述实施方式(和/或其方面)可结合彼此来被使用。此外,可做出很多修改以使特定的情况或材料适合于各种实施方式的教导而不偏离其范围。在本文所述的各种实施方式的尺寸、材料类型、方位以及各种部件的数量和位置被规定为定义某些实施方式的参数,且决不是限制性的而仅仅是示例性的实施方式。在审阅上面的描述时,在权利要求的精神和范围内的很多其它实施方式和修改将对本领域中的技术人员明显。因此,应参考所附权利要求连同这样的权利要求享有权利的等效形式的完全范围来确定可取得专利的范围。
如在描述中使用的,短语“在示例性实施方式中”等意味着所述实施方式仅仅是一个例子。该短语并不意欲将创造性主题限制到那个实施方式。创造性主题的其它实施方式可以不包括所列举的特征或结构。在所附权利要求中,术语“including(包括)”和“in which(其中)”用作相应术语“comprising(包括)”和“wherein(其中)”的浅近英语等效形式。而且,在下面的权利要求中,术语“第一”、“第二”和“第三”等仅仅用作标签,且并不意欲在它们的对象上强加数字要求。此外,下面的权利要求的限制在装置加功能格式中被编写且并没有被规定为基于35U.S.C.§112(f)来被解释,且直到这样的权利要求明确地使用跟随有没有另一结构的功能的陈述的短语“用于…的装置”为止。
- 还没有人留言评论。精彩留言会获得点赞!