用于检测颗粒的检测装置的制作方法
本发明涉及用于检测颗粒的检测装置、检测方法和检测计算机程序。本发明还涉及包括检测装置的生物传感器系统。
背景技术:
WO 2011/036634 A1公开了一种生物传感器系统,包括具有传感器表面的生物传感器试剂盒以及用于检测传感器表面上的颗粒的第一和第二光学检测系统。第一光学检测系统适配成通过检测反射光的强度改变来检测颗粒,所述反射光已经在传感器表面处被反射,其中强度改变是基于衰减全内反射(FTIR)。第二光学检测系统适配成通过检测由颗粒散射的光来检测颗粒。
JP 2008 058249 A公开了一种用于查看光度测定的装置和方法。装置包括用于观察样品的图像的观察系统以及测量来自样品的光的强力度的光度测定系统。来自灯源的光光照针孔,并且针孔的图像经由光学路径切换单元而被投影在样品的底侧上。由样品反射的光再次进入切换单元。该光的部分穿过切换单元并且在成像表面上被检测到,并且另外的部分在切换单元中被反射并且聚焦在光电检测器上。此外,装置包括用于光照样品的上侧的另外的光源设备以用于明场观察。透射样品的光通过切换单元行进至成像表面。
技术实现要素:
本发明的目的是提供用于检测颗粒的检测装置、检测方法和检测计算机程序,其在技术上较不复杂。本发明另外的目的是提供包括检测装置的生物传感器系统。
在本发明的第一方面中,呈现了一种用于检测颗粒检测表面上或靠近颗粒检测表面的颗粒的检测装置,其中检测装置适配成可操作在第一光学检测模式中和第二光学检测模式中,并且其中检测装置包括:
– 用于生成第一光以用于在第一光学检测模式中光照颗粒检测表面的第一光源,
– 用于生成第二光以用于在第二光学检测模式中光照颗粒检测表面的第二光源,
– 用于在已经遇到颗粒检测表面之后检测第一光和第二光的光检测系统,
– 用于在遇到颗粒检测表面之前和/或在已经遇到颗粒检测表面之后修改第一光和第二光的光学系统,
其中光检测系统的组件和/或光学系统的组件布置成使用在第一检测模式中和第二检测模式中。
由于光检测系统的组件和/或光学系统的组件布置成使用在第一检测模式中和第二检测模式中,所以该组件不需要被提供两次,即用于使用在第一检测模式中和用于使用在第二检测模式中。这可以引起减少数目的组件并且可以使检测装置在技术上较不复杂。
检测装置优选地适配成检测颗粒检测表面上或靠近颗粒检测表面的颗粒,其到颗粒检测表面的距离足够小以在光照颗粒检测表面时影响第一光和第二光。检测装置优选地还适配成使用颗粒检测表面上的颗粒的检测以用于检测流体内的物质,其中颗粒检测表面上的颗粒已经附着到(即已经捕获)物质,并且其中检测装置包括用于基于所检测到的第一光和/或所检测到的第二光检测物质的物质来检测单元。物质检测单元优选地适配成基于所检测到的第一光和/或所检测到的第二光来确定例如流体中的物质的浓度。
颗粒优选地为磁珠,特别地为磁性纳米颗粒,其标记流体中的物质,特别地,在比如唾液或血液那样的体液中。磁珠优选地利用附着元素功能化,所述附着元素可以附着到作为例如具体分析物分子的物质,从而生成物质-磁珠组装体。附着元素例如为抗体、蛋白质、TNA、适体等。颗粒检测表面可以包括绑定元素,其适配成在物质分子已经附着到磁珠时绑定物质-磁珠组装体。检测装置优选地还包括用于将磁珠推动到颗粒检测表面上的磁体单元,以便允许已经捕获物质分子的磁珠被绑定到颗粒检测表面上的绑定元素,并且推动未被绑定的磁珠远离颗粒检测表面。检测装置因而可以被视为是磁性生物传感器或者作为其部分,磁性生物传感器可以适配成执行夹心免疫法。
光检测系统和光学系统适配成使得第一光通过由颗粒导致的FTIR来修改并且检测经修改的第一光。而且,光检测系统和光学系统可以适配成使得第二光由颗粒散射并且检测经散射的第二光。基于FTIR的颗粒检测尤其适合于颗粒检测表面上的相对大密度的颗粒。基于散射光的颗粒检测尤其适合于颗粒检测表面上的相对低密度的颗粒。因此,如果颗粒检测表面上或靠近颗粒检测表面的颗粒密度相对大,则检测装置可以操作在第一光学检测模式中以用于基于FTIR来检测颗粒,并且如果颗粒检测表面上或靠近颗粒检测表面的颗粒密度相对低,则检测装置可以操作在第二光学检测模式中以用于基于散射光的检测来检测颗粒。这允许在颗粒检测表面上或靠近颗粒检测表面的相对大范围的颗粒密度之上可靠地检测颗粒。
光检测系统优选地包括光检测表面,其布置成使用在第一光学检测模式中和第二光学检测模式中,其中第一光由光检测表面的第一部分检测并且第二光由光检测表面的第二部分检测。因此,相同检测表面可以使用在第一光学检测模式中和第二光学检测模式中,即不必要求提供例如两个检测器以用于分别在第一光学检测模式和第二光学检测模式中检测第一光和第二光。这允许用于减少检测光的组件。光检测表面优选地为电荷耦合器件(CCD)相机或互补金属氧化物半导体(CMOS)相机的光检测表面。
优选的是,光学系统包括双远心布置,其适配成用于在第一光学检测模式中修改第一光并且用于在第二光学检测模式中修改第二光。因此,相同双远心布置可以用于两个光学检测模式,从而减少光学系统的组件数目。还优选的是,光学系统包括可透性反射镜,其适配成用于在第一光学检测模式中修改第一光并且用于在第二光学检测模式中修改第二光。
在实施例中,光检测系统包括光检测表面,其布置成使用在第一光学检测模式中和第二光学检测模式中,其中检测装置适配成使得a)在第一光学检测模式中,来自颗粒检测表面的第一光定向到可透性反射镜,并且横穿可透性反射镜的第一光定向到光检测表面,并且b)在第二光学检测模式中,由第二光源元件提供的光定向到可透性反射镜,由可透性反射镜反射的光定向到颗粒检测表面,并且来自颗粒检测表面的光定向到光检测表面。由于可透性反射镜的使用,使用在第一光学检测模式中的光学路径可以至少部分地还使用在第二光学检测方法中,特别地,该相同光学路径可以在相反方向上使用在第一和第二光学检测方法中。这允许在第一光学检测方法中和第二光学检测方法中使用沿该光学路径布置的光学系统的组件,从而减少在第一和第二光学检测模式中所要求的光学系统的组件数目。
在优选实施例中,第一光源和光学系统适配成使得在第一光学检测模式中光照颗粒检测表面的较大区域,并且第二光源和光学系统适配成使得在第二光学检测模式中光照颗粒检测表面的较小区域。特别地,颗粒检测表面可以包括其中要检测颗粒的若干检测区,其中第一光源和光学系统可以适配成使得在第一光学检测模式中,颗粒检测表面的较大被光照区域覆盖若干检测区和若干检测区之间的区域,并且其中第二光源和光学系统可以适配成使得在第二光学检测模式中光照仅一个或仅若干检测区,从而光照颗粒检测表面的较小区域。优选地,在第二光学检测模式中,在时间上接连地光照不同检测区使得光检测系统一次检测来自单个检测区的光。这允许时间复用。若干检测区可以由试剂盒的检测腔的底表面形成。
在实施例中,光学系统适配成使得在第二光学检测模式中,提供第二光在遇到颗粒检测表面之前沿其行进的光照光学路径,以及第二光在已经遇到颗粒检测表面之后并且在由光检测系统检测到之前沿其行进的检测光学路径,其中检测装置包括光屏障,比如布置在光照光学路径与检测光学路径之间的屏幕。光屏障可以减少可能从光照光学路径杂散到检测光学路径中的杂散光,并且可以因而被视为杂散光屏障。检测光学路径中的杂散光的减少可以改进第二光的检测质量,其进而可以改进颗粒检测表面上或靠近颗粒检测表面的颗粒的检测质量。
在本发明的另一方面中,呈现了一种用于检测流体内的物质的生物传感器系统,其中生物传感器系统包括:
– 要在其上检测颗粒的颗粒检测表面,以及
– 如权利要求11中所限定的检测装置。
在本发明另外的方面中,呈现了一种用于检测颗粒检测表面上或靠近颗粒检测表面的颗粒的检测方法,其中检测方法适配成可操作在第一光学检测模式中和第二光学检测模式中,并且其中检测方法包括:
– 通过第一光源生成第一光以用于在第一光学检测模式中光照颗粒检测表面,
– 通过第二光源生成第二光以用于在第二光学检测模式中光照颗粒检测表面,
– 在遇到颗粒检测表面之前和/或在已经遇到颗粒检测表面之后通过光学系统修改第一光和第二光,
– 在已经遇到颗粒检测表面之后通过光检测系统检测第一光和第二光,
其中光检测系统的组件和/或光学系统的组件使用在第一检测模式中和第二检测模式中,并且其中第一光通过由颗粒(2)导致的衰减全内反射修改并且检测经修改的第一光。
在本发明的另一方面中,呈现了一种用于检测颗粒检测表面上或靠近颗粒检测表面的颗粒的检测计算机程序,其中检测计算机程序包括用于当计算机程序在控制检测装置的计算机上运行时,使如权利要求1中所限定的检测装置实施如权利要求13中所限定的检测方法的步骤的程序代码构件。
应当理解的是,权利要求1的检测装置、权利要求12的生物传感器系统、权利要求13的检测方法和权利要求14的检测计算机程序具有类似和/或等同的优选实施例,特别地,如从属权利要求中所限定的那样。
应当理解的是,本发明的优选实施例还可以是从属权利要求或以上实施例与相应独立权利要求的任何组合。
本发明的这些和其它方面将从以下描述的实施例显而易见,并且将参照以下描述的实施例进行阐述。
附图说明
在以下图中:
图1示意性且示例性地示出第一光学检测模式中的生物传感器系统的实施例,
图2示意性且示例性地图示了生物传感器系统的颗粒检测表面上的颗粒的绑定,
图3示意性且示例性地示出生物传感器系统的生物传感器试剂盒,
图4示意性且示例性地图示了第一光学检测模式中的生物传感器试剂盒的检测区的光照,
图5示意性且示例性地示出第一光学检测模式中的生物传感器系统的光检测表面上的图像,
图6示意性且示例性地示出第二光学检测模式中的生物传感器系统,
图7示意性且示例性地图示了第二光学检测模式中的生物传感器试剂盒的检测区的光照,
图8示意性且示例性地示出第二光学检测模式中的光检测表面上的图像,
图9示意性且示例性地示出第二光学检测模式中的绑定点的图像,
图10示意性且示例性地示出双远心布置上的顶视图,
图11示意性且示例性地示出双远心布置的侧视图,
图12示意性且示例性地示出生物传感器系统的外壳,其中外壳包括检测装置并且适配成接收生物传感器试剂盒,
图13示出示例性地图示了生物感测方法的实施例的流程图,以及
图14和15示意性且示例性地示出在光检测表面上成像的检测区的图像。
具体实施方式
图1示意性且示例性地示出生物传感器系统40的实施例,包括检测装置1和生物传感器试剂盒45的颗粒检测表面5。在图2中示意性且示例性地图示了生物传感器试剂盒45的颗粒检测表面5上的颗粒的绑定。
生物传感器系统40适配成检测流体44内的物质3,流体44优选地为比如血液或唾液那样的体液,其中流体已经被引入到生物传感器试剂盒45中。生物传感器试剂盒45包括颗粒2,其在该实施例中为经功能化以用于捕获流体44内的物质3的磁珠。颗粒检测表面5包括用于经由物质3绑定磁珠的绑定元素4,如果磁珠2已经捕获到物质3的话。
生物传感器试剂盒45优选地包括若干检测腔,在图1中仅示出其中的单个一个46。另外的检测腔沿垂直于图1的平面的线布置。每一个检测腔包括具有绑定元素的表面,其可以被视为包括所有检测腔的颗粒检测子表面的总体颗粒检测表面的颗粒检测子表面,或者被视为检测区。每一个颗粒检测子表面可以包括若干绑定点,其中每一个绑定点可以包括绑定元素4。
图3示意性且示例性地更加详细图示了生物传感器试剂盒45。生物传感器试剂盒45包括样品沉积开口59,流体通过其可以引入到生物传感器试剂盒45中。经由通道61将流体引导至检测腔46,55,56,68,其中检测区17,18,20,21包括绑定点。生物传感器试剂盒45还包括通气开口60和具有参考表面19的正白参考(TWR)部分58。功能化的磁珠可以以干燥形式存在于检测腔中,其中当流体到达相应检测腔时,磁珠可以与流体混合。在其它实施例中生物传感器试剂盒还可以具有另一配置,例如,其可以包括更少或更多的检测腔,其可以不包括TWR部分,或者功能化的磁珠可以在流体到达相应检测腔之前与流体混合,其中在该情况下,磁珠可以例如存在于布置在检测腔与样品沉积开口之间的混合腔中。
生物传感器试剂盒45优选地包括下部部分41和上部部分47,其中下部部分41优选地包括通道61、检测腔46,55,56,68和TWR部分58,并且上部部分47闭合检测腔46,55,56,68、TWR部分58和通道61。下部部分41可以是注塑成型部分并且上部部分47可以是层压体。
检测装置1还包括用于朝向颗粒检测表面5推动磁珠2的磁体单元,以便允许已经捕获物质3的磁珠2通过绑定元素4绑定,并且用于远离颗粒检测表面5推动未被绑定的磁珠2。图1示意性且示例性地示出磁体单元的磁体尖端71,72,73,其中底侧上的磁体尖端71,72是马蹄形电磁体的磁体尖端,并且顶侧上的磁体尖端73是另一电磁体的磁体尖端。磁体单元可以例如如WO 2011/036634 A1中所公开的那样构造。然而,磁体单元还可以具有另一结构。
检测装置1适配成可操作在第一光学检测模式中和第二光学检测模式中。在该实施例中,在第一光学检测模式中,颗粒检测表面5上或靠近颗粒检测表面5的颗粒2通过FTIR检测,并且在第二光学检测模式中,颗粒检测表面5上或靠近颗粒检测表面5的颗粒2通过由颗粒2散射的光的暗场成像检测。在图1中示意性地指示区80,其中颗粒可以影响光,其中该区80不是按比例的并且仅仅出于说明目的而示出。图1示意性且示例性地图示了当检测装置1操作在第一光学检测模式中时的检测装置1。
检测装置1包括用于生成第一光以用于在第一光学检测模式中光照颗粒检测表面5的第一光源6。在该实施例中,第一光源6是发光二极管(LED)并且第一光横穿透镜22并且在遇到颗粒检测表面5之前通过耦合窗42耦合到生物传感器试剂盒45的下部部分41中。生物传感器试剂盒45还包括参考表面19,其不包括绑定元素并且其布置在颗粒检测子表面或检测区17,18,20,21之间。第一光源6、透镜22和生物传感器试剂盒45的下部部分41优选地适配成使得包括所有检测区和参考表面的整个颗粒检测表面由第一光光照。这在图4中示意性且示例性地图示。
图4示意性且示例性地图示了在第一光学检测模式中、具有中间参考表面19的不同检测区17,18,20,21的光照。如可以在该图中看到的,由第一光生成的光照区域16覆盖所有检测区17,18,20,21和参考表面19。
在已经遇到颗粒检测表面5之后,第一光经过双远心布置13。双远心布置13包括透镜23、反射镜24、中心光阑25、另外的反射镜26和另外的透镜27。双远心布置13适配成针对每一个检测腔得到相同检测条件并且减少关于通过光检测系统8获取的图像的图像失真,如我们以下将进一步描述的那样。透镜23,27之间的中心光阑25确定成像数值孔径(NA)。反射镜24,26用于折叠通过双远心布置13的光学路径使得第一光最终遇到光检测系统8。
在已经横穿双远心布置13之后,第一光在被光检测系统8检测到之前横穿可透性反射镜14。可透性反射镜14是具有例如百分之90的反射率和百分之10的透射率的部分反射的反射镜。
光检测系统8例如是包括光检测表面15的CCD相机或CMOS相机,其在图5中示意性且示例性地图示。光检测表面15包括其上颗粒检测表面在第一光学检测模式中成像的第一部分11,以及其上颗粒检测表面5在第二光学检测模式中成像的第二部分12。在图5中断线10是用于从第二部分12勾勒第一部分11的虚拟线。
图5图示了在第一光学检测模式中在光检测表面15的第一部分11上生成的参考表面19的图像52和检测腔46,55,56,68的底表面17,18,20,21的图像50,51,53,54。图像50,51,53,54内的圆点指示具有相应检测腔46,55,56,68的相应底表面上的绑定元素4的绑定点。
由光检测系统8获取的图像50…54被提供到控制单元29,其适配成控制检测装置,特别地,第一光源6、光检测系统8和第二光源7,其将在以下进一步更加详细地描述。而且,控制单元29适配成基于由光检测表面15的第一部分11检测到的图像50…54来确定流体44内的物质3的浓度。相应绑定点的相应图像的相应部分的强度取决于绑定在相应绑定点处的颗粒数目,因为颗粒由于FTIR而造成强度降低。而且,由于被绑定的颗粒数目取决于在流体内要检测的物质的浓度,因此流体内的物质浓度可以基于由光检测系统8检测到的强度降低来确定。
试剂盒参考表面19的图像52的强度水平可以充当用于所检测到的信号50,51,53和54的参考,即用于相应图像。由于实际FTIR测量是差异测量,其比较当珠体绑定到表面时的实际反射强度水平与当珠体尚未附着到表面时(即在试验的开始处)的起始强度水平,所以FTIR测量的精度取决于在实际测量期间光源的传入强度的恒定性程度。由光源输出中的强度变化或温度变化所引起的实际生物试验测量期间的任何信号漂移可以通过参考区域52的强度的实时测量来补偿。由于没有颗粒可以绑定到参考区域19,所以来自区域52的反射信号中的任何变化是仪器漂移或光源输出变化的直接结果,并且可以此后用于针对这些仪器漂移因素而校正信号50,51,53和54。最后,该漂移补偿允许非常精确的测量,其检测对应于低物质浓度的非常小的信号改变。关于基于FTIR对流体内的物质浓度的确定的更多细节,参考D. M. Bruls等人的“Rapid integrated biosensor for multiplexed immunoassays based on actuated magnetic nanoparticles”,Lab on a Chip,第9卷,第3504至3510页(2009),其通过引用并入于此。
生物传感器试剂盒45的每一个检测腔46,55,56,68可以对流体内的另一物质敏感,即例如,在不同检测腔46,55,56,68中可以存在不同功能化的磁珠,其附着到不同物质,使得针对不同检测腔46,55,56,68检测到的降低的强度指示流体内的不同物质的浓度。相同检测腔内的不同绑定点还可以用于冗余地确定流体内的相同物质的若干浓度,其中这些浓度可以组合以用于减少可能的误差。例如,针对相同检测腔的不同绑定点所确定的浓度可以平均。
检测装置还包括输入单元30,比如键盘、计算机鼠标、触摸垫等,以及用于显示所确定的流体内的物质浓度的显示器31。输入单元30还可以用于在第一光学检测模式和第二光学检测模式之间切换。
图6示意性且示例性地图示了第二光学检测模式中的生物传感器系统40。在第二光学检测模式中,第二光源7生成第二光以用于光照颗粒检测表面5。在该实施例中,第二光源7包括用于光照形成颗粒检测表面5的四个检测腔46,55,56,68的四个底表面17,18,20,21的四个子光源。第二光经过倾斜隔膜32,被可透性反射镜14反射,横穿双远心布置13,并且然后通过耦合窗43耦合到生物传感器试剂盒45的下部部分41中,以便光照颗粒检测表面5。通过使用透镜35将被颗粒检测表面5上或靠近颗粒检测表面5的颗粒散射的第二光投射到光检测系统8的光检测表面15的第二部分12上,在图6中示出其中的仅一个透镜。透镜35形成透镜的一维阵列,其优选地为微型透镜,其中阵列垂直于图6的平面布置。而且,第二光源7的子光源的阵列平行于生物传感器试剂盒45的检测腔的阵列并且平行于透镜35的阵列而取向。
倾斜隔膜32、可透性反射镜14、双远心布置13和生物传感器试剂盒45的下部部分41适配成使得第二光源7的每一个子光源仅光照单个检测腔的表面,即单个颗粒检测子表面。第二光源7的子光源由控制单元29控制使得它们在时间上接连激活使得一次仅光照一个颗粒检测子表面并且将其成像到光检测表面15上。例如,在图7中示意性且示例性地图示的情形中,仅光照颗粒检测子表面20上的区域33,而没有光照其它颗粒检测子表面17,18,21。其它颗粒检测子表面17,18,21上的矩形指示将在其它时间光照的区域。因此,相比于第一光学检测模式,一次仅光照颗粒检测表面5的相对小区域,其中在时间上接连地光照不同颗粒检测子表面。
图8示意性且示例性地示出当仅光照颗粒检测子表面20的区域33时光检测系统8的光检测表面15。实心圆57指示在其内由绑定到衬底的颗粒散射的第二光被成像到光检测表面15上的区段,其中第二光已经由绑定在颗粒检测子表面20的四个绑定点处的颗粒散射。图8中所示的其它圆形81指示如果接通第二光源7的其它子光源,则经散射的第二光将投射到其上的光检测表面15上的位置。
图9示意性且示例性地更加详细示出圆形57中的一个。如可以在图9中看到,已经散射第二光的单个颗粒是可标识的,使得控制单元29可以对相应绑定点内的颗粒数目计数。由于绑定颗粒的数目取决于流体内的相应物质的浓度,因此基于所确定的颗粒数目可以确定流体内的相应物质的浓度。颗粒数目与物质浓度之间的关系可以通过对应校准过程提前确定,其中确定相应绑定点内的颗粒数目,而相应物质的浓度已知。关于基于散射光确定流体内的物质浓度的更多细节,参考WO 2011/036634 A1,其通过引用并入于此。
透镜22、双远心布置13、可透性反射镜14和倾斜隔膜32可以被视为用于在遇到颗粒检测表面5之前和/或在已经遇到颗粒检测表面5之后修改第一光和第二光的光学系统9的组件,其中从第二光源7到颗粒检测表面5的光学路径可以被视为光照光学路径37,并且从颗粒检测表面5到光检测系统8的光学路径可以被视为检测光学路径36。在光照光学路径37与检测光学路径36之间布置屏幕28,以便防止杂散线干扰通过光检测系统8对散射光的检测。屏幕28可以沿虚拟线10布置,该虚拟线10从光检测系统8的光检测表面15的第二部分12分离第一部分11。
图10示意性且示例性地示出在已经展开之后的双远心布置13上的顶视图,并且图11示意性且示例性地示出展开的双远心布置13的侧视图。如可以在图10中看到,倾斜隔膜包括若干开口,其中每一个开口与第二光源7的对应子光源相关联。
检测装置1在第一光学检测模式和第二光学检测模式中使用相同的光检测系统8和相同的双远心布置13,其中关于双远心布置13,在第一光学检测模式和第二光学检测模式中使用相同的光学路径,但是在相反方向上。检测装置1的若干组件优选地布置在外壳64内,其在图12中示意性且示例性地示出,并且其可以包括手柄部分63以用于允许用户在手中握持检测装置1而同时检测流体内的一个或若干物质。外壳64包括用于接收生物传感器试剂盒45的接收部段62。在其它实施例中,外壳64可以具有另一形状。
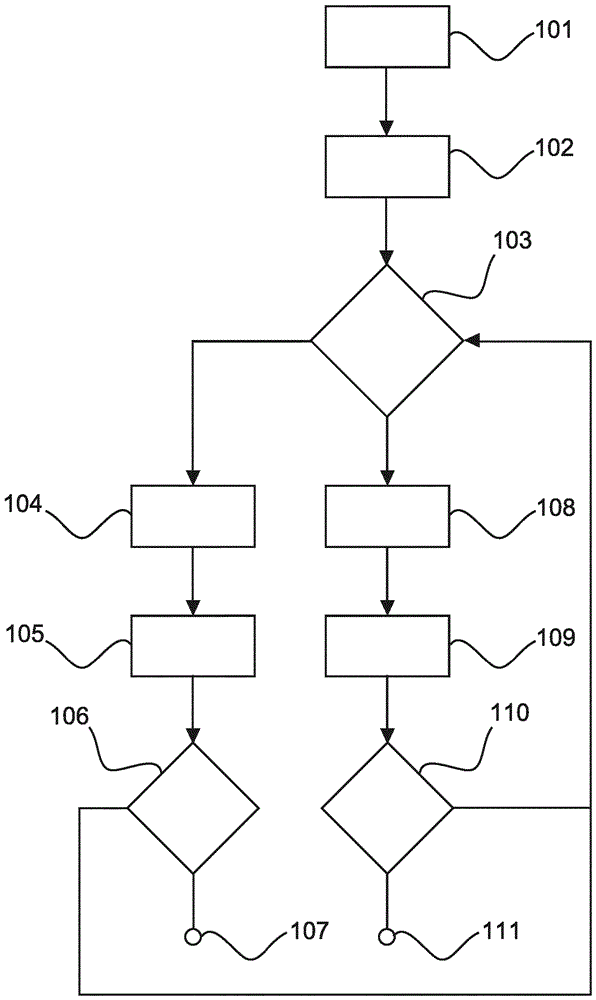
在下文中,将参照图13中所示的流程图来示例性地描述用于检测流体内的物质的生物感测方法的实施例。
在步骤101中,将流体引入到生物传感器试剂盒中并且使其与功能化的磁性颗粒混合,磁性颗粒捕获要检测的物质。在步骤102中,通过使用磁力将颗粒推动到颗粒检测表面上,其中已经捕获物质的颗粒绑定到颗粒检测表面。然后,向颗粒施加磁力使得未被绑定的颗粒从颗粒检测表面移开。用于朝向颗粒检测表面移动颗粒的吸引步骤和用于从颗粒检测表面移开未被绑定的颗粒的清洗步骤可以交替执行若干次。在步骤103中,可以选择应当在第一光学检测模式中还是在第二光学检测模式中操作检测方法。例如,用户可以输入检测方法应当在第一光学检测模式中还是在第二光学检测模式中执行。如果已经选择第一光学检测模式,则方法以步骤104继续。否则,方法以步骤108继续。
在步骤104中,颗粒检测表面由第一光光照并且光检测系统检测来自颗粒检测表面的第一光,其中所检测到的第一光的强度通过FTIR修改。在步骤105中,基于所检测到的光强度确定流体内的物质的浓度。在步骤106中,可以决定流体内的物质的浓度是否应当通过使用例如第二光学检测模式来再次确定,或者检测方法是否应当在步骤107中停止。例如,用户可以指示应当再次确定浓度或者生物感测方法应当停止。
如果在步骤103中已经决定应当应用第二光学检测方法,则在步骤108中,颗粒检测表面由第二光光照并且通过光检测系统检测由颗粒检测表面上或靠近颗粒检测表面的颗粒散射的第二光。在步骤109中,基于所检测到的散射光确定流体内的物质的浓度。在步骤110中,可以决定检测方法是否应当在步骤111中停止,或者检测方法是否应当以通过使用第一光学检测方法或第二光学检测方法再次确定流体内的物质浓度而继续。步骤103至111可以被视为用于检测颗粒检测表面上或靠近颗粒检测表面的检测方法的步骤。
生物感测方法可以用于检测流体内的单个物质或者用于检测流体内的若干物质,其中在后一种情况下可以使用颗粒检测子表面,特别是具有不同检测腔的生物传感器试剂盒,其绑定颗粒和物质的不同组合。
检测装置优选地适配成检测比如唾液、尿液以及尤其血浆和血清那样的体液中的特定目标分子。检测装置和检测方法可以适配成使得能够使用基于磁性颗粒的免疫测定来选择性检测目标蛋白质或其它分子。样品中的目标分子的存在优选地通过磁性颗粒(其还可以被视为磁珠)到绑定点(其还可以被视为覆盖有特定探针的检测点区域,即具有特定绑定元素)的绑定程度来检测。绑定到颗粒检测表面的磁珠的存在通过光学手段来检测。
检测装置可以适配成使用在心脏应用中,其中血液样品用于指示心肌梗塞的发生的数个生物标记物的定量检测。检测装置可以使用在护理点设置中,比如急救室、在床边、在救护车中、在医师的办公室中或甚至在家里。检测装置可以适配成检测心脏标记物蛋白质,比如肌钙蛋白I。而且,检测装置可以适配成检测肌红蛋白、B型钠尿肽、2,3 C-反应蛋白等。在心脏病之后血流中的肌红蛋白水平的快速增加使得能够实现迅速患者分层。B型钠尿肽对于心力衰减的紧急诊断以及对于患有急性冠脉综合征的患者的预后是有用的。这样的心脏标记物的同时定量可以允许临床医生快速诊断冠心病并且准确地设计患者护理策略。一组心脏标记物的快速且可靠的检测将帮助医学专业人员区分示出类似症状的患者。不同标记物以不同的诊断相关浓度存在并且可以要求用于检测和动态范围的最优下限的不同试验条件。为此原因,检测装置优选地适配成在生物传感器试剂盒的不同检测腔中执行针对不同分析物的试验。
即便检测装置用于仅定量一个分析物,多个检测点(即绑定点)也可以是有益的。定量精度可以通过合并冗余度来改进,例如以用于相同分析物的多个检测点区域的形式。而且,动态范围可以例如通过使用具有变化浓度的捕获分子(即绑定元素)的多个检测点(全部特定于相同分析物)来改进。检测的可靠性可以例如通过将一个或多个控制点(control spot)实现为可以指示功能化(即抗体涂敷)的磁性颗粒的功能的指示器来改进。生物传感器试剂盒因而优选地包括多个检测点,即多个绑定点,其可以布置在不同检测腔中。然而,在单个检测腔中也可以存在若干检测点。
检测装置优选地组合两个光学检测技术,FTIR检测技术和基于散射光的暗场成像的检测技术,其允许单个珠体的检测并且因而还可以被视为单个珠体(SB)检测技术。通过组合这两个光学检测技术,可能的是使用高灵敏SB检测技术以用于低浓度范围并且使用FTIR检测技术以用于较大浓度范围,即检测装置适配成在宽范围的浓度之上定量地检测生物标记物。
在低浓度范围中,SB检测技术是非常合适的“数字”技术以获得检测单独标签的最大灵敏度。然而,该方法的特性在于,其不能用于其中可能不再区分单独珠体的高浓度。可能的是针对该浓度范围而切换到散射光的全局强度检测,但是该方案遭受严重的校准问题。只有如果光学光照场强度和检测效率都被良好地校准并且如果生物传感器试剂盒极其可再生产,绝对浓度才能够从散射光强度导出。FTIR检测技术不遭受该问题,因为其测量试验期间的相对信号减小,这使其成为更加固有规格化的量。然而,FTIR检测技术的较低灵敏度使其不太适合于低浓度范围。组合两种检测技术提供整个浓度范围之上的解决方案,但是在原理上将由于用于两种检测技术的相对大量的光学组件和检测组件而造成明显增加的成本。以上参照图1和6描述的检测装置因而再用大多数昂贵的光学组件和检测组件。特别地,光学路径的折叠使得能够将相同的光检测系统用于两种检测技术。以此方式,可能的是具有两种检测技术的优点,而不引入明显的额外成本。
在其中使用FTIR检测技术的第一光学检测模式中,优选地利用有限发散度来全局地光照生物传感器试剂盒中的数个检测腔,即如以上参照图4所描述的那样全局光照对应颗粒检测子表面。反射光用于同时在所有检测区域的光检测系统上制作图像。为了得到针对每一个检测腔的相同检测条件并且为了减少与倾斜成像方案有关的图像失真,有利的是使用双远心成像布置。双远心成像布置的透镜之间的中心光阑在原理上限制成像NA。然而,在实践中,针对FTIR检测系统的NA优选地由FTIR光照光学器件的较小NA,因而由第一光源6的大小和透镜22的焦距的组合来确定,其中第一光源6位于透镜22的焦平面中。双远心成像布置的透镜之间的中心光阑优选地使用在第二光学检测模式中以确定使用在该光学检测模式中的较大光照NA。在第一光学检测模式中,由光检测系统获取的相机图像同时示出不同的检测腔,即不同的颗粒检测子表面。每一个检测腔优选地包括多于一个绑定点,即多于一个捕获点。在以上参照图1至9描述的实施例中,每个检测腔存在四个绑定点。然而,在另一实施例中,每个腔还可以存在更多或更少的绑定点。
通过使用FTIR检测技术,本质上测量在试验期间由绑定点局部反射的光强度中的减小。该测量通过在试验之前和之后拍取图像来执行。测量提供相对信号减小作为试验的结果。这样的相对测量可以容易地在分析器之间比较,即在检测装置之间比较,因为其仅取决于光检测系统的线性度。不需要确定或校准绝对光照和检测功率。
在第二光学检测模式中,优选地应用SB检测技术,其中在时间上接连地光照不同检测腔,即不同颗粒检测子表面。利用优选地源自第二光源的分离LED的第二光束来局部光照各个检测腔。这使得能够按时间顺序一次光照一个检测腔。相应光照光束的渐逝场仅与相应颗粒检测子表面的直接邻域中的珠体相互作用,其中对每一个检测腔,分配将相应检测腔的中心区域竖直向下成像到光检测系统的光检测表面的第二部分上的相应微型物镜35。在以上参照图1至9描述的实施例中,所得图像包括四个点,其对应于相应颗粒检测子表面上的捕获或绑定点。不同检测腔的图像由于检测腔之间的距离而可以在光检测表面上偏移。在实施例中,这些偏移可以通过使用棱镜阵列来补偿。然而,甚至在没有这样的移位补偿的情况下,检测腔的图像由于放大因子而大部分重叠在光检测表面上,其中放大被选择成使得可以识别绑定到绑定点的各个珠体并且对其进行计数。通过按时间顺序对检测腔的光照来避免源自不同检测腔的重叠图像之间一般可能的串扰。
光学系统,尤其是双远心布置,优选地设计成使得在倾斜角度之下仅光照相应平坦颗粒检测子表面的中心部分。触碰检测腔的边缘可能导致杂散光,降低对比度并且破坏SB检测技术的暗场方案。而且,光学系统,特别是双远心布置,优选地设计成保持光照对于每一个检测腔基本上相同。
尽管在以上描述的实施例中将部分透射的反射镜用作可透性反射镜,以便允许检测装置从第一光学检测模式切换到第二光学检测模式并且反之亦然,但是在其它实施例中,取代于部分透射的反射镜,可以使用其它构件,其允许检测装置在不同检测模式之间切换。例如,取代于部分透射的反射镜,可以使用电气、磁性或机械可切换的反射镜,其可以由控制单元29可控并且优选地取决于切换状态而是可透性的,特别地基本上完全可透性的,或者反射的,特别地基本上完全反射的。
尽管在图5和8中示出光检测表面上的颗粒检测子表面的图像的特定组合,但是在另一实施例中,这些图像,即FTIR图像和SB图像,可以以另一方式布置在光检测表面上,特别地取决于光检测表面的纵横比和生物传感器试剂盒的检测腔的数目,其必须在光检测表面上复用。例如,SB图像255和FTIR图像256可以布置在包括通过虚拟线210分离的第一部分211和第二部分212的光检测表面215上,如图14中示意性且示例性地图示。或者,SB图像355和FTIR图像356可以布置在光检测表面315的第二部分312和第一部分311上,如图15中示意性且示例性图示,其中在图15中参考数字310仅指示从第二部分312勾勒第一部分311的虚拟线。
使用在第二光学检测模式中的SB检测技术还可以被视为暗场检测技术,其中杂散光可能削弱暗场检测技术的质量。检测装置因而优选地包括从低强度SB成像分支(即检测光学路径36)分离高强度光照分支(即光照光学路径37)的杂散光减少屏幕。
检测装置高效地再用昂贵的组件,比如光检测系统和双远心布置的双远心透镜对。第二光学检测模式中的光照NA,即在SB检测模式中,由SB光照分支中的隔膜确定,即在光照光学路径37中。在第一光学检测模式中,即在FTIR检测模式中,可以使用较小的光照NA,其由图1和6的左侧上的全局FTIR光照分支确定。FTIR光照发散度和因而用于FTIR的光照NA由第一光源的大小以及第一光源6与生物传感器试剂盒45之间的透镜22的焦距来确定。因而仍旧可能的是独立地选择用于FTIR光照和用于SB光照的NA,其中用于FTIR光照的NA优选地低于用于SB光照的NA。
部分透射的反射镜创建SB光照情形中的某种损失,即在第二光学检测模式期间使用的光照中。反射率优选地选择为高,以便限制SB检测模式中的损失。在FTIR检测模式中,即在第一光学检测模式中,这造成相对高的损失,但是这实际上不是问题,因为在使用FTIR检测技术的第一光学检测模式中,甚至在考虑这些损失的情况下,所检测到的强度也相对大。
检测装置可以适配用于检测分子目标,其通常确定例如细胞、病毒、细胞的部分或病毒的部分、组织提取液等较大成分的浓度和/或存在。磁珠可以直接通过感测方法来检测。此外,可以在检测之前进一步处理颗粒。另外的处理的示例是添加材料或修改磁性标签的化学、生物化学或物理性质以促进检测。检测装置可以适配用于与若干生物化学试验类型一起工作,例如绑定/解绑试验、夹心试验、竞争试验、移位试验、酶促试验等。检测装置可以适配用于传感器复用,即不同传感器和传感器表面的并行使用;标签复用,即不同类型标签的并行使用;以及腔复用,即不同反应腔的并行使用。检测装置可以用作用于小样品体积的迅速、鲁棒且易于使用的护理点生物传感器。一个或若干检测腔优选地为一次性试剂盒的部分,其与检测装置一起使用,其优选地包含一个或多个磁场生成构件。
尽管在以上描述的实施例中,在第一光学检测模式中光检测表面的第一部分用于检测光,并且在第二光学检测模式中光检测表面的第二部分用于检测光,其中第一和第二部分是非重叠的,但是在其它实施例中,在不同光学检测模式中光照的第一和第二部分可以重叠,即光检测表面的相同部分可以用于在第一光学检测模式中和在第二光学检测模式中检测光。如果情况是这样,则杂散光屏障优选地较短,即a)面向光检测表面的杂散光屏障的端部与b)光检测表面之间的距离优选地较大。
尽管在以上描述的实施例中,在第二光学检测模式中一次仅光照单个检测区,但是在其它实施例中还可以在第二光学检测模式中同时光照两个或更多检测区,其中在该情况下,光学系统和光检测系统适配成使得被同时光照的检测区的图像在光检测表面上空间分离。因此,在该情况下,光学系统和光检测系统适配成使得同时光照的检测区的图像在光检测表面上不重叠。
尽管在以上描述的实施例中,检测装置适配成允许用户选择所期望的光学检测模式,但是在另一实施例中,检测装置可以适配成在时间上接连地执行两个光学检测模式,即特别地时间交错,而不必要求用于选择某个光学检测模式的用户交互。检测装置可以适配成总是在时间上接连地使用两个光学检测模式。
尽管在以上描述的实施例中,光检测系统包括使用在第一光学检测模式中和第二光学检测模式中的单个检测器的单个光检测表面,但是在另一实施例中,光检测系统可以包括两个或更多检测器的两个或更多光检测表面,其中第一检测器可以使用在第一光学检测模式中并且第二检测器可以使用在第二光学检测模式中。在该情况下,光检测系统的另一组件和/或光学系统的组件可以使用在两个光学检测模式中。
颗粒优选地为磁珠,其优选地为具有范围在3nm和10000nm之间的至少一个尺寸的纳米颗粒,优选地在10nm和3000nm之间,更优选地在50nm和1000nm之间。
本领域技术人员在实践所要求保护的发明时,通过研究附图、公开内容和随附权利要求,可以理解和实现对所公开的实施例的其它变形。
在权利要求中,词语“包括”不排除其它元件或步骤,并且不定冠词“一”或“一个”不排除多个。
单个单元或设备可以履行权利要求中叙述的若干项的功能。在相互不同的从属权利要求中叙述某些措施的仅有事实不指示这些措施的组合不能用于获益。
比如基于所检测到的光强度对流体内的物质浓度的确定和/或依照检测方法对检测装置的控制那样的过程可以实现为计算机程序的程序代码构件和/或实现为专用硬件。
计算机程序可以存储/分布在合适的介质上,诸如光学存储介质或固态介质,其与其它硬件一起或者作为其部分而供应,但是还可以以其它形式分布,诸如经由互联网或其它有线或无线电信系统。
权利要求中的任何参考标记不应当解释为限制范围。
本发明涉及用于在第一光学检测模式中和第二光学检测模式中检测颗粒检测表面上或靠近颗粒检测表面的颗粒的检测装置,其中检测装置的光检测系统的组件和/或光学系统的组件布置成使用在第一检测模式中和第二检测模式中。由于光检测系统的组件和/或光学系统的组件布置成使用在第一检测模式中和第二检测模式中,因此该组件不需要被提供两次,即用于使用在第一检测模式中和用于使用在第二检测模式中。这可以引起减少数目的组件并且可以使检测装置在技术上较不复杂。
- 还没有人留言评论。精彩留言会获得点赞!