用于肝癌检测的标志物组合及检测试剂盒的制作方法
本发明涉及用于肝癌检测的标志物或其组合,用于检测它们的试剂和试剂盒,以及它们在肝癌检测和将肝癌患者与乙肝患者、肝硬化患者和/或健康者相区分中的应用。
背景技术:
原发性肝癌(PLC,简称肝癌)是临床上最常见的恶性肿瘤之一,起病隐匿,侵袭生长迅速,治疗后易复发,预后极差,被称为“癌中之王”。全世界半数左右的肝癌患者集中在中国,每年我国约有11万人死于肝癌,居恶性肿瘤死亡率的第二位。目前,手术切除及肝移植是肝癌最有效的治疗方法,但绝大多数肝癌患者就诊时已到中晚期,无法手术,手术切除率仅为10-30%。对于不能手术的病例,传统的放、化疗效果不佳,患者生存期一般不超过半年。由此可见肝癌早期诊断至关重要,是临床诊疗和预后的关键。
早期肝癌检出率低的现状反映出目前肝癌的诊断方法还有很大局限性。当前肝癌的诊断主要依靠血清学检查和影像学诊断。血清学检查主要检测血清中的肿瘤标志物,目前主要是依靠甲胎蛋白(AFP)的检测,但AFP在小肝癌中的敏感度仅为40%左右。由此可见,单独使用一种肿瘤标志物无法准确诊断肿瘤的发生和发展,联合检测多种肿瘤标志物才能提高检出的准确率,避免或减少漏诊和假阳性。应用新的检测技术、选择更有诊断价值的标志物组合,提高现有肿瘤标志物检测的灵敏度和特异性对肝癌早期诊断极为重要。目前,常用的肝癌标志物主要包括:甲胎蛋白(AFP)、α-L-岩藻糖甘酶(AFU)、肝细胞生长因子(HGF)、硫酸肝素蛋白多糖3(GPC3)、谷氨酰转移酶同工酶Ⅱ(GGTⅡ)等。
甲胎蛋白(α-fetoprotein,AFP):AFP是目前最常用的HCC诊断标志物,AFP是人体在胚胎时期血液中含有的一种特殊蛋白,正常成人血清中 含量极微,肝细胞癌可显著升高。
α-L-岩藻糖甘酶(alpha-L-fucosidase,AFU):1984年,Deugnier首先发现了HCC患者血清AFU活性明显升高,并报道了对正常人、肝硬化患者和继发转移肝癌患者血清AFU的测定结果,在原发性肝癌中它诊断敏感性为75%,特异性为90%,认为AFU可能成为诊断HCC的一项有用指标。
肝细胞生长因子(Hepatocyte growth factor,HGF):HGF是一种能够刺激干细胞增殖的多肽生长因子。HGF受体(Met)主要分布于各脏器及其肿瘤组织的上皮细胞,在重症肝炎、肿瘤等疾病中,血清中的HGF水平可发生明显变化,有望成为HCC的诊断标志物。
硫酸肝素蛋白多糖3(glypican-3,GPC3):GPC3位于细胞膜表面,是细胞表面多功能的共同受体。Hsu等应用差异显示技术首次发现了GPC3基因在HCC组织中有异常表达。GPC3现已成为肝穿刺标本良恶性肝疾患鉴定的重要参考标志物之一。
谷氨酰转移酶同工酶2(γ-glutamyltransferase isoenzyme2,GGT2):GGT2被认为是AFP以外的最佳肝癌标志物。目前认为GGT2是肝细胞产生的癌胚蛋白,肝细胞产生的GGT糖链结构发生改变,这种差异可在肝癌前期和早期出现,因此具有较高的预测价值和早期诊断价值。
技术实现要素:
本发明公开了一组肝癌血清学检测的标志物组合,包括甲胎蛋白(AFP)、α-L-岩藻糖甘酶(AFU)、肝细胞生长因子(HGF)、硫酸肝素蛋白多糖3(GPC3)、谷氨酰转移酶同工酶2(GGT2),可将肝癌患者与乙肝患者、肝硬化患者或健康者进行有效区分。通过酶联免疫吸附法(ELISA)单独检测HGF或将HGF与其它四个标志物中的一个或多个联合检测,可大幅提高全期肝癌和早期肝癌血清学检测的敏感度和特异性,明显优于肝癌临床检测常用的AFP单指标。本发明为肝癌的血清学检测提供了一种可靠的方法,并提供了一种检测用试剂盒。
在一方面,本发明涉及用于肝癌检测的标志物,所述标志物选自由以下组成的组:甲胎蛋白(AFP)、α-L-岩藻糖甘酶(AFU)、肝细胞生长因 子(HGF)、硫酸肝素蛋白多糖3(GPC3)和谷氨酰转移酶同工酶2(GGT2/GGT II),优选HGF。
在另一方面,本发明涉及用于肝癌检测的标志物组合,其中所述标志物组合包括两种或更多种(三种、四种或五种)选自由以下组成的组的标志物:甲胎蛋白(AFP)、α-L-岩藻糖甘酶(AFU)、肝细胞生长因子(HGF)、硫酸肝素蛋白多糖3(GPC3)和谷氨酰转移酶同工酶2(GGT2/GGT II)。
在一个优选实施方案中,本发明涉及的所述标志物组合包括HGF和选自由以下组成的组的一种或多种(二种、三种或四种)标志物:甲胎蛋白(AFP)、α-L-岩藻糖甘酶(AFU)、硫酸肝素蛋白多糖3(GPC3)和谷氨酰转移酶同工酶2(GGT2/GGT II)。
在一个特别优选的实施方案中,本发明涉及的所述标志物组合选自由以下组成的组:HGF+AFP;HGF+AFU;HGF+GPC3;HGF+GGT2;HGF+AFP+AFU;HGF+AFP+GPC3;HGF+AFP+GGT2;HGF+AFU+GPC3;HGF+GPC3+GGT2;HGF+AFP+GPC3+GGT2;HGF+AFP+AFU+GGT2;和HGF+AFP+GPC3+GGT2+AFU。
在另一方面,本发明涉及能够检测根据本发明的标志物或根据本发明的标志物组合的试剂或试剂组合在制备用于肝癌检测的诊断剂或试剂盒中的应用,优选所述肝癌是全期肝癌或早期肝癌。优选地,所述诊断剂或试剂盒在应用时还考虑受试者的年龄和/或性别。
在另一方面,本发明涉及能够检测根据本发明的标志物或根据本发明的标志物组合的试剂或试剂组合在制备用于将肝癌患者与乙肝患者、肝硬化患者和/或健康者相区分的诊断剂或试剂盒中的应用,优选所述肝癌是全期肝癌或早期肝癌。优选地,所述诊断剂或试剂盒在应用时还考虑受试者的年龄和/或性别。
在以上方面的一个优选实施方案中,所述试剂或试剂组合包含一种或多种(1,2,3,4或5种)特异性结合于人肝癌标志物的抗体或其片段,所述人肝癌标志物选自由以下组成的组:甲胎蛋白(AFP)、谷氨酰转移酶同工酶II(GGT II或GGT2)、α-L-岩藻糖甘酶(AFU)、肝细胞生长因子(HGF)和硫酸肝素蛋白多糖3(GPC3),优选所述试剂或试剂组合包含针对HGF的抗体或其片段和分别针对选自AFP、GGT II、AFU和GPC3的标志物的 抗体或其片段中的一种或多种(1,2,3或4种)。
优选地,所述抗体是多克隆抗体或人IgG2亚类、人IgG1亚类或人IgM亚类单克隆抗体,优选所述片段是单链抗体(scFv),优选其中所述抗体或其片段用于ELISA测定、Western Blotting测定、免疫组织化学测定或免疫荧光测定。
在另一方面,本发明涉及试剂盒,其包含能够检测本发明的标志物或本发明的标志物组合的试剂或试剂组合,所述试剂盒用于肝癌检测或用于将肝癌患者与乙肝患者、肝硬化患者和/或健康者相区分,优选所述肝癌是全期肝癌或早期肝癌,更优选所述试剂盒在使用时还考虑受试者的年龄和/或性别,优选所述试剂盒包含一种或多种(1,2,3,4或5种)特异性结合于所述标志物的抗体或其片段,更优选所述片段是单链抗体(scFv)。
发明详述
为了改善目前临床肝癌检出率低及现有血清学检测方法敏感度低的问题,本发明提供了一个肝癌标志物组合,AFP、AFU、HGF、GPC3和GGT2,将这五个标志物进行HGF单指标检测或HGF与其他标志物联合应用,大幅提高了全期肝癌和早期肝癌血清学检测的敏感度和特异性,为肝癌的检测提供了一种可靠的方法。
具体地,本发明提供以下各项:
1.用于肝癌检测的标志物组合,包括甲胎蛋白(AFP)、α-L-岩藻糖甘酶(AFU)、肝细胞生长因子(HGF)、硫酸肝素蛋白多糖3(GPC3)、谷氨酰转移酶同工酶2(GGT2);
2.根据以上1所述的标志物组合,其特征在于AFP、AFU、HGF、GPC3和GGT2五个标志物中,进行HGF单指标检测,以及HGF联合其它标志物进行双指标、三指标、四指标及五指标检测时,能够与乙肝患者、肝硬化患者和健康者区别开来而检测肝癌;
3.用于检测肝癌的方法,其特征在于测定同一患者血清中的AFP、AFU、HGF、GPC3和GGT2五种标志物的含量,通过对五种标志物的量进行统计学分析确定其患肝癌的可能性;
4.根据以上3所述的方法,其五种标志物含量的测定,是通过酶联免 疫吸附法(ELISA)进行的;
5.根据以上3所述的方法,在全部人群(肝癌、乙肝、肝硬化和正常人)中筛查肝癌,在乙肝患者中筛查肝癌,以及在肝硬化患者中筛查肝癌时,HGF单指标检测全期肝癌和早期肝癌均有很高的敏感度和特异性,单独检测HGF,必要时纳入受试者的年龄和性别,可以满足临床肝癌诊断的需要,HGF是优于AFP的肝癌标志物;
6.根据以上3所述的方法,检测两个指标在全部人群筛查肝癌,在乙肝患者中筛查肝癌,以及在肝硬化患者中筛查肝癌时,纳入年龄或性别之一后,HGF与AFP、AFU、GPC3、GGT2四个标志物之一分别联用,检测全期肝癌和早期肝癌均可达到很高的敏感度和特异性,对于原发性肝癌患者的诊断具有显著意义,特别是HGF与AFP的联合为肝癌患者血清学诊断及早期诊断的最佳组合,说明HGF与其它四种标志物之一联合检测,必要时综合受试者的年龄或者性别,可以作为HGF单指标检测的补充,满足临床肝癌诊断的需求;
7.根据以上3所述的方法,检测三个指标在全部人群中筛查肝癌,检测全期肝癌时,HGF+AFP+AFU联用,HGF+AFP+GPC3联用,HGF+AFP+GGT2联用,HGF+AFU+GPC3联用时,均可达到91.8%以上的敏感度和90.2%以上的特异性,检测早期肝癌时,HGF+AFP+AFU联用,HGF+AFP+GPC3联用,以及HGF+AFP+GGT2联用时,均可达86.3%以上的敏感度和85.5%以上的特异性,在乙肝患者中筛查肝癌时,HGF+AFP+AFU,HGF+AFP+GPC3,HGF+AFP+GGT2,HGF+AFU+GPC3以及HGF+GPC3+GGT2联合应用,检测全期肝癌的敏感度均可达92.3%以上,特异性可达93.5%以上,检测早期肝癌也有较好效果,特别是HGF+AFP+AFU的组合,敏感度达90.2%,特异性达98.4%;在肝硬化患者中筛查肝癌时,HGF与另两种标志物联用,也可达到较满意的效果,说明HGF与另外两种标志物联合检测,可以满足临床肝癌血清学诊断及早期诊断的需求;
8.根据以上3所述的方法,检测四个指标筛查肝癌时,敏感度和特异性均有提高,在全部人群中筛查肝癌时,HGF、AFP、GPC3和GGT2的组合检测全期肝癌的敏感度为91.3%,特异性为92.0%,检测早期肝癌的 敏感度为86.3%,特异性为90.5%,在乙患者中筛查肝癌时,HGF、AFP、AFU和GGT2的组合检测全期肝癌的敏感度为91.8%,特异性为98.4%,检测早期肝癌的敏感度为92.2%,特异性为98.4%,在肝硬化患者中筛查肝癌时,HGF与另外三种指标联用时,均可达到较高的敏感度和特异性;
9.根据以上3所述的方法,五种标志物联合应用,敏感度和特异性进一步提高,在全人群中筛查肝癌时,其检测全期肝癌的敏感度可达91.2%,特异性可达93%,检测早期肝癌的敏感度为84.3%,特异性可达87.2%,在乙肝患者中筛查肝癌时,检测全期肝癌的敏感度为91.8%,特异性为98.4%,检测早期肝癌的敏感度为92.2%,特异性为98.4%,在肝硬化患者中筛查肝癌时,检测全期肝癌的敏感度为91.3%,特异性为76.2%,检测早期肝癌的敏感度为92.2%,特异性为66.7%;
10.一种用于肝癌血清学检测的试剂盒,同时包含AFP、AFU、HGF、GPC3和GGT2中的一种或多种单克隆抗体,可用于患者血清的ELISA检测。
更具体地,本发明提供AFP、AFU、HGF、GPC3和GGT2联合应用的方法,其包括的步骤为:
1)收集不同人群的血清,包括肝癌患者,乙肝患者,肝硬化患者和健康者;
2)通过酶联免疫吸附法(ELISA)法检测每例血清中的AFP、AFU、HGF、GPC3及GGT2五个标志物的含量,为减小实验误差,一个指标设3个附孔取平均值;
3)分别对五个标志物的含量进行单指标、两指标、三指标、四指标及五指标联合ROC曲线分析,并对结果进一步的统计学分析;
4)根据病例资料,将肝癌患者依照巴塞罗那标准进行分期,分析单标志物和两个、三个或更多标志物组合在早期(A)、中期(B)和晚期(C+D)中的敏感度和特异性。
5)对血清中五种标志物检测值进行建模,分析其预测肝癌的准确性。
本发明所述的肝癌标志物组合,即AFP、AFU、HGF、GPC3和GGT2,五种指标在肝癌患者血清中的含量,显著高于健康者(p<0.0001);AFP、 HGF与GGT2在肝癌患者血清中的含量均高于乙肝患者和肝硬化患者,而AFU在肝癌患者血清中的含量低于乙肝患者高于肝硬化患者,GPC3在肝癌患者血清中的含量高于乙肝患者低于肝硬化患者。
本发明所述的肝癌血清学检测方法,使用HGF单指标在全部人群(肝癌、乙肝、肝硬化和正常人)中筛查肝癌,其检测全期肝癌的敏感度为90.3%,特异性为90.5%,在巴塞罗那分期的早期(A期)肝癌患者中,检测的敏感度为90.2%,特异性为84.1%,纳入受试者的年龄和性别后,HGF在全期肝癌中的敏感度为91.3%,特异性为90.9%,在早期肝癌中的敏感度为86.3%,特异性为90.5%;在乙肝患者中筛查肝癌,HGF单指标检测全期肝癌的敏感度为94.4%,特异性为91.8%,检测早期肝癌的敏感度为90.2%,特异性为91.9%,纳入受试者年龄性别后,检测全期肝癌的敏感度为90.8%,特异性为95.2%,检测早期肝癌的敏感度为92.2%,特异性为90.2%;在肝硬化患者中筛查肝癌,HGF单指标检测全期肝癌和早期肝癌的敏感度和特异性均可达72%和73%以上,显著优于临床常用的AFP,说明单独检测血清中HGF的含量,必要时并综合受试者年龄和性别可以满足临床肝癌诊断的需要。
本发明所述的肝癌血清学检测方法,检测两个指标在全部人群筛查肝癌时,只纳入受试者性别进行统计后,HGF与AFP联用检测全期肝癌的敏感度为90.8%,特异性为93.1%,HGF与AFU联用检测全期肝癌的敏感度为87.2%,特异性为94.6%,HGF与GPC3联用检测全期肝癌的敏感度为91.8%,特异性为90.6%,HGF与GGT2联用检测全期肝癌的敏感度为89.3%,特异性为93.1%;只纳入受试者年龄后,HGF与AFP联用检测全期肝癌的敏感度为92.3%,特异性为90.9%,HGF与AFU联用检测全期肝癌的敏感度为90.8%,特异性为91.6%,HGF与GPC3联用检测全期肝癌的敏感度为90.3%,特异性为90.9%,HGF与GGT2联用检测全期肝癌的敏感度为89.3%,特异性为92.3%。在检测早期肝癌时,将HGF与AFP,HGF与AFU,HGF与GPC3,HGF与GGT2分别联用,纳入年龄或性别之一后,均可达到86%以上的敏感度和和84%以上的特异性。
而在乙肝患者中筛查肝癌时,只纳入受试者性别进行统计后,HGF与AFP联用检测全期肝癌敏感度为92.9%,特异性为95.2%,HGF与AFU 联用检测全期肝癌敏感度为93.4%,特异性为93.5%,HGF与GPC3联用检测全期肝癌敏感度为93.4%,特异性为93.5%,HGF与GGT2联用检测全期肝癌敏感度为92.3%,特异性为93.5%。;只纳入受试者年龄进行统计后,HGF与AFP联用检测全期肝癌敏感度为92.3%,特异性为93.5%,HGF与AFU联用检测全期肝癌敏感度为93.9%,特异性为93.4%,HGF与GPC3联用检测全期肝癌敏感度为93.9%,特异性为93.4%,HGF与GGT2联用检测全期肝癌敏感度为93.4%,特异性为95.1%。在检测早期肝癌时,将HGF与AFP,HGF与AFU,HGF与GPC3,HGF与GGT2分别联用,纳入年龄或性别之一后,均可达到86.3%以上的敏感度和和83.9%以上的特异性。在肝硬化患者中筛查肝癌时,纳入年龄或性别之一后,HGF与其他四个标志物分别联用,检测全期肝癌和早期肝癌均可达到较高的敏感度和特异性。说明HGF与其他四个指标单独联合检测,并综合受试者年龄或性别后,对于原发性肝癌患者的诊断具有显著意义,特别是HGF与AFP的联合为肝癌患者血清学诊断及早期诊断的最佳组合。
本发明所述的肝癌血清学检测方法,检测三个指标在全部人群中筛查肝癌,检测全期肝癌时,HGF+AFP+AFU联用,HGF+AFP+GPC3联用,HGF+AFP+GGT2联用时,均可达到91.8%以上的敏感度和90.2%以上的特异性,检测早期肝癌时,HGF+AFP+AFU联用,HGF+AFP+GPC3联用,以及HGF+AFP+GGT2联用时,均可达86.3%以上的敏感度和85.5%以上的特异性。在乙肝患者中筛查肝癌时,HGF+AFP+AFU,HGF+AFP+GPC3,HGF+AFU+GPC3以及HGF+GPC3+GGT2联合应用,检测全期肝癌的敏感度均可达92.3%以上,特异性可达93.5%以上,检测早期肝癌也有较好效果,特别是HGF+AFP+AFU的组合,敏感度达90.2%,特异性达98.4%。在肝硬化患者中筛查肝癌时,HGF与另两种标志物联用,也可达到较满意的效果。说明HGF与另外两种标志物联合检测,可以满足临床肝癌血清学诊断及早期诊断的需求。
本发明所述的肝癌血清学检测方法,检测四个指标筛查肝癌时,敏感度和特异性均有提高。在全部人群中筛查肝癌时,HGF、AFP、GPC3和GGT2的组合检测全期肝癌的敏感度为91.3%,特异性为92.0%,检测早期肝癌的敏感度为86.3%,特异性为90.5%;在乙患者中筛查肝癌时,HGF、 AFP、AFU和GGT2的组合检测全期肝癌的敏感度为91.8%,特异性为98.4%,检测早期肝癌的敏感度为92.2%,特异性为98.4%;在肝硬化患者中筛查肝癌时,HGF与另外三种指标联用时,均可达到较高的敏感度和特异性。
本发明所述的肝癌血清学检测方法,五种标志物联合应用,在全人群中筛查肝癌时,其检测全期肝癌的敏感度可达91.2%,特异性可达93%,检测早期肝癌的敏感度为88.2%,特异性可达87.2%,在乙肝患者中筛查肝癌时,检测全期肝癌的敏感度为91.8%,特异性为98.4%,检测早期肝癌的敏感度为92.2%,特异性为98.4%,在肝硬化患者中筛查肝癌时,检测全期肝癌的敏感度为91.3%,特异性为76.2%,检测早期肝癌的敏感度为92.2%,特异性为66.7%,显著优于目前临床肝癌检测的金标准AFP。
为了验证检测结果的准确性,本发明将五种标志物在肝癌病人血清,正常人血清和乙肝病人血清中的检测值建立了模型,将全部研究对象的危险系数(RS)从小到大排列,分割为高危组(RS≥0.5)和低危组(RS<0.5),大部分肝癌患者被正确分到高危组,散点图趋势明显,说明模型结果符合事实情况。该模型可以用于分析AFP、AFU、HGF、GPC3、GGT2五种标志物检测值与肝癌的相关性。
本发明通过大量样本验证和统计学分析,证明HGF可以作为肝癌标志物单独用于肝癌的筛查和早期诊断,其检测灵敏度和特异性均大幅优于临床的金标准AFP,HGF与其它一个或多个指标的联合使用,可作为HGF检测的补充,进一步提高肝癌血清学诊断的灵敏度和特异性。
本发明还提供了一种用于肝癌血清学检测的ELISA试剂盒,包含HGF、AFP、AFU、GPC3、GGT2中的一对或多对单克隆抗体,可通过双抗体夹心法在一次实验中同时测定受试者血清中的一个或多个指标的含量,有望开发成为肝癌血清学临床诊断的有力工具。
定义
术语“抗体”涵盖抗体结构的多种形式,包括但不限于完整的抗体和抗体片段。根据本发明所述的抗体优选地是人源化的抗体、嵌合抗体或其它遗传改造的抗体,只要根据本发明的特征性质仍旧保留。
抗体的“类别”是指其重链具有的恒定结构域或恒定区的类型。有五个主要类别的抗体:IgA,IgD,IgE,IgG和IgM,并且这些中的一些可以进一步被划分为亚类(同种型),例如,IgG1,IgG2,IgG3,IgG4,IgA1和IgA2。对应于不同类别的免疫球蛋白的重链恒定结构域分别被称为α,δ,ε,γ和μ。
“抗体片段”是指不同于完整抗体的分子,其包含完整抗体的部分,所述部分结合完整抗体结合的抗原。抗体片段的实例包括但不限于Fv,Fab,Fab',Fab’-SH,F(ab')2;双抗体;线性抗体;单链抗体分子(例如scFv);和由抗体片段形成的多特异性抗体。
术语“单克隆抗体”或“单克隆抗体组合物”用于本文中时,指单一氨基酸组成的抗体分子制剂。
“可变结构域”(轻链(VL)的可变结构域,重链(VH)的可变结构域)用于本文中时,表示直接参与抗体与抗原结合的每对轻链和重链结构域。可变轻链和重链的结构域具有相同的一般结构且每个结构域包括4个构架(FR)区,所述构架区的序列普遍保守,其通过3个“高变区”(或互补决定区,CDRs)相连接。构架区采用β-折叠构象且CDR可以形成连接β-折叠结构的环。每条链中的CDR通过构架区以其三维结构保持并与来自另一条链的CDR一起形成抗原结合位点。抗体重链和轻链CDR3区在按照本发明的抗体的结合特异性/亲和力方面发挥特别重要的作用并因此提供本发明的另一个目的。
用于本文时,术语“抗体的抗原结合部分”指负责抗原结合的抗体的氨基酸残基。抗体的抗原结合部分包括来自“互补决定区”或“CDRs”的氨基酸残基。“构架”或“FR”区是除本文中定义的高变区残基之外的那些可变结构域区域。因此,抗体的轻链和重链可变结构域从N端到C端包括结构域FR1,CDR1、FR2、CDR2、FR3、CDR3和FR4。特别地,重链的CDR3是最有助于抗原结合的区域并且限定抗体的性质。按照Kabat,E.A.,等,免疫目的的蛋白质序列(Sequences of Proteins of Immunological Interest),第5版,公众健康服务,国家健康研究所(Public Health Service,National Institutes of Health),Bethesda,MD.(1991))的标准定义确定CDR和FR区域,和/或来自“高变环”的那些残基。
根据本发明所述的抗体可以由重组方式产生。因此,本发明的一个方面是编码根据本发明所述的抗体的核酸,并且另一个方面是包含编码根据本发明抗体的所述核酸的细胞。用于重组生产的方法是现有技术中广泛已知的并且包含在原核细胞和真核细胞中的蛋白表达,以及随后的抗体分离和通常纯化为药用纯度。对于将前述抗体在宿主细胞中的表达,将编码各个修饰的轻链和重链的核酸通过标准方法插入表达载体中。在适合的原核或真核宿主细胞如CHO细胞,NS0细胞,SP2/0细胞,HEK293细胞,COS细胞,PER.C6细胞,酵母,或大肠杆菌细胞中进行表达,并且将所述抗体从细胞(上清液或裂解后的细胞)中回收。用于重组生产抗体的一般方法是现有技术中公知的,并且例如在Makrides,S.C.,Protein Expr.Purif.17(1999)183-202;Geisse,S.,等,Protein Expr.Purif.8(1996)271-282;Kaufman,R.J.,分子生物技术(Mol.Biotechnol.)16(2000)151-161;Werner,R.G.,J.Drug Res(药物研究杂志).48(1998)870-880的综述文章中描述。
根据本发明所述的抗体适当地从培养基中通过常规免疫球蛋白纯化方法分离,所述纯化方法如,例如蛋白A-琼脂糖,羟基磷灰石层析法,凝胶电泳,透析或亲和层析法。编码所述单克隆抗体的DNA和RNA容易地使用常规方法进行分离和测序。杂交瘤细胞可以充当所述DNA和RNA的来源。一旦被分离,可以将DNA插入表达载体中,所述表达载体接着被转染到不另外产生免疫球蛋白的宿主细胞如HEK 293细胞,CHO细胞,或骨髓瘤细胞中,从而在宿主细胞中获得重组单克隆抗体的合成。
提供下列实施例,序列表和附图来辅助理解本发明,其真实范围在后附的权利要求中提出。需要理解可以在不背离本发明实质的情况下对本发明进行改动。
附图说明
图1.AFP、AFU、HGF、GPC3和GGT2在四组受试者血清中含量统计图;
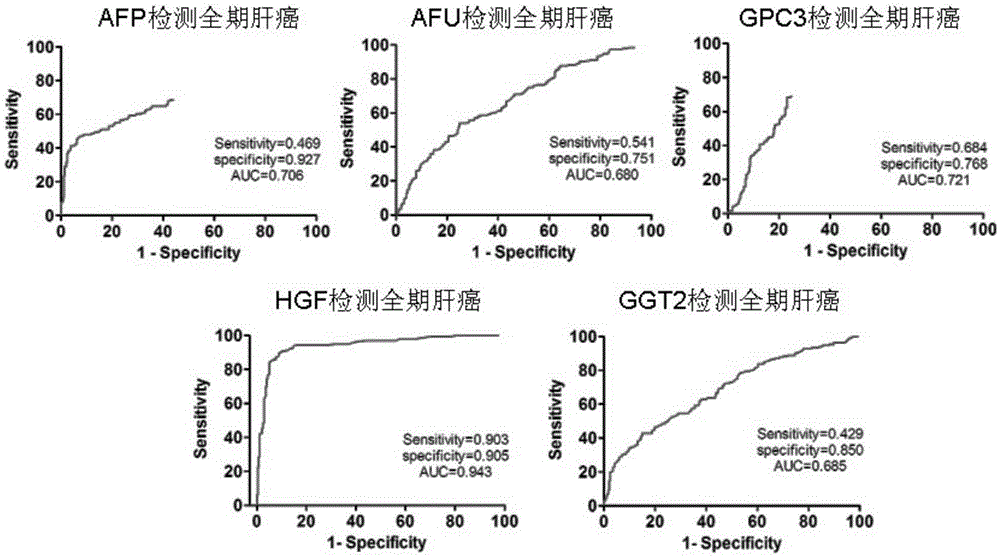
图2.在全人群筛查肝癌时AFP、AFU、HGF、GPC3和GGT2单独检测全期肝癌患者血清的ROC曲线图;
图3.在全人群筛查肝癌时HGF单指标纳入受试者年龄和性别检测全 期肝癌和早期肝癌患者血清的ROC曲线图;
图4.在全人群筛查肝癌时,双指标纳入受试者性别检测全期肝癌和早期肝癌患者血清的ROC曲线图;
图5.在全人群筛查肝癌时,双指标纳入受试者年龄检测全期肝癌和早期肝癌患者血清的ROC曲线图;
图6.在全人群筛查肝癌时,三指标检测全期肝癌和早期肝癌患者血清的ROC曲线图;
图7.在全人群筛查肝癌时,四指标检测全期肝癌和早期肝癌患者血清的ROC曲线图;
图8.在全人群筛查肝癌时,五指标联合检测全期及早期肝癌患者血清的ROC曲线图;
图9.在肝炎患者中筛查肝癌时,HGF单指标及HGF纳入受试者年龄性别检测全期肝癌和早期肝癌的ROC曲线图;
图10.在肝炎患者中筛查肝癌时,双指标纳入受试者性别检测全期肝癌和早期肝癌患者血清的ROC曲线图;
图11.在肝炎患者中筛查肝癌时,双指标纳入受试者年龄检测全期肝癌和早期肝癌患者血清的ROC曲线图;
图12.在肝炎患者中筛查肝癌时,三指标检测全期肝癌和早期肝癌患者血清的ROC曲线图;
图13.在肝炎患者中筛查肝癌时,四指标检测全期肝癌和早期肝癌患者血清的ROC曲线图;
图14.在肝炎患者中筛查肝癌时,五指标检测全期肝癌和早期肝癌患者血清的ROC曲线图;
图15.在肝硬化患者中筛查肝癌时,HGF单指标及HGF纳入受试者年龄性别检测全期肝癌和早期肝癌的ROC曲线图;
图16.在肝硬化患者中筛查肝癌时,双指标纳入受试者性别或年龄检测全期肝癌和早期肝癌患者血清的ROC曲线图;
图17.在肝硬化患者中筛查肝癌时,三指标检测全期肝癌和早期肝癌患者血清的ROC曲线图;
图18.在肝硬化患者中筛查肝癌时,四指标检测全期肝癌和早期肝癌 患者血清的ROC曲线图;
图19.在肝硬化患者中筛查肝癌时,五指标检测全期肝癌和早期肝癌患者血清的ROC曲线图;和
图20.AFP、AFU、HGF、GPC3和GGT2在肝癌病人血清,乙肝病人血清,肝硬化病人血清及正常人血清中检测值模型验证。
具体实施方式
下面通过实施例对本发明进行具体描述,它们只用于对本发明进行进一步的说明,不能理解为对本发明保护范围的限制,本领域的技术人员根据上述本发明的内容做出一些非本质的改进和调整,均属本发明保护范围。
实施例1:不同人群的血清收集及处理
在天津医科大学肿瘤医院,分别收集肝癌患者、乙肝患者及正常者外周血各60-300例。在实验中收集了肝癌患者血清288例,乙肝患者血清87例,肝硬化患者80例,正常者血清241例。
外周血收集1小时内,3000g离心5-10分钟,取血清移入新的离心管,-80℃冰箱保存。
实施例2:本发明标志物或其组合的诊断应用
使用商购的试剂盒(详细信息如下所示),按照制造商的使用说明,通过ELISA检测待测血清中AFP、AFU、GPC3、GGT2和HGF的浓度。
1)诊断试验评价指标及选择
采用灵敏度(真阳性率,Sensitivity)、特异度(真阴性率,Specificity)、阳性预测值(PPV)、阴性预测值(NPV)评价待测指标的诊断效果:
灵敏度=TP/(TP+FN)×100%
特异度=TN/(TN+FP)×100%
阳性预测值=TP/(TP+FP)×100%
阴性预测值=TN/(TN+FN)×100%
正确指数(Youden index)=(灵敏度+特异度)-100%
其中,TN(true negative)=真阴性;FP(false positive)=假阳性;TP(true positive)=真阳性;FN(false negative)=假阴性。
选用受试者工作曲线(receiver operating characteristic curve,ROC)对所有可能的切点作计算显示灵敏度和特异度之间相互关系。通过改变切点,获得多对真阳性率(即灵敏度)与假阳性率(1-特异度)值,以假阳性率为横坐标,以灵敏度为纵坐标,绘制ROC曲线,从而动态、客观地反映诊断系统的效能。ROC曲线下面积(AUC)表示诊断系统中阳性和 阴性诊断结果分布的重叠程度,反映诊断系统区分阳性和阴性诊断结果的能力大小,也就是诊断试验的价值大小。通过找到ROC曲线上正确指数最大点确定诊断指标临界值,并通过Bootstrap方法随机抽样1000次,确定临界值95%可信区间。
2)统计模型的构建
通过logistic回归模型实现单指标、多指标联合诊断试验HCC,并分别应用于健康正常人、HBV感染者、肝硬化患者,在三组和病人群中进行ROC分析。根据疾病状态建立logistic回归模型,通过形成的预测概率或联合预测因子为分析指标,并结合非参数模型和双正态模型建立ROC曲线。
Logistic回归模型:
且有
常数项β0表示暴露剂量为0时个体发病(HCC)与不发病(HBV感染者、肝硬化患者、健康人,或三者之和)概率之比的自然对数。回归系数β0,β1,…βn表示自变量xi改变一个单位时的改变量。对于研究变量(5个蛋白)在某个连续的截断点Pk有:βY≥g(Pk),Yik=1;βY|g(Pk),Yik=0。而同于多指标结合的诊断试验,其图形为一个平面从而获得灵敏度和特异度构建ROC曲线。
分析和统计结果参见附图。
结果和讨论:
早期肝癌检出率低的现状反映出目前肝癌的诊断方法还有很大局限性。当前肝癌的诊断主要依靠血清学检查和影像学诊断。血清学检查主要检测血清中的肿瘤标志物,目前主要是依靠AFP的检测,但AFP在小肝癌中的敏感度仅为40%左右。
利用特异性结合于人肝癌标志物的抗体或其单链抗体片段,在AFP、AFU、HGF、GPC3和GGT2五个标志物中,进行HGF单指标检测,以及HGF联合其它标志物进行双指标、三指标、四指标及五指标检测时,能够 与乙肝患者、肝硬化患者和健康者区别开来而检测肝癌。
在全部人群(肝癌、乙肝、肝硬化和正常人)中筛查肝癌,在乙肝患者中筛查肝癌,以及在肝硬化患者中筛查肝癌时,HGF单指标检测全期肝癌和早期肝癌均有很高的敏感度和特异性。通过利用特异性结合于HGF的抗体或其单链抗体片段,利用所述的肝癌血清学检测方法,使用HGF单指标在全部人群(肝癌、乙肝、肝硬化和正常人)中筛查肝癌,其检测全期肝癌的敏感度为90.3%,特异性为90.5%,在巴塞罗那分期的早期(A期)肝癌患者中,检测的敏感度为90.2%,特异性为84.1%,纳入受试者的年龄和性别后,HGF在全期肝癌中的敏感度为91.3%,特异性为90.9%,在早期肝癌中的敏感度为86.3%,特异性为90.5%;在乙肝患者中筛查肝癌,HGF单指标检测全期肝癌的敏感度为94.4%,特异性为91.8%,检测早期肝癌的敏感度为90.2%,特异性为91.9%,纳入受试者年龄性别后,检测全期肝癌的敏感度为90.8%,特异性为95.2%,检测早期肝癌的敏感度为92.2%,特异性为90.2%;在肝硬化患者中筛查肝癌,HGF单指标检测全期肝癌和早期肝癌的敏感度和特异性均可达72%和73%以上,显著优于临床常用的AFP,说明单独检测血清中HGF的含量,必要时并综合受试者年龄和性别可以满足临床肝癌诊断的需要。
检测两个指标在全部人群筛查肝癌,在乙肝患者中筛查肝癌,以及在肝硬化患者中筛查肝癌时,HGF与AFP、AFU、GPC3、GGT2四个标志物之一分别联用,检测全期肝癌和早期肝癌均可达到很高的敏感度和特异性,对于原发性肝癌患者的诊断具有显著意义,特别是HGF与AFP的联合为肝癌患者血清学诊断及早期诊断的最佳组合。
特别地,检测两个指标在全部人群筛查肝癌时,只纳入受试者性别进行统计后,HGF与AFP联用检测全期肝癌的敏感度为90.8%,特异性为93.1%,HGF与AFU联用检测全期肝癌的敏感度为87.2%,特异性为94.6%,HGF与GPC3联用检测全期肝癌的敏感度为91.8%,特异性为90.6%,HGF与GGT2联用检测全期肝癌的敏感度为89.3%,特异性为93.1%;只纳入受试者年龄后,HGF与AFP联用检测全期肝癌的敏感度为92.3%,特异性为90.9%,HGF与AFU联用检测全期肝癌的敏感度为90.8%,特异性为91.6%,HGF与GPC3联用检测全期肝癌的敏感度为 90.3%,特异性为90.9%,HGF与GGT2联用检测全期肝癌的敏感度为89.3%,特异性为92.3%。在检测早期肝癌时,将HGF与AFP,HGF与AFU,HGF与GPC3,HGF与GGT2分别联用,纳入年龄或性别之一后,均可达到86%以上的敏感度和和84%以上的特异性。
而在乙肝患者中筛查肝癌时,只纳入受试者性别进行统计后,HGF与AFP联用检测全期肝癌敏感度为92.9%,特异性为95.2%,HGF与AFU联用检测全期肝癌敏感度为93.4%,特异性为93.5%,HGF与GPC3联用检测全期肝癌敏感度为93.4%,特异性为93.5%,HGF与GGT2联用检测全期肝癌敏感度为92.3%,特异性为93.5%。;只纳入受试者年龄进行统计后,HGF与AFP联用检测全期肝癌敏感度为92.3%,特异性为93.5%,HGF与AFU联用检测全期肝癌敏感度为93.9%,特异性为93.4%,HGF与GPC3联用检测全期肝癌敏感度为93.9%,特异性为93.4%,HGF与GGT2联用检测全期肝癌敏感度为93.4%,特异性为95.1%。在检测早期肝癌时,将HGF与AFP,HGF与AFU,HGF与GPC3,HGF与GGT2分别联用,纳入年龄或性别之一后,均可达到86.3%以上的敏感度和和83.9%以上的特异性。在肝硬化患者中筛查肝癌时,纳入年龄或性别之一后,HGF与其他四个标志物分别联用,检测全期肝癌和早期肝癌均可达到较高的敏感度和特异性。说明HGF与其他四个指标单独联合检测,并综合受试者年龄或性别后,对于原发性肝癌患者的诊断具有显著意义,特别是HGF与AFP的联合为肝癌患者血清学诊断及早期诊断的最佳组合。
检测三个指标在全部人群中筛查肝癌,检测全期肝癌时,HGF+AFP+AFU联用,HGF+AFP+GPC3联用,HGF+AFP+GGT2联用,HGF+AFU+GPC3联用时,均可达到91.8%以上的敏感度和90.2%以上的特异性,检测早期肝癌时,HGF+AFP+AFU联用,HGF+AFP+GPC3联用,以及HGF+AFP+GGT2联用时,均可达86.3%以上的敏感度和85.5%以上的特异性,在乙肝患者中筛查肝癌时,HGF+AFP+AFU,HGF+AFP+GPC3,HGF+AFP+GGT2,HGF+AFU+GPC3以及HGF+GPC3+GGT2联合应用,检测全期肝癌的敏感度均可达92.3%以上,特异性可达93.5%以上,检测早期肝癌也有较好效果,特别是HGF+AFP+AFU的组合,敏感度达90.2%,特异性达98.4%;在肝硬化患者中筛查肝癌时,HGF与另两种标志物联用, 也可达到较满意的效果,说明HGF与另外两种标志物联合检测,可以满足临床肝癌血清学诊断及早期诊断的需求。
检测四个指标筛查肝癌时,敏感度和特异性均有提高,在全部人群中筛查肝癌时,HGF、AFP、GPC3和GGT2的组合检测全期肝癌的敏感度为91.3%,特异性为92.0%,检测早期肝癌的敏感度为86.3%,特异性为90.5%,在乙患者中筛查肝癌时,HGF、AFP、AFU和GGT2的组合检测全期肝癌的敏感度为91.8%,特异性为98.4%,检测早期肝癌的敏感度为92.2%,特异性为98.4%,在肝硬化患者中筛查肝癌时,HGF与另外三种指标联用时,均可达到较高的敏感度和特异性。
五种标志物联合应用,敏感度和特异性进一步提高,在全人群中筛查肝癌时,其检测全期肝癌的敏感度可达91.2%,特异性可达93%,检测早期肝癌的敏感度为84.3%,特异性可达87.2%,在乙肝患者中筛查肝癌时,检测全期肝癌的敏感度为91.8%,特异性为98.4%,检测早期肝癌的敏感度为92.2%,特异性为98.4%,在肝硬化患者中筛查肝癌时,检测全期肝癌的敏感度为91.3%,特异性为76.2%,检测早期肝癌的敏感度为92.2%,特异性为66.7%。显著优于目前临床肝癌检测的金标准AFP。
为了验证检测结果的准确性,本发明将五种标志物在肝癌病人血清,正常人血清和乙肝病人血清中的检测值建立了模型,将全部研究对象的危险系数(RS)从小到大排列,分割为高危组(RS≥0.5)和低危组(RS<0.5),大部分肝癌患者被正确分到高危组,散点图趋势明显,说明模型结果符合事实情况。该模型可以用于分析AFP、AFU、HGF、GPC3、GGT2五种标志物检测值与肝癌的相关性。
本发明通过大量样本验证和统计学分析,通过利用单克隆抗体或其单链抗体片段,证明HGF可以作为肝癌标志物单独用于肝癌的筛查和早期诊断,其检测灵敏度和特异性均大幅优于临床的金标准AFP,HGF与其它一个或多个指标的联合使用,可作为HGF检测的补充,进一步提高肝癌血清学诊断的灵敏度和特异性。
虽然为了清楚的理解,已经借助于附图和实施例在一些细节上描述了上述发明,但是说明书和实施例不应当被视为限制本发明的范围。本文中引用的所有专利和科学文献的公开内容通过引用完整地清楚并入。
- 还没有人留言评论。精彩留言会获得点赞!