谷物中赤拟谷盗虫卵的快速检测方法与流程
本发明涉及虫卵快速检测的方法,具体地说,涉及谷物,特别是大米或面粉中赤拟谷盗虫卵的快速检测方法。
背景技术:
赤拟谷盗害虫是主要的储粮害虫之一。在面粉加工厂和大米加工厂,该害虫均能造成很大的粮食污染。赤拟谷盗是次级储粮害虫,会取食加工过程中的残留面粉以及米糠粉,以及隐蔽性害虫(像玉米象,米蛾)在蛀蚀粮粒时产生的粮食粉末,并将虫卵产于粉末中。
现今的主要研究和应用方向在于如何有效地在谷物中诱捕成虫,如何使用有效的杀虫剂杀死成虫以及抑制虫卵和幼虫的孵化。在实际操作应用中,诱捕成虫对于控制储粮生虫的作用并不明显,杀虫剂的熏蒸处理相对比较直接,但是杀虫剂的使用涉及食品安全的问题,实际应用中因化学物质对仓库的腐蚀,化学物质在米库的渗透性等问题,操作起来并不容易。现今的粮食研究领域,主要研究方向在于找寻天然的杀虫剂来高效地驱赶或者杀灭储粮害虫及其虫卵,但是天然杀虫剂的复杂性以及成本导致在现有的工业水平中无法完全被接受。
技术实现要素:
本发明提供了一种可用于赤拟谷盗虫卵检测的抗体。
本发明提供的抗体能与gi|91092654特异性结合。
在本发明的一个具体实施方案中,所述抗体为gi|91092654的抗体。
在本发明的一个具体实施方案中,所述抗体以gi|91092654为抗原制备。
在本发明的一个具体实施方案中,所述抗体为单克隆抗体或多克隆抗体。
本发明还提供了一种试纸条。
本发明提供的试纸条包含能与gi|91092654特异性结合的抗体。
在本发明的一个具体实施方案中,所述抗体为gi|91092654的抗体。
在本发明的一个具体实施方案中,所述抗体以gi|91092654为抗原制备。
在本发明的一个具体实施方案中,所述抗体为单克隆抗体或多克隆抗体。
在本发明的一个具体实施方案中,所述试纸条为胶体金试纸条。
本发明还提供了一种试剂盒。
本发明提供的试剂盒包含能与gi|91092654特异性结合的抗体。
在本发明的一个具体实施方案中,所述抗体为gi|91092654的抗体。
在本发明的一个具体实施方案中,所述抗体以gi|91092654为抗原制备。
在本发明的一个具体实施方案中,所述抗体为单克隆抗体或多克隆抗体。
本发明还提供了一种检测赤拟谷盗虫卵的方法。
本发明提供的方法采用前述的抗体对谷物进行检测。
在本发明的一个具体实施方案中,所述抗体为gi|91092654的抗体。
在本发明的一个具体实施方案中,所述抗体以gi|91092654为抗原制备。
在本发明的一个具体实施方案中,所述抗体为单克隆抗体或多克隆抗体。
在本发明的一个具体实施方案中,所述检测为检测所述谷物的研磨上清液。
在本发明的一个具体实施方案中,将所述谷物进行研磨,然后将沉淀与溶液分离,以获得研磨上清。在本发明的一个具体实施方案中,通过静置、离心将沉淀与溶液分离。
在本发明的一个具体实施方案中,所述谷物包括但不限于大米,面粉,小麦,高粱,荞麦,燕麦,黑麦,大麦等粮食谷物。
本发明还提供了赤拟谷盗虫卵卵黄蛋白或赤拟谷盗虫卵卵黄蛋白抗体用于检测赤拟谷盗或赤拟谷盗虫卵的用途。
在本发明的一个具体实施方案中,将赤拟谷盗虫卵卵黄蛋白作为抗原制备与赤拟谷盗虫卵卵黄蛋白特异性结合的抗体。
在本发明的一个具体实施方案中,包括筛选或制备与赤拟谷盗虫卵卵黄蛋白特异性结合的化合物的步骤。
在本发明的一个具体实施方案中,使用与赤拟谷盗虫卵卵黄蛋白特异性结合的抗体或与赤拟谷盗虫卵卵黄蛋白特异性结合的化合物检测赤拟谷盗或赤拟谷盗虫卵。
在本发明的一个具体实施方案中,包括将与赤拟谷盗虫卵卵黄蛋白特异性结合的抗体或与赤拟谷盗虫卵卵黄蛋白特异性结合的化合物与待检测产品或待检测产品溶液或待检测产品的研磨液或待检测产品的研磨液上清接触的步骤。
本发明还提供了赤拟谷盗虫卵卵黄蛋白或赤拟谷盗虫卵卵黄蛋白抗体用于制备检测赤拟谷盗或赤拟谷盗虫卵的产品的用途。
本发明还提供了赤拟谷盗虫卵卵黄蛋白或赤拟谷盗虫卵卵黄蛋白抗体用于制备免疫定位赤拟谷盗或赤拟谷盗虫卵的杀虫产品的用途。
在本发明的一个具体实施方案中,所述杀虫产品可以是人工酶或合成药物。
在本发明的一个具体实施方案中,所述产品为试剂盒或试纸条。在本发明的一个具体实施方案中,所述产品为胶体金试纸条。
在本发明的一个具体实施方案中,包括筛选或制备与赤拟谷盗虫卵卵黄蛋白特异性结合的化合物,和使用与赤拟谷盗虫卵卵黄蛋白特异性结合的化合物制备检测产品。
本发明还提供了一种预警虫害爆发的方法。
本发明的方法包括:使用虫卵的蛋白的抗体对目标产品进行检测,根据检测结果确定是否存在虫害爆发的威胁,从而预警虫害爆发。
在本发明的一个具体实施方案中,目标产品为粮食,优选为谷物,更优选为大米,面粉,小麦,高粱,荞麦,燕麦,黑麦,大麦。
在本发明的一个具体实施方案中,针对不同批次的粮食取样后,使用虫卵的蛋白的抗体或包含虫卵的蛋白的抗体的检测产品(包括但不限于试纸条和试剂盒)对样品进行检测,从而对样品中的虫卵含量进行评估,并针对该含量,预计后期虫害爆发的可能性和/或爆发前的安全期。进一步的,还可以基于检测结果,对不同批次的粮食进行相应的处理,具体处理方法可以采用本领域的常规处理方法,例如,包括但不限于对不会爆发虫害的粮食按正常运作,对即将爆发虫害的粮食做合适的杀虫处理,从而降低或消除虫害爆发。
在本发明的一个具体实施方案中,所述虫卵的蛋白为卵黄蛋白。
在本发明的一个具体实施方式中,所述虫害为赤拟谷盗虫害,所述虫卵的蛋白为赤拟谷盗虫卵卵黄蛋白。
本发明具有以下优点:
采用本发明的方案可以实现快速和初步定量性的谷物虫卵检测。在工厂生产线,采购验收等环节可以落地使用。
采用本发明的方案可以实现快速简易的操作。
本发明的方案具有高特异性和/或高敏感性。
附图说明
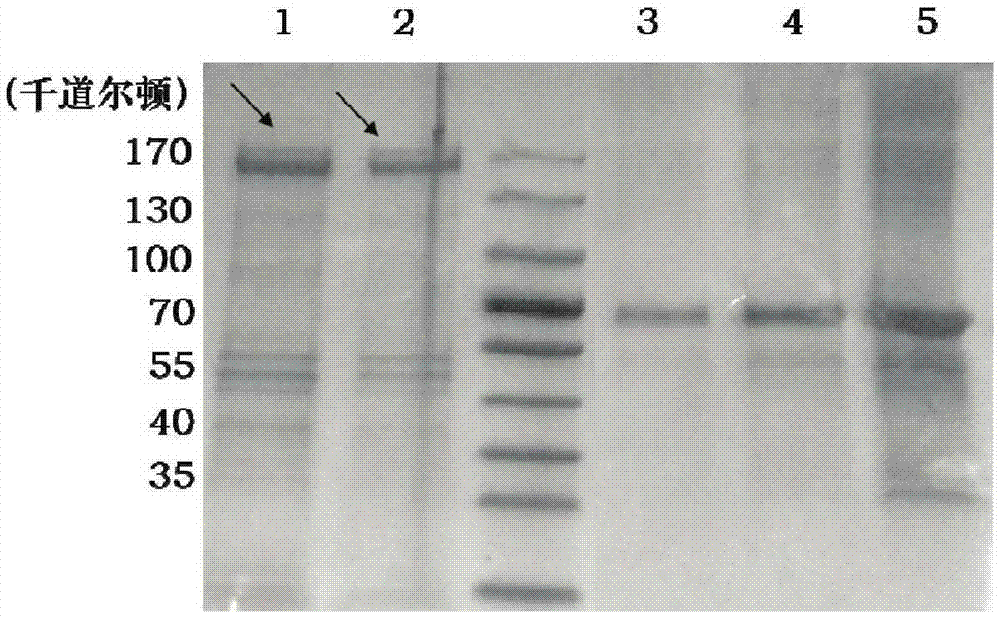
图1是赤拟谷盗虫卵蛋白质电泳检测结果,其中,泳道1和2分别显示了4颗和2颗 赤拟谷盗虫卵裂解后的蛋白质图谱,泳道3、4、5分别显示了牛血清白蛋白(BSA)稀释至0.1、0.25、0.75g/L,上样20L后的蛋白质图谱,箭头所指即为赤拟谷盗虫卵的卵黄蛋白。
图2是赤拟谷盗虫卵蛋白质分离纯化图,其中,检测器采用UV280nm进行对蛋白质含量进行监测,采用UV254nm进行对照监测。
图3是赤拟谷盗虫卵蛋白质分离纯化目标蛋白峰浓缩液的电泳检测结果,其中,泳道1显示了浓缩纯化后的赤拟谷盗卵黄蛋白的图谱,泳道2显示了未浓缩但已纯化后的赤拟谷盗卵黄蛋白的图谱,泳道3显示了面粉粒混合赤拟谷盗虫卵裂解后提取的高浓度蛋白上清的电泳蛋白图谱。
图4是不同大米样品检测结果,其中,1号试纸条代表了无虫卵大米的试纸条检测结果,2号试纸条代表了含有1颗虫卵的大米的试纸条检测结果,3号试纸条代表了含有5颗虫卵的大米的试纸条检测结果。
图5是玉米象虫卵离心上清和带卵小虾离心上清检测结果,其中,泳道1、2分别代表了Tris-Cl缓冲液(pH 7.7),磷酸缓冲液(pH 7.3)直接滴加至加样孔的对照检测实验结果,泳道3显示了玉米象虫卵离心上清的检测结果,泳道4显示了带卵小虾离心上清的检测结果。
图6是米厂采样的米糠粉检测结果,其中,每个试纸条对应的编号代表检测样品的取样地点编号,该编号和表1中的取样地点编号一致。
具体实施方式
以下结合具体实施例,对本发明作进一步说明。应理解,以下实施例仅用于说明本发明而非用于限定本发明的范围。
在本发明中,所述“抗体”指的是能与目标蛋白特异性结合的化合物,包括但不限于采用常规的单克隆抗体制备技术或多克隆抗体制备技术,使用目标蛋白制备的单克隆抗体或多克隆抗体;也可以是通过筛选技术,例如高通量筛选技术获得的能与目标蛋白特异性结合的化合物。
对本发明的测定方法而言,可以使用多克隆抗体。对本发明的测定方法而言,可以使用单克隆抗体本身,也可使用它们的显示出相应的免疫学性质的片段(Fc片段)。因而,“单克隆抗体”这一术语,也可理解为这些片段。不仅完整的抗体,而且它们的片段也可用固定化的形式。
抗体片段是抗体的部分,诸如F(ab')2、Fab'、Fab、Fv、sFv等等。无论结构如何,抗体片段结合全长抗体识别的相同抗原。术语“抗体片段”还包括由抗体的可变区组成的分离片段,诸如由重链和轻链可变区组成的“Fv”片段和轻链与重链可变区通过肽连接子连接的重组单链多肽分子(“scFv蛋白”)。抗体片段的另一种形式是单结构域抗体(纳米抗体)。裸抗体是未与治疗剂或诊断剂缀合的抗体或其片段。裸抗体包括多克隆抗体和单克隆抗体二者,以及融合蛋白和某些重组抗体。
本发明提供了一种可用于赤拟谷盗虫卵检测的抗体。
本发明提供的抗体能与赤拟谷盗虫卵卵黄蛋白特异性结合。
在本发明的一个具体实施方案中,所述赤拟谷盗虫卵卵黄蛋白序列如gi|91092654所示。
在本发明的一个具体实施方案中,所述赤拟谷盗虫卵卵黄蛋白序列与gi|91092654具有70%,优选75%,更优选80%,更优选85%,更优选90%,更优选95%,更优选96%,更优选97%,更优选98%,更优选99%以上的同源性。
在本发明的一个具体实施方案中,所述抗体为gi|91092654的抗体。
在本发明的一个具体实施方案中,所述抗体以gi|91092654为抗原制备。
在本发明的一个具体实施方案中,所述抗体为单克隆抗体或多克隆抗体。
本发明还提供了一种试纸条。
本发明提供的试纸条包含能与赤拟谷盗虫卵卵黄蛋白特异性结合的抗体。
在本发明的一个具体实施方案中,所述赤拟谷盗虫卵卵黄蛋白序列如gi|91092654所示。
在本发明的一个具体实施方案中,所述赤拟谷盗虫卵卵黄蛋白序列与gi|91092654具有70%,优选75%,更优选80%,更优选85%,更优选90%,更优选95%,更优选96%,更优选97%,更优选98%,更优选99%以上的同源性。
在本发明的一个具体实施方案中,所述抗体为gi|91092654的抗体。
在本发明的一个具体实施方案中,所述抗体以gi|91092654为抗原制备。
在本发明的一个具体实施方案中,所述抗体通过高通量筛选获得。
在本发明的一个具体实施方案中,所述抗体为单克隆抗体或多克隆抗体。
在本发明的一个具体实施方案中,所述试纸条为胶体金试纸条。
本发明还提供了一种试剂盒。
在本发明的一个具体实施方案中,所述试剂盒包括能与赤拟谷盗虫卵卵黄蛋白特异性结合的抗体。
在本发明的一个具体实施方案中,所述赤拟谷盗虫卵卵黄蛋白序列如gi|91092654所示。
在本发明的一个具体实施方案中,所述赤拟谷盗虫卵卵黄蛋白序列与gi|91092654具有70%,优选75%,更优选80%,更优选85%,更优选90%,更优选95%,更优选96%,更优选97%,更优选98%,更优选99%以上的同源性。
在本发明的一个具体实施方案中,所述抗体为gi|91092654的抗体。
在本发明的一个具体实施方案中,所述抗体以gi|91092654为抗原制备。
在本发明的一个具体实施方案中,所述抗体为单克隆抗体或多克隆抗体。
在本发明的一个具体实施方案中,所述抗体通过高通量筛选获得。
在本发明的一个具体实施方案中,所述试剂盒为胶体金试纸条检测试剂盒,ELISA试剂盒,普通显色试剂盒。
本发明还提供了一种检测赤拟谷盗虫卵的方法。
本发明提供的方法采用前述的抗体对谷物进行检测。
在本发明的一个具体实施方案中,所述赤拟谷盗虫卵卵黄蛋白序列与gi|91092654具有70%,优选75%,更优选80%,更优选85%,更优选90%,更优选95%,更优选96%,更优选97%,更优选98%,更优选99%以上的同源性。
在本发明的一个具体实施方案中,所述赤拟谷盗虫卵卵黄蛋白序列如gi|91092654所示。
在本发明的一个具体实施方案中,所述抗体为gi|91092654的抗体。
在本发明的一个具体实施方案中,所述抗体以gi|91092654为抗原制备。
在本发明的一个具体实施方案中,所述抗体为单克隆抗体或多克隆抗体。
在本发明的一个具体实施方案中,所述抗体通过高通量筛选获得。
在本发明的一个具体实施方案中,所述检测为检测所述谷物的研磨上清液。
在本发明的一个具体实施方案中,将所述谷物进行研磨,然后将沉淀与溶液分离,以获得研磨上清。在本发明的一个具体实施方案中,通过静置、离心将沉淀与溶液分离。
在本发明的一个具体实施方案中,所述谷物包括但不限于大米,面粉,小麦,高粱,荞麦,燕麦,黑麦,大麦等粮食谷物。
本发明还提供了赤拟谷盗虫卵卵黄蛋白或赤拟谷盗虫卵卵黄蛋白抗体用于检测赤拟谷盗或赤拟谷盗虫卵的用途。
在本发明的一个具体实施方案中,将赤拟谷盗虫卵卵黄蛋白作为抗原制备与赤拟谷盗虫卵卵黄蛋白特异性结合的抗体。
在本发明的一个具体实施方案中,包括筛选或制备与赤拟谷盗虫卵卵黄蛋白特异性结合的化合物的步骤。
在本发明的一个具体实施方案中,使用与赤拟谷盗虫卵卵黄蛋白特异性结合的抗体或与赤拟谷盗虫卵卵黄蛋白特异性结合的化合物检测赤拟谷盗或赤拟谷盗虫卵。
在本发明的一个具体实施方案中,包括将与赤拟谷盗虫卵卵黄蛋白特异性结合的抗体或与赤拟谷盗虫卵卵黄蛋白特异性结合的化合物与待检测产品或待检测产品溶液或待检测产品的研磨液或待检测产品的研磨液上清接触的步骤。
本发明还提供了赤拟谷盗虫卵卵黄蛋白或赤拟谷盗虫卵卵黄蛋白抗体用于制备检测赤拟谷盗或赤拟谷盗虫卵的产品的用途。
本发明还提供了赤拟谷盗虫卵卵黄蛋白或赤拟谷盗虫卵卵黄蛋白抗体用于制备免疫定位赤拟谷盗或赤拟谷盗虫卵的杀虫产品的用途。
由于赤拟谷盗虫卵卵黄蛋白抗体可以很好的定位至赤拟谷盗和赤拟谷盗虫卵,因此,技术人员可利用赤拟谷盗虫卵卵黄蛋白抗体携带可杀灭赤拟谷盗或赤拟谷盗虫卵的化合物(包括但不限于人工酶或合成药物),从而将该化合物定位至赤拟谷盗或赤拟谷盗虫卵,进而可以以较低的剂量即可很好的灭杀赤拟谷盗或赤拟谷盗虫卵。用于杀灭赤拟谷盗或赤拟谷盗虫卵的化合物通常可以使用本领域中常规使用的化合物,例如,包括但不限于:噻虫嗪、噻嗪酮、吡蚜酮、烯啶虫胺、有机硫化合物、氯虫酰胺、甲氧虫酰肼、吡唑杀菌剂、苯甲酰脲类化合物、菊酯类化合物。
在本发明的一个具体实施方案中,所述产品为试剂盒或试纸条。在本发明的一个具体实施方案中,所述产品为胶体金试纸条。
在本发明的一个具体实施方案中,包括筛选或制备与赤拟谷盗虫卵卵黄蛋白特异性结合的化合物,和使用与赤拟谷盗虫卵卵黄蛋白特异性结合的化合物制备检测产品。
本发明还提供一种预警虫害爆发的方法。
本发明的方法包括:使用虫卵的蛋白的抗体对目标产品进行检测,根据检测结果确定是否存在虫害爆发的威胁,从而预警虫害爆发。本领域的技术人员,还可根据检测结果,对存在虫害爆发威胁的目标产品进行处理,从而还可预防虫害的爆发,基于此,还提供了一种预防虫害爆发的方法。
在本发明的一个具体实施方案中,目标产品为粮食,优选为谷物,更优选为大米,面粉,小麦,高粱,荞麦,燕麦,黑麦,大麦。
在本发明的一个具体实施方案中,针对不同批次的粮食均匀取样后,使用虫卵的蛋白的抗体或包含虫卵的蛋白的抗体的检测产品(包括但不限于试纸条和试剂盒)对样品进行检测,从而对样品中的虫卵含量进行评估。在本发明的一个具体实施方案中,还可进一步针对该含量,预计后期虫害爆发的可能性和/或爆发前的安全期。本领域的技术人员,还可以进一步基于检测结果,对不同批次的粮食进行相应的处理,例如,包括但不限于对不会爆发虫害的粮食按正常运作,对即将爆发虫害的粮食做合适的杀虫处理,从而降低或消除虫害爆发。
在本发明的一个具体实施方案中,所述虫卵的蛋白为卵黄蛋白。
在本发明的一个具体实施方式中,所述虫害为赤拟谷盗虫害,所述虫卵的蛋白为赤拟谷盗虫卵卵黄蛋白。
在本发明的一个具体实施方式中,所述虫害为玉米象虫害,所述虫卵的蛋白为玉米象虫卵卵黄蛋白。
在本发明的一个具体实施方式中,所述虫害为印度谷螟虫害,所述虫卵的蛋白为印度谷螟虫卵卵黄蛋白。
在本发明的一个具体实施方式中,所述虫害为谷蠹虫害,所述虫卵的蛋白为谷蠹虫卵卵黄蛋白。
在本发明的一个具体实施方式中,所述虫害为麦蛾虫害,所述虫卵的蛋白为麦蛾虫卵卵黄蛋白。
在本发明的一个具体实施方式中,所述虫害为锯谷盗虫害,所述虫卵的蛋白为锯谷盗虫卵卵黄蛋白。
在本发明的一个具体实施方式中,所述虫害为杂拟谷盗虫害,所述虫卵的蛋白为杂拟谷盗虫卵卵黄蛋白。
本发明具有以下优点:
采用本发明的方案可以实现快速和初步定量性的谷物虫卵检测。在工厂生产线,采购验收等环节可以落地使用。
采用本发明的方案可以实现快速简易的操作。
本发明的方案具有高特异性和/或高敏感性。
下文将以具体实施例的方式阐述本发明。应理解,这些实施例仅仅是阐述性的,并不限制本发明的保护范围。实施例中所用的方法、原料和试剂,除非另有说明,否则均是本领域常规的方法、原料和试剂。
实施例1、赤拟谷盗虫卵蛋白质初步分析
分别取赤拟谷盗虫卵2颗和4颗,加入裂解液(250mM Tris-HCl(pH 6.8),10%(W/V)SDS,0.5%(W/V)溴酚蓝,50%(V/V)甘油,5%(W/V)β-巯基乙醇)中进行裂解,然后进行SDS-PAGE电泳,将牛血清白蛋白(BSA)分别稀释至0.1、0.25、0.75g/L,作为对照,结果如图1所示。
根据图1结果,选取约170KD处蛋白作为目标蛋白。经检测,所述目标蛋白序列与NCBI的gi|91092654相同,为赤拟谷盗虫卵卵黄蛋白。
实施例2、蛋白纯化
取275mg赤拟谷盗虫卵投入1.5mL试管,加入1mL磷酸盐缓冲溶液(10mM),研磨至无明显的完整虫卵粒。
将研磨液在4℃,8000rpm中进行离心,取离心后的上清液体,用磷酸盐缓冲溶液(10mM)稀释到2.5mL。
使用生物纯化仪(GE AKTA explore 100),对分子筛纯化柱(GE Hiload 16/600 Superdex200)进行预平衡(使用磷酸盐缓冲溶液(10mM)作为预平衡溶液)后,将虫卵裂解的上清液进样,使用磷酸盐缓冲溶液(10mM)作为洗脱流动相进行洗脱。采用UV280nm进行对蛋白质含量进行监测,采用UV230nm进行对照监测,结果如图2所示。纯化图谱显示约31-42分钟会出现280nm的强吸收峰,收集该处洗脱流分,进行SDS-PAGE的分析,结果显示,其主要为目标蛋白,将洗脱液通过MilliporeUltra-0.5(10kD)超滤管,在4℃,12000rpm中进行离心超滤,将洗脱液浓缩至800L,取5L进行SDS-PAGE 的鉴定,并使用纯化前蛋白液和浓缩前洗脱液作为对照,结果如图3所示。结果显示纯化效果并不能完全纯化出170kD的大分子蛋白,由于裂解虫卵的裂解液中不含有任何蛋白变性成份,所以可能会一定程度还保留目标蛋白的二级及三级结构,所以当浓缩后样品在SDS-PAGE蛋白电泳分析后,在40-55kD分子量区域也有明显条带,这一图谱与直接裂解虫卵的PAGE图谱相似。
将得到的800微升的蛋白浓缩液进行冷冻干燥,获得蛋白粉末4mg,经测序,结果显示所述蛋白为目的蛋白(赤拟谷盗虫卵卵黄蛋白)。
实施例3、抗体制备
将实施例2中获得的蛋白粉末作为抗原蛋白,委托北京勤邦生物技术公司进行单克隆抗体的制备。
在免疫细胞株筛选阶段,使用上述抗原蛋白进行了效价的检测以及配对筛选。结果显示,免疫反应良好,得到阳性细胞株10株,可以配对的细胞株33对。
实施例4、胶体金试纸条制备及检测
4.1、试纸条制备
从实施例3中的阳性细胞株中进行了包被抗体后各配对组合的效价检测,试纸条的实际显色效果检测,挑选了最佳的1对配对的细胞株,委托北京勤邦生物技术公司培养,并使用从发酵液中纯化获得的单克隆抗体制备胶体金试纸条,命名为赤拟谷盗虫卵胶体金试纸条,其包括“S”样品孔,控制线“C”线,检测线“T”线。使用时,将待检测液体滴加至赤拟谷盗虫卵胶体金试纸条下方的“S”样品孔中,待溶液渗透5分钟后,进行观察:“C”线如显色代表此次检测结果有效,如不显色,此次结果无效;如果“C”线显色,且“T”线也显色(阳性结果),证明已检测到虫卵含量超过试纸条的检测限,如果“T”线不显色(阴性结果),则证明样品中的虫卵含量没有超过试纸条的检测限。
4.2试纸条检测
取市售大米,经温度28℃,湿度60%的培养箱培养,目测筛查未发现幼虫、成虫,显示该大米样品中不包含赤拟谷盗虫卵。
取上述市售大米各20克(约1000粒),分别加入0颗、1颗和5颗赤拟谷盗虫卵。
将上述大米样品分别在研钵中浸泡于20mL的50mM磷酸盐缓冲溶液10分钟,研磨 大米样品至无明显颗粒,待研磨液沉降15分钟后,用吸管吸取上层较清的液体,滴加至赤拟谷盗虫卵胶体金试纸条下方的“S”样品孔中,待溶液渗透5分钟后,进行观察,结果如图4所示。
根据图4结果,该试纸条可以有效地检测出1000粒大米中含有1颗虫卵的情况,具有很好的灵敏度。
分别通过从大米中解剖出的玉米象虫卵、市场购买的带卵小虾,使用50mM磷酸盐缓冲溶液将其组织研磨粉碎,在4℃,12000rpm中进行离心,提取,获得玉米象虫卵离心上清和带卵小虾离心上清。将玉米象虫卵离心上清通过SDS-PAGE检测(图未示),结果显示其中含有分子量在170kD的虫卵特异性卵黄蛋白;带卵小虾离心上清使用红鳌虾卵黄蛋白试剂盒(Shanghai Lengton Bioscience公司,BPE90023型号)检测,结果显示其中含有卵黄蛋白。使用赤拟谷盗虫卵试纸条分别对玉米象虫卵的离心上清和带卵小虾离心上清进行检测,结果如图5所示。图5结果显示,玉米象虫卵黄蛋白以及市售河虾的卵黄蛋白都不具有阳性反应,根据图5结果,该赤拟谷盗虫卵黄蛋白抗体以及试纸条产品的免疫检测性具备很好的特异性。
实施例5、
在生产线的不同地点(如表1所示)进行采样(100克),分别均匀取20克去除石块和硬物的米糠粉,分别加入20mL 50mM的磷酸缓冲溶液(pH 7.3),研磨至无明显颗粒。待沉降15分钟后,吸取上层清液使用试纸条检测,同时,取剩下的80克样品在模拟工厂库房的环境下进行培养和检测,观察时间设计为7天,15天,30天进行幼虫和成虫的计数,以作为验证试纸条结果的对照,结果如表1和图6所示。
表1
注:“-”未检测到信号;“+”检测到疑似信号(指现场肉眼观察存在颜色反应,但不明显,并且拍照结果显示不出来);“++”检测到明显信号;“+++”检测到很强信号。
根据表1结果,采用赤拟谷盗虫卵检测试纸条对车间16个疑似虫害发生点进行取样检测的结果与工厂食品安全员对车间的常规虫害检查结果基本一致,但更为灵敏,例如,对成品米地脚米的检测结果为++,而培养实验需要在30天实验中才能检测到存在赤拟谷 盗幼虫。
- 还没有人留言评论。精彩留言会获得点赞!