使用色谱分离富集来检测微生物的方法与流程
本专利申请要求2014年10月7日提交的美国临时专利申请号62/060,621的优先权,该专利申请的公开内容全文以引用方式并入本文。
背景技术:
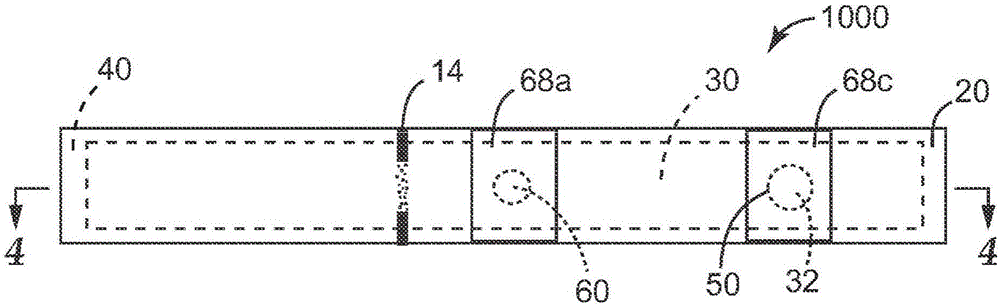
:在一些情况下,检测复杂基质(如,食物、创伤流出物、唾液、痰、粪便)中的特定细胞(如,微生物)可能较为困难,因为基质包含与检测系统的一种或多种组分干扰的物质(如,生物分子、酶、化学品、离子)。因此,操作人员通常使用各种方法来降低基质中所发现物质的抑制作用。一种降低基质效应的方法是稀释含基质的样本,以降低抑制物质的浓度。然而,此方法可限制测试的总体检测灵敏度。降低样本基质效应的另一种方法是使用免疫磁性分离(IMS)来隔离和/或净化所关注的细胞,如Chen等人在“AutomatedimmunomagneticseparationforthedetectionofEscherichiacoliO157:H7fromspinach”(用于检测菠菜中大肠杆菌O157:H7的自动免疫磁性分离,2014年,国际食品微生物学杂志,179:33-37)中对此有所描述。此方法已广为应用,因为采用自动化过程,消除了需要操作人员干预的步骤,以实现从基质物质中有用地分离出靶细胞。此外,使用IMS方法已得到改进的检测灵敏度。尽管在样本制备上有进步,但对于快速简单地制备用于检测靶细胞的样本的方法,仍然存在需求。技术实现要素:总体而言,本公开涉及检测靶细胞(如,微生物)的方法和装置。具体地讲,本公开涉及使用色谱分离装置在色谱分离装置内的预定位置富集靶细胞,并随后从装置释放预定位置和/或靶细胞。从装置释放预定位置和/或靶细胞之后,可使用本领域中已知的各种检测过程中的一种或多种来检测和任选地识别细胞。有利的是,本公开的方法和装置相对于非靶细胞和其它可能以其它方式干扰靶细胞检测的颗粒或分子来富集靶细胞。此外,通过此方法实现的富集提供增强的靶细胞检测灵敏度,在靶细胞以低浓度存在于样本中时尤其如此。在一个方面,本公开提供了检测靶微生物的第一方法。该方法可包括使液体样本接触样本制备装置的多孔载体,所述装置包括具有第一开口和第二开口的壳体以及多孔载体。多孔载体包括位于第一预定位置处的样本接收区和位于第二预定位置处的靶细胞结合区,多孔载体限定从样本接收区延伸穿过靶细胞结合区的第一流体通路。第二流体通路穿过壳体从第一开口延伸到第二开口,第二流体通路在靶细胞结合区与多孔载体相交。第一方法还可包括:使液体样本的至少一部分从样本接收区朝向靶细胞结合区纵向移动穿过多孔载体;在液体的至少一部分移动到靶细胞结合区之后,迫使脱离构件穿过第二流体通路从第一开口到达第二开口,并从而排出靶细胞结合区的一部分;以及处理靶细胞结合区的该部分或从其释放的细胞,以检测靶微生物的指示。在另一方面,本公开提供了检测靶微生物的第二方法。该方法可包括使液体样本接触样本制备装置的多孔载体,所述装置包括具有第一开口和第二开口的壳体,以及多孔载体。多孔载体包括位于第一预定位置处的样本接收区和位于第二预定位置处的靶细胞结合区,多孔载体限定从样本接收区延伸穿过靶细胞结合区的第一流体通路。第二流体通路穿过壳体从第一开口延伸到第二开口,第二流体通路在靶细胞结合区与多孔载体相交。第二方法还可包括:使液体样本的至少一部分从样本接收区朝向靶细胞结合区纵向移动穿过多孔载体;在液体的至少一部分移动到靶细胞结合区之后,如果存在于第二流体通路中,则迫使靶释放溶液穿过第二流体通路,并从而将包含靶微生物的靶释放溶液的一部分排出装置;以及处理释放溶液的部分以检测靶微生物的指示。在第一方法和第二方法的上述任意实施方案中,在液体的至少一部分移动到靶细胞结合区之后,该方法还包括使洗涤溶剂经由第二流体通路穿过多孔载体的步骤。在第一方法和第二方法的上述任意实施方案中,该方法还可包括邻近第二开口定位接收器,其中排出靶细胞结合区的一部分或排出释放溶液的一部分进一步包括将靶细胞结合区的该部分或释放溶液的该部分移动到接收器中。在又一方面,本公开提供了装置。该装置可包括:包括内部、第一开口和第二开口的壳体;以及包括样本接收区和靶细胞结合区的多孔载体。多孔载体限定从样本接收区延伸至靶细胞结合区的第一流体通路。多孔载体的至少一部分设置在壳体的内部。包括中心轴线的第二流体通路从第一开口和第二开口延伸穿过壳体,第二流体通路在靶细胞结合区与多孔载体相交。中心轴线可取向成与多孔载体正交。在上述任意实施方案中,壳体还可包括沿通路从样本端口延伸至壳体内部的第一导管。在上述任意实施方案中,壳体还可包括沿通路从第一开口延伸至壳体内部的第二导管。在上述任意实施方案中,装置还可包括邻近第二开口设置的吸收主体,其中吸收主体与多孔载体间隔开。在上述任意实施方案中,装置还可包括尺寸被设计为从第一开口到第二开口横贯第二流体通路的脱离构件,其中脱离构件的一部分以可滑动的方式接合第二流体通路。在上述任意实施方案中,脱离构件可包括切割结构。在上述任意实施方案中,脱离构件可被构造成用于迫使含水液体穿过第二导管。在又一方面,本公开提供了试剂盒。该试剂盒可包括上述任意实施方案的装置。在任意实施方案中,试剂盒还可包括洗涤液体。在任意实施方案中,试剂盒还可包括释放溶液。术语“包括”及其变型形式在说明书和权利要求中出现这些术语的地方不具有限制的含义。本文所用的“一种(个)”、“所述(该)”、“至少一种(个)”以及“一种(个)或多种(个)”可互换使用。因此,例如,结合配体可理解为“一个或多个”结合配体。术语“和/或”意指所列要素的一个或全部,或者所列要素的任何两个或更多个的组合。另外,在本文中,通过端点表述的数值范围包括该范围内包含的所有数值(例如,1至5包括1、1.5、2、2.75、3、3.80、4、5等)。本发明的上述
发明内容并非意图描述本发明的每一个公开的实施方案或本发明的每种实施方式。以下描述更具体地举例说明示例性实施方案。在本专利申请的全文的若干处,通过示例列表提供了指导,这些示例可以各种组合使用。在每种情况下,引用的列表都只用作代表性的组,而不应理解为排它性列表。这些及其它实施方案的附加细节在下文附图和描述中示出。通过具体实施方式、附图和权利要求书,其它特征、对象和优点将变得显而易见。附图说明图1是根据本公开的样本制备装置的一个实施方案的局部分解透视图。图2为图1的装置的平面图。图3为图1的装置的底视图。图4为图2的装置沿线4-4截取的横截面侧视图,图中移除了两个盖元件,以示出延伸穿过壳体的第二流体通路。图5为根据本公开的由基底支撑的多孔载体的一个实施方案的透视图。图6为图5的由基底支撑的多孔载体的底视图。图7为样本制备装置的一个实施方案的横截面侧视图,该样本制备装置包括邻近第二开口设置的吸收主体。图8为根据本公开的样本制备装置的一个实施方案的分解透视图,该样本制备装置包括用于加载样本的导管和沿第二流体通路延伸的导管。图9为图8的样本制备装置的平面图。图10为图9的装置沿线10-10截取的横截面侧视图。图11A为根据本公开包括脱离构件的样本制备装置的局部分解横截面侧视图。图11B为图11A的脱离构件的顶端的细部图。图12A为图10的样本制备装置的局部剖视侧视图,该装置包括设置在其中第一操作位置的脱离构件。图12B为图10的样本制备装置的局部剖视侧视图,该装置包括设置在其中第二操作位置的脱离构件。图12C为图10的样本制备装置的局部剖视侧视图,该装置包括设置在其中第三操作位置的脱离构件。图13为根据本公开的样本制备装置的局部分解透视图,该装置包括具有在壳体外部延伸的样本接收区的多孔载体。图14为图13的装置的平面图。图15为图14的装置沿线15-15截取的横截面侧视图。图16为图15的装置的侧视图。具体实施方式在详细解释本发明的任何实施方案之前,应当了解,本发明在其应用中不仅限于下文说明中所提及或下文附图中所示出的构造细节和部件布置方式。本发明能够具有其它实施方案,并且能够通过各种方式实践或进行。另外,应当理解,本文使用的措词和术语是用于说明目的而不应被视为限制性的。本文使用的“包括”、“包含”或“具有”及其变型形式意在涵盖其后列出的项目及其等同形式以及附加的项目。除非另外说明或限定,否则术语“连接”和“联接”及其变型形式均按广义使用,并且涵盖直接和间接这两方面的连接和联接。此外,“连接”和“联接”不限于物理或机械连接或联接。应当理解,在不脱离本公开范围的情况下,可采用其它实施方案并且可进行结构性或逻辑性变更。此外,术语例如“前面”“后面”“顶部”“底部”等仅用于描述与另一个元件相关的元件,但绝非意图说明装置的具体方位,表明或暗示装置必需或需要的方位,或指定在应用中如何使用、安装、展示或放置本文所述的发明。本公开整体涉及有利于检测靶细胞(如,靶微生物或微生物组)的方法和装置。如本文所用,“靶细胞”是指在样本中的存在(或不存在)情况待确定的特定细胞(如,普通细胞、癌细胞)。如本文所用,“靶微生物”是指在样本中的存在(或不存在)情况待确定的特定微生物。靶微生物可能是病原生物体,或也可能是存在情况与其它生物体(其中一些可能为病原性生物体)的存在情况相关联的非病原生物体。具体地讲,本公开涉及采用色谱分离装置的方法,其中色谱分离装置被构造成有利于去除在其中捕获的靶细胞,且不必拆卸或部分拆卸色谱分离装置。有利的是,本公开的方法和装置允许操作人员释放捕获细胞中的至少一个,以供进一步分析之用。甚至更有利的是,至少一个捕获的细胞可轻松直接地释放并进入接收器(如,反应管),且不会不当地将该部分暴露到可能的污染源。本公开的一个方面是,其可用于检测各种样本物质上存在的靶细胞的方法。本发明的装置和方法可用于希望检测样本物质(如,食物样本、土壤样本、水样本、临床样本)上存在的细胞(如,微生物)的多种应用。在任意实施方案中,样本物质可得自各种表面,包括但不限于食物表面(如,牛胴体、生产的外表面)、食物处理表面、水或水膜表面、患者表面、患者治疗表面、医院环境表面、临床环境表面和法医环境表面。这些样本可大致由单独的或成多种组合的固体、半固体、凝胶状或液态材料组成。在本公开方法的任意实施方案中,样本悬浮在能够移动(如,通过毛细作用力)穿过多孔载体的液体(如,含水液体)中。本公开的装置以及本发明的方法可用于定性或定量地测定来自初始样本的一种或多种所关注的细胞的存在。要在样本中检测的所关注的示例性细胞是金黄色葡萄球菌(“S.aureus”)。这是致使广谱感染的病原体,广谱感染包括:表面损伤,诸如小面积的皮肤脓肿和伤口感染;系统性病症和危及生命的病症,诸如心内膜炎、肺炎和败血病;以及中毒症,例如食物中毒和中毒性休克综合征。一些菌株(例如,耐甲氧西林金黄色葡萄球菌,也称MRSA)能够耐受除少数几种抗生素以外的几乎所有抗生素。要在食物加工区域和样本中检测的所关注的示例性分析物是李斯特菌属的成员。李斯特菌被分类为革兰氏阳性杆状细菌,并包括如下:单核细胞增多性李斯特菌(Listeriamonocytogenes)、无害李斯特菌(L.innocua)、威氏李斯特菌(L.welshimeri)、斯氏李斯特菌(L.seeligeri)、绵羊李斯特菌(L.ivanovii)和格雷氏李斯特菌(L.grayi)。其中,单核细胞增多性李斯特菌是造成大多数人李斯特菌病例的原因,并且免疫失能者、孕妇、老年人和新生儿具有增加的易受感染性。李斯特菌病的最普通症状是败血病、脑膜炎和流产。特别关注用于分析目的的其他微生物包括原核生物和真核生物,特别是革兰氏阳性细菌、革兰氏阴性细菌、真菌、支原体和酵母。具体地讲,相关的生物体包括以下科或属的成员:肠杆菌科、或微球菌科或葡萄球菌属、链球菌属、假单胞菌属、肠球菌属、沙门氏菌属、军团杆菌属、志贺菌属、耶尔森氏鼠疫杆菌属、肠杆菌属、大肠杆菌属、芽孢杆菌属、弧菌属、梭菌属、棒状杆菌属、曲霉菌属、镰刀菌属和念珠菌属。具体地讲,致命生物体包括:金黄色葡萄球菌(包括耐药菌株,诸如耐甲氧西林金黄色葡萄球菌(MRSA))、表皮葡萄球菌、肺炎链球菌、无乳链球菌、化脓性链球菌、粪肠球菌、耐万古霉素肠球菌(VRE)、耐万古霉素金黄色葡萄球菌(VRSA)、万古霉素中介耐药的金黄色葡萄球菌(VISA)、炭疽杆菌、绿脓杆菌、大肠杆菌、黑曲霉菌、烟曲霉菌、棒曲霉菌、腐皮镰刀菌、尖孢镰刀菌、厚孢镰刀菌、霍乱弧菌、副溶血性弧菌、猪霍乱沙门氏菌、伤寒沙门氏菌、鼠伤寒沙门氏菌、白色念珠菌、光滑念珠菌、克柔氏念珠菌、阪崎肠杆菌、大肠杆菌O157、含ESBL的微生物、以及多种耐药革兰氏阴性杆菌(MDR)。图1至图4示出根据本公开的样本制备装置1000的一个实施方案的各种视图。样本制备装置1000包括包围多孔载体30的至少一部分的壳体100。在任意实施方案中,壳体100可为中空的(即,可包括其中设置有多孔载体30的空隙空间)。如图1至图4的例示的实施方案所示,任选的隔件40侧面相接多孔载体30的至少一部分或围绕全部多孔载体。尽管在文本例示的实施方案中显示为一体部件,但设想隔件可包括可能或可能没有互连的多个部件(未示出)。隔件40的功能是将壳体100的部件间隔开,并从而形成其中设置有多孔载体30的空隙空间。多孔载体30包括样本接收区32和与样本接收区间隔开的靶细胞结合区34。因此,多孔载体30限定从样本接收区延伸至靶细胞结合区的第一流体通路70。这样,当液体样本(如,含水液体样本(未示出))接触多孔载体30(如,在样本接收区32处),样本中的至少一部分液体从样本接收区移动到靶细胞结合区34。在任意实施方案中,液体例如通过毛细管作用力、重力、离心力或前述力中任意两种或更多种的组合移动穿过多孔载体30。在任意实施方案中,多孔载体30可为大致平坦的(即,片状),并由此限定平面。在图1至图4的例示的实施方案中,壳体100包括两个单独形成的部件的组件,该部件包括限定壳体的第一侧的第一件10和限定与壳体的第一侧相对的第二侧的第二件20。第一件10包括面向外部的第一侧12和面向内部的第二侧14。第二侧14面向多孔载体30。第二件20包括面向外部的第四侧24和面向内部的第三侧22。第三侧22面向多孔载体30。例示的实施方案的壳体100还包括有助于包封多孔载体30的任选隔件40。在任意实施方案中,第一件10可包含使用本领域已知的工艺(如,挤出、模塑、浇注、压印)形成的金属、玻璃或聚合物材料(如,聚烯烃、聚酯、聚苯乙烯或它们的组合)。在任意实施方案中,第二件20可包含使用本领域已知的工艺(如,挤出、模塑、浇注、压印、3D打印)形成的金属、玻璃或聚合物材料(如,聚烯烃、聚酯、聚苯乙烯或它们的组合)。在任意实施方案中,第一件10可包含与第二件20相同的材料和/或与第二件20不同的材料。在任意实施方案中,壳体100的第一件10的一部分或全部以及第二件20的一部分或全部由光可透射的材料(如,聚合物材料)制成。因此,可通过观察光穿过壳体100,以光学方式(如,目视)检测设置在多孔载体30上和/或中的光学可检测型指示剂。优选地,第一件10和第二件20两者均包含防水材料,和/或还包含分别设置在第二侧14和第三侧22上的防水涂层(如,疏水性粘合剂涂层,未示出)。如果第二侧14上存在任选的疏水性粘合剂,则其可将第一件10联接到隔件40、多孔载体30和/或第二件20。类似地,如果第三侧22上存在任选的疏水性粘合剂(粘合剂层26),则其可将第二件20联接到隔件40、多孔载体30和/或第一件10。在任意实施方案中,隔件40在任一或全部两侧上涂覆任选的粘合剂层(未示出),以有利于将隔件40联接到第一件10和/或第二件20。设想在任意实施方案中,装置的壳体可为一体部件(未示出)。一体壳体可例如使用本领域熟知的工艺(如,注塑)通过模塑热塑性聚合物形成。一体壳体可包括开口(如,可密封的开口),多孔载体的一部分或全部可穿过该开口插入壳体中。返回附图,壳体100包括样本端口50、与样本端口间隔开的第一开口60和与第一开口相对的第二开口64。第一开口60和第二开口64优选地对准或部分对准,使得物体可沿穿过第一开口60和第二开口64两者的大致直线(未示出)传递。第一开口60与第二开口64的尺寸可以相同或不同。样本端口50邻近第一流体通路(本文所述的第一流体通路70)的起点设置,第一流体通路延伸穿过多孔载体30,从样本端口50到达并超出第一开口60。样本端口50和第一开口60任选地设置在同一侧,并且在壳体100的同一件上。样本端口50提供进入多孔载体的样本接收区32附近的多孔载体30的路径。因此,在图1至图4例示的实施方案中,样本接收区32设置在壳体100的内部。第一开口和第二开口(分别为第一开口60和第二开口64)限定延伸穿过壳体100的第二流体通路的终点。第二流体通路74(图4)包括中心轴线75并且在预定位置处(即,在本文所述的靶细胞结合区34处)与多孔载体30相交。在任意实施方案中,第二流体通路74的路径为大致直的。因此,第一开口60和第二开口64中的每一者提供经由第二流体通路74直接进入靶细胞结合区34附近的多孔载体30的路径。在根据本公开的装置的任意实施方案中,第二流体通路74的中心轴线75取向成与由多孔载体30限定的第一流体通路正交。第二流体通路74起到至少两种功能:i)提供流体通路,使液体(如,含水液体,诸如缓冲液)经过多孔载体的靶细胞结合区34;以及ii)提供入口(如,第一开口60),本文所述的脱离构件可通过该入口插入装置1000并被迫使穿过第二流体通路74,由此脱离多孔载体30的靶细胞结合区34的至少一部分或另选地全部,以及提供出口(如,第二开口64),靶细胞结合区的脱离部分可通过该出口排出装置。另选地,设想第二开口64可用作入口并且第一开口60可用作出口。在任意实施方案中,第一开口60和第二开口64中的任一者或两者的形状和尺寸可被设计为接收液体分配器械(如,注射器)。一个或多个开口的尺寸还可被设计为与液体分配器械联接(例如,通过摩擦配合),使得联接大致密封,以免出现液体泄漏。有利的是,具有此构造的装置有利于使用正压、负压或它们的组合使液体(例如,缓冲溶液)经过多孔载体30的靶细胞结合区34。在任意实施方案中,样本制备装置1000任选地还可包括一个或多个盖元件(如,分别为第一盖元件68c、第二盖元件68a和第三盖元件68b),这些盖元件可移除地分别覆盖样本端口50、第一开口60和/或第二开口64。盖元件68a-68c可由合适的材料(如,塑料)制成,并且尺寸和形状可被设计为例如提供摩擦配合、按扣配合或拧入式连接到端口或开口。另选地,在任意实施方案中,盖元件的尺寸可被设计为提供例如摩擦配合、按扣配合或拧入式连接到延伸穿过端口或开口的凸缘(未示出)。另选地,在任意实施方案中,盖元件68a-68c可包括一薄层塑料膜、金属箔等,该层覆盖开口,并任选地包括可移除地将盖元件固定到壳体100的粘合剂涂层(未示出),如图1至图4中所示。在任意实施方案中,一个或多个盖元件(盖元件68a-68c)可能为易碎的。因此,如上所述驱使脱离构件穿过第二流体通路还包括驱使脱离构件穿过第二盖元件68a和/或第三盖元件68b。多孔载体30允许液体样本的增溶和/或悬浮组分(如,细胞、蛋白质、核酸、盐)从样本接收区朝向靶细胞结合区纵向(如,侧向)芯吸或流动。通常,侧向流装置呈多孔材料条的形式(如,尺寸为4-8mm×40-80mm)。优选的是,多孔材料例如由硝化纤维素膜、聚偏氟乙烯(PVDF)、尼龙或单一多孔材料基质(如,Fusion5TM(可购自英国米德尔塞克斯的沃特曼公司(Whatman,Middlesex,UK)),并如美国专利申请公布号2006/0040408中所述)构成。样本接收区32为其上施用有含样本液体(未示出)的多孔载体30的区域,并且一旦施用,含样本液体穿过载体30朝向靶细胞结合区34从其纵向移动(如,通过毛细作用)。相对于垂直流动穿过膜过滤器,例如样本纵向移动穿过多孔载体30有利地改善从颗粒(如,土壤、灰尘、食物颗粒、非靶细胞)和/或分子(如,蛋白质、脂肪、盐、螯合剂)中分离样本中的靶细胞(如,微生物),这些颗粒和分子可能以其它方式抑制或干扰靶细胞或与其相关的靶分子的检测。如本文所用,“靶分子”和“靶生物分子”是指指示样本中是否存在靶细胞的分子。在图1至图4例示的实施方案中,可经由样本端口50触及样本接收区。在使用中,例如,盖元件68c(如果存在的话)被移动或移除以露出样本端口50,并且一定容量(如,预定容量)的含样本液体可倾倒或吸移到多孔载体30的露出样本接收区32中。另选地,样本端口50可浸入样本(未示出)一段足够长的时间,使得一部分样本吸收到多孔载体中。靶细胞结合区34为包括固定的结合配体(如,抗体、结合蛋白、凝集素、寡核苷酸)的多孔载体30的预定区域。结合配体(未示出)优先结合链接到靶细胞(如,靶微生物)的靶分子(如,表面蛋白质、脂多糖、肽聚糖)。这样,通过形成与靶分子的键,固定的结合配体在多孔载体30的靶细胞结合区34处固定靶细胞。使用本领域中熟知的方法将结合配体固定到多孔载体30上和/或固定在其中。随着携带靶细胞(未示出)穿过靶细胞结合区34并且液体迁移穿过多孔载体30,靶分子结合到结合配体,致使靶细胞变为固定在靶细胞结合区34。这样,靶细胞有效地浓缩在样本制备装置1000的靶细胞结合区。在任意实施方案中,本公开的多孔载体可由基底支撑。在任意实施方案中,多孔载体还可联接(如,粘合联接)到基底。有利的是,将多孔载体固定到基底可有利于组装装置,并有利于将多孔载体的靶细胞结合区与壳体的第一开口和第二开口对准。此外,在多孔载体接触液体样本之后,基底有助于保持靶细胞结合区与壳体的第一开口和第二开口对准,这可能致使多孔载体溶胀。图5和图6示出由基底35支撑的多孔载体30的一个实施方案的各种视图。基底35可使用不吸水的材料制成。合适的材料包括例如玻璃、塑料膜、金属箔或它们的组合。在任意实施方案中,多孔载体30可联接(如,通过粘合剂,未示出)到基底35。在任意实施方案中,基底35可包括邻近多孔载体30的靶细胞结合区34的弱区36。弱区36可包括一个或多个有刻痕的段、一个或多个薄弱的接合点、或有利于分离基底35的部分37的穿孔。在组装好的装置中,弱区优选地对准第二流体通路,使得当脱离构件被迫使穿过第二流体通路时,脱离构件沿多孔载体30的靶细胞结合区34(在图5中显示为阴影区域)的一部分(未示出)或全部脱离基底35的部分37。返回图1,在任意实施方案中,本公开的样本制备装置可任选地包括流动指示剂80,以指示液体样本已移动穿过多孔载体30,从样本接收区32移动到或超出靶细胞结合区34。流动指示剂80为本领域中已知的侧向流免疫诊断装置,并可包括例如微粒。微粒可包括能够结合到固定在流动指示剂控制区38处的对应结合配体(如,抗生物素蛋白)的表面分子(如,生物素)。将结合配体固定到多孔载体30的方法在本领域中是熟知的。此外,微粒可包括能够可视地观察的着色或荧光染料或颜料。流动指示剂80可由液体样本携带穿过多孔载体30到达流动指示剂控制区38。流动指示剂控制区38为预定区域,通常设置在多孔载体30上和/或其中的某一位置处,其中靶细胞结合区34设置在样本接收区32与流动指示剂控制区38之间。在使用过程中,液体样本迁移穿过多孔载体30,从样本接收区32朝向并超出靶细胞结合区34,并由此移动流动指示剂80朝向流动指示剂控制区38。当流动指示剂80到达流动指示剂控制区38时,它们结合到对应的结合配体,从而致使流动指示剂80出现可观测到的积聚(如,积聚为着色或荧光线条或点)。返回图1,在根据本公开的样本制备装置1000的任意实施方案中,装置任选地包括一个或多个标记15。标记15可对准多孔载体30的任选流动指示剂控制区38,从而指示流动指示剂控制区38的某个位置,在该位置,可能无法以其它方式从多孔载体30的其它部分区分开来直至流动指示剂80结合到流动指示剂控制区38。在任意实施方案中,样本制备装置的壳体可包括邻近流动控制结合区的任选观察窗口(未示出),以有利于观察结合到其的流动指示剂。在任意实施方案中,本公开的样本制备装置可任选地包括邻近第二开口设置的吸收主体。图7示出了包括吸收主体85的样本制备装置1001的一个实施方案。装置1001包括壳体100,壳体具有第一件10、第二件20和任选的隔件40,各自如本文所述。装置1001还包括样本端口50、第一开口60、第二开口64和第二流体通路74,各自如本文所述。吸收主体85邻近第二开口64设置,并且与第二流体通路74流体连通。因此,随着液体(如,洗涤溶液)被迫使经由第二流体通路74穿过多孔载体30的靶细胞结合区(图7中未示出),液体被吸收主体85吸收并保留。在任意实施方案中,吸收主体85可任选地联接(如,经由粘合剂,未示出)到壳体100。除此之外或另选地,吸收主体85可由覆盖第二开口64的盖元件(如,图1例示的实施方案中所示的第三盖元件68b)保持在合适位置以及任选地联接到盖元件。吸收主体85与多孔载体30间隔开,使得吸收主体不与经过由多孔载体限定的第一流体通路70的液体流体连通。然而,吸收主体85与第二流体通路74流体连通,并因此接收被迫使经由第二流体通路穿过装置1001的液体。吸收主体85可使用能够吸收被迫使经由第二流体通路74穿过装置1001的液体(如,含水液体)的任何吸收材料制成。合适材料的非限制性示例包括泡沫(如,开孔泡沫)、海绵、纱布、棉花等。在任意实施方案中,该材料可包含超吸收聚合物(如,聚丙烯酸酯/聚丙烯酰胺共聚物)和/或它们的颗粒。在任意实施方案中,本公开的样本制备装置任选地可包括从开口延伸到多孔载体的至少一个导管。图8至图10示出包括多个导管的样本制备装置1002的一个实施方案,每个导管从壳体101中的开口延伸至多孔载体30。壳体101包括第一件10'、第二件20和任选的隔件40,如本文所述。多孔载体30包括样本接收区32和靶细胞结合区34,并且限定从样本接收区32延伸至并超出靶细胞结合区34的第一流体通路70。第二件20具有第三侧22和与第一侧相对的第四侧24。第二件20还包括第二开口64和可将第二件联接到第一件10'和/或隔件40的任选粘合剂层26,各自如本文所述。装置1002还包括邻近壳体101外部的第二开口64设置的吸收主体85。样本制备装置1002的第一件10'包括从其延伸的两个导管(如,分别为第一导管52和第二导管62)。任选的第一导管52在壳体101的远侧端部包括样本端口50。第一导管52具有其中可沉积(如,通过倾倒或吸移)液体样本的内部体积。内部体积由第一导管52的长度和直径限定,并因此能够保持操作人员希望传递经过多孔载体30的任何液体体积。有利的是,第一导管52允许操作人员将样本分配到导管中然后走开,同时液体迁移进入多孔载体30。在任意实施方案中,任选的第三导管(未示出)可从第二开口64延伸。任选的第二导管62在壳体101的远侧末端包括第一开口60。第二导管62也具有其中可沉积(如,通过倾倒或吸移)液体的内部体积。可使用洗涤溶液例如冲洗非靶生物分子、碎屑和/或化学品,这些物质存在于靶细胞结合区34处,但未具体结合到在靶细胞结合区处固定的结合配体。内部体积由第二导管62的长度和直径限定,并因此能够保持操作人员希望传递经过多孔载体30的任何液体体积。有利的是,第二导管62允许操作人员将液体(如,洗涤溶液、指示试剂)分配到第一开口60,并使液体经由第二流体通路74经过多孔载体30。例如,液体可通过负压和重力流经过多孔载体30,或者另选地可使用本文所述的脱离构件通过正压迫使液体经过多孔载体。特别有利的是,包括与第二流体通路对准的第二导管的本公开的装置允许操作人员采用活塞流方法使大量洗涤溶剂(相对于多孔载体的靶细胞结合区的空隙体积)经过靶细胞结合区。例如,如果多孔载体为约0.2mm厚并且靶细胞结合区设置在约6mm2的区域中,靶细胞结合区的空隙体积可为约5-25μL。在该示例中,使500μL洗涤溶剂经过多孔载体的靶细胞结合区导致用约20-100倍液体体积洗涤多孔载体。这进而导致显著稀释和/或从靶细胞结合区移除未结合的物质。在任意实施方案中,本公开的样本制备装置还包括任选的脱离构件。图11A为根据本公开包括脱离构件500的样本制备装置1003的一个实施方案。脱离构件500以可滑动的方式接合第二流体通路74,并可用于脱离多孔载体30的一部分(如,包括靶细胞结合区的一部分,未示出)并将该部分排出装置1003,如本文所述。脱离构件500包括具有顶端592的轴591。轴591的尺寸被设计为横贯第二流体通路74至少从第一开口60到第二开口64的长度。此外,脱离构件500任选地包括可用于迫使轴591的顶端592(如,使用手动压力)穿过装置1003的第二流体通路74的柄部595。脱离构件500可使用本领域中熟知的方法(如,挤出或模塑工艺)由多种材料形成,材料包括但不限于塑料、玻璃、木材、金属以及它们的组合。图11B示出了图11A的脱离构件500的顶端592的细部图。在任意实施方案中,顶端可被构造成用于形成与装置的第二导管62的大致不透液密封。有利的是,在这些实施方案中,可使用脱离构件500迫使位于第二导管62中的液体(未示出)穿过第二流体通路74。在任意实施方案中,脱离构件500的轴591可包括任选的密封件593(如,橡胶O形环),以有利于脱离构件500与第二导管62的壁之间的可滑动接触。在任意实施方案中,脱离构件500的顶端592可被构造成有利于样本制备装置的一部分多孔载体的脱离(即,顶端592可包括切割结构)。例如,顶端592可呈凹形(未示出),从而形成有利于切割多孔载体的周边边缘。另选地,顶端592可包括有利于切割多孔载体的切割特征结构(如,锯齿形边,未示出)。另选地,顶端592可大致缺乏切割特征结构(即,顶端592可为钝的)。脱离构件可用于在本公开的样本处理装置中执行多种功能。因此,可通过相对于样本制备装置的壳体将脱离构件从一个操作位置移动到另一个操作位置来实现多种功能。图12A至图12C示出了本公开的样本处理装置中脱离构件的若干操作位置。图12A示出了设置在相对于样本制备装置1003的第一操作位置中的脱离构件500的一个实施方案。例示的实施方案的装置1003包括包围多孔载体30的壳体101,如本文所公开。壳体101包括位于一侧的第一开口60和与第一开口相对的第二开口64,如本文所述。第一开口设置在从壳体101延伸的第二导管62的端部处,如本文所述。在该实施方案中,脱离构件500的顶端(即,轴591的顶端592,如图11A所示)以可滑动的方式接合装置1003的第一开口60中。在第一操作位置,脱离构件用作闭合件,用于防止外部物质通过第一开口60进入装置1003,从而防止可能污染或以其它方式干扰样本制备装置1003的多孔载体30的一部分(如,靶细胞结合区,未示出)。图12B示出了图12A的样本制备装置1003,其中脱离构件500设置在第二操作位置(即,脱离构件的顶端邻近多孔载体30设置)。脱离构件500从第一操作位置移动到第二操作位置可实现至少两个功能:i)移动脱离构件可将脱离构件500邻近多孔载体30定位,之后再使用脱离构件来切割和/或脱离多孔载体的一部分;以及ii)如果第二导管62的内部体积中存在液体(如,如本文所述的洗涤液体),则移动脱离构件可迫使该液体经由第二流体通路(如图11A中所示的第二流体通路74)穿过多孔载体。通过迫使液体经由第二流体通路穿过多孔载体,操作人员可稀释或洗掉可能以其它方式抑制或干扰在方法的后续步骤中检测靶细胞的非靶颗粒和/或分子(如,蛋白质、脂肪、核酸、盐、螯合剂。)图12C示出了图12A的样本制备装置1003,其中脱离构件500设置在第三操作位置(即,脱离构件的顶端邻近第二开口64设置)。脱离构件500从第一操作位置或第二操作位置到第三操作位置的移动起到脱离多孔载体的一部分(脱离部分30a,例如,其可包括多孔载体30的靶细胞结合区的至少一部分或全部)的作用。此外,脱离构件500到第三操作位置的移动任选地从壳体101中排出多孔载体的脱离部分30a,供进一步处理以检测与靶细胞相关联的靶分子。图12C还示出了可邻近第二开口64定位的接收器600(如,反应管),并且脱离部分30a可由脱离构件500排出并进入该接收器。在任意实施方案中,样本制备装置可通过仅将样本接收部分浸入液体样本来具体地调节以便获得样本。图13至图16示出样本制备装置1004的一个实施方案的各种视图,该装置通过浸渍来具体地调节以便获得样本。装置1004包括壳体102,壳体具有第一件10和第二件20(两者均如在本文中所述)和任选的隔件41。任选的隔件41包括开口端42。装置1004包括具有靶细胞结合区34的多孔载体30,如本文所述。多孔载体30的样本接收区32延伸穿过隔件41的开口端42和壳体102的外部。因此,样本接收区32易于浸入液体样本(未示出),以便样本移动到并穿过多孔载体30。装置1004包括形成第二流体通路74的终点的第一开口60和第二开口64,如本文所述。在另一方面,本公开提供用于检测样本中的靶细胞的试剂盒。该试剂盒包括本文所述样本制备装置的任意实施方案。在任意实施方案中,试剂盒还包括本文所述脱离构件的任意实施方案。脱离构件的尺寸被设计为从第一开口到第二开口横贯侧向通道,如本文所述。在任意实施方案中,脱离构件以可滑动的方式接合样本制备装置的第二流体通路。在任意实施方案中,脱离构件被构造成用于迫使含水液体穿过壳体(如,穿过壳体的第二导管)。在任意实施方案中,试剂盒还包括用于核酸扩增的洗涤液体和/或试剂(如,引物、核糖核苷酸三磷酸腺苷、脱氧核糖核苷酸三磷酸腺苷、聚合酶)。在任意实施方案中,试剂盒可包括释放溶液,如下文所述。在另一方面,本公开提供用于检测样本中靶细胞(如,靶微生物)的第一方法。第一方法包括将液体样本与本文所公开样本制备装置的任意实施方案的多孔载体接触。在第一方法的任意实施方案中,样本制备装置包括具有第一开口、第二开口和多孔载体的壳体。多孔载体包括位于第一预定位置处的样本接收区和位于与第一预定位置间隔开的第二预定位置处的靶细胞结合区。此外,多孔载体限定在样本接收区与靶细胞结合区之间延伸的第一流体通路。多孔载体的至少一部分设置在壳体中。第二流体通路从第一开口和第二开口延伸穿过壳体,第二流体通路在靶细胞结合区与多孔载体相交。在第一方法的任意实施方案中,将液体样本与多孔载体接触包括将液体样本与多孔载体的样本接收区接触,如本文所述。在第一方法的任意实施方案中,将液体样本与多孔载体接触包括将得自富集培养物的液体样本与多孔载体(在样本接收区处)接触。有利的是,富集培养物的一部分可直接加载到样本制备装置中,并且富集培养物中存在的靶细胞(如,微生物)可在靶细胞结合区捕获以供进一步分析,如本文所述。第一方法还包括如下步骤:使液体样本的至少一部分从至少样本接收区向靶细胞结合区(如,纵向)移动穿过多孔载体;在液体的至少一部分移动到靶细胞结合区之后,迫使脱离构件穿过第二流体通路从第一开口到达第二开口,从而排出靶细胞结合区的一部分或全部;以及处理靶细胞结合区的该部分,以检测靶微生物的指示。随着液体移动到靶细胞结合区,如果样本中存在靶细胞,液体即携带靶细胞穿过多孔载体。此外,液体可携带与靶细胞无关的其它颗粒(如,土壤、灰尘、食物颗粒、非靶细胞)和分子(如,蛋白质、脂肪、核酸、盐、螯合剂)。这些非靶颗粒和分子可能可干扰后续可用于检测样本中是否存在靶细胞的分析过程(如,核酸扩增过程)。随着液体样本迁移穿过多孔载体的靶细胞结合区,靶细胞(如果存在的话)可结合到在靶细胞结合区附接到多孔载体的结合配体(如,抗体、凝集素、核酸),如本文所述。样本中存在的至少一些非靶颗粒和分子可相对于靶细胞被阻释,原因是液体穿过多孔载体,并因此不在靶细胞结合区与靶细胞共聚积。此外,至少一些非靶颗粒和分子继续随液体流动穿过靶细胞结合区,从而将这些非靶颗粒和分子从靶细胞分离开来。因此,第一方法将靶细胞(如果存在的话)从可能干扰或以其它方式抑制用于检测靶细胞的流程(如,核酸扩增检测流程)的非靶颗粒和分子分离开来。在第一方法的任意实施方案中,在液体的至少一部分移动穿过样本制备装置到达靶细胞结合区之后,该方法包括迫使脱离构件穿过第二流体通路从第一开口到达第二开口,从而脱离并排出靶细胞结合区的一部分。在第一方法的任意实施方案中,脱离并排出靶细胞结合区的一部分可包括脱离并排出全部靶细胞结合区。处理靶细胞结合区的该部分以检测靶微生物的指示可使用本领域已知的任何合适检测过程执行,包括但不限于培养方法、生物化学方法(如,检测与靶微生物相关联的酶活动)、免疫方法(如,免疫染色、ELISA)、组织学方法(如,组织学染色)和基因方法(如,核酸扩增、杂交)。在任意实施方案中,扩增核酸序列可包括扩增与靶微生物相关联的核苷酸序列。核酸扩增的特别优选方法包括用3MTM分子检测系统(购自明尼苏达州圣保罗的3M公司(3MCompany,St.Paul,MN))实现的等温DNA扩增和生物发光检测方法。在第一方法的任意实施方案中,在液体的至少一部分移动到靶细胞结合区之后,该方法任选还可包括使洗涤溶剂经由第二流体通路穿过多孔载体。洗涤溶液的用途是从靶细胞结合区洗掉与靶细胞无关的任何未结合杂质(如,颗粒(如,土壤、灰尘、食物颗粒、非靶细胞))和/或分子(如,蛋白质、脂肪、核酸、盐、螯合剂)。可例如通过迫使(如,经由注射器或吸移管)洗涤溶剂(如,无菌水、缓冲溶液)穿过第二流体通路,使洗涤溶液穿过多孔载体。有利的是,由于样本制备装置的第二流体通路取向成与第一流体通路正交,因此洗涤溶剂将未结合的材料(如,蛋白质、核酸、细胞片段、食物颗粒、盐)从多孔载体的靶细胞结合区洗掉,从而消除可能以其它方式干扰结合到靶细胞结合区的靶分析物的检测的材料。当如本文所述装置中存在第二导管时,洗涤溶剂可装载到第二导管中,并且可迫使该溶剂穿过多孔载体,例如通过重力流,或利用柱塞或本文所述的脱离构件经由施加在液体上的正压。此任选的步骤可显著减少初始样本中某些物质的数量,这些物质可能干扰或以其它方式降低用于处理靶细胞结合区的部分以检测靶微生物指示的后续流程的灵敏度。在第一方法的任意实施方案中,洗涤溶剂经由第二流体通路穿过多孔载体可在从样本处理装置顶出多孔载体的部分之前或之后执行。在另选的实施方案(未示出)中,将负压源(如,真空软管)可操作地施加于第二开口,以抽吸穿过第二流体通路的洗涤溶剂。在本公开第一方法的任意实施方案中,该方法任选地包括处理多孔载体的排出部分或任何从其释放的细胞,以致使细胞裂解。多种致使细胞裂解的合适方法在本领域中是已知的,并且包括但不限于物理裂解方法(如,煮沸、超声处理、弗氏细胞压碎器空化)和化学裂解方法(如,使样本接触洗涤剂、表面活性剂、季胺、离液剂或有机溶剂)。因此,多孔载体的排出部分或任何从其洗脱的细胞可以致使细胞裂解的方式处理,以释放指示是否存在靶细胞的可检测生物分子(如,内部或外部生物分子,诸如蛋白质、酶、多糖、核酸),或为了渗透细胞以便接触检测部分(如,引物、聚合酶、标记抗体)从而与细胞内的可检测分子交互。有利的是,靶细胞可原位(即,在多孔载体的顶出部分)裂解,或者另选地,细胞可从多孔载体的靶细胞结合区释放,之后再进行处理以致使细胞裂解。可通过本领域中已知的任何合适方法从靶细胞结合区释放细胞。例如,如果捕获靶细胞的结合配体为抗体,则可通过使靶细胞结合区的顶出部分与合适的释放溶液(如,具有可致使结合到抗体的靶细胞抗原释放的合适pH值和/或离子强度的含水溶液)接触来释放靶细胞。因此,随着释放溶液穿过结合有靶细胞的靶细胞结合区,靶细胞即释放到释放溶液中。在任意实施方案中,第一方法还可包括邻近第二开口定位接收器。在任意实施方案中,接收器可大致不含生物材料。在任意实施方案中,迫使脱离构件穿过第二流体通路以脱离靶细胞结合区的至少一部分进一步可包括将多孔载体的一部分(如,靶细胞结合区的至少一部分或全部)移入接收器,如图12C所示。有利的是,以此方式执行多孔载体的部分的传输可消除多孔载体的部分与壳体外部的生物材料潜在源之间发生接触的可能性。处理靶细胞结合区的顶出部分的优选方法包括使用购自明尼苏达州圣保罗的3M公司(3MCompany,St.Paul,MN)的分子检测系统(在下文中称为“MDS”)处理该部分。因此,靶细胞结合区的该部分可直接排出到MDS裂解管中,并且可处理所得溶胞产物的等分试样以扩展和检测用于指示是否存在靶微生物的核酸。在另一方面,本公开提供检测样本中靶细胞(如,靶微生物)的第二方法。第二方法包括将液体样本与本文所公开样本制备装置的任意实施方案的多孔载体接触。在第二方法的任意实施方案中,样本制备装置包括具有第一开口、第二开口和多孔载体的壳体。多孔载体包括位于第一预定位置处的样本接收区和位于与第一预定位置间隔开的第二预定位置处的靶细胞结合区。此外,多孔载体限定在样本接收区于靶细胞结合区之间延伸的第一流体通路。多孔载体的至少一部分设置在壳体中。第二流体通路从第一开口和第二开口延伸穿过壳体,第二流体通路在靶细胞结合区与多孔载体相交。在第二方法的任意实施方案中,将液体样本与多孔载体接触包括将液体样本与多孔载体的样本接收区接触,如本文所述。在第二方法的任意实施方案中,将液体样本与多孔载体接触包括将得自富集培养物的液体样本与多孔载体(在样本接收区处)接触。有利的是,富集培养物的一部分可直接加载到样本制备装置中,并且富集培养物中存在的靶细胞(如,微生物)可在靶细胞结合区捕获以供进一步处理和分析,如本文所述。第二方法还可包括如下步骤:使液体样本的至少一部分从至少样本接收区向靶细胞结合区(如,纵向)移动穿过多孔载体;在液体的至少一部分移动到靶细胞结合区之后,如果存在于第二流体通路中,则迫使释放溶液穿过第二流体通路,并从而将包含靶微生物的释放溶液的一部分排出装置;以及处理靶细胞结合区的该部分以检测靶微生物的指示。随着液体移动到靶细胞结合区,如果样本中存在靶细胞,液体即携带靶细胞穿过多孔载体。此外,液体可携带与靶细胞无关的其它颗粒(如,土壤、灰尘、食物颗粒、非靶细胞)和分子(如,蛋白质、脂肪、核酸、盐、螯合剂)。这些非靶颗粒和分子可能可干扰后续可用于检测样本中是否存在靶细胞的分析过程(如,核酸扩增过程)。随着液体样本迁移穿过多孔载体的靶细胞结合区,靶细胞(如果存在的话)可结合到在靶细胞结合区处附接到多孔载体的结合配体(如,抗体、凝集素、核酸),如本文所述。样本中存在的至少一些非靶颗粒和分子可相对于靶细胞被阻释,原因是液体穿过多孔载体,并因此不在靶细胞结合区处与靶细胞共聚积。此外,至少一些非靶颗粒和分子继续随液体流动穿过靶细胞结合区,从而将这些非靶颗粒和分子从靶细胞分离开来。因此,第二方法将靶细胞(如果存在的话)从可能干扰或以其它方式抑制用于检测靶细胞的流程(如,核酸扩增检测流程)的非靶颗粒和分子分离开来。这样,在第二方法的任意实施方案中,在液体的至少一部分移动到靶细胞结合区之后,该方法任选地包括使洗涤溶剂经由第二流体通路穿过多孔载体。洗涤溶液的用途是从靶细胞结合区洗掉与靶细胞无关的任何未结合杂质(如,颗粒(如,土壤、灰尘、食物颗粒、非靶细胞)和/或分子(如,蛋白质、脂肪、核酸、盐、螯合剂))。可例如通过迫使(如,经由注射器或吸移管)洗涤溶剂(如,无菌水、缓冲溶液)穿过第二流体通路,使洗涤溶液穿过多孔载体。有利的是,由于样本制备装置的第二流体通路取向成与第一流体通路正交,因此洗涤溶剂将未结合的材料(如,蛋白质、核酸、细胞片段、食物颗粒、盐)从多孔载体的靶细胞结合区洗掉,从而消除可能以其它方式干扰对结合到靶细胞结合区的靶细胞的检测的材料。当如本文所述装置中存在第二导管时,洗涤溶剂可装载到第二导管中,并且可迫使该溶剂穿过多孔载体,例如通过重力流,或利用柱塞或本文所述的脱离构件经由施加在液体上的正压。此任选的步骤可显著减少初始样本中某些物质的数量,这些物质可能干扰或以其它方式降低用于处理靶细胞结合区的部分以检测靶微生物指示的后续流程的灵敏度。在另选的实施方案(未示出)中,将负压源(如,真空软管)可操作地施加于第二开口,以抽吸穿过第二流体通路的洗涤溶剂。本公开的第二方法包括迫使释放溶液穿过第二流体通路并因此将包含靶微生物(如果存在于第二流体通路中的话)的释放溶液的一部分排出装置。使用本领域中已知的任何合适释放溶液从靶细胞结合区释放细胞。例如,如果捕获靶细胞的结合配体为抗体,靶细胞的释放方式可为:迫使(如,通过正压、负压或重力流)合适的释放溶液(如,具有可致使结合到抗体的靶细胞抗原释放的合适pH值和/或离子强度的含水溶液)穿过第二流体通路,以及收集(如,收集在反应管中)经由第二开口离开第二流体通路的释放溶液的该部分。因此,随着释放溶液穿过结合有靶细胞的靶细胞结合区,靶细胞即释放到释放溶液中并与经由第二开口离开装置的释放溶液一起被收集。在任意实施方案中,第二方法还可包括邻近第二开口定位接收器。在任意实施方案中,接收器可大致不含生物材料。在任意实施方案中,迫使释放溶液穿过第二流体通路并因此将包含靶微生物(如果存在于第二流体通路中的话)的释放溶液的一部分排出装置还可包括在释放溶液的一部分经由第二开口(未示出)离开样本处理装置时收集释放溶液的该部分。有利的是,以此方式收集释放溶液的一部分可消除离开样本制备装置的释放溶液与装置壳体外部的生物材料潜在源之间发生接触的可能性。处理收集到的释放溶液的优选方法包括使用购自明尼苏达州圣保罗的3M公司(3MCompany,St.Paul,MN)的分子检测系统(在下文中称为“MDS”)处理收集到的溶液(以及其中的靶细胞)。因此,收集到的释放溶液可直接排出到MDS裂解管中,并且可处理所得溶胞产物的等分试样以扩展和检测用于指示是否存在靶微生物的核酸。在本公开第二方法的任意实施方案中,该方法任选地包括裂解由释放溶液释放的细胞。致使细胞裂解的多种合适方法在本领域中是已知的,并包括但不限于物理裂解方法(如,煮沸、超声处理、弗氏细胞压碎器空化)和化学裂解方法(如,使样本接触洗涤剂、表面活性剂、季胺、离液剂或有机溶剂)。因此,由释放溶液释放的细胞可以致使细胞裂解的方式处理,以释放指示是否存在靶细胞的可检测生物分子(如,内部或外部生物分子,诸如蛋白质、酶、多糖、核酸),或为了渗透细胞以便接触检测部分(如,引物、聚合酶、标记抗体)从而与细胞内的可检测分子交互。在第二方法的任意实施方案中,处理由释放溶液释放的细胞以检测靶微生物的指示可使用本领域已知的任何合适检测过程执行,包括但不限于培养方法、生物化学方法(如,检测与靶微生物相关联的酶活动)、免疫方法(如,免疫染色、ELISA)、组织学方法(如,组织学染色)和基因方法(如,核酸扩增、杂交)。在任意实施方案中,扩增核酸序列可包括扩增与靶微生物相关联的核苷酸序列。核酸扩增的特别优选方法包括用3MTM分子检测系统(购自明尼苏达州圣保罗的3M公司(3MCompany,St.Paul,MN))实现的等温DNA扩增和生物发光检测方法。示例性实施方案实施方案A为一种检测靶细胞的方法,包括:使液体样本接触样本制备装置的多孔载体,该装置包括:包括第一开口和第二开口的壳体;和多孔载体;其中多孔载体包括位于第一预定位置处的样本接收区和位于第二预定位置处的靶细胞结合区,多孔载体限定从样本接收区延伸穿过靶细胞结合区的第一流体通路;其中多孔载体的至少一部分设置在壳体中;其中第二流体通路穿过壳体从第一开口延伸到第二开口,第二流体通路在靶细胞结合区与多孔载体相交;使液体样本的至少一部分从样本接收区朝向靶细胞结合区纵向移动穿过多孔载体;在液体的至少一部分移动到靶细胞结合区之后,迫使脱离构件穿过第二流体通路从第一开口到达第二开口,并从而排出靶细胞结合区的一部分;以及处理靶细胞结合区的该部分或从其释放的细胞,以检测靶细胞的指示。实施方案B为根据实施方案A所述的方法,其中装置还包括覆盖第一开口的第一盖元件或覆盖第二开口的第二盖元件,其中迫使脱离构件穿过第二流体通路包括迫使脱离构件穿过第一盖元件或第二盖元件。实施方案C为根据前述实施方案中任一项所述的方法,其中载体由基底支撑,其中迫使脱离构件穿过第二流体通路以脱离靶细胞结合区的至少一部分进一步包括使用脱离构件脱离基底的一部分。实施方案D为一种检测靶细胞的方法使液体样本接触样本制备装置的多孔载体,该装置包括:包括第一开口和第二开口的壳体;和多孔载体;其中多孔载体包括位于第一预定位置处的样本接收区和位于第二预定位置处的靶细胞结合区,多孔载体限定从样本接收区延伸穿过靶细胞结合区的第一流体通路;其中多孔载体的至少一部分设置在壳体中;其中第二流体通路从第一开口和第二开口延伸穿过壳体,第二流体通路在靶细胞结合区与多孔载体相交;使液体样本的至少一部分从样本接收区朝向靶细胞结合区纵向移动穿过多孔载体;在液体的至少一部分移动到靶细胞结合区之后,迫使释放溶液穿过第二流体通路并因此将包含靶微生物(如果存在于第二流体通路中的话)的释放溶液的一部分排出装置;以及处理释放溶液的部分,以检测靶微生物的指示。实施方案E为根据前述实施方案中任一项所述的方法,其中在液体的至少一部分移动到靶细胞结合区之后,该方法还包括使洗涤溶剂经由第二流体通路穿过多孔载体的步骤。实施方案F为根据前述实施方案中任一项所述的方法,还包括邻近第二开口定位接收器,其中排出靶细胞结合区的一部分或排出释放溶液的一部分进一步包括将靶细胞结合区的该部分或释放溶液的该部分移动到接收器中。实施方案G为根据前述实施方案中任一项所述的方法,其中将液体样本与多孔载体接触包括将得自富集培养物的液体样本与多孔载体接触。实施方案H为根据前述实施方案中任一项所述的方法,其中处理分析物结合区的该部分或处理释放溶液的部分以检测靶微生物的指示进一步包括处理分析物结合区的该部分或释放溶液的该部分以检测与靶细胞相关联的生物分子。实施方案I为根据实施方案G所述的方法,其中检测与靶细胞相关联的生物分子包括检测核酸、酶或抗原生物分子。实施方案J为根据前述实施方案中任一项所述的方法,其中处理靶细胞结合区的该部分或处理释放溶液的部分包括扩增核酸序列,其中核酸序列包括与靶细胞相关联的核苷酸序列。实施方案K为根据前述实施方案中任一项所述的方法,其中检测靶细胞的方法为检测靶微生物的方法。实施方案L为一种装置,包括:包括内部、第一开口和第二开口的壳体;和包括样本接收区和靶细胞结合区的多孔载体;其中多孔载体限定从样本接收区延伸至靶细胞结合区的第一流体通路;其中多孔载体的至少一部分设置在壳体的内部;其中包括中心轴线的第二流体通路从第一开口和第二开口延伸穿过壳体,第二流体通路在靶细胞结合区与多孔载体相交;其中中心轴线取向成与第一流体通路正交。实施方案M为根据实施方案L所述的装置,还包括能够触及样本接收区的样本端口,其中样本接收区设置在壳体的内部。实施方案N为实施方案L或实施方案M所述的装置,其中壳体还包括从样本端口延伸至壳体的内部的第一导管。实施方案O为根据实施方案L至N中任一项所述的装置,其中壳体还包括从第一开口延伸至壳体的内部的第二导管。实施方案P为根据实施方案L至O中任一项所述的装置,还包括在第一流体通路中设置在多孔载体中的流动指示剂。实施方案Q为根据实施方案P所述的装置,还包括流动指示剂控制区,其中流动指示剂控制区设置在第一流体通路的多孔载体中,其中靶细胞结合区设置在样本接收区与流动指示剂控制区之间的第一流体通路中。实施方案R为根据实施方案L至Q中任一项所述的装置,还包括可移除地覆盖第一开口的可移除的第一盖元件。实施方案S为根据实施方案L至R中任一项所述的装置,还包括可移除地覆盖第二开口的可移除的第二盖元件。实施方案T为根据实施方案L至S中任一项所述的装置,还包括可移除地覆盖样本端口的可移除的第三盖元件。实施方案U为根据实施方案L至T中任一项所述的装置,还包括邻近第二开口设置的吸收主体。实施方案V为根据实施方案U所述的装置,如依赖于实施方案S,其中吸收主体联接到第二盖元件。实施方案W为根据实施方案T或实施方案U所述的装置,其中吸收主体与多孔载体间隔开。实施方案X为根据前述实施方案中任一项所述的装置,该装置还可包括尺寸被设计为从第一开口到第二开口横贯第二流体通路的脱离构件,其中脱离构件的一部分以可滑动的方式接合第二流体通路。实施方案Y为根据实施方案X所述的装置,其中脱离构件包括切割结构。实施方案Z为根据实施方案X或实施方案Y所述的装置,其中脱离构件被构造成用于迫使含水液体穿过第二导管。实施方案AA为包括根据实施方案L至W中任一项所述的装置的试剂盒。实施方案AB为根据实施方案AA所述的试剂盒,还包括尺寸被设计为从第一开口到第二开口横贯第二流体通路的脱离构件。实施方案AC为根据实施方案AB所述的试剂盒,其中脱离构件包括切割结构。实施方案AD为根据实施方案AB或实施方案AC所述的试剂盒,其中脱离构件被构造成用于迫使含水液体穿过壳体。实施方案AE为根据实施方案AA至AD中任一项所述的试剂盒,还包括洗涤液。实施方案AF为根据实施方案AA至AE中任一项所述的试剂盒,还包括释放溶液。实施方案AG为根据实施方案AA至AF中任一项所述的试剂盒,还包括用于核酸扩增的试剂。实施例通过下面的实施例进一步说明了本发明的目的和优点,但这些实施例中列举的具体材料及其量以及其它条件和细节不应被理解为是对本发明的不当限制。除非另外指明,否则所有的份数和百分比以重量计,所有的水为蒸馏水并且所有的分子量为重均分子量。参照实施例1从在侧向流多孔支承体中捕获的微生物中检测核酸。快速沙门氏菌属侧向流试纸(部件号3000034)购自密苏里州联合城的罗莫实验室公司(RomerLabs,Union,MO)。沙门氏菌属的菌株在缓冲蛋白胨水中生长过夜,然后在巴特菲尔德缓冲液中稀释(即,连续10倍稀释)。使用一毫升10-7稀释液接种PETRIFILMTM肠杆菌计数板(购自尼苏达州圣保罗的3M公司(3MCompany,St.Paul,MN))。按照制造商的说明温育该板,并发现该板包括110个菌落形成单位数。将一片试纸放入沙门氏菌属培养物的10-3、10-4、10-5、10-6和10-7连续稀释液中的每一个中,并且试纸按照制造商的说明进行处理。使用剃刀刀片从每张试纸上切下“对照”线和“靶”线(结合有沙门氏菌属微生物)。使用新的手套和剃刀刀片切下每条线以避免交叉感染。将每条切下的线再悬浮在1.5mL微量离心管中的100μL的SS2缓冲液(KCl,3.19g/L;(NH4)2SO4,1.41g/L;Tris碱,2.72g/L;950,0.526g/L;聚乙烯吡喀烷酮,0.43g/L;TritonTMX-100,80g/L)中。将该管置于加热块中,在100℃下放置10分钟,以裂解任何结合到线的细胞。沸腾之后,(使用微量吸移管)混合样本,并抽吸20μL等分试样并将其用于重构3M分子检测系统的单独沙门氏菌属试剂片(部件号MDAS96NA,购自明尼苏达州圣保罗的3M公司(3MCompany,St.Paul,MN))。为了进行比较,使用沙门氏菌属培养物的10-3、10-4、10-5、10-6和10-7连续稀释液的20μL等分试样重构3M分子检测系统的单独沙门氏菌属试剂片。所有重构的测得物均使用3M分子检测系统器械(购自明尼苏达州圣保罗的3M公司(3MCompany,St.Paul,MN))根据制造商的说明进行处理。每次测定中是否存在可检测沙门氏菌属示于表1中。表1:检测结合到侧向流试纸的沙门氏菌属。“+”(加号)代表样本中阳性检测出沙门氏菌属微生物。“-”(减号)代表样本中未检测出沙门氏菌属微生物。结果指示用于浓缩侧向流装置的靶细胞结合区中的靶微生物的方法在靶微生物的检测中提供至少约10倍的增强。实施例1:构造侧向流样本制备装置。构造类似于图11A中所示装置的装置,不同之处在于在壳体的第一件与间隔元件之间插入一层3M双面胶带。在双面胶带上切出孔,使得孔可与第一导管和第二导管对准,从而允许液体从第一导管和第二导管流向多孔载体。间隔元件为PET膜(0.254mm厚)的条,其具有可覆盖多孔载体的足够大的开口。壳体的第一件使用PET膜(0.254mm厚)制成。钻出两个穿过第一件的孔。将反向微离心管的开口粘合(使用3MTM粘合转移带6035PC,购自明尼苏达州圣保罗的3M公司(3MCompany,St.Paul,MN))到其中一个孔,以形成第一导管。切断管的底部,以将该管反转到中空圆柱体中。将1毫升一次性塑料注射器的筒体粘合(使用3MTM粘合转移带6035PC)到另一个孔,以形成第二导管。一次性注射器的柱塞用作脱离构件。多孔载体为购自沃特曼公司(Whatman)的FUSION5TM侧向流材料的条(4mm宽)。第二件为涂覆有粘合剂(3MTM粘合转移带6035PC)的PET膜(0.254mm厚)的条,该粘合剂将第二件粘合到间隔元件。第二件具有与第二导管对准的锯齿形孔,由此使得当脱离构件被迫使穿过第二导管直至顶端接触多孔支承体时,脱离构件上的进一步压力迫使多孔载体抵靠锯齿形边缘,从而切割多孔载体的一部分并将该部分穿过锯齿形孔排出。组装好装置之后,制备每个多孔载体的靶细胞结合区。将两微升BACTRACETM抗大肠杆菌O157乳胶凝集微球(购自马里兰州盖瑟斯堡的KPL(KPL,Gaithersburg,MD))的两微升悬浮液加入500μL去离子水中,进行混合,然后添加到装置的第二导管(即,注射器筒体)中。将脱离构件(即,注射器柱塞)插入导管并慢慢压下,从而迫使微球进入多孔载体。从装置抽出柱塞,然后在真空环境中于40℃下干燥装置两小时,从而将微球固定在多孔基体中。实施例2:在制备样本和检测所述制备样本中的微生物的方法中使用侧向流样本制备装置。根据实施例1制备样本制备装置。将大肠杆菌O157(采集自血琼脂板)的菌落悬浮在巴特非尔德氏缓冲液中并在巴特非尔德氏缓冲的初始悬浮液中连续稀释(10倍稀释),以此制备细菌悬浮液。使用3M分子检测系统按照制造商的说明,分析10-2稀释液至10-6稀释液中每一种的六个20微升等分试样中是否存在大肠杆菌O157。结果示于表2中,显示从细菌悬浮液的10-2至10-5稀释液中取出的等分试样中可再现检测大肠杆菌O157。结果还显示从细菌悬浮液的10-6稀释液中取出的等分试样中无法可再现检测大肠杆菌O157。表2:在细菌悬浮液的连续稀释液中对大肠杆菌O157的存在进行检测。分子显示每种稀释液中大肠杆菌O157检测呈阳性的样本数。分母显示每种稀释液测试的样本数。将10-5、10-6和10-7连续稀释液的250微升等分试样装载到单个样本处理装置的第一导管中,该装置被构造成用于检测大肠杆菌O157,并使样本液体流过多孔载体10分钟。10分钟之后,使用脱离构件(即,柱塞)将多孔载体的靶细胞结合部分顶出每个装置。每个靶细胞结合部分被顶入到单独的反应管中。将100微升的SS2溶液加入到每个反应管中,然后将管放置在加热块上于100℃下保持10分钟以裂解结合到靶细胞结合部分的任何细胞。冷却该管之后,从反应管中取出20μL,并用来重构3M分子检测系统的大肠杆菌O157试剂片。所有重构的溶液均使用3M分子检测系统器械根据制造商的说明进行处理。每次测定中是否存在可检测大肠杆菌O157示于表3中。表3:在实施例2中测试从样本处理装置顶出的靶细胞结合部分中对大肠杆菌O157的存在的检测。“+”(加号)代表样本中阳性检测出大肠杆菌微生物。“-”(减号)代表样本中未检测出大肠杆菌微生物。测试的稀释液结果10-5+10-6+10-7-将表2中所示的结果与表3中所示的结果进行比较,指出使用本公开样本处理装置检测微生物的方法比常规检测方法更灵敏。实施例3:在包括侧向流装置中洗涤步骤的样本制备方法中使用侧向流样本制备装置。如实施例1中所述制备样本制备装置。使用靶细胞结合区的抗大肠杆菌O157乳胶凝集微球(购自KPL)制备一个装置,并使用靶细胞结合区的抗大肠杆菌O26乳胶凝集微球(购自KPL)制备另一个装置。如实施例2所述的那样分别制备并稀释大肠杆菌O157和大肠杆菌O26的无菌悬浮液。将每种细菌悬浮液的10-5稀释液的250微升等分试样加载到被构造成用于检测对应的细菌的样本处理装置中,并使样本渗透穿过多孔载体10分钟。10分钟之后,将500μL的洗涤溶剂(巴特非尔德氏缓冲液)吸移到第二导管中,并随后使用脱离构件(即,柱塞)迫使洗涤溶剂穿过多孔载体的靶细胞结合区。在洗涤溶剂通过多孔构件之后,迫使脱离构件抵靠多孔构件,直至将多孔构件的一部分(靶细胞结合区)从装置中顶出到反应管中。将100微升的SS2溶液加入到每个反应管中,然后将管放置在加热块上于100℃下保持10分钟以裂解结合到靶细胞结合部分的任何细胞。冷却该管之后,从反应管中取出20μL,并用来重构3M分子检测系统的对应试剂片(即,大肠杆菌O157试剂片或大肠杆菌O26试剂片)。所有重构的溶液均使用3M分子检测系统器械根据制造商的说明进行处理。每次测定中是否存在可检测大肠杆菌示于表4中。表4:在实施例3中测试从样本处理装置顶出的靶细胞结合部分中对大肠杆菌的存在的检测。“+”(加号)代表样本中阳性检测出大肠杆菌微生物。“-”(减号)代表样本中未检测出大肠杆菌微生物。结果指示即使在样本处理装置中原位洗涤靶细胞结合区之后,装置仍然能够检测结合到靶细胞结合区的大肠杆菌O157微生物。本文引用的所有专利、专利申请和专利公开的全部公开内容以及可供使用的电子版材料均以引用方式并入。在本专利申请的公开内容和以引用方式并入本文的任何文献的一个或多个公开内容之间存在任何矛盾的情况下,应以本专利申请的公开内容为准。上述具体实施方式和实施例仅为清楚理解本发明而给出。而不应被理解为不必要的限制。本发明不限于上述的具体细节,本领域所属技术人员可在权利要求书限定的本发明内作出各种变化。所有的标题是为了阅读者方便,而不应该用于限制该标题后面的正文的含义,除非如此规定。本文说明性地描述的本发明可在不存在本文未具体公开的任何元件的情况下进行适当地实践。因此,例如,在本文的每个实例中,术语“包括”、“基本上由......组成”和“由......组成”中的任一个可被替换为其它两个术语中的任一个。尽管将已采用的术语和表达用作描述而非限制术语,并且非旨在使用此类术语和表达而排出所示和所描述的特征或其部分的任何等同物,但是已经认识到,在所要求保护的本发明的范围内的各种修改是可能的。因此,应当理解,尽管本发明已通过优选的实施方式和任选的特征而具体公开,但是本领域的技术人员可推出本文所公开的概念的修改和变型,并且此类修改和变型被视为在由所附的权利要求所限定的本发明的范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1