等离子体特异性结合配偶体测定中的信号放大的制作方法
本申请要求2014年8月13日提交的美国临时申请号62/037,071和2014年11月20日提交的美国临时申请号62/082,468的优先权,所述申请各自以引用的方式整体并入本文中。
技术领域
本发明涉及检测样品中的目标分析物的系统和方法。具体地,本发明提供基于局部等离子体共振的分析物检测系统,其能够检测样品中的极少量目标分析物。
发明背景
当前免疫测定和生物分子结合测定通常需要多个步骤和复杂设备来执行测定。在执行此类非均相测定中所涉及的灵敏度的缺乏和复杂性由将标记的特异性结合配偶体与未标记的特异性结合配偶体分离的特定需要所引起。
已经尝试开发基于贵金属纳米颗粒的局部表面等离子体共振(LSPR)性质的测定(Tokel等,Chem Rev.,第114卷:5728–5752,2014)。LSPR为通过入射光诱导的纳米大小结构中的电子的集体振荡。金属纳米颗粒对于其最近处的折射系数变化具有强电磁反应,因此纳米颗粒的共振频率的偏移可作为结合至纳米颗粒表面的分子的指示来测量。虽然金属纳米颗粒,尤其是金纳米颗粒,在诊断测定中用于检测结合事件,此类测定总体上受到低灵敏度的影响并且不能用于定量地监测连续结合事件的动力学。
因此,需要在提供增加的灵敏度的同时使用均相格式的改进测定方法。利用标准实验室技术诸如光谱学的测定将亦为合乎需要的。
技术实现要素:
本发明部分地基于以下发现:复合金属纳米结构可增强通过分子结合至金属纳米层表面所诱导的光学信号。所观察到的放大极大地增加了检测特异性生物分子结合事件的灵敏度,以使得可检测亚皮克数量的生物分子。因此,本发明提供分析物检测装置和使用此类装置来检测样品中的极少量目标分析物的方法。
在一个实施方案中,分析物检测装置包括多个检测缀合物、含有金属纳米层的表面和多个捕获分子,其中所述捕获分子固定于所述金属纳米层上并且能够特异性结合至目标分析物。在分析物检测装置以夹心测定格式来配置的实施方案中,检测缀合物包含偶合至能够特异性结合至目标分析物的结合配偶体的复合金属纳米结构。在分析物检测装置以直接竞争测定格式来配置的实施方案中,检测缀合物包含偶合至目标分析物的复合金属纳米结构。
检测缀合物中的复合金属纳米结构总体上包含至少两种贵金属、过渡金属、碱金属、镧系元素或其组合。在一些实施方案中,复合金属纳米结构包含至少两种选自金、银、铜、铂、钯、镉、铁、镍以及锌的金属。在某些实施方案中,每种复合金属纳米结构包括第一金属的核心和第二金属的涂层。在一些实施方案中,核心可为镀金的银或铜。在其他实施方案中,第一金属的核心可在涂布之后溶解以使得产生由第二涂层金属组成的空心结构。
沉积于表面上的金属纳米层可为金属薄膜或由固定于表面上的多个金属纳米结构组成。金属纳米层也可由贵金属或过渡金属组成。在一些实施方案中,金属纳米层包含金、银、铜、铂、钯、镉、锌或其复合物。在一个实施方案中,金属纳米层包含金。在另一个实施方案中,金属纳米层包含银。仍在另一个实施方案中,金属纳米层包含用金纳米层覆盖的银纳米层。
本发明还提供使用本文所述的分析物检测装置来检测样品中的目标分析物的方法。在一个实施方案中,所述方法包括将样品与多种检测缀合物混合、将混合物与含有其上固定有多个捕获分子的金属纳米层的表面接触、将表面暴露于紫外光-可见光-红外光光谱内的波长范围下的光源;以及测量来自表面的光学信号,其中所述光学信号的变化指示样品中的目标分析物的存在。在某些实施方案中,本发明的方法能够检测样品中的毫微微克至纳克数量的目标分析物。
本发明包括测定复合物,其包含:含有偶合至结合配偶体的复合金属纳米结构的检测缀合物;目标分析物;以及其上固定有捕获分子的金属纳米层涂布珠粒,其中检测缀合物中的结合配偶体结合至目标分析物上的第一表位并且捕获分子结合至目标分析物上的第二表位,从而形成包含检测缀合物、目标分析物和捕获分子的复合物。在一些实施方案中,复合金属纳米结构为镀金的银纳米结构或镀金的铜纳米结构并且涂布在珠粒上的金属纳米层包含金。
在另一方面,本发明提供一种用于制备用于本文描述的检测装置和方法的复合金属纳米结构的方法。在一个实施方案中,所述方法包括制备包含聚合物与氯金酸的混合物的第一溶液、制备包含银或铜纳米结构的第二溶液以及将第一溶液与第二溶液孵育一段时间,其中所得混合物包含镀金的银纳米结构或镀金的铜纳米结构。在某些实施方案中,将还原剂诸如抗坏血酸添加至反应混合物以增加所产生的纳米结构的数量。在一个实施方案中,第一溶液中的聚合物为聚乙烯吡咯烷酮。在另一个实施方案中,第一溶液中的聚合物为聚乙烯醇。
附图简述
图1.牛血清白蛋白(BSA)偶合金纳米层传感器(通道1)和人IgG偶合金纳米层传感器(通道2-4)的峰波长的移位相对于采集时间的图。箭头指示未标记蛋白质A、1mM HCl或用胶体金(CGC)标记的蛋白质A的注射顺序和浓度。
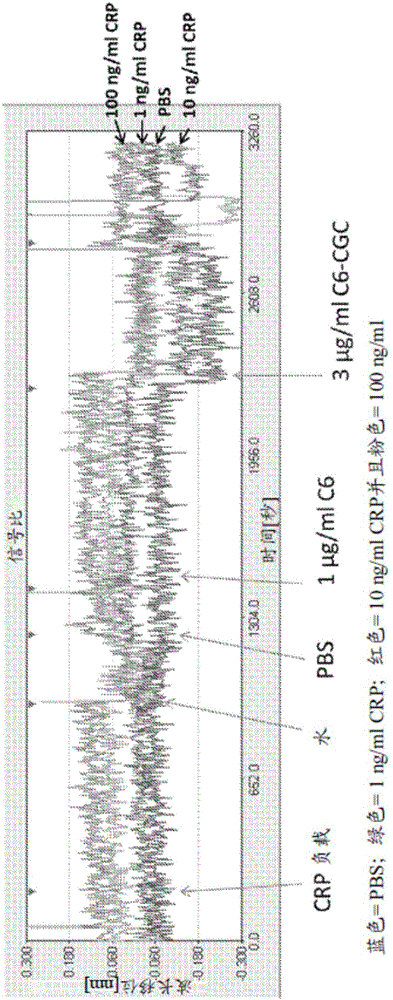
图2.抗-CRP C7抗体偶合金纳米层传感器的峰波长的移位相对于采集时间的图。箭头指示0至100ng/ml浓度的不同通道中的CRP(CRP负荷)、1μg/ml未标记抗-CRP C6抗体或3μg/ml用胶体金标记的抗-CRP C6抗体(C6-CGC)的注射顺序。当传感器表面以未标记抗-CRP C6抗体占据时,未观察到进一步C6-CGC结合。
图3.抗-CRP C7抗体偶合金纳米层传感器的峰波长的移位相对于采集时间的图。箭头指示0至100ng/ml浓度的不同通道中的CRP(CRP负荷)、1μg/ml用胶体金标记的抗-CRP C6抗体(C6-CGC)、3μg/ml C6-CGC、或1mM HCl(酸)的注射顺序。
图4A.以图3中的不同C6-CGC浓度的10ng/ml CRP负载的抗-CRP C7抗体偶合金纳米层传感器的反射光谱。
图4B.在引入用胶体金标记的3μg/ml抗-CRP C6抗体(C6-CGC)之后,使用三个浓度之一的CRP孵育的抗-CRP C7抗体偶合金纳米层传感器的峰波长的移位相对于采集时间的图。右侧的表描绘在引入C6-CGC之后700秒的峰分析。
图5.抗-CRP C7抗体偶合金纳米层传感器的峰波长的移位相对于采集时间的图。箭头指示0至100ng/ml浓度的不同通道中的CRP(CRP负荷,其具有最小化的孵育时间)、3μg/ml用胶体金标记的抗-CRP C6抗体(C6-CGC)或1mM HCl(酸)的注射顺序。
图6.在即时引入3μg/ml用胶体金标记的抗-CRP C6抗体(C6-CGC)之后,图5中的痕量的峰波长的移位相对于采集时间的图。右侧的表描绘与通过CRP孵育获得的峰移位(值展示于图4B中)相比,在引入C6-CGC之后700秒的峰分析。
图7.使用三个浓度之一的CRP和缀合至镀金的银纳米结构的C6抗-CRP抗体孵育的抗-CRP C7抗体偶合金纳米层传感器的峰波长的移位相对于采集时间的图。对照为具有固定的牛血清白蛋白(BSA)代替C7抗体的金纳米层传感器。
发明详述
本发明部分地基于以下发现:基于LSPR的测定中的显著放大可通过以复合金属纳米结构标记的结合配偶体来达成。因此,本发明提供包括以下的分析物检测装置:LSPR表面(例如含有金属纳米层的表面)、固定至金属纳米层的多个捕获分子以及包含偶合至生物分子的复合金属纳米结构的多个检测缀合物。
分析物检测装置可以夹心测定格式或直接竞争测定格式来配置。例如,在一个实施方案中,夹心测定格式的分析物检测装置包括(i)多个检测缀合物,其中缀合物包含偶合至能够特异性结合至目标分析物的结合配偶体的复合金属纳米结构,(ii)含有金属纳米层的表面,以及(iii)多个捕获分子,其中捕获分子固定于金属纳米层上并且能够特异性结合至目标分析物。在另一个实施方案中,直接竞争测定格式的分析物检测装置包括(i)多个检测缀合物,其中缀合物包含偶合至目标分析物的复合金属纳米结构,(ii)含有金属纳米层的表面,以及(iii)多个捕获分子,其中捕获分子固定于金属纳米层上并且能够特异性结合至目标分析物。
本发明的分析物检测装置包括含有金属纳米层的表面。表面可为任何合适的尺寸和形状,诸如芯片、孔、试管或珠粒。在一些实施方案中,表面为长方形芯片。在其他实施方案中,表面为圆盘。在某些实施方案中,表面为试管(例如,圆柱形或长方形试管)的底部、盖子和/或内壁。在其他实施方案中,表面为非金属颗粒的阵列。表面可由各种材料制造,所述材料包括但不限于玻璃、石英、硅、二氧化硅、聚苯乙烯、石墨、织物(例如聚乙烯织物)、丝网或膜(例如胶乳、聚乙烯、尼龙或聚酯膜)。
金属纳米层优选沉积于表面上。在一些实施方案中,金属纳米层可覆盖具体表面的整个表面区域。在其他实施方案中,金属纳米层可仅沉积于表面的一部分上。举例而言,表面可含有多个凹陷或孔并且金属纳米层沉积于凹陷或孔内。在其他实施方案中,金属纳米层可以穿过表面的多个间隔沉积物形式施加至表面。金属纳米层的光学性质可通过改变纳米层的厚度和/或纳米结构的性质来调节。在一个实施方案中,纳米层由金属纳米岛组成。在另一个实施方案中,纳米层由纳米棒组成。用于本发明装置和方法中的金属纳米层的合适厚度包括约0.5nm至约100nm、约5nm至约30nm或约3nm至约10nm。具有可用于本发明装置和方法中的金属纳米层涂层的示例性表面包括在美国专利公布号2006/0240573中所描述的表面,所述专利公布以引用的方式整体并入本文。
在某些实施方案中,金属纳米层为金属薄膜。将金属薄膜沉积于基板表面上的方法为本领域技术人员已知并且包括但不限于,原子层沉积、脉冲激光沉积、落模铸造、气相沉积以及吸附。参见,例如,Atanasov等,Journal of Physics:Conference Series 514(2014);Walters和Parkin,Journal of Materials Chemistry,19:574-590,2009;以及Gupta等,J.Appl.Phys.92,5264-5271,2002,所述文献各自以引用的方式整体并入本文。金属薄膜可包含其他组分,例如金属薄膜可为聚合物薄膜、Langmuir-Blodgett薄膜或氧化物薄膜。在一些实施方案中,金属薄膜包含两个层,其中每个层包含不同金属。举例而言,金属薄膜可包括用金层覆盖的银层。
在其他实施方案中,金属纳米层包含固定至表面的多个金属纳米结构。金属纳米结构可固定至表面,所述固定为通过用试剂处理表面材料以添加化学化学官能团,诸如氰化物、胺、硫醇、羧基、醛或马来酰亚胺,并且使金属纳米结构与所处理表面反应来实现的。已知金属纳米结构以较高亲和力结合至此类化学官能团。在一些实施方案中,包括金属纳米层的金属纳米结构为球状纳米颗粒。此类纳米颗粒具有小于约300nm、小于约200nm或小于约150nm的直径。在一些实施方案中,球状纳米颗粒具有约5nm至约200nm、约10nm至约100nm或约20nm至约60nm的直径。在某些实施方案中,用于产生金属纳米层的金属纳米结构的尺寸类似于用于检测缀合物中的复合纳米结构的尺寸。在此类实施方案中,将两组纳米结构的尺寸匹配可提供反射光谱、发射光谱或散射光谱中的最佳波长移位。
金属纳米层(金属薄膜或多个金属纳米结构)可主要由贵金属或其复合物组成。在其他实施方案中,金属纳米层(金属薄膜或多个金属纳米结构)可主要由过渡金属或其复合物组成。在某些实施方案中,金属纳米层包含选自金、银、铜、铂、钯、钌、铑、锇、铱、钛、铬、镉、锌、铁、钴、镍及其复合物的金属。在一个特定实施方案中,金属纳米层(例如金属薄膜或多个金属纳米结构)包含金。在另一个特定实施方案中,金属纳米层(例如金属薄膜或多个金属纳米结构)包含银。在某些实施方案中,金属纳米层(例如金属薄膜或多个金属纳米结构)包含金与银或金与铜的复合物。使用碱金属(例如锂、钠、钾、铷、铯以及钫)或镧系元素(例如镧、铈、镨、钕、钷、钐、铕、钆、铽、镝、钬、铒、铥、镱以及镥)可提高LSPR峰的强度。因此,在一些实施方案中,金属纳米层(金属薄膜或多个金属纳米结构)可主要由一或多种碱金属或镧系元素组成。在其他实施方案中,金属纳米层(金属薄膜或多个金属纳米结构)可主要由贵金属和碱金属或镧系元素的组合组成。
本发明的分析物检测装置还包括固定至沉积于表面上的金属纳米层的多个捕获分子。捕获分子能够特异性结合至目标分析物。如本文使用的,“特异性结合”是指以高亲和力结合至目标分子,例如,至少10-6M的亲和力。在一些实施方案中,捕获分子为半抗原和其他小分子、药物、激素、生物大分子,包括但不限于抗体或其片段(例如,Fv、Fab、(Fab)2、单链、CDR等)、抗原、受体、配体、多核苷酸、适体、多肽、多糖、脂多糖、糖肽、脂蛋白或核蛋白。在某些实施方案中,多个捕获分子为抗体。在其他实施方案中,多个捕获分子为抗原。
将分子固定至金属纳米层或纳米结构的方法为本领域技术人员已知的。此类方法包括共轭化学,诸如涉及1-乙基-3-[3-二甲胺基丙基]碳二亚胺盐酸盐(EDC)、磺基-NHS偶合、疏水性结合或硫醚化学的那些方法。在一些实施方案中,分子可经由较大载体分子或蛋白质来间接地偶合至金属纳米层或纳米结构。当分子较小,诸如为激素、药物和小于10kD的其他小分子时,此间接偶合尤其适用。优选地,载体蛋白质不能够与目标分析物特异性相互作用。
本发明的分析物检测装置还可包括多个检测缀合物。根据测定配置,检测缀合物包含偶合至能够特异性结合至目标分析物或捕获分子的结合配偶体的金属纳米结构。举例而言,在装置以夹心测定格式配置的实施方案中,检测缀合物包含偶合至或缀合至能够特异性结合目标分析物的结合配偶体的金属纳米结构。在装置以直接竞争测定格式配置的其他实施方案中,检测缀合物包含偶合至或缀合至目标分析物的金属纳米结构。
结合配偶体可为与捕获分子相同类型的分子,包括但不限于半抗原和其他小分子、药物、激素、生物大分子,诸如抗体或其片段(例如,Fv、Fab、(Fab)2、单链、CDR等)、抗原、受体、配体、多核苷酸、适体、多肽、多糖、脂多糖、糖肽、脂蛋白或核蛋白。在一些实施方案中,结合配偶体为与捕获分子相同类型的分子,但是优选在不同于捕获分子的结合部位的位置处结合至目标分析物。举例而言,结合配偶体和捕获分子可均为识别目标分析物的抗体,但是结合配偶体结合目标分析物的表位与捕获分子结合目标分析物的表位分开并且理想地不重叠。因此,在某些实施方案中,结合配偶体为识别目标分析物的第一表位的抗体并且捕获分子为识别目标分析物的第二表位的不同抗体。
检测缀合物中的金属纳米结构可主要由贵金属或其复合物组成。在一些实施方案中,检测缀合物中的金属纳米结构可主要由过渡金属或其复合物组成。在一些实施方案中,检测缀合物中的金属纳米结构可包含碱金属或镧系元素以及贵金属或过渡金属。在某些实施方案中,检测缀合物中的金属纳米结构包含选自金、银、铜、铂、钯、钌、铑、锇、铱、钛、铬、镉、锌、铁、钴、镍及其复合物的金属。在一个实施方案中,金属纳米结构为金纳米结构。在另一个实施方案中,金属纳米结构为银纳米结构。
在优选实施方案中,检测缀合物中的金属纳米结构为复合金属纳米结构。“复合金属纳米结构”是指包含至少两种贵金属、过渡金属、碱金属或镧系元素的纳米结构。两种或更多种金属可混合在一起,如在合金中,或两种或更多种金属可存在于纳米结构的单独部分中。举例而言,一种金属可形成纳米结构的核心,而第二金属形成纳米结构的外壳层或涂层。在一些实施方案中,复合金属纳米结构包含至少两种选自金、银、铜、铂、钯、钌、铑、锇、铱、钛、铬、镉、锌、铁、钴及镍的金属。在其他实施方案中,复合金属纳米结构包含至少两种选自金、银、铜、铂、钯、镉、铁、镍及锌的金属。在一个特定实施方案中,复合金属纳米结构包含金和银。在另一个实施方案中,复合金属纳米结构包含金和铜。在另一个实施方案中,复合金属纳米结构包含银和铜。
在一些实施方案中,每种复合金属纳米结构为第一金属与第二金属的合金。在某些实施方案中,每种复合金属纳米结构包含第一金属的核心和第二金属的涂层。在一个实施方案中,核心为银并且涂层为金。在另一个实施方案中,核心为铜并且涂层为金。在另一个实施方案中,核心为银并且涂层为铜。在一些实施方案中,每种复合金属纳米结构包含电介质核心(例如二氧化硅、硫化金、二氧化钛、二氧化硅及聚苯乙烯),第一金属的第一涂层和第二金属的第二涂层。在一个特定实施方案中,核心为二氧化硅,第一涂层(即内涂层)为镀银层,并且第二涂层为镀金层(即外涂层)。在另一个实施方案中,核心为二氧化硅,第一涂层(即内涂层)为镀铜层,并且第二涂层为镀金层(即外涂层)。
在一些实施方案中,在使用第二金属的涂布过程之后,将包含第一金属的核心溶解以形成由第二金属组成的空心结构。例如,银核心用金纳米颗粒涂布产生银核心周围的金外壳并且银核心随后溶解或降解,导致形成中空纳米金壳层结构。
金属纳米结构包括球状纳米颗粒以及纳米片和纳米壳。纳米片具有大于其厚度的横向尺寸(例如边缘长度)。纳米片包括纳米盘、纳米多边形、纳米六边形、纳米立方体、纳米环、纳米星形以及纳米棱柱体。在一些实施方案中,金属纳米结构,包括复合纳米结构,具有选自以下的几何结构;球状纳米颗粒、锥体纳米颗粒、六边形纳米颗粒、纳米管、纳米壳、纳米棒、纳米点、纳米岛、纳米线、纳米盘、纳米立方体或其组合。其他形状也为可能的,包括不规则形状。在某些实施方案中,金属纳米结构的尺寸和形状为不均匀的–即金属纳米结构为不同形状和尺寸的纳米结构的非均匀混合物。
对于球状纳米颗粒,合适直径范围包括约5nm至约200nm、约10nm至约100nm和约20nm至约60nm。对于纳米片,边缘长度可为约10nm至约800nm、约20nm至约500nm、约50nm至约200nm、约30nm至约100nm或约10nm至约300nm。纳米片的厚度范围可为约1至约100nm、约5nm至约80nm、约10nm至约50nm或约5nm至约20nm。
在一些实施方案中,纳米片具有大于2的纵横比。纵横比为边缘长度与厚度的比率。优选地,纳米片具有约2至约25、约3至约20、约5至约10、约2至约15或约10至约30的纵横比。
结合配偶体或目标分析物可使用与以上对于将捕获分子固定至金属纳米层所述类似的方法来偶合至或缀合至金属纳米结构(例如复合纳米结构)。此类方法包括但不限于,EDC共轭化学、磺基-NHS偶合、疏水性结合或硫醚化学。结合配偶体或目标分析物可经由各种化学官能团来偶合至金属纳米结构,所述化学官能团包括硫醇、胺、二硫醇、丙烯酸亚磷酰胺、迭氮化物或炔。
在一些实施方案中,用于沉积于表面上的金属纳米层中的一种或多种金属可与制造检测缀合物中的金属纳米结构的一种或多种金属相同。举例而言,在一个实施方案中,沉积于表面上的金属纳米层包括金薄膜或多个金纳米结构并且检测缀合物包含金纳米结构。在其他实施方案中,用于沉积于表面上的金属纳米层的金属不同于用于产生检测缀合物中的金属纳米结构的一种或多种金属。例如,在一些实施方案中,沉积于表面上的金属纳米层包括银薄膜或多个银纳米结构并且检测缀合物包含金纳米结构。在其他实施方案中,沉积于表面上的金属纳米层包括金薄膜或多个金纳米结构并且检测缀合物包含银纳米结构。在某些实施方案中,沉积于表面上的金属纳米层包括金薄膜或多个金纳米结构并且检测缀合物包含复合纳米结构。在相关实施方案中,复合纳米结构包含镀金的银纳米结构。在其他具体实施方案中,沉积于表面上的金属纳米层包括金薄膜或多个金纳米结构并且检测缀合物包含复合纳米结构,包括镀金的铜纳米结构。在其他实施方案中,沉积于表面上的金属纳米层包括金薄膜或多个金纳米结构并且检测缀合物包含复合纳米结构,包括镀金的磁石纳米结构。在其他实施方案中,沉积于表面上的金属纳米层包括金薄膜或多个金纳米结构并且检测缀合物包含复合纳米结构,包括金和碱金属或镧系元素。
本发明还包括包含如本文所公开的本发明的分析物检测装置的试剂盒。在一个实施方案中,试剂盒包含(i)含有其上固定有多个捕获分子的金属纳米层的表面和(ii)包含如本文描述的多个检测缀合物的组合物。在某些实施方案中,组合物与表面分开地封装以使得它可随后在执行检测方法期间与表面接触。在一些实施方案中,将包含多个检测缀合物的组合物冻干,例如,呈球团或珠粒形式。在相关实施方案中,含有金属纳米层的表面可为芯片、圆盘或试管。在一个特定实施方案中,含有金属纳米层的表面为适合与离心转子一起使用的试管。在此类实施方案中,金属纳米层可沉积于试管的盖子、底部和/或壁上。
在某些实施方案中,本文所述分析物检测系统的所有组分包含于离心转子或圆盘内。例如,转子或圆盘可含有一个或多个反应腔室,其中定位含有固定捕获分子和多个检测缀合物的金属纳米层表面。在一个实施方案中,金属纳米层表面为定位于反应腔室的底部的芯片。在另一个实施方案中,金属纳米层直接沉积于反应腔室的底板上。在又另一个实施方案中,金属纳米层表面为以金属纳米层涂布的珠粒(例如塑料珠粒)。在所有此类实施方案中,捕获分子固定至金属纳米层表面。在相关实施方案中,多个检测缀合物以冻干组合物,诸如冻干珠粒或球团形式存在。
在替代性实施方案中,捕获分子缀合至金属纳米结构,所述金属纳米结构呈胶体悬浮体形式。将多个检测缀合物添加至在测试样品存在下的悬浮液。如果目标分析物存在于样品中,在检测缀合物与含有捕获分子的悬浮纳米结构之间发生复合物形成,从而引起光学信号变化(例如,悬浮纳米结构的峰吸光率波长的移位)。
因此,在一些实施方案中,试剂盒包含具有一个或多个反应腔室的转子或圆盘,其中每个反应腔室包含(i)含有如本文描述的多个检测缀合物的冻干组合物和(ii)以金属纳米层涂布的颗粒,其中多个捕获分子固定至金属纳米层。此类试剂盒提供一步式分析物检测方法,由此测试样品与转子或圆盘接触,并且将离心力施加至转子或圆盘将测试样品递送至反应腔室,其中样品与多个检测缀合物和含有固定捕获分子的金属纳米层涂布珠粒混合。在转子或圆盘含有超过一个反应腔室的实施方案中,可选择检测缀合物和捕获分子以使得可在每个反应腔室中检测不同分析物。如果转子包含多个反应腔室,这些转子格式检测装置可以夹心测定格式、直接竞争格式或两者来配置。
本文论述的任何类型金属纳米层或金属纳米结构可与这些转子格式检测装置一起使用。在一些实施方案中,涂布在珠粒上的金属纳米层为金纳米层并且检测缀合物中的金属纳米结构为金纳米结构。在其他实施方案中,涂布在珠粒上的金属纳米层为银纳米层并且检测缀合物中的金属纳米结构为金纳米结构。在其他实施方案中,涂布在颗粒上的金属纳米层为金纳米层并且检测缀合物中的金属纳米结构为银纳米结构。在一个实施方案中,涂布在颗粒上的金属纳米层为用金纳米层覆盖的银纳米层并且检测缀合物中的金属纳米结构为金纳米结构。在某些实施方案中,涂布在珠粒上的金属纳米层为金纳米层并且检测缀合物中的金属纳米结构为复合纳米结构。例如,在一个实施方案中,复合纳米结构为镀金的银纳米结构。在另一个实施方案中,复合纳米结构为镀金的铜纳米结构。
本发明的试剂盒还可包括用于使用装置检测测试样品中的分析物的说明书、用于收集生物样品的装置或工具和/或用于从固体材料诸如土壤、食物和生物组织中获得样品的提取缓冲液。
本发明还提供检测在样品中的目标分析物的方法。在一个实施方案中,方法包括:(i)将测试样品与如本文描述的多个检测缀合物混合;(ii)使所述混合物与含有金属纳米层的表面接触,其中如本文描述的多个捕获分子固定至金属纳米层;(iii)将表面暴露于紫外光-可见光-红外光光谱内的波长范围下的光源;以及(iv)测量来自表面的光学信号,其中光学信号的变化指示样品中的目标分析物的存在。
在一些实施方案中,检测方法为夹心测定。在此类实施方案中,检测缀合物包含偶合至结合配偶体的金属纳米结构,所述结合配偶体能够特异性结合至存在于样品中的目标分析物以形成分析物-检测缀合物复合物。固定至金属纳米层表面的多个捕获分子还能够特异性结合至存在于样品中的目标分析物。将金属纳米层暴露于光源并且测量光学信号,其中光学信号的变化指示样品中的分析物的存在。经由说明,当含有目标分析物的样品与多个检测缀合物混合时,目标分析物结合至检测缀合物中的结合配偶体以形成分析物-检测缀合物复合物。这些复合物进而结合至经由分析物固定至金属纳米层表面的多个捕获分子,从而使检测缀合物中的金属纳米结构紧邻金属纳米层表面。通过金属纳米层表面吸收或散射的光的量受到复合物中的金属纳米结构的接近性影响,因而产生峰吸收波长的增强移位,从而指示样品中的目标分析物的存在。
在其他实施方案中,检测方法为竞争性测定。在此类实施方案中,检测缀合物包含偶合至所关注目标分析物的金属纳米结构。如在夹心测定方法中,固定至金属纳米层表面的多个捕获分子能够特异性结合至目标分析物。在此类型的测定中,检测缀合物最初将结合至捕获分子。如果含有目标分析物的样品与此类初始复合物混合,则样品中的未标记或游离目标分析物将与检测缀合物竞争以结合至捕获分子。此类型的测定中的光学信号的变化将由于检测缀合物中的金属纳米结构自金属纳米层表面的位移产生,从而成比例地减少峰吸收波长的波长移位。
测试样品可为任何类型液体样品,包括生物样品或由环境或食物样品制备的提取物。在一个特定实施方案中,测试样品为生物样品。生物样品包括但不限于,全血、血浆、血清、唾液、尿液、胸膜腔积液、汗液、胆液、脑脊液、粪便、阴道流体、精子、眼晶状体液、黏液、滑液、腹膜液、羊水、活检组织、唾液以及细胞裂解物。生物样品可从怀疑患有疾病病状,诸如癌症、传染病(例如,病毒、细菌、寄生虫或真菌感染)、心血管疾病、代谢疾病、自身免疫疾病等的人受试者或动物受试者获得。生物样品也可从经历常规医学检查的健康受试者(例如人类或动物)获得。
在所述方法的一些实施方案中,将测试样品与多个检测缀合物混合并且随后使得混合物与含有固定捕获分子的金属纳米层表面接触。在其他实施方案中,使测试样品与含有固定捕获分子的金属纳米层表面接触并且随后添加多个检测缀合物。在某些实施方案中,使得样品、多个检测缀合物与含有固定捕获分子的金属纳米层表面同时接触。例如,使样品与两种试剂同时接触可在如上所述的转子格式检测装置中发生。
如上所述的任何分析物检测装置可用于本发明的检测方法中。因此,本文所述的各种金属纳米层表面、捕获分子和检测缀合物适用于检测方法中。例如,在所述方法的一些实施方案中,含有金属纳米层的表面为芯片、孔、试管或珠粒。在所述方法的某些实施方案中,含有金属纳米层的表面为并入或适合与离心转子一起使用的试管的壁和底部。在这些和其他实施方案中,表面上的金属纳米层为金属薄膜,如金薄膜。在所述方法的其他实施方案中,表面上的金属纳米层包含固定于表面上的多个金属纳米结构,如金纳米结构。
在检测方法的某些实施方案中,检测缀合物包含偶合至结合配偶体或目标分析物的复合金属纳米结构。如本文描述,复合金属纳米结构包含至少两种贵金属或过渡金属。在所述方法的一些实施方案中,复合金属纳米结构包含至少两种选自金、银、铜、铂、钯、钌、铑、锇、铱、钛、铬、镉、锌、铁、钴及镍的金属。在所述方法的其他实施方案中,复合金属纳米结构包含至少两种选自金、银、铜、铂、钯、镉、铁、镍及锌的金属。在一个特定实施方案中,复合金属纳米结构包含金和银。在另一个实施方案中,复合金属纳米结构包含金和铜。在另一个实施方案中,复合金属纳米结构包含银和铜。用于本发明方法中的复合金属纳米结构可包括许多不同的几何形状,诸如球状纳米颗粒、锥体纳米颗粒、六边形纳米颗粒、纳米管、纳米壳、纳米棒、纳米点、纳米岛、纳米线、纳米盘、纳米立方体或其组合。
在某些实施方案中,用于本发明方法中的复合金属纳米结构为第一金属与第二金属的合金。在一些实施方案中,用于本发明方法中的复合金属纳米结构包含第一金属的核心和第二金属的涂层。在具体实施方案中,复合金属纳米结构包含银核心和镀金层。在其他实施方案中,复合金属纳米结构包含铜核心和镀金层。在另一个实施方案中,核心为银并且涂层为铜。在一些实施方案中,每种复合金属纳米结构包含电介质核心(例如二氧化硅、硫化金、二氧化钛、二氧化硅和聚苯乙烯)、第一金属的第一涂层和第二金属的第二涂层。在检测方法的一个特定实施方案中,核心为二氧化硅,第一涂层(即内涂层)为镀银层,并且第二涂层为镀金层(即外涂层)。在另一个实施方案中,核心为二氧化硅,第一涂层(即内涂层)为镀铜层,并且第二涂层为镀金层(即外涂层)。
本发明检测方法可用于测定目标分析物的定性或定量的量。此类方法尤其适用于测定样品中的目标分析物的近似量,其尤其可用于诊断某些医学病状或评估药物疗法的功效。在一个实施方案中,可测定目标分析物的数量,方法是通过如本文对于具有已知量目标分析物的样品所描述地测量来自金属纳米层表面的光学信号的变化来建立具体分析物的校准曲线;测定测试样品的光学信号变化;并且将测试样品的光学信号变化与对于校准曲线获得的值比较。在一些实施方案中,测定第一试剂与第二试剂之间的复合物的数量包括将来自测试样品的吸光率和/或反应速率与来自具有已知量复合物的一个样品的吸光率和/或反应速率比较,从而测定测试样品中的复合物的数量。自测试样品获得的定量值可与预先确定的临界值比较,其中所述预先确定的临界值指示目标分析物的异常或正常水准。
本发明的检测方法提供一种用于检测样品中的极少量目标分析物的高度灵敏技术。如通过工作实例展示,来自金纳米层表面的基于等离子体共振的信号的放大可使用金纳米结构缀合物达成,以使得可检测样品中的纳克数量的目标分析物。因此,在所述方法的一个实施方案中,检测到纳克数量的目标分析物的存在。发明人意外地发现来自金纳米层表面的基于等离子体共振的信号的显著更大放大可使用复合金属纳米结构缀合物来达成。使用缀合至分析物特异性抗体的镀金的银纳米结构使得能够检测皮克数量的目标分析物,与使用金纳米结构缀合物获得的数量相比,灵敏度增加1000倍。参见实施例3。因此,在所述方法的一些实施方案中,检测皮克数量的目标分析物的存在。在所述方法的其他实施方案中,检测毫微微克数量的目标分析物的存在。更大灵敏度可通过改变复合金属纳米结构和/或金属纳米层表面的组成和/或形状来获得。
当入射光施加于金属纳米结构,金属中的导带电子在入射电磁波的相同频率下共同地振荡。由于此类共振振荡,纳米结构强烈吸收并散射特定波长范围的光。对于包含贵金属或过渡金属的金属纳米结构,此波长范围为在紫外光-可见光-红外光光谱中,这取决于纳米结构的具体组成。因此,施加适用于本发明方法的电磁能的光源可包括可施加紫外光-可见光光谱或紫外光-可见光-红外光光谱内的波长范围的任何来源,包括弧光灯和激光。在一些实施方案中,光源可装备单色器以使得特定波长的光可施加于金属纳米层表面。
金属纳米层和纳米结构的光学性质取决于其尺寸、形状和组成。例如,固体金纳米颗粒具有约515nm至约560nm的吸收峰波长(λ最大),这取决于粒径。具有30nm直径的金球状纳米颗粒在约520nm下最大吸收,并且随着粒径增加,λ最大移位至更长波长。银和铜颗粒在紫外光/蓝光或红光区域(例如,约350nm至约500nm)中具有λ最大,并且增加的粒径导致λ最大移位至更长波长。金属纳米棒具有横向λ最大1和纵向λ最大2。不同金属的合金通常展现出构成金属的吸收峰之间的中间范围内的吸收峰。举例而言,包含金与银的50/50合金的纳米结构展现约470nm的λ最大,并且金的量逐渐增加导致吸收峰移位至更长波长。LSPR信号对于局部媒介折射系数的变化的灵敏度可通过改变纳米结构的形状或几何结构来调节。例如,与球相比,非球形颗粒(例如纳米棱柱体、纳米棒、纳米壳等)具有增加的LSPR灵敏度。在一些实施方案中,光学性质(例如在具体波长下的吸收/散射)通过改变沉积于表面上的金属纳米层或用于检测缀合物中的金属纳米结构的尺寸、形状或组成来针对具体应用加以定制。
入射光与金属纳米层表面之间的相互作用可作为反射光或透射光来监测。吸收或散射的入射光的量可作为反射模式中的吸收光谱或透射模式中的吸收光谱来测量。在一些实施方案中,由金属纳米层测量的光学信号可为光学反射、吸收光谱、散射光谱和/或发射光谱。
由结合配偶体、目标分析物与捕获分子之间的复合物形成所导致的金属纳米层与检测缀合物中的金属纳米结构之间的等离子体偶合产生了金属纳米层的局部表面等离子体共振光谱的变化。例如,此类变化可包括增加的光学消光、增加的光学反射和/或增加的散射和/或发射信号。在一些实施方案中,指示样品中的目标分析物的存在的光学信号的变化包括光学散射的移位、增加或减少或这些特征的组合。在某些实施方案中,指示样品中的目标分析物的存在的光学信号的变化为光谱峰波长移位。在一个实施方案中,光学光谱峰的波长移位可为200nm至1200nm光谱窗内的红移(例如,移位至更长波长)。在另一个实施方案中,光学光谱峰的波长移位可为200nm至1200nm光谱窗内的蓝移(例如,移位至更短波长)。光学信号的变化可在设定反应期之后的具体时间点测量。另外或可选地,可测量在反应期内的光学信号的变化(例如速率测定)。两种类型测量可用于目标分析物的定性或定量分析。
用于测量不同波长的光学信号并获得消光、散射或发射光谱的各种方法在本领域中为已知的。任何分光光度仪器或光度仪器适用于所公开的方法。一些非限制性实例包括板读出器、Cobas Fara分析器以及Piccolo和Vetscan分析器(Abaxis,Inc.,Union City,CA)、光纤读出器(例如,LightPathTM S4(LamdaGen,Menlo Park,CA))、SPR仪器(例如,可自GE Healthcare获得的Biacore仪器)、来自Olympus,Hitachi的离心分析器等。
本发明还包括一种测定复合物,其包含(i)含有偶合至结合配偶体的复合金属纳米结构的检测缀合物、(ii)目标分析物和(iii)其上固定有捕获分子的金属纳米层涂布珠粒,其中检测缀合物中的结合配偶体结合至目标分析物上的第一表位并且捕获分子结合至目标分析物上的第二表位,从而形成包含检测缀合物、目标分析物和捕获分子的复合物。在一些实施方案中,测定复合物包含在适合与离心转子一起使用的试管中。在其他实施方案中,测定复合物包含在离心转子或圆盘中的反应腔室内。
测定复合物中的结合配偶体和捕获分子可为如上所述的任何类型的分子,包括半抗原和其他小分子、药物、激素、生物大分子,诸如抗体或其片段(例如,Fv、Fab、(Fab)2、单链、CDR等)、抗原、受体、配体、多核苷酸、适体、多肽、多糖、脂多糖、糖肽、脂蛋白、或核蛋白。在一个实施方案中,结合配偶体为抗体并且捕获分子为不同抗体。
以上详细描述了金属纳米层和复合金属纳米结构。在一个实施方案中,涂布珠粒(例如塑料或玻璃珠粒)的金属纳米层为金纳米层。在另一个实施方案中,涂布珠粒的金属纳米层为银纳米层。所述珠粒优选小于0.5cm,但是大于0.1mm。在某些实施方案中,复合金属纳米结构为镀金的银纳米结构。在其他实施方案中,复合金属纳米结构为镀金的铜纳米结构。在其他实施方案中,金属纳米结构包含用银离子、铜离子或这两种离子掺杂的金。
任何类型的目标分析物可使用本发明的方法、装置和测定复合物来检测,尤其为有效诊断疾病的那些方法、装置和测定复合物。目标分析物可包括但是不限于蛋白质、酶、抗原、抗体、肽、核酸(RNA、DNA、mRNA、miRNA)、激素、糖蛋白、多糖、毒素、病毒、病毒粒子、药物分子、半抗原或化学品。在一些实施方案中,目标分析物为与人和/或动物的传染病相关的标记或抗原。在其他实施方案中,目标分析物为与具体生理状态或病理病状相关的标记或抗原。
在某些实施方案中,目标分析物为致病抗原或致病抗原的抗体。例如,致病抗原可为病毒抗原(例如,猫白血病病毒、犬细小病毒、口蹄疫病毒、流感病毒、a型、b型、c型肝炎病毒、HIV病毒、人乳头瘤病毒、爱泼斯坦-巴尔病毒、狂犬病病毒等)、细菌抗原(例如,埃立克体属、疏螺旋体属、无形体属、炭疽、沙门氏菌、杆菌等)、真菌抗原、或寄生虫抗原(例如,犬心丝虫、梨形鞭毛虫、恶性疟原虫、非洲锥虫、布氏锥虫等)。在其他实施方案中,目标分析物为疾病相关抗原或疾病相关抗原的抗体。疾病相关抗原包括但不限于癌症相关抗原或标记(例如,PSA、AFP、CA125、CA15-3、CA19-9、CEA、NY-ESO-1、MUC1、GM3、GD2、ERBB2等)、心血管疾病相关抗原或标记(例如,肌钙蛋白、C-反应蛋白、脑钠肽、CKMB、脂肪酸结合蛋白等)、代谢相关抗原或标记(例如,促甲状腺激素、甲状腺素、瘦蛋白、胰岛素)或自身免疫疾病相关抗原或标记(例如,自身抗体)。在某些实施方案中,目标分析物为炎症抗原或标记(例如,C-反应蛋白、MRP14、MRP8、25F9等)。在其他实施方案中,目标分析物为妊娠相关抗原或标记(例如,胎儿抗原、人绒毛膜促性腺素)。
本发明还提供一种用于制备复合金属纳米结构的方法。在一个实施方案中,所述方法包含制备包含聚合物与氯金酸的混合物的第一溶液、制备包含银或铜纳米结构的第二溶液以及将第一溶液与第二溶液一起孵育一段时间,其中所得混合物包含镀金的银纳米结构或镀金的铜纳米结构。所得混合物优选具有约515nm至约670nm或约520nm至约560nm的峰吸光率。在一个实施方案中,所得混合物具有约530nm的峰吸光率。
用于制备第一溶液的聚合物可为以下中的任一种:聚乙烯吡咯烷酮、聚乙烯醇、聚丙烯酸酯、聚乙二醇、聚乙烯亚胺、聚天冬氨酸、聚谷氨酸、各种树胶、明胶或包含任何前述物质的混合聚合物。在一个特定实施方案中,聚合物为聚乙烯吡咯烷酮。不同类型的涂布纳米结构可通过改变聚合物的分子量来获得。聚合物的合适分子量范围包括约5,000道尔顿至约150,000道尔顿、约10,000道尔顿至约100,000道尔顿、约20,000道尔顿至约80,000道尔顿。在一些实施方案中,聚合物具有小于50,000道尔顿的分子量。在其他实施方案中,聚合物具有小于20,000道尔顿的分子量。在某些实施方案中,聚合物具有约10,000道尔顿的分子量。
镀金层的特征可通过调整聚合物与氯金酸的浓度比来控制。例如,聚合物与氯金酸的浓度比为约100:1至约1:100、约2:1至约5:1或约1.5:1至约8:1。在一些实施方案中,聚合物与氯金酸的浓度比为1:1。聚合物的合适浓度包括但不限于水或乙醇中的约0.1%至约20%湿重。氯金酸的合适浓度包括但不限于约0.001M至约1.0M、约0.010M至约0.500M和约0.050M至约0.100M。
涂层效率和厚度也可受到涂布溶液(即第一溶液)的pH和卤化物含量影响。在某些实施方案中,溶液的pH保持在约3至约14的范围内。在一些实施方案中,溶液的卤化物含量小于150mM。在其他实施方案中,溶液的卤化物含量在约0至约50mM范围内。
制备银和铜纳米结构的溶液的方法为本领域技术人员已知的。例如,包含银或铜纳米结构的第二溶液可通过美国专利公布号2012/0101007、美国专利公布号2014/0105982或美国专利公布号2013/0230717描述的任何方法来制备,所述专利各自以引用的方式整体并入本文。在一个实施方案中,包含银或铜纳米结构的第二溶液通过将银源或铜源与还原剂混合来制备。合适银源包括银盐,诸如硝酸银。合适铜源包括硫酸铜(II)、氯化铜(II)、氢氧化铜(II)和硝酸铜(II)、乙酸铜(II)和三氟乙酸铜(II)。可与银源或铜源反应以形成纳米结构的还原剂可包括葡萄糖、抗坏血酸、硼氢化钠以及聚合物诸如PVP的碱性溶液(例如pH大于7.5)。在某些实施方案中,还原剂为抗坏血酸。银纳米结构或铜纳米结构的所需形状和光学光谱峰可通过调整反应物的比率或浓度来实现,如普通本领域技术人员已知的。仅举例而言,高浓度的还原剂可产生五角形和双锥形纳米结构,而低浓度的还原剂可产生细长纳米线或管。根据纳米结构的具体形状,包含银或铜纳米结构的第二溶液可具有约550nm至约1000nm、约600nm至约700nm、约630nm至约680nm、约750nm至约850nm、约900nm至约940nm、约580nm至约620nm或约550nm至约750nm的峰吸光率。在某些实施方案中,包含银纳米结构的第二溶液具有约600nm(即595nm至605nm,包括端点)的峰吸光率。在一些实施方案中,包含铜纳米结构的第二溶液具有约585nm(即580nm至590nm,包括端点)的峰吸光率。在一些实施方案中,与包含类似尺寸和形状的银纳米结构的溶液的峰吸光率相比,包含铜纳米结构的溶液的峰吸光率更大(即红移)。
在一些实施方案中,第一溶液与第二溶液的孵育期为至少12小时。在其他实施方案中,第一溶液与第二溶液的孵育期大于24小时,优选大于48小时,更优选至少72小时。反应混合物的峰吸光率的变化可在孵育期期间监测以相应地调整孵育时间。举例而言,峰吸光率移位至较短波长,例如在520nm至550nm区域内,可指示镀金的纳米结构已经稳定。在某些实施方案中,所得纳米结构对于氯化钠(例如,0.25-1M)的稳定性用于指示纳米结构的适当涂层。
在某些实施方案中,本发明提供合成具有大于约50/mL的光学密度的纳米结构的方法。在一个实施方案中,所述方法包括将如本文描述的聚合物与氯金酸混合、将混合物在设定温度下搅拌第一时段、将抗坏血酸添加至混合物以及将混合物孵育第二时段。纳米结构的尺寸和形状通过聚合物与氯金酸的浓度比以及孵育温度和时间来决定。聚合物和氯金酸的浓度可在如上所述范围内。温度可基于所需纳米结构的尺寸和形状来调节,但是可在约4℃至约100℃范围内。类似地,孵育期(即第一时段)可基于纳米结构的所需性质来调节,但是可在约15分钟至一天范围内。
在一些实施方案中,在第一孵育期之后,将约0.1至1份的抗坏血酸(例如约1至5M)添加至混合物。添加抗坏血酸之后的第二孵育期可为约1至约24小时。不受理论约束,添加抗坏血酸使得所产生纳米结构的数量大幅度增加。
在某些实施方案中,所述方法还包括将混合物添加或掺杂约1至约100份的氯化金(例如约0.001M至1M)或硝酸银(例如约0.001M至1M)或其他金属(例如贵金属、过渡金属、碱金属或镧系元素)。此掺杂步骤可进一步增加所得纳米结构的共振强度。在一些实施方案中,在将抗坏血酸添加至反应之前,将氯化金、硝酸银或其他金属添加至混合物。在其他实施方案中,在添加抗坏血酸之后,将氯化金、硝酸银或其他金属添加至混合物。金属和抗坏血酸的添加顺序可调节以将所得纳米结构定制为所需形状和尺寸。
本发明通过不应视为限制的以下额外实施例来进一步说明。然而,根据本公开,本领域技术人员应了解可在不脱离本发明的精神和范围的情况下对所公开的具体实施方案进行许多改变并且仍获得相似或类似的结果。
在整个本公开中提及的所有专利和非专利文件出于所有目的以引用的方式整体并入。
实施例
实施例1.金纳米颗粒缀合分析物的LSPR信号的放大
通过提供其上沉积有金纳米层薄膜的塑料芯片来制备分析物检测系统。将人IgG蛋白质(100μg/ml)固定至金纳米层薄膜以产生传感器表面。通过将牛血清白蛋白固定至金纳米层薄膜来构建控制传感器。将两种类型的传感器表面定位于装备有发光和集光纤维的仪器内,所述纤维将光照在金纳米层表面上并且收集自表面反射回来的光。
使含有游离蛋白质A(10μg/ml)的样品与两种类型传感器表面接触并且测量反射光谱的变化。如图1所示出,将游离蛋白质A引入到含有固定人IgG的传感器并不产生金纳米层薄膜的反射光谱的显著可见变化,如通过峰波长的移位所测量的。
通过用1mM盐酸处理来再生传感器表面并且将含有两种不同浓度(3.5μg/ml和0.175μg/ml)的缀合至胶体金纳米颗粒(CGC)的蛋白质A的样品与传感器表面接触。当蛋白质A(即目标分析物)缀合至胶体金纳米颗粒时,金纳米层表面的反射光谱的变化加剧。确切地说,与10μg/ml未标记蛋白质A相比,3.5μg/ml蛋白质A-CGC产生更大的峰波长移位。参见图1,传感器2。等离子体共振信号的放大足够大到使得能够检测纳克浓度的蛋白质A-CGC。参见图1,传感器3。BSA传感器的反射光谱的变化代表蛋白质A分子非特异性结合至传感器表面并且与蛋白质A分子特异性结合至固定IgG分子所诱导的变化相比,显著更小。
此初始实验的结果表明由金属纳米层表面处的结合事件所诱导的局部化表面等离子体共振信号的变化的显著放大可通过将目标分析物偶合至胶体金纳米颗粒来达成。对于所检测的纳克数量的分析物,观察到灵敏度提高将近60倍。
实施例2.夹心测定中的LSPR信号的放大
此实施例描述一系列实验,其被设计来评估使用金纳米颗粒缀合物的局部化表面等离子体共振信号的放大是否也可在目标分析物不直接缀合至金纳米颗粒的夹心测定格式中达成。金纳米层芯片表面如实施例1描述来制备。将针对C-反应蛋白(CRP)(100μg/ml)的C7抗体固定至沉积于芯片表面上的金纳米层薄膜以产生抗-CRP传感器。将识别与C7抗体相比有所不同的非重叠CRP表位的C6抗体缀合至胶体金纳米颗粒(C6-CGC),以用于一些实验或以未标记形式用于其他实验。
在第一系列实验中,将含有三种不同浓度的CRP(1ng/ml、10ng/ml或100ng/ml)的样品与抗-CRP传感器一起孵育15至20分钟并且监测金纳米层的反射光谱的变化。如图2所示,在CRP结合至传感器表面上的固定C7抗-CRP抗体后,观察到极小峰移位。随后传感器表面暴露至未标记C6抗-CRP抗体(1μg/ml)并未导致显著进一步峰移位。参见图2。类似地,随后传感器表面暴露至3μg/ml的C6-CGC并不产生反射光谱的任何进一步变化,指示结合CRP分子可能以未标记C6抗体饱和。参见图2。
在第二系列实验中,将含有三种不同浓度的CRP(1ng/ml、10ng/ml或100ng/ml)的样品与抗-CRP传感器一起孵育15至20分钟。随后引入两种不同浓度的C6-CGC(1μg/ml和3μg/ml)并且测量反射光谱的变化(图3和图4A)。结果表明与未标记C6抗体相比,使C6抗-CRP抗体缀合至金纳米颗粒会放大峰波长移位。增加C6-CGC的浓度产生峰波长的剂量依赖性移位。然而,1ng/ml与10ng/ml之间的信号差异较小(图4B)。
在第三系列实验中,评估分析物孵育时间对于信号显现的效应。将抗-CRP传感器与含有0ng/ml、10ng/ml或100ng/ml CRP的样品接触并且立即引入3μg/ml C6-CGC而无任何分析物孵育时间或洗涤。如图5和图6所示,较短分析物孵育时间产生较小峰波长移位。
此三组实验的结果表明LSPR信号的放大可使用金纳米颗粒缀合物以夹心测定格式来达成。与未标记抗体相比,当检测器抗体用胶体金颗粒标记时,观察到增强的信号移位,从而允许检测纳克浓度的分析物。
实施例3.使用镀金的银纳米结构的增强信号放大
为了检查改变用于标记结合配偶体的金属的类型是否影响LSPR信号的放大,制备复合金属纳米结构。具体地,镀金的银纳米结构制备如下。通过添加50.0mL去离子H2O、500.0μL柠檬酸三钠(75mM)、200μL AgNO3(200mM)和500.0μL H2O2(27%)同时在室温下强力地搅拌来制备银纳米结构。然后,将500μL等分试样的NaBH4(200mM)快速注射到水溶液,引起颜色变为淡黄色。在几分钟时间内,颜色继续自暗黄色变化至红色至紫色并且最后稳定于蓝色。UV/Vis光谱测定的溶液的峰吸光率为604.5nm。
通过将5.0mL蓝色溶液添加至50μL聚乙烯吡咯烷酮(PVP MW≈10,000乙醇中的20%)与50μL的HAuCl4(20mM)的混合物来将镀金层添加至银纳米结构。在72小时孵育时间之后,样品变为暗红色并且具有534.5nm的峰吸光率。通过在20,000rpm下离心20分钟来将纳米颗粒洗涤两次并且重新悬浮于2.0mL去离子H2O中。溶液具有深红色、530.3nm的吸收峰和15.0OD单位的总吸光率。
镀金的银纳米结构(Au@AgNPs)缀合至C6抗-CRP抗体通过添加600.0μL Au@AgNPs和20.0μL C6抗-CRP抗体(8.0mg/mL)至880.0μL去离子H2O来执行,使最终抗体浓度达到17.8μg/mL/OD。在4℃下2小时孵育期之后,将样品在30,000g下离心20分钟并且重新悬浮于含有PBS中的BSA(10mg/mL)的1.5mL封闭溶液中。将缀合至抗-CRP C6抗体的Au@AgNP储存于4℃下直到进一步使用为止。
如实施例2描述地来制备抗-CRP金纳米层传感器并且其具有530nm下的峰吸收。还制备含有金纳米层而没有任何固定抗体的控制传感器。将传感器用100μL PBS平衡。
将在PBS中稀释至1.5OD的缀合至Au@AgNP的100μL C6抗-CRP抗体与1、10或500pg/mL CRP抗原一起预混合1分钟。然后使混合物与抗-CRP或对照传感器表面接触并且测量金纳米层表面的反射光谱的变化。结果表明镀金的银纳米结构增强了由CRP-抗体复合物结合至传感器表面所诱导的峰波长移位(图7)。使用镀金的银纳米结构来检测1pg/mL的CRP抗原是可能的,与使用金纳米颗粒获得的灵敏度相比,灵敏度提高1000倍。在较高浓度的抗原下,结合位点饱和并且没有发生进一步移位。
此实验的结果证明在复合纳米结构,诸如镀金的银纳米结构,用于标记分析物结合配偶体时,实现来自金属纳米层表面的LSPR信号的显著增强的放大。
实施例4.合成较高光密度纳米结构
通过将1ml最终体积的以下试剂以所指示顺序混合来制备金纳米颗粒:0.1ml的1%PVP-10(1%wt/wt)、0.2ml的0.1M氯化金、0.1ml的5N NaOH、0.4ml的水和0.2ml的1M抗坏血酸。在每次添加之后,将反应混合物混合。光谱测量指示在室温下24小时之后,反应大部分完成。此方案产生球状金纳米颗粒,其展现约535nm的LSPR峰和每ml约80的对应光密度。通过将硝酸银或氯化金添加至预成型金纳米颗粒来进行使用额外金或银的成层。通过在30,000g下离心1-2小时来移除过量试剂。
在单独反应中,将0.05ml的20%PVP(wt/wt)与0.25ml水、0.1ml的5N NaOH、0.1ml的1M柠檬酸钠、0.5ml的0.1M氯化金和1ml的1M抗坏血酸混合。此方案导致立即形成约90/ml的OD和~525nm的LSPR峰的胶体金颗粒。在最终OD与最终反应混合物中的2.5mM金与25mM金之间的金浓度之间观察到线性对应。
应了解所公开的发明不限于所描述具体方法、协定和材料,因为这些可变化。还应了解本文所用的术语为仅出于描述特定实施方案的目的,且不欲限制本发明的范围,本发明的范围将仅由所附权利要求书所限定。
本领域技术人员将仅使用常规实验即会认识到或能够确定本文所述的发明的特定实施方案的许多等效物。此类等效物意欲由以下权利要求书涵盖。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺
- 利用特异性挥发物筛选昆虫相关嗅觉蛋白的方法与制造工艺
- 使用与表面偶联的单特异性四聚抗体复合物组合物从样品中分离出靶实体的方法与制造工艺
- 抗-WT1/HLA双特异性抗体的制造方法与工艺