一种基于聚吡咯‑聚多巴胺的电化学免疫传感器的制备方法与流程
本发明涉及高分子材料科学和电化学生物分析等科技领域,具体涉及一种基于聚吡咯-聚多巴胺的免疫传感器的制备方法
背景技术:
通过抗原-抗体的结合反应形成生物活性体的机理十分复杂,而抗原-抗体的结合反应在人类疾病的预后治疗中有着重要地位。免疫传感器是基于抗原-抗体的结合反应从而对抗原等进行选择性的识别与检测的传感器。由于抗原与相应的抗体的结合是一一对应的,因此,基于抗原-抗体的电化学免疫传感器有着高度的选择性、敏感性及较好的稳定性。但是原子级别的抗原-抗体间相互作用通常需要X射线光散射技术或者核磁共振技术进行检测,相应的免疫传感器制备复杂、所需检测时间较长、成本较高,因此其应用受到了限制。而将抗原-抗体的结合反应与电化学技术相结合能很好地解决这些问题。传统电化学传感器制备成本较低,同时还具有响应时间短、灵敏度高及轻便性等优点,在检测领域应用广泛。将两者相结合制备的电化学免疫传感器在临床分析及早期肿瘤的筛查和诊断领域都有着举足轻重的地位。
目前,已有报道将生物相容性的、亲水、抗污的PEG基聚合物和壳聚糖进行改性,从而提高其生物物理性质,并将其运用于电化学生物传感器方面。但是,由于大多数PEG基聚合物及壳聚糖都不具有导电性,因此其在电化学分析方面的应用受到了很大的限制。而导电聚合物的出现很好的解决了传统生物相容性聚合物导电性差的问题,拓展了电化学免疫传感器的应用范围。
在众多导电聚合物中,聚吡咯由于具有优异的导电性、制备成本低廉、有较好的长期稳定性及生物相容性等优点而得到广泛的研究。但是,聚吡咯是一种黑色沉淀,在水以及大多数有机溶剂中都不溶,使得其后期的功能化改性与制备十分困难。同时,由于聚吡咯机械性能较差,且几乎不具有粘附性,因此严重阻碍了其在工业上的应用。常用于改善导电聚合物溶解性的办法是掺杂。具有良好的生物相容性的多巴胺是与具有粘附性的贻贝蛋白有着相似的结构的小分子,并且在碱性以及氧化剂存在的条件下可以在几乎任何基材上自聚形成具有粘附性的聚多巴胺膜。其制备条件温和,过程中不需要加入有机溶剂及有毒物质,因此,聚多巴胺在功能化涂层及提高众多生物材料、纳米材料的粘附性能等方面有着广泛应用。多巴胺在吡咯聚合过程中可以充当掺杂剂,在不降低聚吡咯生物相容性的情况下可以提高聚吡咯的水溶性及粘附性能。
技术实现要素:
为了改善聚吡咯的水溶性和导电性,本发明将多巴胺作为掺杂剂提高聚吡咯的水溶性和粘附性能,在聚多巴胺的弱还原作用下,将氯金酸原位还原形成金纳米粒子,利用金纳米粒子与抗体之间的相互作用将抗体固定在聚吡咯-聚多巴胺膜表面得到能检测相应抗原的电化学免疫传感器。所述方法包括如下步骤:
第一步:聚吡咯-聚多巴胺复合物的制备
将吡咯(PPy)、多巴胺(DA)溶于缓冲溶液中,通15~30min N2除去体系中的氧气,将溶液体系移入冰浴中,在400~1000rpm的转速下搅拌,然后向其中加入过硫酸铵(APS)溶液,反应8~24h,得到聚吡咯-聚多巴胺悬浮液,离心后,沉淀用去离子水洗涤,如此重复至上层清夜无色,将沉淀分散在水中,冷冻干燥得到聚吡咯-聚多巴胺复合物粉末;
第二步:聚吡咯-聚多巴胺膜修饰电极的制备
将第一步所得到的聚吡咯-聚多巴胺溶于超纯水中,通过滴涂或旋涂的方法将聚吡咯-聚多巴胺水溶液修饰在电极表面,自然晾干后,得到聚吡咯-聚多巴胺膜修饰电极;
第三步:电化学免疫传感器的构建
将聚吡咯-聚多巴胺膜修饰电极浸泡在氯金酸溶液中,氯金酸在电极表面原位还原形成金纳米粒子,将得到的电极用去离子水清洗,再将表面修饰有金纳米粒子的电极浸入到含抗体的磷酸盐缓冲溶液中,分别用去离子水和磷酸盐缓冲溶液清洗,然后将其浸入到牛血清蛋白溶液中以屏蔽非特异性吸附位点,再用去离子水和磷酸盐缓冲溶液清洗后即制得电化学免疫传感器。具体路线如附图1所示。
与现有技术相比,本发明具有如下优点:
(1)本发明中将多巴胺作为吡咯聚合的掺杂剂,提高聚吡咯水溶性的同时还增强了其粘附性能,解决了聚吡咯后期加工困难的缺点,能实现对多种基材的改性,同时避免了小分子掺杂剂的加入,不破坏聚吡咯的生物相容性。
(2)在免疫传感器中引入导电聚吡咯及金纳米粒子,明显提高了电极的导电性,同时增大了电极表面的比表面积,能大量固定抗体并保持其活性,因此制备的电化学免疫传感器具有较高的灵敏度,较宽的检测范围和较低的检测下限。
(3)与传统X射线、核磁共振的检测方法相比,电化学传感器避免了检测过程中对人体的伤害,同时具有耗时短、成本低廉、无需专业人员操作等优点。
(4)本发明介绍的检测方法是基于抗原-抗体的结合反应,因此对所检测的抗原具有很好的普适性,能用于多种对应的抗体-抗原检测。
附图说明
图1是Ab/Au/PPy-PDA/Au免疫传感器的制备示意图;
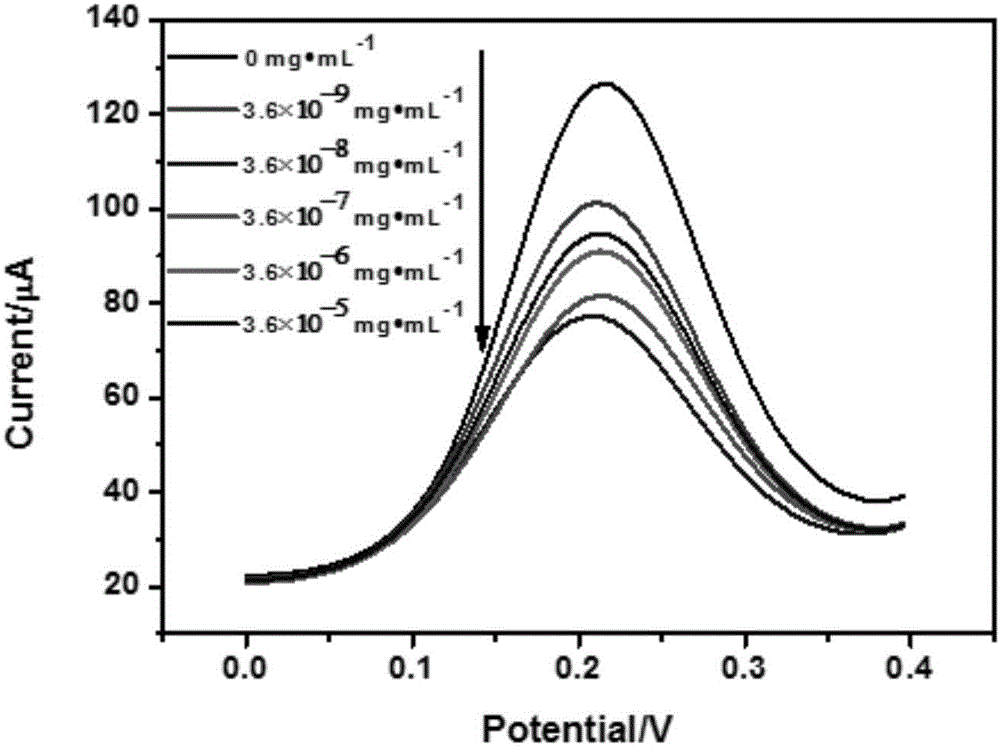
图2是实施例1中Ab/Au/PPy-PDA/Au电极对不同浓度的CEA抗原溶液的DPV曲线;
具体实施方式
下面结合具体实例,进一步阐述本发明。这些实例仅用于说明本发明而不用于限制本发明的范围。
实施例1
第一步:称取0.1g Py和0.282g DA溶于40mL缓冲液中,冰浴搅拌,然后向其中加入5mL 1.0mg·mL-1的APS溶液,Py与DA摩尔比例1:1,通N2 15min除掉氧气,冰水浴下搅拌12h,反应完成后将产物离心并用去离子水洗涤至上清液无色,所得沉淀再次分散在去离子水中,通过冷冻干燥的方法得到产物PPy-PDA;
第二步:称取0.005g PPy-PDA,加入到6mL水,超声分散1h,用微量计量器吸取10μL PPy-PDA水溶液滴涂于金电极表面,自然晾干,得到PPy-PDA/Au电极;
第三步:将PPy-PDA/Au电极浸入到0.5mg·mL-1的氯金酸溶液中12h,用去离子水冲洗得到Au/PPy-PDA/Au电极。将Au/PPy-PDA/Au电极在4℃下浸入到1.08×10-2mg·mL-1的癌胚抗体(CEA Ab)溶液中24h,用去离子水和PBS溶液清洗,得到Ab/Au/PPy-PDA/Au电极,再将Ab/Au/PPy-PDA/Au电极浸入到10mg·mL-1牛血清蛋白溶液中,在37℃下孵化2h,得到电化学免疫传感器,使用前将其保存在4℃的pH=6.0的磷酸盐缓冲溶液中。
实施例2
第一步:称取0.1g Py和0.565g DA溶于40mL缓冲液中,冰浴搅拌,然后向其中加入5mL 1.0mg·mL-1的APS溶液,Py与DA摩尔比例1:2,通N2 15min除掉氧气,冰水浴下搅拌12h,反应完成后将产物离心并用去离子水洗涤至上清液无色,所得沉淀再次分散在去离子水中,通过冷冻干燥的方法得到产物PPy-PDA;
第二步:称取0.005g PPy-PDA,加入到6mL水,超声分散1h,用微量计量器吸取10μL PPy-PDA水溶液滴涂于金电极表面,自然晾干,得到PPy-PDA/Au电极;
第三步:将PPy-PDA/Au电极浸入到0.5mg·mL-1的氯金酸溶液中12h,用去离子水冲洗得到Au/PPy-PDA/Au电极。将Au/PPy-PDA/Au电极在4℃下浸入到1.08×10-2mg·mL-1的癌胚抗体(CEA Ab)溶液中24h,用去离子水和PBS溶液清洗,得到Ab/Au/PPy-PDA/Au电极,再将Ab/Au/PPy-PDA/Au电极浸入到10mg·mL-1牛血清蛋白溶液中,在37℃下孵化2h,得到电化学免疫传感器,使用前将其保存在4℃的pH=6.0的磷酸盐缓冲溶液中。
实施例3
第一步:称取0.1g Py和1.41g DA溶于40mL缓冲液中,冰浴搅拌,然后向其中加入5mL 1.0mg·mL-1的APS溶液,Py与DA摩尔比例1:5,通N2 15min除掉氧气,冰水浴下搅拌12h,反应完成后将产物离心并用去离子水洗涤至上清液无色,所得沉淀再次分散在去离子水中,通过冷冻干燥的方法得到产物PPy-PDA;
第二步:称取0.005g PPy-PDA,加入到6mL水,超声分散1h,用微量计量器吸取10μL PPy-PDA水溶液滴涂于金电极表面,自然晾干,得到PPy-PDA/Au电极;
第三步:将PPy-PDA/Au电极浸入到0.5mg·mL-1的氯金酸溶液中12h,用去离子水冲洗得到Au/PPy-PDA/Au电极。将Au/PPy-PDA/Au电极在4℃下浸入到1.08×10-2mg·mL-1的癌胚抗体(CEA Ab)溶液中24h,用去离子水和PBS溶液清洗,得到Ab/Au/PPy-PDA/Au电极,再将Ab/Au/PPy-PDA/Au电极浸入到10mg·mL-1牛血清蛋白溶液中,在37℃下孵化2h,得到电化学免疫传感器,使用前将其保存在4℃的pH=6.0的磷酸盐缓冲溶液中。
实施例4
第一步:称取0.1g Py和1.97g DA溶于40mL缓冲液中,冰浴搅拌,然后向其中加入5mL 1.0mg·mL-1的APS溶液,Py与DA摩尔比例1:7,通N2 15min除掉氧气,冰水浴下搅拌12h,反应完成后将产物离心并用去离子水洗涤至上清液无色,所得沉淀再次分散在去离子水中,通过冷冻干燥的方法得到产物PPy-PDA;
第二步:称取0.005g PPy-PDA,加入到6mL水,超声分散1h,用微量计量器吸取10μL PPy-PDA水溶液滴涂于金电极表面,自然晾干,得到PPy-PDA/Au电极;
第三步:将PPy-PDA/Au电极浸入到0.5mg·mL-1的氯金酸溶液中12h,用去离子水冲洗得到Au/PPy-PDA/Au电极。将Au/PPy-PDA/Au电极在4℃下浸入到1.08×10-2mg·mL-1的癌胚抗体(CEA Ab)溶液中24h,用去离子水和PBS溶液清洗,得到Ab/Au/PPy-PDA/Au电极,再将Ab/Au/PPy-PDA/Au电极浸入到10mg·mL-1牛血清蛋白溶液中,在37℃下孵化2h,得到电化学免疫传感器,使用前将其保存在4℃的pH=6.0的磷酸盐缓冲溶液中。
实施例5
第一步:称取0.1g Py和2.82g DA溶于40mL缓冲液中,冰浴搅拌,然后向其中加入5mL 1.0mg·mL-1的APS溶液,Py与DA摩尔比例1:10,通N2 15min除掉氧气,冰水浴下搅拌12h,反应完成后将产物离心并用去离子水洗涤至上清液无色,所得沉淀再次分散在去离子水中,通过冷冻干燥的方法得到产物PPy-PDA;
第二步:称取0.005g PPy-PDA,加入到6mL水,超声分散1h,用微量计量器吸取10μL PPy-PDA水溶液滴涂于金电极表面,自然晾干,得到PPy-PDA/Au电极;
第三步:将PPy-PDA/Au电极浸入到0.5mg·mL-1的氯金酸溶液中12h,用去离子水冲洗得到Au/PPy-PDA/Au电极。将Au/PPy-PDA/Au电极在4℃下浸入到1.08×10-2mg·mL-1的癌胚抗体(CEA Ab)溶液中24h,用去离子水和PBS溶液清洗,得到Ab/Au/PPy-PDA/Au电极,再将Ab/Au/PPy-PDA/Au电极浸入到10mg·mL牛血清蛋白溶液中,在37℃下孵化2h,得到电化学免疫传感器,使用前将其保存在4℃的pH=6.0的磷酸盐缓冲溶液中。
实施例6
第一步:称取0.1g Py和0.786g DA溶于40mL缓冲液中,冰浴搅拌,然后向其中加入5mL 1.0mg·mL-1的APS溶液,Py与DA摩尔比例5:1,通N2 15min除掉氧气,冰水浴下搅拌12h,反应完成后将产物离心并用去离子水洗涤至上清液无色,所得固体再次分散在去离子水中,通过冷冻干燥的方法得到产物PPy-PDA;
第二步:称取0.005g PPy-PDA,加入到6mL水,超声分散1h,用微量计量器吸取10μL PPy-PDA水溶液滴涂于金电极表面,自然晾干,得到PPy-PDA/Au电极;
第三步:将PPy-PDA/Au电极浸入到0.5mg·mL-1的氯金酸溶液中12h,用去离子水冲洗得到Au/PPy-PDA/Au电极。将Au/PPy-PDA/Au电极在4℃下浸入到1.08×10-2mg·mL-1的癌胚抗体(CEA Ab)溶液中24h,用去离子水和PBS溶液清洗,得到Ab/Au/PPy-PDA/Au电极,再将Ab/Au/PPy-PDA/Au电极浸入到10mg·mL-1牛血清蛋白溶液中,在37℃下孵化2h,得到电化学免疫传感器,使用前将其保存在4℃的pH=6.0的磷酸盐缓冲溶液中。
测试例
制备的电化学免疫传感器对癌胚抗原(CEA)的电化学检测
将实施例1制备好的免疫传感器分别浸入浓度依次为(a)0mg·mL-1,(b)3.6×10-8mg·mL-1,(c)3.6×10-7mg·mL-1,(d)3.6×10-6mg·mL-1,(e)3.6×10-5mg·mL-1,(f)3.6×10-4mg·mL-1的癌胚抗原磷酸盐缓溶液(pH=7.4)中,37℃条件下孵育2h;将吸附癌胚抗原(CEA)的免疫传感器取出,分别用去离子水和磷酸盐缓冲液冲洗后,以该免疫传感器为工作电极,饱和甘汞电极为参比电极,铂丝电极为对电极,在上海辰华CHI660A电化学工作站上,采用差分脉冲伏安法法(DPV)进行测定。
通过测试未结合抗原的免疫传感器与结合不同浓度癌胚抗原的免疫传感器的DPV曲线,通过峰电流的变化,实现对癌胚抗原的检测,检测结果如附图2所示。
- 还没有人留言评论。精彩留言会获得点赞!