一种基于DES液液微萃取技术的检测饮料中合成色素的方法与流程
本发明涉及一种基于DES液液微萃取技术的检测饮料中合成色素的方法,属于食品检测技术领域。
背景技术:
食品色素是最令人感兴趣的食品添加剂。食品的颜色常常决定其对消费者的吸引力。由于天然色素的不稳定及在加工过程中易于降解,
使得人工合成色素得到了广泛的应用[1]。食用合成着色剂简称合成色素,为增进人们的食欲,保持食品色泽鲜艳而添加的非营养成分。由于合成色素具有色泽鲜艳、着色力强、易于调色、性质稳定以及成本低廉等优势而得到广泛应用[2]。但超标、超范围等不规范使用则会造成人体被动的摄入过量的食用合成色素,导致出现嗳气、偏头痛、多种过敏症状以及中毒等症状[3],更有甚者造成致癌、致畸、致突变等危害[4]。这也是必须控制食品中合成色素用量的主要原因。为此,建立了许多同时分析食品中合成色素的方法。包括高效液相色谱法[5、6、7],分光光度法[8],薄层色谱法[9]等。
液相微萃取(LLME)自问世以来,由于具有操作简单、萃取时间短、富集倍数高、分析成本低等优点获得了极大的发展。传统液液微萃取通常采用密度比水大的含卤族元素溶剂为萃取剂,但是含卤族元素溶剂由于其毒性巨大且容易挥发,对环境和试验操作人员的健康是一个潜在的威胁。为此,寻找一类既能满足传统LLME中对萃取剂的要求,又能最大程度上降低萃取剂挥发性和毒性,减少其对操作人员危害的“绿色萃取剂”,受到分析化学工作者越来越多的关注。
低温共融物(DES)作为一种新型“绿色溶剂”近几年来获得了迅速发展。其由季胺盐(氯化胆碱)与氢键供体(尿素、甘油、糖、羧酸等)以一定摩尔比混合,在融点相互渗透,在室温时形成液体混合物DES([10、11、12]。低温共融物具有生物降解性、无可燃性、廉价、易制备、环境友好等特点([13、14、15、16]。因此,各种类型的低温共融物被制备,并获得了广泛的应用,这其中就包括作为绿色溶剂从各种样品中提取分离目标化合物[17]。比如红花中酚类代谢物提取分离[18],植物中黄酮类化合物提取[19],生物样品中重金属元素提取分析[20]等均取得了较好的结果。这些制备的低温共融物均为水溶性,在一定程度上限制了其在含水样品中的应用。
[1]Marta Kucharskaa,*,Jan Grabka.A review of chromatographic methods for determination of synthetic food dyes[J].Talanta,2010,80:1045–1051.
[2]Kus E,Eroglu H E.Genotoxic and cytotoxic effects of sunset yellow and brilliant blue,colorant food additives,on human blood lymphocytes[J].Pakistan journal of pharmaceutical sciences,2015,28(1):227-230.
[3]Goodman D W.Artificial food colour exclusion and free fatty acid supplementation may reduce symptom severity in children with ADHD[J].Evidence Based Mental Health,2013,16(3):77-77.
[4]Sarlkaya R,Selvi M,F.Evaluation ofpotential genotoxicity of five food dyes using the somatic mutation and recombination test[J].Chemosphere,2012,88(8):974-979.
[5]Hao Wu,Jing-bo Guo,Li-ming Du.A rapid shaking-based ionic liquid dispersive liquid phase microextraction for the simultaneous determination of six synthetic food colourants in soft drinks,sugar-and gelatin-based confectionery by high-performance liquid chromatography.Food Chemistry 141(2013)182–186;
[6]Ou Sha,Xiashi Zhu,Yanli Feng,Weixing Ma.Aqueous two-phase based on ionic liquid liquid–liquid microextraction for simultaneous determination of ive synthetic food colourants in different food samples by high-performance liquid chromatography.Food Chemistry 174(2015)380–386;
[7]Z.Zhang,L.Wang,X.Liu,D.Zhang,L.Zhang and Q.Li,RSC Adv.,2015.
[8]Turak&Ozgur,2013.
[9]Morlock&Oellig,2009.
[10]A.P.Abbott,G.Capper,D.L.Davies,R.K.Rasheed,V.Tambyrajah,Chem.Commun.7(2003)70.
[11]A.P.Abbott,G.Capper,D.L.Davies,R.K.Rasheed,Inorg.Chem.43(2004)3447.
[12]A.P.Abbott,D.Boothby,G.Capper,D.L.Davies,R.K.Rasheed,V.Tambyrajah,J.Am.Chem.Soc.126(2004)9142.
[13]Y.Yu,X.Lu,Q.Zhou,K.Dong,H.Yao,S.Zhang,Chem.:Eur.J.14(2008)11174.
[14]K.D.Weaver,H.J.Kim,J.Sun,D.R.MacFarlane,G.D.Elliott,Green Chem.12(2010)507.
[15]F.Ilgen,D.Ott,D.Kralish,C.Reil,A.Palmberger,B.Green Chem.11(2009)1948.
[16]D.Reinhardt,F.Ilgen,D.Kralisch,B.G.Kreisel,Green Chem.10(2008)1170.
[17]Baokun Tang,Heng Zhang,Kyung Ho Row,Application of deep eutectic solvents in the extraction and separation of target compounds from various samples,J.Sep.Sci.2015,38,1053–1064.
[18]Yuntao Dai,Geert-Jan Witkamp,Robert Verpoorte,and Young Hae Choi,Natural Deep Eutectic Solvents as a New Extraction Media for Phenolic Metabolites in Carthamus tinctorius L.Anal.Chem.2013,85,6272-6278.
[19]Wentao Bia,c,Minglei Tianb,c,Kyung Ho Row.Evaluation of alcohol-based deep eutectic solvent in extraction and determination of lavonoids with response surface methodology optimization,Journal of Chromatography A,1285(2013)22–30.
[20]Kamal Ghanemi,Mohammad-Amin Navidi,Mehdi Fallah-Mehrjardi and Ali Dadolahi-Sohrab,Ultra-fast microwave-assisted digestion in choline chloride–oxalic acid deep eutectic solvent for determining Cu,Fe,Ni and Zn in marine biological Samples,Anal.Met hods,2014,6,1774-1781.
技术实现要素:
本发明提供了一种新的低温共融物(四丁基氯化铵:辛酸)。将其作为液液微萃取的萃取溶剂,应用到饮料中8种微量色素的富集分析中,建立了一种快速富集、分离饮料中8种微量人工合成色素的方法。
技术方案是:
第一个方面:
一种低温共融物的制备方法,包括如下步骤:
将含有8~10个碳原子的脂肪酸与季铵盐混合均匀,升温反应后,即得到低温共融物。
所述的含有8~10个碳原子的脂肪酸选自癸酸或者辛酸。
季铵盐选自三辛基甲基氯化铵、三辛基甲基氯化铵、四丁基氯化铵或者四丁基氯化铵。
脂肪酸与季铵盐的摩尔比是1:1~2,更优选是1:1.2。
升温反应的温度是35~45℃,更优选是40℃;反应时间是15h,并使反应液变成透明澄清液体。
第二个方面:
由上述方法所直接制备得到的低温共融物。
第三个方面:
一种检测饮料中合成色素的方法,包括如下步骤:
第1步,在饮料样品中加入上述的低温共融物,再加入NaCl,并调节pH至3~9之间;
第2步,涡旋提取,再将低温共融物经过离心分离出,将得到的低温共融物稀释在甲醇中,采用液相色谱法进行检测。
所述的第1步中,低温共融物在饮料样品中的加入量是体积比0.5~2:100,更优选是1:100。
所述的第1步中,还需要在饮料样品中加入饮料样品重量的3~8%NaCl,更优选是5%。
所述的第1步中,饮料样品中的合成色素的浓度范围是12g/mL,所述的合成色素选自柠檬黄、苋菜红、日落黄、靛蓝、胭脂红、诱惑红、亮蓝或者赤藓红中的一种或者几种;所述的饮料是碳酸饮料、茶饮料或者果汁饮料。
所述的第2步中,涡旋提取的时间是1~10min,更优选是3min。
有益效果
本发明制备了一种新的低温共融物(四丁基氯化铵:辛酸)。将其作为液液微萃取的萃取溶剂,应用到饮料中8种微量色素的富集分析中,建立了一种快速富集、分离饮料中8种微量人工合成色素的方法。
附图说明
图1是不同DES用量对检测结果的影响柱状图;
图2是不同pH值对检测结果的影响柱状图;
图3是不同加盐量对检测结果的影响柱状图;
图4是不同涡旋时间对检测结果的影响柱状图;
具体实施方式
下面通过具体实施方式对本发明作进一步详细说明。但本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。本文使用的近似语在整个说明书和权利要求书中可用于修饰任何数量表述,其可在不导致其相关的基本功能发生变化的条件下准许进行改变。因此,由诸如“约”的术语修饰的值并不局限于所指定的精确值。在至少一些情况下,近似语可与用于测量该值的仪器的精度相对应。除非上下文或语句中另有指出,否则范围界限可以进行组合和/或互换,并且这种范围被确定为且包括本文中所包括的所有子范围。除了在操作实施例中或其他地方中指明之外,说明书和权利要求书中所使用的所有表示成分的量、反应条件等等的数字或表达在所有情况下都应被理解为受到词语“约”的修饰。本文使用的词语“包括”、“包含”、“具有”或其任何其他变体意欲涵盖非排它性的包括。例如,包括列出要素的工艺、方法、物品或设备不必受限于那些要素,而是可以包括其他没有明确列出或属于这种工艺、方法、物品或设备固有的要素。以范围形式表达的值应当以灵活的方式理解为不仅包括明确列举出的作为范围限值的数值,而且还包括涵盖在该范围内的所有单个数值或子区间,犹如每个数值和子区间被明确列举出。例如,“大约0.1%至约5%”的浓度范围应当理解为不仅包括明确列举出的约0.1%至约5%的浓度,还包括有所指范围内的单个浓度(如,1%、2%、3%和4%)和子区间(例如,0.1%至0.5%、1%至2.2%、3.3%至4.4%)。
以下实施例中所采用的仪器及试剂:
实验仪器
高效液相色谱仪(岛津20A);控温磁力搅拌器(德国IKA公司);Genius 3涡旋仪(德国IKA公司);玻璃注射器(25ml);
试剂
癸酸,辛酸,十八烷酸,三辛基甲基氯化铵,四丁基氯化铵,十二烷基三甲基氯化铵购自成捷化学(上海),柠檬黄、日落黄、靛蓝、胭脂红、诱惑红、亮蓝和赤藓红标准品购自北京振翔公司,纯度>98%。甲醇为色谱纯(美国Fisher公司),其他试剂为分析纯。去离子水由GenPure UV-TOC/UF×CAD plus(美国Thermo公司)超纯水器制备。
DES供试液的色谱检测参数:
标准溶液配制
分别吸取1.0mL柠檬黄、苋菜红、日落黄、靛蓝、胭脂红、诱惑红、亮蓝、赤藓红的标准品至1000mL容量瓶中,用去离子水定容作为储备液,于4℃冰箱中保存备用。使用前,用去离子水稀释上述标准储备溶液,配制成不同浓度的标准工作液,于4℃条件下保存。不同浓度的混合标准溶液现配现用。
色谱条件
色谱柱:C18色谱柱(250mm×4.6mm,5mm);柱温:35℃;进样量:10μL;流动相:流动相A为0.02mol/L乙酸铵水溶液,流动相B为甲醇,流速为1mL/min;梯度洗脱程序:20%B在5min内线性增加到35%B,然后在7min内线性增加到98%B,保持6min,最后在0.1min内线性递减至20%B,保持8min。
实施例1DES制备
制备DES。按表1所示摩尔比分别称取癸酸和季铵盐至50mL烧瓶中混合,在40℃油浴中加热,直到两混合物完全变成透明澄清液体即可。放凉至室温后备用。
表1不同种类的DES制备
实施例2 DES的筛选
准确吸取加标的市售某苹果汁饮料样品10mL(待测样品溶液中添加柠檬黄、苋菜红、靛蓝、胭脂红、日落黄、诱惑红、赤藓红的浓度分别都为250ng/mL,亮蓝的浓度为1μg/mL)于25mL玻璃注射器中,首先加入样品重量5%NaCl,再加入50μLDES(分别采用实施例1中制备得到的4种DES),用HCl或者NaOH调节pH为6,涡旋提取3min,将DES利用注射器的注射活塞推至注射器口,用微量进样针吸取已吸附色素的DES于2mL压盖离心管中,重复上述步骤至DES完全吸出。用甲醇稀释定容至1mL,用0.45μm滤膜过滤后进样分析。
用制备好的四种DES分别萃取加标饮料样品中的8中合成色素。1号DES对胭脂红、诱惑红、赤藓红无吸附,2号DES对8中合成色素均无吸附,3号和4号DES对8中合成色素均有吸附,4号DES吸附效果更好。因此选择4号DES(四丁基氯化铵:辛酸)为本次实验的DES。
实施例3 DES的用量的筛选
准确吸取加标的市售某苹果汁饮料样品10mL(待测样品溶液中添加柠檬黄、苋菜红、靛蓝、胭脂红、日落黄、诱惑红、赤藓红的浓度分别都为250ng/mL,亮蓝的浓度为1μg/mL)于25mL玻璃注射器中,首先加入样品重量5%NaCl,再加入实施例1中的4号DES(用量分别是20、50、80、100、150、200μL),用HCl或者NaOH调节pH为6,涡旋提取3min,将DES利用注射器的注射活塞推至注射器口,用微量进样针吸取已吸附色素的DES于2mL压盖离心管中,重复上述步骤至DES完全吸出。用甲醇稀释定容至1mL,用0.45μm滤膜过滤后进样分析。每个样品重复5次。
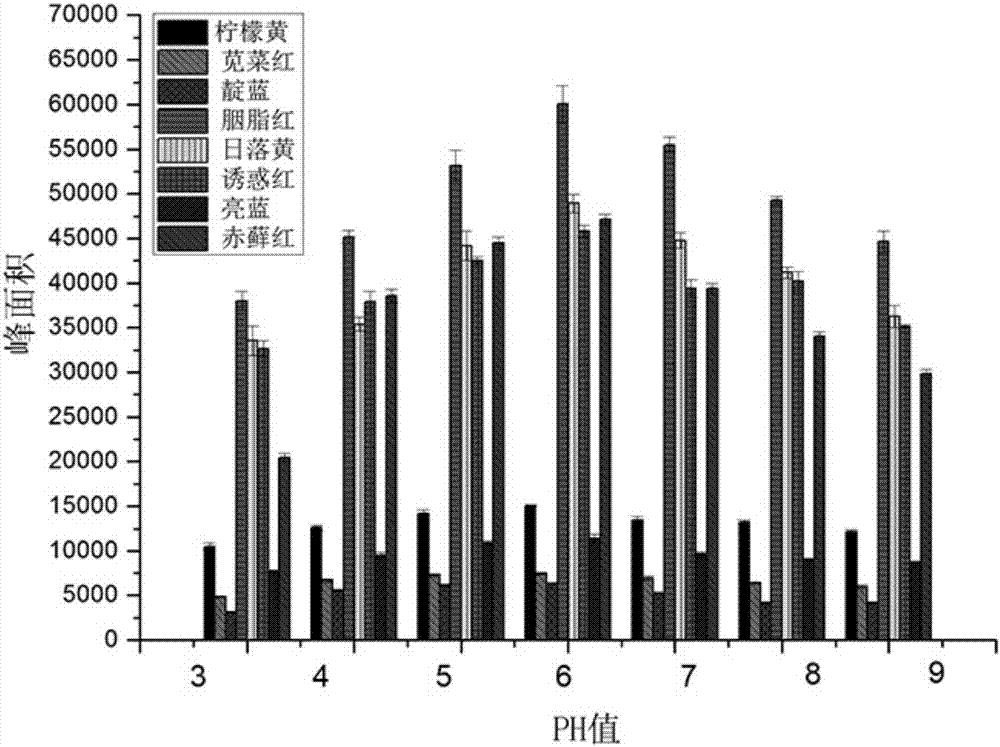
如图1所示:DES在吸附混合色素时表现为竞争吸附:日落黄、胭脂红、苋菜红>亮蓝>柠檬黄>赤藓红、诱惑红>靛蓝,结果如下表所示。综合考虑最终选择DES的用量为100μL。
表2
实施例3待测溶液pH值的筛选
由于不同的饮料(碳酸饮料、茶饮料、果汁饮料等)的pH值存在差异,考虑到实际应用,将待测溶液的pH值作为一个关键因素进行优化。
准确吸取加标的市售某苹果汁饮料样品10mL(待测样品溶液中添加柠檬黄、苋菜红、靛蓝、胭脂红、日落黄、诱惑红、赤藓红的浓度分别都为250ng/mL,亮蓝的浓度为1μg/mL)于25mL玻璃注射器中,首先加入样品重量5%NaCl,再加入实施例1中的4号DES100μL),用HCl或者NaOH调节pH分别为(3、4、5、6、7、8、9),涡旋提取3min,将DES利用注射器的注射活塞推至注射器口,用微量进样针吸取已吸附色素的DES于2mL压盖离心管中,重复上述步骤至DES完全吸出。用甲醇稀释定容至1mL,用0.45μm滤膜过滤后进样分析。每个样品重复5次。
结果如图2所示。柠檬黄、苋菜红、胭脂红、日落黄、亮蓝在pH值3、6时吸附效果较好,靛蓝在pH值5、6时吸附效果较好,诱惑红在pH值3、4、6时吸附效果较好,赤藓红在pH值6~9时吸附效果较好,综合考虑选取6作为最佳提取pH值。
表3
实施例3加盐量的筛选
由于不同的饮料(碳酸饮料、茶饮料、果汁饮料等)的pH值存在差异,考虑到实际应用,将待测溶液的pH值作为一个关键因素进行优化。
准确吸取加标的市售某苹果汁饮料样品10mL(待测样品溶液中添加柠檬黄、苋菜红、靛蓝、胭脂红、日落黄、诱惑红、赤藓红的浓度分别都为250ng/mL,亮蓝的浓度为1μg/mL)于25mL玻璃注射器中,首先加入样品重量0~8%的NaCl,再加入实施例1中的4号DES100μL),用HCl或者NaOH调节pH分别为6,涡旋提取3min,将DES利用注射器的注射活塞推至注射器口,用微量进样针吸取已吸附色素的DES于2mL压盖离心管中,重复上述步骤至DES完全吸出。用甲醇稀释定容至1mL,用0.45μm滤膜过滤后进样分析。每个样品重复5次。
针对不同的加盐量,不同色素的提取效率有明显的变化,如图3所示。当NaCl的添加量为4%时,各种色素的提取效率均较满意。
表4
实施例4涡旋时间的筛选
准确吸取加标的市售某苹果汁饮料样品10mL(待测样品溶液中添加柠檬黄、苋菜红、靛蓝、胭脂红、日落黄、诱惑红、赤藓红的浓度分别都为250ng/mL,亮蓝的浓度为1μg/mL)于25mL玻璃注射器中,首先加入样品重量0~8%的NaCl,再加入实施例1中的4号DES100μL),用HCl或者NaOH调节pH分别为6,涡旋提取10s~6min不等的时间,将DES利用注射器的注射活塞推至注射器口,用微量进样针吸取已吸附色素的DES于2mL压盖离心管中,重复上述步骤至DES完全吸出。用甲醇稀释定容至1mL,用0.45μm滤膜过滤后进样分析。每个样品重复5次。
涡旋时间的提高有助于目标物在DES和水溶液之间的分配平衡,同时促进回收率的提高。本试验考察了涡旋时间对萃取效率的影响,结果如图4所示。在1到3min内,随着萃取时间的增长萃取效率也逐渐增加,当时间为3min时达到最大值,5min时即更长的时间再无明显变化。
表5
实施例5方法学考察
在最佳的实验条件下,建立了一种新的定量分析饮料中各种色素的分析方法。为了评价所建立方法的性能,分别对工作曲线、线性范围、相关系数、检出限和定量限以及重复性进行了考察。选择加标样品进行分析测定。此萃取方法的重现性用日间精密度和日内精密度数据来评估。
1.线性范围和定量限
分别配制8种目标物不同浓度的系列混合标准工作液,以目标组分峰面积对相应浓度进行线性回归,以加标样品中待测化合物色谱峰的信噪比为3倍的噪声信号时所对应的被测物的浓度值计算检出限(LODs),结果见表6。
表6 8种色素检测方法的线性、精密度、检出限
2.方法的回收率和精密度
在3种不同饮料(碳酸饮料、茶饮料、果汁饮料)基质中添加不同量的混合标准溶液,8种色素的的加标水平分别为1.0、10.0、50.0μg/kg,每个水平设5个平行。按上述最优条件进行处理和测定,计算相对目标物的回收率和相对标准偏差,结果见表7。
表7饮料中8种目标化合物的回收率和相对标准偏差(n=5)
- 还没有人留言评论。精彩留言会获得点赞!