一种重组蛋白A介导的免疫靶向纳米金的制备方法与流程
本发明涉及纳米金与抗体偶联技术,特别涉及利用抗体fc段与自组装纳米金表面的重组蛋白a(proteina\g)特异性结合制备免疫靶向纳米金。
背景技术:
近年来,随着纳米技术的发展,纳米材料的应用逐渐成为研究的重点。纳米金作为金属纳米材料的重要成员,除了自身具有独特的物理化学性质,还具备小尺寸效应、表面效应和宏观量子隧道效应等性质,因此,纳米金在物质检测、生物传感器和免疫靶向等领域中表现出极大的潜力。特别是免疫靶向领域,作为稳定、可标记、生物安全性高的载体,纳米金需要与靶向物质结合才能获得靶向性,能够与抗原特异性结合形成抗原-抗体复合体的抗体是最理想的选择。
目前连接免疫靶向纳米金的方法主要包括物理吸附和化学键合:
(1)物理吸附
物理吸附是连接抗体最简单有效的方法。物理吸附过程中,抗体主要通过疏水作用或者氢键结合静电作用被连接在亲水或疏水载体表面(参见图1)。
(2)化学键合
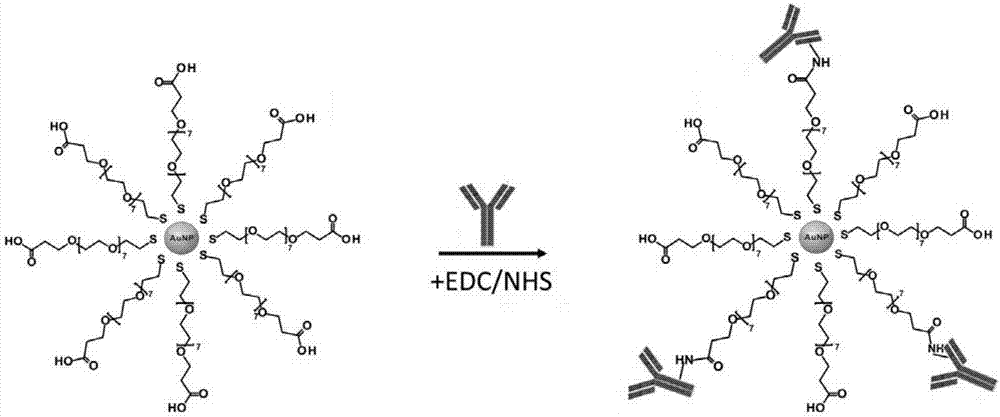
抗体与载体表面一些特殊官能团(氨基、巯基、羧基和醛基等)形成化学键来连接抗体。例如利用硅烷偶联剂3-氨基丙基三乙氧基硅烷(3-aminopropytruethoxysilaneaptes)在纳米金表面产生氨基与抗体的羧基以酰胺键的形式共价连接;利用戊二醛一端的醛基与氨基形成共价键连接纳米金,另一端醛基与抗体的氨基形成稳定的共价键;利用还原剂(疏基乙醇或二硫苏糖醇)将抗体二硫键中的巯基与纳米金表面修饰的马来酰亚胺结合;在n-羟基丁二酰亚胺(n-hydroxysuccinimide,nhs)和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(1-ethyl-3-(3’-dimethylaminopropyl)carbodiimide,edc)存在的条件下,利用抗体赖氨酸侧链的氨基与连接在纳米金表面的羧基形成肽键(参见图2)。
上述常用方法均可以合成免疫靶向纳米金,但均存在不同程度的缺点:物理吸附法纳米金通过静电作用可以直接吸附抗体,但无法控制抗体与纳米金的结合部位,会出现连接抗体不均一、生物活性低、容易从纳米金表面脱落;化学键合法由于上述官能团在抗体重链和轻链均有分布,通过随机结合形成的化学键同样会降低抗体的生物活性和承载率。因此在实际应用中如何提高纳米金的有效承载率是提高靶向纳米金效率和作用的关键。
技术实现要素:
本发明的目的是克服现有技术存在的上述不足,提供一种重组蛋白a(proteina\g)介导的免疫靶向纳米金的制备方法,利用抗体fc段与纳米金表面重组proteina\g特异性结合形成靶向免疫纳米金系统,保证抗体fab段抗原决定簇充分暴露,大大提高了抗体表面承载率,具有很好的反应稳定性和特异性。
proteina\g分别是金黄色葡萄球菌细胞壁和链球菌g族的细胞表面蛋白的组成成分,均含有igg抗体结合区,能与人及多种哺乳动物血清igg分子中的fc片段结合(参见图3)。重组proteina\g经改造后含有一个c末端半胱氨酸,可以单一位点结合纳米金,从而降低了空间位阻,增加了纳米金与igg的结合能力(参见图3)。此外,由于proteina\g中缺乏胱氨酸和半胱氨酸,无法形成二硫键,保证了proteina\g可以特异性结合抗体的fc段比物理吸附和化学键和作用获得更好的抗体定向效果,有望成为解决免疫靶向纳米金抗体承载率和生物活性低问题的关键。
本发明的技术方案
该重组蛋白a(proteina\g)介导的免疫靶向纳米金的制备方法包含以下步骤:
第1步、纳米金的制备
在用柠檬酸三钠还原法制备纳米金的过程中,将所有玻璃仪器均用新配置的王水(hno3:hcl,1:3)清洗,二次蒸馏水冲洗,使用前烘干。
第1.1步、将0.01%氯金酸50-100ml加入到锥形瓶中置于加热磁力搅拌器上,固定反应温度为95-120℃,搅拌速度300-400r/min。
第1.2步、20nm纳米金或40nm纳米金的制备
第1.2.1步、制备20nm纳米金(参见图4):在上述第1.1步所述溶液中迅速加入1%柠檬酸三钠0.75-1.5ml,25s后沸腾的溶液开始变成微蓝色,(约70s后)待蓝色突然变成鲜红色,继续搅拌加热煮沸10-15min,当金充分完成反应,溶液逐渐稳定成橘红色或酒红色,此时停止加热继续搅拌15-20min,自然冷却至室温后用蒸馏水定容50.0-100ml,2-8℃保存(参见图6);
第1.2.2步、制备40nm纳米金(参见图5):在上述溶液迅速加入1%柠檬酸三钠0.5-1ml,25s后沸腾的溶液开始变成微蓝色,(约120s后)待蓝色突然变成鲜红色;继续搅拌加热煮沸10-15min,当金充分完成反应,溶液逐渐稳定成橘红色或酒红色,此时停止加热继续搅拌15-20min,自然冷却至室温后用蒸馏水定容50.0-100.0ml,2-8℃保存(参见图7);
第2步、自组装重组proteina\g
第2.1步、用0.01m磷酸缓冲液(ph=7.2-7.4)将重组proteina\g配制为浓度为1mg/ml溶液;
第2.2步、保证第1步制备的纳米金溶液ph=7.0-8.0的条件下,将重组proteina\g自组装在纳米金颗粒的表面,按体积比1:10-20将第2.1步配制好的重组proteina\g溶液缓慢添加至第1步制备的纳米金溶液中,混合液利用旋转培养器混匀,根据具体情况转速保持10-20转/min,4℃过夜;
第2.3步、反应完成后13000转/min离心三次,每次15min,倾倒上清去除未组装proteina\g,沉淀用1ml0.01m磷酸缓冲液(ph=7.2-7.4)溶解,配制成重组proteina\g修饰的纳米金溶液并保证溶液恢复深酒红色;
第3步、抗体fc端连接
取第2步制备的重组proteina\g修饰的纳米金溶液1ml,缓慢加入适量或过量抗体(抗体加入量100-500ug),混合液利用旋转培养器混匀,根据具体情况转速保持10-20转/min,4℃振荡过夜,反应完成后13000转/min离心三次,每次15min,倾倒上清除去过量抗体,沉淀用1ml0.01m磷酸缓冲液(ph=7.2-7.4)重悬,配制成连接抗体的免疫靶向纳米金溶液并保证溶液恢复深酒红色(参见图8-9);
第4步、免疫靶向纳米金的储存及检测
在1ml第3步制备的免疫靶向纳米金溶液中加入100ul浓度为10%的牛血清白蛋白(bsa),一方面封闭纳米金表面未结合位点,消除免疫非特异性结合反应;另一方面保证免疫靶向纳米金的抗体不被降解。混合液4℃振荡1-2h后,可在2-8℃长期保存;使用前13000转/min离心15min,倾倒上清后沉淀用1ml0.01m磷酸缓冲液(ph=7.0)重悬,保证溶液恢复深酒红色后即可使用,使用前可利用免疫压迹实验检测抗体结合情况(参见图10)。
本发明的优点和有益效果:
本发明制备的免疫靶向纳米金可以单一位点偶联于纳米金上,即降低了空间位阻,又增加了与抗体的结合能力,之后通过非共价键特异性结合抗体的fc段,得到比物理吸附和化学键合作用更好的抗体定向效果。该制备方法可根据具体应用情况,制备复杂的多组分、多功能的复合靶向免疫纳米金来满足不同的需求。本发明制备的免疫靶向纳米金,不仅具有反应特异性和稳定性,还具有较强的抗干扰能力和环境耐受力,在靶向示踪、生物制药和精准治疗等领域具有很好的应用前景。
附图说明
图1纳米金物理吸附抗体示意图。
图2在nhs和ecd存在条件下,纳米金通过羧基官能团连接抗体示意图。
图3重组proteina\g介导的纳米金与抗体结合的示意图。
图4柠檬酸三钠还原法制备直径20nm纳米金的透视电镜图。
图5柠檬酸三钠还原法制备直径40nm纳米金的透视电镜图。
图620nm纳米金溶液梯度稀释标准曲线的测定,紫外-可见光谱检测纳米金溶液的紫外吸收峰在520nm,以吸光度为纵坐标,以波长为横坐标,标准曲线:y=-0.083xc+0.442(r2=0.993)。
图740nm纳米金溶液梯度稀释标准曲线的测定,紫外-可见光谱检测纳米金溶液的紫外吸收峰在520nm,以吸光度为纵坐标,以波长为横坐标,标准曲线y=-0.068xc+0.377(r2=0.989)。
图8重组proteina\g介导的20nm纳米金分别连接spaca3、spag8和or1d2抗体制备免疫靶向纳米金,紫外-可见光谱检测纳米金溶液的紫外吸收峰在528nm,抗体紫外吸收峰在277nm。
图9重组proteina\g介导的40nm纳米金分别连接spaca3、spag8和or1d2抗体制备免疫靶向纳米金,紫外-可见光谱检测纳米金溶液的紫外吸收峰在529nm,抗体紫外吸收峰在277nm。
图10免疫压迹实验利用抗igg抗体检测免疫靶向纳米金的抗体承载情况。1、3、5泳道依次是兔igg多克隆spaca1、spag8和or1d2抗体,上样量25ug,2、4、6泳道分别是0.5ml结合兔igg多克隆spaca3、spag8和or1d2抗体的免疫靶向纳米金溶液的蛋白提取物。
具体实施方式
实施例1:重组proteina\g介导的20nm纳米金连接spaca3抗体制备免疫靶向纳米金
免疫靶向纳米金体系制备方法,步骤如下:
抗体fc段通过与纳米金表面重组proteina\g特异性结合形成靶向免疫纳米金系统,该免疫靶向纳米金的制备方法包含以下步骤:
1、20nm纳米金的制备:用柠檬酸三钠还原法制备纳米金的过程中所有玻璃仪器均用新配置的王水(hno3:hcl,1:3)清洗,二次蒸馏水冲洗,使用前烘干。将0.01%氯金酸50ml加入到锥形瓶中置于加热磁力搅拌器上,固定反应温度为95℃,搅拌速度300r/min。在上述溶液中迅速加入1%柠檬酸三钠0.75ml,25s后沸腾的溶液开始变成微蓝色,约70s后蓝色突然变成鲜红色。继续搅拌加热煮沸10min,当金充分完成反应,溶液逐渐稳定成橘红色或酒红色,此时停止加热继续搅拌15-20min,自然冷却至室温后用蒸馏水定容50.0ml,2-8℃保存。利用透射电镜观察纳米金直径为20nm(参见图4);20nm纳米金溶液在紫外-可见光谱的吸收峰为520nm(参见图6);
2、自组装重组proteina\g:用0.01m磷酸缓冲液(ph=7.2-7.4)将重组proteina\g配制为浓度为1mg/ml溶液,保证纳米金溶液ph=7.0-8.0的条件下,将重组proteina\g自组装在纳米金颗粒的表面,具体操作是:取100ul重组proteina\g溶液缓慢添加至1ml纳米金溶液中,混合液利用旋转培养器混匀,根据具体情况转速保持10-20转/min,4℃过夜;反应完成后13000转/min离心三次,每次15min,倾倒上清去除未组装proteina\g,沉淀用1ml0.01m磷酸缓冲液(ph=7.2-7.4)溶解,配制成重组proteina\g修饰的纳米金溶液并保证溶液恢复深酒红色;
3、抗体fc端连接:取重组proteina\g修饰的纳米金溶液1ml,缓慢加入适量或过量spaca3抗体(抗体加入量100-500ug),混合液利用旋转培养器混匀,根据具体情况转速保持10-20转/min,4℃振荡过夜,反应完成后13000转/min离心三次,每次15min,倾倒上清除去过量抗体,沉淀用1ml0.01m磷酸缓冲液(ph=7.2-7.4)重悬,配制成连接抗体的免疫靶向纳米金溶液并保证溶液恢复深酒红色,连接spaca3抗体的免疫靶向纳米金溶液分别在528nm和277nm可见纳米金和抗体紫外吸收峰(参见图8);
4、免疫靶向纳米金的储存及检测:
4.1免疫靶向纳米金的储存:在1ml免疫靶向纳米金溶液中加入100ul浓度为10%的牛血清白蛋白(bsa),一方面封闭纳米金表面未结合位点,消除免疫非特异性结合反应;另一方面保证靶向免疫纳米金的抗体不被降解。混合液4℃振荡1-2h后,可在2-8℃长期保存;使用前13000转/min离心15min,倾倒上清后沉淀用1ml0.01m磷酸缓冲液(ph=7.0)重悬,保证溶液恢复深酒红色后即可使用。
4.2利用蛋白免疫印迹实验检测抗体结合效率(参见图10)。
蛋白免疫印迹具体实验方法为:westernblot实验方法
4.2.1免疫靶向纳米金和抗体溶液的蛋白质提取
1)取0.5ml连接spaca3抗体的免疫靶向纳米溶液,13000转/min离心15min,倾倒上清后,沉淀用4×sds-page蛋白上样缓冲液25ul震荡充分裂解蛋白;将25ulspaca3抗体溶液(浓度为1mg/ml)与4×sds-page蛋白上样缓冲液按体积比(3:1)混合震荡充分裂解蛋白,加热95℃5min,-20℃保存待用。
4.2.2主要试剂配制
4.2.2.1分离胶缓冲液1.5mmol/ltris-hcl(ph8.8)的配制
称取18.15gtris溶于40ml去离子水中,用1mol/lhcl混合调至ph8.8,加去离子水稀释至100ml终体积。过滤后4℃保存。
4.2.2.2浓缩胶缓冲液0.5mmol/ltris-hcl(ph6.8)的配制
称取6.05gtris溶于40ml水中,用1mol/lhcl混合调至ph6.8,加去离子水稀释至100ml终体积。过滤后4℃保存。
4.2.2.310%分离胶的配制
4.2.2.45%浓缩胶的配制
4.2.2.55×tris-甘氨酸电泳缓冲液的配制
称取tris30.0g、甘氨酸140.0g、sds5.0g,加ddh20定容至1000ml。
4.2.2.610×转膜缓冲液的配制
称取tris30.3g、甘氨酸144.1g,ddh20定容至1600ml。使用时,加400ml甲醇(总体积2l),再稀释为1×转膜缓冲液。
4.2.2.7上样缓冲液的配制(5×):4℃保存
最后加ddh2o定容至200ml。
4.2.2.8tbst的配制
10×tbs:tris24.2g,nacl80g,加水定容至1l,ph7.6。将10×tbs稀释成1×tbs,1000mltbs+0.5mltween-20=tbst
4.2.2.95%脱脂牛奶:(-20℃保存)
每次一般配制30ml,1.5g脱脂牛奶+30mltbst,搅拌充分即可用于封膜。
4.2.3westernblot实验步骤
4.2.3.1sds-page凝胶的配置
在进行蛋白电泳前一天需制备sds-page凝胶,配制8%或10%分离胶,灌胶8毫升左右,无水乙醇封胶。约一小时后胶凝固(可根据剩余的分离胶凝固情况确定板中胶是否凝固),倒去乙醇,配制5%积层胶5毫升,灌胶至板装满,插入1.5mmteflon梳子,30-40分钟聚合后(可根据剩余的分离胶凝固情况确定板中胶是否凝固),置于去离子水中放于4摄氏度冰箱;
4.2.3.2将预制好的凝胶置于电泳仪上,加入1×电泳缓冲液,小心拔出梳子后用吸管吹去胶丝,在泳道中分别加入3ulmarker、33.3ulspaca3抗体裂解液和20ul连接spaca3抗体的免疫靶向纳米金的蛋白裂解液,恒压60v进行电泳,待蛋白marker分出条带后加大电压至90v,观察loadingbuffer接近板底部时停止电泳;
4.2.3.3根据电泳道数裁剪pvdf膜,使膜大小较蛋白样品道稍大即可,裁剪好的pvdf膜需放于甲醇中以活化膜上面的正电基团,使它更容易跟带负电的蛋白质结合,活化后放入电转液中,裁剪6张8×6cm大小的3m滤纸;
4.2.3.4取出凝胶板,使用bio-rad公司的trans-blotsemi-dry进行蛋白质转移,将电转板放于1×电泳液中,白色一面置于下方,依次放置海绵、8×6cm的3m滤纸3张、凝胶、pvdf膜、8×6cm的3m滤纸3张、海绵,凝胶与pvdf膜之间需确保无气泡,翻转黑色一面电转板并固定,置于电转槽,恒定电流250ma120-150分钟,整个装置需放于冰水混合液中以保证温度不过高;
4.2.3.5电转结束后,取出pvdf膜,紧贴凝胶的一面朝上,在膜的左上方剪一个小角以辨别正反,用tbst洗膜3次,每次10分钟;
4.2.3.65%牛奶常温下孵育pvdf膜一小时,以减少抗原抗体的非特异性结合;
4.2.3.7tbst洗膜3次,每次10分钟;
4.2.3.8用tbst按照1:10000稀释辣根过氧化物酶hrp标记的羊抗兔二抗,室温下温和摇晃孵育一小时;
4.2.3.9tbst洗膜3次,每次10分钟,最后一次洗膜时,打开bio-rad凝胶成像系统使机器预冷,配制显影液,取eclwesternblottingdetectionreagents,将solutiona与solutionb按照1:1配制,洗膜完全后,将pvdf膜放于玻璃皿上置于曝光仪内,滴加显影液,开始进行拍照。第1泳道检测兔igg多克隆spaca3抗体25ug;第6泳道检测0.5ml兔igg多克隆抗体spaca3免疫靶向纳米金溶液的总蛋白提取物,两条泳道均可见清晰的蛋白条带,曝光结果参考图10。
实施例2:重组proteina\g介导的40nm纳米金连接spag8抗体制备免疫靶向纳米金;
免疫靶向纳米金体系制备方法,步骤如下:
抗体fc段通过与纳米金表面重组proteina\g特异性结合形成靶向免疫纳米金系统,该免疫靶向纳米金的制备方法包含以下步骤:
1、40nm纳米金的制备:用柠檬酸三钠还原法制备纳米金的过程中所有玻璃仪器均用新配置的王水(hno3:hcl,1:3)清洗,二次蒸馏水冲洗,使用前烘干。将0.01%氯金酸100ml加入到锥形瓶中置于加热磁力搅拌器上,固定反应温度为120℃,搅拌速度400r/min。在上述溶液中迅速加入1%柠檬酸三钠1ml,25s后沸腾的溶液开始变成微蓝色,约120s后蓝色突然变成鲜红色。继续搅拌加热煮沸10min,当金充分完成反应,溶液逐渐稳定成橘红色或酒红色,此时停止加热继续搅拌15-20min,自然冷却至室温后用蒸馏水定容100.0ml,2-8℃保存。利用透射电镜观察纳米金直径为40nm(参见图5);40nm纳米金溶液在紫外-可见光谱的吸收峰为520nm(参见图7);
2、自组装重组proteina\g:用0.01m磷酸缓冲液(ph=7.2-7.4)将重组proteina\g配制为浓度为1mg/ml溶液,保证纳米金溶液ph=7.0-8.0的条件下,将重组proteina\g自组装在纳米金颗粒的表面,具体操作是:取100ul重组proteina\g溶液缓慢添加至1ml纳米金溶液中,混合液利用旋转培养器混匀,根据具体情况转速保持10-20转/min,室温震荡1-2小时;反应完成后13000转/min离心三次,每次15min,倾倒上清去除未组装proteina\g,沉淀用1ml0.01m磷酸缓冲液(ph=7.2-7.4)溶解,配制成重组proteina\g修饰的纳米金溶液并保证溶液恢复深酒红色;
3、抗体fc端连接:取重组proteina\g修饰的纳米金溶液1ml,缓慢加入适量或过量or1d2抗体(抗体加入量100-500ug),混合液利用旋转培养器混匀,根据具体情况转速保持10-20转/min,室温震荡2-3小时,反应完成后13000转/min离心三次,每次15min,倾倒上清除去过量抗体,沉淀用1ml0.01m磷酸缓冲液(ph=7.2-7.4)重悬,配制成免疫靶向纳米金溶液并保证溶液恢复深酒红色,连接or1d2抗体的免疫靶向纳米金溶液分别在529nm和277nm可见纳米金和抗体蛋白紫外吸收峰(参见图9);
4、免疫靶向纳米金的储存及检测:
4.1、免疫靶向纳米金的储存:在1ml免疫靶向纳米金溶液中加入100ul浓度为10%的牛血清白蛋白(bsa),一方面封闭纳米金表面未结合位点,消除免疫非特异性结合反应;另一方面保证靶向免疫纳米金的抗体不被降解。混合液4℃振荡1-2h后,可在2-8℃长期保存;使用前13000转/min离心15min,倾倒上清后沉淀用1ml0.01m磷酸缓冲液(ph=7.0)重悬,保证溶液恢复深酒红色后即可使用。
4.2、利用蛋白免疫印迹实验检测抗体结合效率
蛋白免疫印迹具体实验方法为:westernblot实验方法
4.2.1、免疫靶向纳米金和抗体溶液的蛋白质提取
取0.5ml连接兔igg多克隆or1d2抗体的免疫靶向纳米溶液,13000转/min离心15min,倾倒上清后,沉淀用4×sds-page蛋白上样缓冲液25ul震荡充分裂解蛋白;将25ulor1d2抗体溶液(浓度为1mg/ml)与4×sds-page蛋白上样缓冲液按体积比(3:1)混合震荡充分裂解蛋白,加热95℃5min,-20℃保存待用。
4.2.2、主要试剂配制
主要试剂及其配制同实施例1,此处略。
4.2.3、westernblot实验步骤
实验步骤同实施例1,此处略。
实验结果:第5泳道检测兔igg多克隆or1d2抗体25ug;第6泳道检测0.5ml兔igg多克隆抗体or1d2免疫靶向纳米金溶液的总蛋白提取物,两条泳道均可见清晰的蛋白条带,曝光结果参考图10。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种肿瘤靶向丝胶蛋白胶束及其制备方法和应用与流程
- 一种靶向缺血心肌的VEGF重组蛋白的制作方法与工艺
- 一种胰岛靶向蛋白及其真核表达方法与流程
- 一种基于Ion Torrent测序平台的靶向叶绿体测序方法与流程
- 用于癌症靶向治疗的包含基于重组血红蛋白蛋白质或亚基的治疗剂的药物组合物的制作方法与工艺
- 基于STAT3蛋白靶点的靶向抗癌药物的发明的制作方法与工艺
- 靶向泛素化降解PLK1和BRD4蛋白的化合物及其应用的制造方法与工艺
- 抗HBV复制的靶向融合蛋白及其构建方法与流程
- 靶向于钙粘着蛋白‑11的EC1结构域的人源化抗体及相关组合物和方法与流程
- 用于刺激靶向热休克蛋白以及促进蛋白质修复的脉冲电磁和超声疗法的制造方法与工艺