一种提高蛋白浓度测定准确性的快速测定试剂及其测定方法与流程
本发明属于生物技术的应用领域,涉及到一种提高蛋白浓度测定准确性的快速测定试剂及其测定方法,特别但不限于应用于生物制药中蛋白药物样品浓度的精确定量。
背景技术:
蛋白浓度测定是蛋白生物技术(包括生物制药中蛋白药物)实验中一项基本实验内容,它是进行SDS-PAGE电泳、Western Blot、Elisa、蛋白酶活性测定、蛋白二维电泳、蛋白质谱、蛋白分子量测定、蛋白测序等实验的基本前提,比较常见的为蛋白浓度测定方法包括Bradford法,Lowry法,BCA法等。
根据汪家政的蛋白质技术手册一书所述,Bradford试剂在酸性条件下,与蛋白的结合能力与蛋白中所含赖氨酸、精氨酸和组氨酸所带电荷相关,同时范德华力和疏水作用力也参与了蛋白与染料的结合。由于各种蛋白所含有赖氨酸、精氨酸和组氨酸的数量变化比较大,导致不同样品的变异系数明显偏大,同时Bradford试剂与蛋白混合后,必须在10分钟内完成吸收值得测量,否则随着时间的延长,染料复合体以及蛋白-染料复合体会逐渐沉降,导致吸收值明显降低,这样在做大量蛋白样品定量时,它所具有的缺点就更加明显,同时也容易受到蛋白样品溶液中存在的各种离子或非离子或两性去污试剂的干扰。Lowry法是蛋白在碱性溶液中肽键与Cu2+螯合,形成蛋白-铜复合物,在还原剂磷钼酸-磷钨酸试剂的作用下,产生蓝色的化合物,蓝色深浅与蛋白浓度呈线性关系,该方法适用于脂类含量较高的样品的测定,也能够耐受较高浓度的去污试剂,但易受硫酸铵、Tris、甘氨酸和各种硫醇的影响,而且颜色深浅随不同蛋白而产生变化,标准曲线不是严格的直线形式,且专一性较差。BCA法基于双缩脲原理,碱性条件下蛋白将Cu2+还原为一价铜,BCA与一价铜螯合,产生蓝紫色复合物并在562nm有吸收峰。吸收值与蛋白浓度的线性关系较好。该方法主要是蛋白中的肽键参与了反应,同时也与蛋白中的半胱氨酸、胱氨酸、酪氨酸、色氨酸含量有关,由于不同蛋白中氨基酸的组成不同,Bradford法吸收值的变异系数在不同蛋白样品中明显大于BCA法,同时在常规的蛋白提取、纯化、保存的过程中,通常是需要加入低浓度的还原试剂(DTT,巯基乙醇等),以保持蛋白的稳定,避免蛋白的变性和沉淀,但是还原试剂存在会导致BCA法中的二价铜被还原,吸收值明显增加,从而测定的蛋白样品浓度明显偏高。
以上的三种用于蛋白浓度测定方法,要么受蛋白氨基酸组成成分的影响,不同蛋白的变异系数较大,而且颜色的稳定性也较差;要么受各种干扰试剂的影响,蛋白浓度与吸收值得线性关系不好;要么受蛋白溶液中所添加还原试剂的影响,蛋白浓度测定的结果产生偏差。
技术实现要素:
发明目的:为了克服以上不足,本发明的目的在于提供一种蛋白样品精确定量的快速测定试剂及其测定方法,以克服现有技术在蛋白样品定量过程中,由于不同样品蛋白氨基酸组成差异,蛋白样品中存在的各种干扰试剂,蛋白与试剂形成的有色复合物稳定性差所造成的对蛋白样品定量所产生的偏差。
技术方案:为了克服现有技术中存在的不足,本发明提供了一种提高蛋白浓度测定准确性的快速测定试剂,包括
沉淀试剂,所述沉淀试剂能够将蛋白样品溶液中的蛋白沉淀出来,且蛋白没有损失,并可进一步去除位于上清中的各种化学试剂;
碱性铜试剂,所述碱性铜试剂溶解沉淀的蛋白并与蛋白的肽键结合;
生色试剂,未与蛋白结合的碱性铜试剂被还原后与所述生色试剂反应,产生特定范围的吸收波长,其最佳吸收波长的吸收值与蛋白样品溶液中的蛋白量成线性关系。
本发明所述的提高蛋白浓度测定准确性的快速测定试剂,组分合理,其中沉淀试剂能够将含有各种复杂化学试剂的蛋白样品溶液中的蛋白沉淀出来,且蛋白没有损失。碱性铜试剂,能够溶解经过特殊的沉淀试剂处理并去除位于上清中的各种化学试剂的蛋白沉淀,同时与蛋白的肽键结合。而生色试剂在铜试剂与蛋白结合的同时,未与蛋白结合的铜试剂被还原后能够与生色试剂发生化学反应,产生特定范围(420-560nm)的吸收波长,吸收波长的吸收值与溶液中的蛋白量具有良好的线性关系,其中在454nm波长条件下最佳。此外,本发明所述的提高蛋白浓度测定准确性的快速测定试剂不受到蛋白氨基酸组成的影响,去除了蛋白样品溶液中存在的各种干扰试剂,未与蛋白结合的铜试剂还原后与生色试剂形成的有色复合物稳定较好,蛋白浓度测定准确性高。
进一步的,上述的提高蛋白浓度测定准确性的快速测定试剂,所述沉淀试剂按质量组分计,包括以下组分:
三氯乙酸20-30份
氯化钠25-35份
脱氧胆酸钠0.01-0.05份
水100-150份。
进一步的,上述的提高蛋白浓度测定准确性的快速测定试剂,所述碱性铜试剂按质量组分计,包括以下组分:
五水硫酸铜0.05-0.1份
酒石酸钠钾0.1-0.5份
氢氧化钠2-10份
水200-300份。
进一步的,上述的提高蛋白浓度测定准确性的快速测定试剂,所述生色试剂按质量组分计,包括以下组分:
2,9-二甲基-1,10-菲啰啉盐酸盐0.1-0.8份
还原型谷胱甘肽3-10份
柠檬酸钠50-90份
水200-400份。
作为本发明的一种优选,上述的提高蛋白浓度测定准确性的快速测定试剂,所述沉淀试剂按质量组分计,包括以下组分:
三氯乙酸25份
氯化钠29.22份
脱氧胆酸钠0.02份
水125份。
作为本发明的一种优选,上述的提高蛋白浓度测定准确性的快速测定试剂,所述碱性铜试剂按质量组分计,包括以下组分:
五水硫酸铜0.0625份
酒石酸钠钾0.255份
氢氧化钠6份
水250份。
作为本发明的一种优选,上述的提高蛋白浓度测定准确性的快速测定试剂,所述生色试剂按质量组分计,包括以下组分:
2,9-二甲基-1,10-菲啰啉盐酸盐0.285份
还原型谷胱甘肽7份
柠檬酸钠75份
水250份。
本发明还提供了一种提高蛋白浓度测定准确性的快速测定试剂的测试方法,将蛋白样品溶液经过沉淀试剂快速沉淀,再舍弃上清,以除去绝大多常规蛋白浓度测定过程中存在的各种干扰物质,碱性铜试剂溶解被沉淀的蛋白并与蛋白的肽键结合,因而不受到蛋白氨基酸副链的影响;未与蛋白质结合的碱性铜试剂被还原为一价铜后与生色试剂反应,产生特定范围的吸收波长,蛋白质量与其最佳吸收波长吸收值有良好的线性关系。
本发明所述的提高蛋白浓度测定准确性的快速测定试剂的测试方法,检测快速,准确性高,适应范围广,具有极高的推广应用价值。
进一步的,上述的提高蛋白浓度测定准确性的快速测定试剂的测试方法,包括以下步骤:
(1)将梯度稀释的蛋白标准样品和待测定的未知浓度蛋白样品溶液与一定体积比的沉淀试剂混合;
(2)高速离心沉淀蛋白,去除上清,吸干残留液体,以除去各种干扰物质;
(3)碱性铜试剂溶解蛋白沉淀,并与蛋白的肽键相结合;
(4)未与蛋白结合的铜试剂在碱性条件被还原后与生色试剂下发生反应,并产生特定颜色的吸收波长;
(5)制作标准曲线,蛋白质量与最佳吸收波长吸收值成反比,根据标准曲线,确定待测蛋白样品的蛋白质量,从而得出待测样品的蛋白浓度。
此方法合理,易于实现,在室温条件下即可以完成蛋白含量测定。
进一步的,上述的提高蛋白浓度测定准确性的快速测定试剂的测试方法,所述蛋白标准样品包括溶解于PBS缓冲液中的牛血清白蛋白。此外,也可以采用其他的形式的单一或混合蛋白,蛋白可以是溶解在变性试剂或非变性试剂;离子型去污试剂或非离子型去污试剂或两性去污试剂;还原试剂或氧化试剂的蛋白,例如溶解于各种复杂缓冲液中的蛋白Marker PR1500和MK033,该方法适应性比较广。
有益效果:
本发明所述的蛋白样品精确定量的快速测定试剂及其测定方法,不受到蛋白氨基酸组成的影响,去除了蛋白样品溶液中存在的各种干扰试剂,未与蛋白结合的铜试剂被还原后与生色试剂形成的有色复合物稳定较好,蛋白浓度测定准确性高。
附图说明
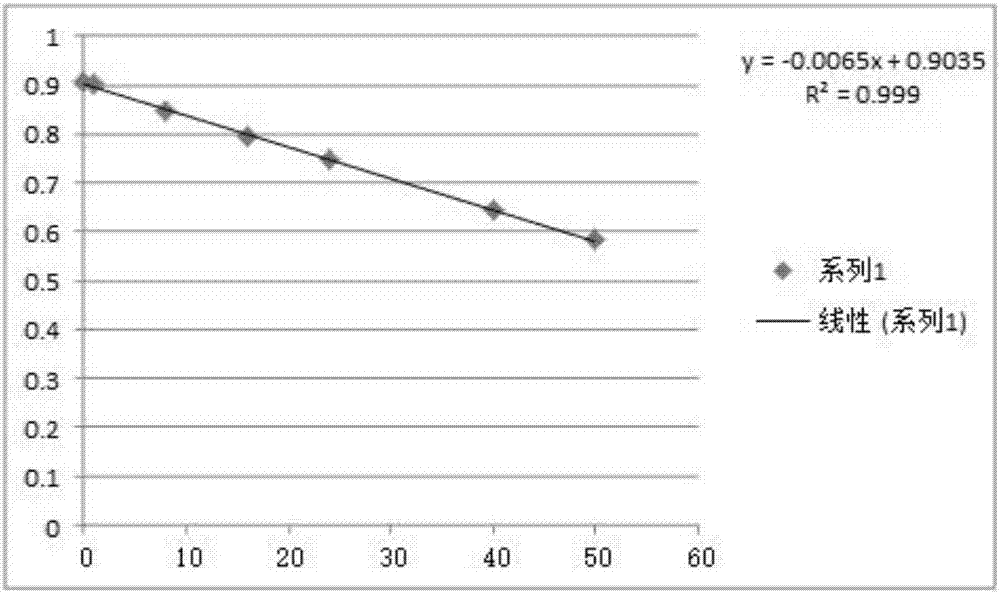
图1用溶解于PBS中的BSA做标准蛋白,通过此方法得出的蛋白量(μg)与OD454吸收值得标准曲线图,横坐标为蛋白量(μg);纵坐标为OD454吸收值;
图2用溶解于Laemmeli Buffer(0.5M Tris-HCl pH6.8,0.05%溴酚蓝,50%甘油,50m M DTT,1%SDS)中的Marker PR1500做标准蛋白,通过此方法得出的蛋白量(μg)与OD454吸收值得标准曲线图,横坐标为蛋白量(μg);纵坐标为OD454吸收值;
图3用溶解于2D Sample Buffer(6M尿素,2M硫脲,2%Chaps,1%NDSB-201)中的Marker MK033做标准蛋白,通过此方法得出的蛋白量(μg)与OD454吸收值得标准曲线图,横坐标为蛋白量(μg);纵坐标为OD454吸收值。
具体实施方式
下面将通过几个具体实施例,进一步阐明本发明,这些实施例只是为了说明问题,并不是一种限制。
材料:
牛血清白蛋白(BSA)、蛋白Marker PR1500(北京索莱宝科技有限公司)和MK033(合肥博美生物科技有限责任公司)、分析天平FA2004、紫外可见分光光度计UV-1800、PH计PHS-3E、离心机、各种规格离心管、枪头和烧杯、各种用于配置沉淀试剂,碱性铜试剂以及生色试剂的各种分析纯试剂。
实施例1
一种提高蛋白浓度测定准确性的快速测定试剂,包括
沉淀试剂,所述沉淀试剂能够将蛋白样品溶液中的蛋白沉淀出来,且蛋白没有损失;
碱性铜试剂,所述碱性铜试剂溶解沉淀的蛋白并与蛋白的肽键结合;
生色试剂,未与蛋白结合的碱性铜试剂被还原后与所述生色试剂反应,产生特定范围的吸收波长,其最佳吸收波长的吸收值与蛋白样品溶液中的蛋白量成线性关系。
其中,所述沉淀试剂按质量组分计,包括以下组分:
三氯乙酸20份
氯化钠25份
脱氧胆酸钠0.01份
水100份。
此外,所述碱性铜试剂按质量组分计,包括以下组分:
五水硫酸铜0.0625份
酒石酸钠钾0.255份
氢氧化钠6份
水250份。
进一步的,所述生色试剂按质量组分计,包括以下组分:
2,9-二甲基-1,10-菲啰啉盐酸盐0.8份
还原型谷胱甘肽10份
柠檬酸钠90份
水400份。
实施例2
一种提高蛋白浓度测定准确性的快速测定试剂,包括
沉淀试剂,所述沉淀试剂能够将蛋白样品溶液中的蛋白沉淀出来,且蛋白没有损失;
碱性铜试剂,所述碱性铜试剂溶解沉淀的蛋白并与蛋白的肽键结合;
生色试剂,未与蛋白结合的碱性铜试剂被还原后与所述生色试剂反应,产生特定范围的吸收波长,其最佳吸收波长的吸收值与蛋白样品溶液中的蛋白质量成线性关系。
其中,所述沉淀试剂按质量组分计,包括以下组分:
三氯乙酸25份
氯化钠29.22份
脱氧胆酸钠0.02份
水125份。
此外,所述碱性铜试剂按质量组分计,包括以下组分:
五水硫酸铜0.05份
酒石酸钠钾0.5份
氢氧化钠10份
水200份。
进一步的,所述生色试剂按质量组分计,包括以下组分:
2,9-二甲基-1,10-菲啰啉盐酸盐0.1份
还原型谷胱甘肽3份
柠檬酸钠50份
水200份。
实施例3
一种提高蛋白浓度测定准确性的快速测定试剂,包括
沉淀试剂,所述沉淀试剂能够将蛋白样品溶液中的蛋白沉淀出来,且蛋白没有损失;
碱性铜试剂,所述碱性铜试剂溶解沉淀的蛋白并与蛋白的肽键结合;
生色试剂,未与蛋白结合的碱性铜试剂被还原后与所述生色试剂反应,产生特定范围的吸收波长,最佳吸收波长的吸收值与蛋白样品溶液中的蛋白质量成线性关系。
其中,所述沉淀试剂按质量组分计,包括以下组分:
三氯乙酸30份
氯化钠35份
脱氧胆酸钠0.05份
水150份。
此外,所述碱性铜试剂按质量组分计,包括以下组分:
五水硫酸铜0.1份
酒石酸钠钾0.1份
氢氧化钠2份
水300份。
进一步的,所述生色试剂按质量组分计,包括以下组分:
2,9-二甲基-1,10-菲啰啉盐酸盐0.285份
还原型谷胱甘肽7份
柠檬酸钠75份
水250份。
实施例4:各种试剂的配置
1、沉淀试剂的配置
用分析天平FA2004(上海方瑞仪器有限公司)准确称取25克的固体三氯乙酸,29.22克的氯化钠和0.02克的脱氧胆酸钠放置于烧杯中,加入100毫升的双蒸水,玻璃棒搅拌溶解并定容到125毫升。
2、铜试剂的配置
用分析天平准确称取0.0625克的五水硫酸铜,0.255克的酒石酸钠钾和6克的氢氧化钠,加入双蒸水,玻璃棒搅拌溶解并定容到250毫升。
3、生色试剂的配置
称取2,9-二甲基-1,10-菲啰啉盐酸盐0.285克溶解于100ml双蒸水中待用,另外称取还原型谷胱甘肽7克和柠檬酸钠75克,用双蒸水溶解,用PH计PHS-3E(上海江仪仪器有限公司)柠檬酸调节PH值到4.2,定容到250毫升,使用时将前后者按照100:1的体积比混合待用。
实施例5:BSA标准曲线的确立
将取12支1.5ml的离心管,每两管为一个编号,将2mg/ml的BSA蛋白标准样品(溶解于PBS缓冲液中)分别在不同编号的离心管中加入0、4、8、12、20、25μl的标准蛋白,相同编号的离心管加入相同体积的经过稀释的蛋白标准溶液。试管中加入1ml沉淀试剂,涡旋震荡30秒,在室温下放置3分钟。12,000rpm离心5分钟,这样会在试管的底部,形成可见或不可见的紧密的蛋白质沉淀团块。将试管从离心机上取出,用枪头尽可能去除上清,保留沉淀,再将试管倒置在滤纸上,以便让试管中的残液流干。加入100μl的铜试剂和400μl的双蒸水,涡旋震荡30秒,直到蛋白质沉淀团块完全溶解。再加入1ml的生色试剂混合液,颠倒试管混匀几次,室温下放置15分钟,再在20分钟内,在紫外可见分光光度计UV-1800(上海美谱达仪器有限公司)将454nm波长处的吸收值测量完毕,以相同编号的离心管吸收值的平均值为纵坐标,对应的BSA蛋白量为横坐标,在Microsoft Excel软件中绘制BSA标准曲线。
得到的蛋白质量与454nm波长处的吸收值的平均值关系如下,得出的标准曲线如图1所示。
实施例6:待测样品蛋白浓度的测定
在制作标准曲线的同时,另外取两支1.5ml的离心管,分别加入同样体积的1-50μl(蛋白总量不超过50μg)的待定量的蛋白质样品溶液,按照在制作标准曲线的实验流程,得出待测样品蛋白454nm波长处的吸收值的平均值,再根据标准曲线得出待测样品的蛋白质量,从而得出待测蛋白样品的浓度。
实施例7:用蛋白Marker PR1500制作标准曲线
蛋白Marker PR1500各含有myosin(肌球蛋白200KD);Calmodulin(钙调素,130KD);Phosphorylase B(97.4KD);BSA(66.2KD);Actin(肌动蛋白,43KD)各20%,取500μg干粉溶解于Laemmeli Buffer(0.5M Tris-HCl pH6.8,0.05%溴酚蓝,50%甘油,50m M DTT,1%SDS)中,蛋白浓度为2mg/ml,按照实施例2:BSA标准曲线的确立方法,将取14支1.5ml的离心管,每两管为一个编号,分别在不同编号的离心管中加入0、0.5、4、8、12、20、25μl的标准蛋白,相同编号的离心管加入相同体积的经过稀释的蛋白标准溶液。试管中加入1ml沉淀试剂,涡旋震荡30秒,在室温下放置3分钟。12,000rpm离心5分钟,这样会在试管的底部,形成可见或不可见的紧密的蛋白质沉淀团块。将试管从离心机上取出,用枪头尽可能去除上清,保留沉淀,再将试管倒置在滤纸上,以便让试管中的残液流干。加入100μl的铜试剂和400μl的双蒸水,涡旋震荡30秒,直到蛋白质沉淀团块完全溶解。再加入1ml的生色试剂混合液,颠倒试管混匀几次,室温下放置15分钟,再在20分钟内,在紫外可见分光光度计UV-1800将454nm波长处的吸收值测量完毕,以相同编号的离心管吸收值的平均值为纵坐标,对应的Marker PR1500混合蛋白质量为横坐标,在Microsoft Excel软件中绘制Marker PR1500混合蛋白标准曲线。
得到的蛋白质量与454nm波长处的吸收值的平均值关系如下,得出的标准曲线如图2所示。
实施例8:用蛋白Marker MK033制作标准曲线
蛋白Marker PR1500为含有分子量为6.2KD;14.4KD;20.1KD;31KD;66.2KD;97.4KD六种蛋白的混合物,各种蛋白的含量相等,取500μg干粉溶解于2D Sample Buffer(6M尿素,2M硫脲,2%Chaps,1%NDSB-201)中,蛋白浓度为2mg/ml,按照实施例2:BSA标准曲线的确立方法,将取14支1.5ml的离心管,每两管为一个编号,分别在不同编号的离心管中加入0、0.5、4、8、12、20、25μl的标准蛋白,相同编号的离心管加入相同体积的经过稀释的蛋白标准溶液。试管中加入1ml沉淀试剂,涡旋震荡30秒,在室温下放置3分钟。12000rpm离心5分钟,这样会在试管的底部,形成可见或不可见的紧密的蛋白质沉淀团块。将试管从离心机上取出,用枪头尽可能去除上清,保留沉淀,再将试管倒置在滤纸上,以便让试管中的残液流干。加入100μl的铜试剂和400μl的双蒸水,涡旋震荡30秒,直到蛋白质沉淀团块完全溶解。再加入1ml的生色试剂混合液,颠倒试管混匀几次,室温下放置15分钟,再在20分钟内,在紫外可见分光光度计UV-1800将454nm波长处的吸收值测量完毕,以相同编号的离心管吸收值的平均值为纵坐标,对应的Marker MK033混合蛋白质量为横坐标,在Microsoft Excel软件中绘制Marker MK033混合蛋白标准曲线。
得到的蛋白质量与454nm波长处的吸收值的平均值关系如下,得出的标准曲线如图3所示。
在实施例5,7和8中,通过本发明所述的方法,用沉淀试剂沉淀蛋白样品溶液,去除位于上清中存在的各种干扰物质,再用碱性铜试剂溶解蛋白沉淀并与蛋白的肽键项结合,未结合的碱性铜试剂被还原后,与生色试剂结合并显色产生的特定波长吸收值与蛋白量的关系上看,无论蛋白标准样品是否复杂或简单,也无论蛋白标准样品所在的蛋白溶液中是否含有变性试剂或非变性试剂;离子型去污试剂还是非离子型去污试剂或两性去污试剂;还原试剂或氧化试剂,所做的标准曲线与用常规BSA做标准蛋白所做的标准曲线基本是一致的,从而说明了该沉淀试剂可以沉淀低至1μg的蛋白,同时该方法与蛋白中氨基酸的组成没有直接关系,形成的有色复合物稳定较好,蛋白量与最佳吸收波长的吸收值的线性关系较好,也不受到待测蛋白样品中所含有的各种化学试剂的干扰。该方法克服了常规Bradford法、Lowry法、BCA法的不足之处,确实为蛋白样品定量的提供了一种更为精确方法。
- 还没有人留言评论。精彩留言会获得点赞!