一种检测葛根中生物胺的方法与流程
本发明涉及一种检测葛根中生物胺的方法,属于检测技术领域。
背景技术:
生物胺(bas)是一类具有生物活性和氮的低分子碱性化合物。它们主要由相应的氨基酸在微生物脱羧下形成,或由醛和酮在氨基酸转氨酶的作用下产生[1]。常见的生物胺包括色胺、腐胺、酪胺、组胺、精胺、亚精胺、苯乙胺、章胺、尸胺等[2]。一般情况生物胺是有毒的,当人体在一定程度上积聚时,会对人体造成中毒。它们可引起头痛、恶心、呕吐、腹泻、心悸、血压变化、呼吸紊乱和其他过敏反应,严重时可能危及生命[3]。在生物胺中,组胺毒性最大,腐胺、尸胺、精胺和亚精胺可以与亚硝酸盐反应生成亚硝胺,一种强致癌物质[4]。生物胺广泛存在于富含蛋白质和氨基酸的食物中,如肉类和肉制品、罐头食品、海鲜、奶酪、啤酒、葡萄酒植物和农产品[5-6]。近来发现中草药中也可能有生物胺的存在[1]。目前,一些国家已对食品中生物胺含量的限制提出了规定。例如,在欧盟[6]中,组胺限量为100mg/kg,而在美国[7],水产品中组胺限量为50mg/kg;而在中国,高组胺鱼类组胺限量为40mg/100g,其他鱼类组胺限量为20mg/100g[8-9]。国内外植物产品中生物胺均未见限量规定,但本研究中发现葛根的根茎含有生物胺。生物胺具有较高的活性,有助于葛根的功效。
然而,微量生物胺是人体内的正常活性成分,在生物细胞中具有重要的生理功能[11]。建立葛根中生物胺的鉴别和同步测定方法,无论是从食品安全的角度还是从成分活性的角度,都是十分必要的。
生物胺的检测方法有gc-ms/ms[12]、离子色谱[13-14]、hplc[15-17]、tlc[18]和hplc-ms/ms方法[1][18],但前处理步骤比较复杂,操作困难,检测难度较大。同时,九种生物胺的测定超过30min。现有国家标准[19]是针对食品中生物胺的测定的,但前处理方法十分复杂。样品预处理相对繁琐,包括正己烷脱脂、液-液萃取、ph调节、吹氮等步骤,需要大量的有机溶剂,这对实验人员的健康有害。
[1]wuyh,zhous,xugm.determinationofeightbiogenicaminesinanimal-derivedfoodstuffsbyhighperformanceliquidchromatography-tandemmassspectrometrywithoutderivatization.chinesejournalofchromatography,2013.31(2):111-116.
[2]sillasantosmh.biogenicamines:theirimportanceinfoods.internationaljournaloffoodmicrobiology,1996,29(2/3):213-231.
[3]wanggq,yujs,huj,etal.progressinresearchonbiogenicaminesinfoods.foodscience,2016,37(1):269-278.
[4]shalabyar.significanceofbiogenicaminestofoodsafetyandhumanhealth.foodresearchinternational,1996,29(7):675-690.
[5]liuj,renj,sunkj.safetyofbiogenicaminesinfoods.foodscience,2013,34(5):322-326.
[6]zhanglu,bianyin-bing,xingzeng-taoetal.advanceindetectingtechniquesofbioaminesinagri-foodandagri-products.actaagricultureshanghai,2011,27(3):135-139.
[7]europeancommission(ec).commissionrecommendationof10january2003concerningacoordinatedprogrammerfortheofficialcontroloffoodstuffsfor2003(2003/10/ec).
[8]u.s.foodanddrugadministration.cpgsec.540.525decompositionandhistamineraw,frozentunaandmahi-mahi;cannedtuna;andrelatedspecies,revisedcompliancepolicyguide,availability.
[9]gb2733-2015nationalfoodsafetystandardsoffresh,frozenanimalaquaticproducts.
[10]ny5073—2006thepollution-freefoodpoisonousandharmfulmaterialsetlimittoofaquaticproducts.
[11]sunyn,zhangn,wangcl.identificationanddeterminationofbiogenicaminesinevodiarutaecarpa(juss.)benthbyhigh
performanceliquidchromatography.analyticalchemistry.2014,42(2):273-277
wenyz,fanwl,xuy.identificationofavarietyofbiogenicaminesbygc-msmethodinchina’sliquor.liquormaking,2013,140(1):38-41.
[12]zhaoxy,jiaox,xiam,etal.determinationoffivebiogenicaminesinsourcewaterbyionchromatography.chinesejournalofchromatography,2009,27(4):505-508.
[13]zhouy,wangpy,zhaoh,etal.determinationofbiogenicaminesinfrozenmeatproductsbyhighperformanceion-exchangechromatography-electrochemical.thefoodindustry,2014,35(5):238-241.
[14]huy,huangzy.columnbeforederivativehplcdeterminationofmanykindsofbiogenicaminesinfishatthesametimeanditschangerule.journalofchineseinstituteoffoodscienceandtechnology,2012,12(11):142-147.
[15]zhaihl,yangxq,haosx,etal.optimizationofoperatingconditionsforhplcdeterminationofbiogenicamines.foodscience,2011,32(18):180-184.
[16]zhangn,wangcl,hongbl,etal.identificationanddeterminationofbiogenicaminesinephedraeherbabyrp-hplcwithprecolumnderivatization.chinjpharmanal2015,35(3):389-395.
[17]shalabyar.simple,rapidandvalidthinlayerchromatographicmethodfordeterminingbiogenicaminesinfoods.foodchemistry,1999,65(1):117-121.
[18]dingt,lvc,liuh,etal.determinationofeightbiogenicaminesinredwinesbyliquidchromatography–quadrupole/electrostaticfieldorbittrapmassspectrometry.journalofinstrumentalanalysis,2014,33(1):27-32.
[19]gb5009.208.nationalstandardoffoodsafetyofdeterminationofbiogenicamineinfoods.
技术实现要素:
本实验建立了柱前衍生化uplc法同时测定葛根中9种生物胺的方法。通过uplc系统,可以采用小粒度的柱来实现更好的分离和更短的分析时间。同时,简化了前处理步骤,为葛根等农产品植物食品中多种生物胺的快速检测方法提供了依据。
技术方案是:
一种检测葛根中生物胺的方法,包括如下步骤:
第1步,生物胺单标溶液的配制:准确称量腐胺、组胺、酪胺、精胺、亚精胺、苯乙胺、章胺、尸胺、色胺的标准品,放入容量瓶;加入盐酸定容;配制成标准储备溶液;
第2步,生物胺混合标准溶液的配制:分别取等量的第1步中得到的各个标准品的标准储备溶液,混合之后,用盐酸定容,配制成生物胺混合原液;
第3步,生物胺混合工作液的配制:将生物胺混合原液用水稀释后制成设定浓度的溶液,作为生物胺混合工作液;
第4步,生物胺标准溶液衍生化:取0.5-2ml的生物胺混合工作液移入15ml离心管中,然后加入1.5ml饱和碳酸钠溶液和1ml丹磺酰氯溶液;盖上盖子后,在40℃的温度控制的动筛中放置和振摇1小时,然后加入100μl的氨水终止反应;加入乙腈将体积调节到5ml。在4000r/min下进行5分钟的离心,最后用0.22μm的过滤器过滤上清液;
第5步,样品溶液的制备:取待检测的葛根样品,加入盐酸溶液进行提取,再在冷冻离心中进行离心,取上清;将上清中加入饱和碳酸氢钠溶液和丹磺酰氯化物溶液,在摇床上放置和摇动,加入氨水中止反应,反应液加乙腈稀释,作为样品溶液;
第6步,uplc检测:采用第4步得到的衍生化生物胺标准溶液以及第5步得到的标准溶液,通过uplc检测,通过外标法得到待测的生物胺的含量。
所述的第1步中,各个标准储备溶液的浓度为1mg/ml;盐酸溶液的浓度0.1mol/l。
所述的第2步中,盐酸溶液的浓度0.1mol/l;生物胺混合原液的浓度100μg/ml。
所述的第4步中,丹磺酰氯溶液是指浓度为10mg/ml的丙酮溶液。
所述的第5步中,盐酸溶液的浓度是0.4mol/l。
所述的第5步中,冷冻离心得到的上清液需要经过氧化钛吸附剂吸附除杂之后,再进入后续加入饱和碳酸氢钠溶液和丹磺酰氯化物溶液的步骤。
所述的第6步中,uplc中的色谱柱是uplcbehc18柱,uplc柱的温度设定在35℃。流动相以0.4ml/min的速率泵送;采用pda检测器在254nm波长下测定9种生物胺。
所述的第6步中,流动相a为5mmol/l乙酸铵,流动相b为乙腈;梯度洗脱如下所示:
有益效果
本实验优化了样品的前处理条件,首次尝试采用超高效液相色谱法,建立了葛根中9种生物胺提取方法及准确定量检测的方法。本研究也是国内外首次发现葛根中含有色胺、苯乙胺、腐胺、尸胺、精胺等生物胺成分。在所建立的色谱条件下,可以在8分钟内检测到样品。9种生物胺在0.1-20mg/l范围内呈良好的线性关系(r>0.999)。9种生物胺的定量限均为10mg/kg。精密实验表明,该方法重现性好。本方法简便、快速、准确、可靠,适用于大批量样品的快速检测,为快速、准确检测其他新鲜植物或药物及食品同源食品中的生物胺提供了技术支持。也为药食同源产品的功效成分研究提供了有效的检测手段。
附图说明
图19种生物胺普通高效液相色谱分离图(0.2μg/ml)
图29种生物胺超高效液相色谱分离图(0.2μg/ml)
图3新鲜葛根样品超高效液相色谱图
图4新鲜葛根样品添加混合标准溶液(200mg/kg)超高效液相色谱图
具体实施方式
实验材料
除特殊说明外,所有溶剂均为分析试剂级。(微孔,美国)去离子水由milli-q超纯水机整体10(milli-q;millipore,bedford,ma,usa)应用研究。腐胺、组胺、酪胺、精胺、亚精胺、苯乙胺、章胺、尸胺的标准,是从ehrenstorfer博士购买了(德国),色胺购自安谱(上海,中国)。腐胺、组胺水平,精胺和亚精胺的纯度为99;酪胺是99.5%、97.5%的苯乙胺,章鱼是96.5%,尸胺是99%、98%色胺。
丹磺酰氯购自安培(上海,中国),纯度为98%。乙腈,丙酮和醋酸铵的色谱纯度购自tedia公司(tedia,美国)。碳酸氢钠、盐酸、高氯酸和氨水均为化学试剂有限公司的分析纯。
葛根植物样品购自广西医药市场。
标准溶液的配制
生物胺单标溶液:准确称量50mg的腐胺、组胺、酪胺、精胺、亚精胺、苯乙胺、章胺、尸胺、色胺的标准,放入50ml容量瓶;加入0.1mol/l盐酸定容;配制成1mg/ml标准储备溶液,然后储存在冰箱在4℃在容量瓶的材料。
九种生物胺混合标准溶液:1ml每一种生物胺的单标准溶液分别移取加入同一10ml容量瓶,再加入0.1mol/l盐酸定容,配制成100μg/ml生物胺混合原液。
九种生物胺混合工作液:根据实验的需要,生物胺的混合溶液用水稀释后制成生物胺的混合标准工作溶液的不同浓度。
生物胺标准溶液衍生化
将适量的生物胺混合工作液用吸管移入15ml离心管中,然后加入1.5ml饱和碳酸钠溶液和1ml丹磺酰氯溶液(10mg/ml,溶于丙酮)。盖上盖子后,在40℃的温度控制的动筛中放置和振摇1小时,然后加入100μl的氨水终止反应。加入乙腈将体积调节到5ml。在4000r/min下进行5分钟的离心,最后用0.22μm的过滤器过滤上清液进行液相色谱。
样品前处理
在本实验中,对预处理步骤进行了优化,将样品直接提取,然后进行衍生化。本实验研究了水、高氯酸溶液、盐酸溶液、甲醇、乙腈等萃取剂的萃取效果,重在考虑如何通过提取过程将中草药中生物胺提取出来。结果表明,盐酸溶液提取效果最好,9种生物胺的总回收率最高。由于大多数生物胺不是uv发色基团,所以它们在被检测之前需要进行衍生。在此方法中,比较了常用的两种衍生试剂邻苯二甲醛(opa)和丹磺酰氯(dns-cl)。结果表明,邻苯二甲醛作为衍生化试剂反应时间短,但衍生化产物不稳定,重现性差。丹磺酰氯具有较好的衍生效果,其中衍生条件易于控制,衍生产物稳定,重现性好。
采用以下方法进行前处理:称量2.00±0.01g的均质样品(用德国flukofa25分散均质机),放入50ml离心管中,加入20ml0.4mol/l盐酸。然后,将样品均质2min,用德国sigma3-18k高速冷冻离心机(sigma)在10000r/min下在4℃下离心10分钟。1ml上清液移至15ml离心管中。然后加入1.50ml饱和碳酸氢钠溶液和1ml丹磺酰氯化物溶液(10mg/ml,溶解于丙酮中)。盖上盖子后,在40℃摇床(alt-032r智能温控摇床,上海堪鑫仪器设备有限公司)中放置和摇动,避光1h。然后加入100μl的氨水来终止衍生反应。反应液加乙腈稀释至5ml,在4000r/min离心5min,最后用0.22μm滤膜过滤后上清液进行超高效液相色谱分析。
实施例1色谱分析方法的对比
为了比较液相色谱分离效果,本研究中使用了两个系统进行分析。
一个是watersacquityuplc系统(waters,美国),包括二元溶剂管理器泵、样品管理器和pda(光电二极管阵列)检测器。用uplcbehc18(1.7μm,2.1mm×100mm)(wates,美国)柱分离九种生物胺。uplc柱的温度设定在35℃。流动相以0.4ml/min的速率泵送,梯度洗脱如表1所示,流动相a为5mmol/l乙酸铵,流动相b为乙腈。进样体积为5μl,在254nm波长下测定9种生物胺。
表1梯度洗脱程序
另一个分析系统是安捷伦hplc1260系统(美国安捷伦公司),包括g1311c1260quat泵vl、g132981260als自动采样器和g1315d1260dadvl。用安捷伦zobaxsb-c18(5μm,4.6mm×250mm)(安捷伦,美国)柱分离九种生物胺。hplc柱的温度为35℃。流动相以1.0ml/min的速率泵送,流动相a为10mmol/l乙酸铵,流动相b为乙腈。梯度洗脱:0-25min:45%流动相a加55%流动相b,25-30min:5%流动相a加95%流动相b,进样体积为10μl,在254nm波长下测定9种生物胺的光谱。
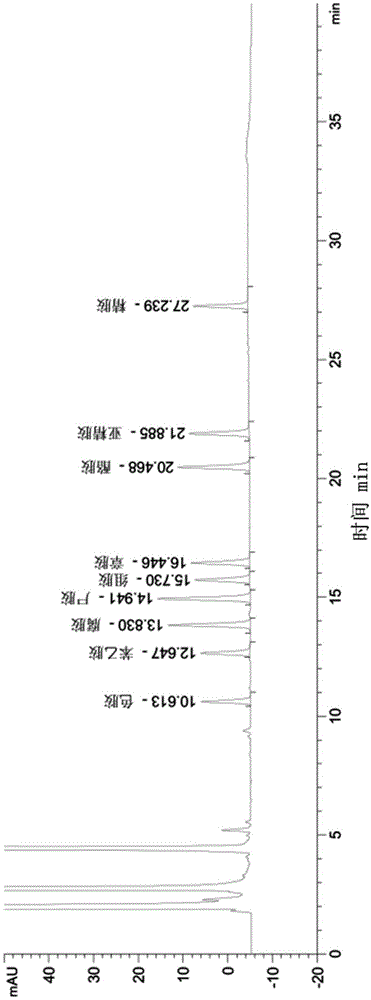
采用安捷伦1260高效液相色谱仪,按国家标准gb5009.208进行色谱条件检测,色谱分离图见图1。从图1可以看出,9种生物胺的峰完全出现大约需要27分钟,完成一次注射需要35分钟以上。
相比之下uplc平台具有耐高压、粒径小、分析速度快、分离效果好、灵敏度高、检测效率倍增等特点。9种生物胺的峰只需要大约5分钟就可以完全显现出来(见图2)。样品注射完成只需8分钟,峰形和分辨率良好,不受异色峰的干扰。适用于大批量样品的快速检测。标准溶液的色谱图如图2所示。从图2中可以看出,9种生物胺的峰清晰对称,没有异色峰的干扰,可以实现完全分离。
实施例2色谱柱的选择
在实施例1的uplc参数的基础上,对色谱柱进行了对比试验,区别在于:研究了acquityuplcbehc18(1.7μm,2.1×100mm)柱和acquityuplcbeh屏蔽rp18(1.7μm,2.1×100mm)柱。当使用acquityuplcbehshieldrp18柱时,9种生物胺的峰完成的时间比acquityuplcbehc18柱短,但是尸胺和组胺不能完全分离。当使用acquityuplcbehc18柱时,9种生物胺的峰值响应值高于acquityuplcbehshieldrp18柱。为此,选择了uplcbehc18柱。
实施例3流动相的选择
在实施例1的uplc参数的基础上,对流动相进行了对比试验,区别在于:比较了乙腈-水(与实施例1)、乙腈-10mmol/l醋酸铵缓冲液(体积比1:1)和甲醇-水(体积比1:1)三种应用最广泛的流动相体系。发现以甲醇-水为流动相,苯乙胺和腐胺、尸胺和酪胺的色谱峰不能完全分离。当乙腈-水为流动相时,尸胺和组胺的保留时间不够稳定,并且由于保留时间的漂移,两个组分不能完全分离,影响了定量的准确性。采用乙腈-乙酸铵缓冲盐溶液流动相体系时,各目标峰形状较好,对称,无尾现象,无杂峰干扰,组分分离完全,保留时间稳定。因此,本研究采用乙腈-10mmol/l醋酸铵缓冲盐溶液作为流动相体系。
实施例4线性范围和检测限的验证
在实施例1的参数基础上,配制浓度为0.1、0.5、1、5、10和20μg/ml的生物胺混合标准溶液用于检测。以生物胺混合标准溶液浓度为横坐标,峰面积为纵坐标,绘制了标准曲线。线性方程和线性相关系数如表2所示。
表29种生物胺标准曲线
在0.1~20μg/ml范围内,9种生物胺的浓度与峰面积呈良好的线性关系(r>0.999)。
实施例5方法回收率和精密度
将不同浓度的生物胺混合标准溶液加入到葛根样品中。用该方法进行检测。并进行了标准加入回收率和精密实验。表3所示的结果表明,9种生物胺在20、50和200mg/kg的水平上均出现尖峰,平均回收率为75.6%~97.2%(n=6),相对标准偏差(rsd)为0.12%~5.32%(n=6),满足试验方法对回收率和精密度的要求。
表3葛根样品中生物胺加标回收及精密度结果(n=6)
图3和图4中示出了葛根样品的色谱图和附加标准的色谱图。
实施例6样品预处理的改进
在实施例1的基础上,对样品预处理进行方法调节,在加入饱和碳酸氢钠溶液和丹磺酰氯化物溶液之后,反应液中加入氧化钛吸进行吸附除杂处理,氧化钛比表面积180m2/g,吸附温度25℃,吸附时间为30min,吸附除杂完成后,将吸附剂离心分离,再将上清液在摇床中进行处理,后续步骤同实施例1。进行加样回收率和精密度的表征,结果如表4。
表4葛根样品中生物胺加标回收及精密度结果(n=6)
可以看出,经过样品液吸附除杂处理之后,可以提高检测的精度,并使回收率更精准。
另外,本发明还可以采用对氧化钛颗粒的表面进行氨基改性处理,其可以提高对生物胺的排斥力,选择吸附性更好。将上述的氧化钛吸附颗粒与2wt%甲基磺酸水溶液按照重量比1:100混合,升温至70℃保持2h,使氧化钛颗粒表面活化;再将氧化钛颗粒滤出、去离子水洗涤、烘干后,再加入至10wt%的3-氨基丙基三乙氧基硅烷的乙醇溶液中,活化氧化钛颗粒与乙醇溶液的重量比是1:90,于65℃保持3h反应,将产物滤出,依次用乙醇和去离子水洗涤、烘干,得到氨基改性氧化钛颗粒吸附剂。依同法对样品溶液进行预处理,在加入饱和碳酸氢钠溶液和丹磺酰氯化物溶液之后,反应液中加入氨基改性氧化钛颗粒吸附剂吸进行吸附除杂处理,吸附温度25℃,吸附时间为30min,吸附除杂完成后,将吸附剂离心分离,再将上清液在摇床中进行处理,后续步骤同实施例1。
表5葛根样品中生物胺加标回收及精密度结果(n=6)
可以看出,采用氨基处理后的吸附剂对样品处理,可以有效地提高待测成分与杂质的分离性,可以提高检测的精度,并使回收率更精准。
实施例5实际样品分析
用本研究制定的方法对12个不同产地葛根样品进行了分析。阳性样品的结果如表6所示。
表6葛根样品中生物胺的含量实际测定结果(mg/kg)
“/”表示检测检出
发现葛根中含有色胺、苯乙胺、腐胺、尸胺、亚精胺、精胺和组胺。含量在9.79mg/kg~125mg/kg之间。这与孙艳妮等人[11]测定吴茱萸中存在生物胺的结论不相矛盾。葛根和吴茱萸都属于根茎类植物,但之间有物种和生物胺含量的差异。
- 还没有人留言评论。精彩留言会获得点赞!