一种整合蛋白质组和糖蛋白组的定量分析方法与流程
本发明涉及生物化学领域,具体涉及一种整合蛋白质组和糖蛋白质组的定量分析方法。
背景技术:
人们已经发现大量疾病患者体内重要蛋白质及其糖基化修饰会发生异常变化,这种变化既包括蛋白种类、蛋白表达量、糖链结构、糖基化修饰位点、糖基化修饰程度等。因而深入了解这些重要蛋白质及其糖基化修饰变化,开发同时分析蛋白质组和糖蛋白质组的新方法,获取多维信息有助于理解疾病的发生发展机制并提供诊断标志物和治疗靶标。
但是目前缺少整合蛋白质组和糖蛋白质组的定量分析方法,原因在于技术方法上存在很多困难和挑战。
首先,在单独研究蛋白质组的样品前处理中,由于糖基化修饰丰度很低,因而糖肽在质谱检测中其信号会被非糖肽所抑制,因而只能对蛋白质进行定性定量分析。
其次,在单独研究糖蛋白质组的样品前处理中,糖基化肽段丰度很低,因此需要有效的糖肽富集方法富集糖肽并去除非糖肽的干扰,因而在质谱检测中只能得到糖肽的信息。
最后,传统的基于碰撞的质谱碎裂方法如碰撞碎裂(cid)会优先碎裂糖链,只能产生很少的肽段骨架碎片和很低的糖氧鎓离子,对于完整糖肽的鉴定是很困难的,因此需要寻找替代的碎裂方式,比如阶梯能量hcd碎裂的质谱分析方法(sce-hcd-ms/ms)。
此外,现有技术中对蛋白质组和糖蛋白组的研究主要是分别研究,整合定量分析蛋白质组和糖蛋白质组(完整n-糖肽以及去唾液酸的n-糖肽)的报道很少。zhanghui等建立了整合蛋白质组和糖蛋白质组的分析方法去研究前列腺癌细胞系,但是蛋白质组定量方法为itraq标记定量,并且糖蛋白质组为去糖基化的糖肽,因而该方法成本高、时间长,且丢失了糖基化位点特异性信息。
技术实现要素:
本发明的目的在于,建立了整合无标记的蛋白质组定量和完整n-糖肽、去唾液酸n-糖肽的定量分析方法。
本发明的技术方案包括:
一种整合蛋白质组和糖蛋白质组的定量分析方法,包括以下步骤:
(1)蛋白加热变性后,进行还原烷基化处理,打开蛋白的二硫键并烷基化封闭;
(2)在超滤管中使用胰蛋白酶将蛋白质酶切成肽段,离心即得肽段;
(3)亲水作用色谱hilic填料结合肽段,洗涤除杂,再洗脱即得完整n-糖肽;
(4)加入三氟乙酸并加热去除n-糖链外围唾液酸,得到去唾液酸的n-糖肽;
(5)使用hcd-ms/ms分析肽段得到蛋白质组数据,并使用maxquant软件进行定性定量分析;
(6)使用sce-hcd-ms/ms分析完整n-糖肽和去唾液酸的n-糖肽得到糖蛋白质组数据,使用xcalibur软件进行定性定量分析。
如前述的方法,步骤(1)所述还原烷基化处理使用终浓度为10~40mmol/l的二硫苏糖醇在50~60℃振荡反应45分钟,加入终浓度为25~100mmol/l碘乙酰胺在室温避光反应0.5~2h。
如前述的方法,步骤(2)所述超滤管的过滤孔径是30kda或10kda。
如前述的方法,步骤(2)所述酶切反应遵照如下参数:
酶用量:每100μg蛋白质使用2~10μg的酶;
反应溶液:50mmol/l的碳酸氢铵;
反应温度:37℃;
反应时间:2~16h。
如前述的方法,步骤(3)所述hilic填料是博纳爱杰尔的venusilhilic填料,粒径为3μm、5μm和/或10μm,孔径为
如前述的方法,步骤(3)所述结合条件是在室温旋转结合2h。洗涤除杂所用流动相为水、乙腈、三氟乙酸的混合液,体积比按前述顺序为:(10~30)∶(70~90)∶0.2。洗脱时用0.1~1%(v/v)三氟乙酸溶液洗脱。
如前述的方法,步骤(4)所述的优选反应溶液为0.1~1%(v)三氟乙酸溶液,反应温度为80℃,反应时间为1~2h。
如前述的方法,步骤(5)和步骤(6)所述的色谱条件为:
色谱柱:magicc18柱的内径为75μm,长度为15em,c18粒径为3μm。
流动相a液:0.1%(v)三氟乙酸的水溶液;
流动相b液:0.1%(v)三氟乙酸的80%(v)的乙腈溶液;
流动相b的线性梯度:5~32%;
流动相的流速:0.3μl/min。
如前述的方法,步骤(5)所述的质谱条件为:
质谱仪碎裂模式为hcd,时间为78min,流速为0.3μl/min。一级质谱离子扫描的质量范围为300~1400da,分辨率为120000,agc为5e5,最大it为50ms,排除时间18s;二级质谱离子窗口设置为1.6m/z,检测模式为离子阱,agc为5e3,最大it为35ms。
如前述的方法,步骤(6)所述的质谱条件为:
质谱仪碎裂模式为hcd,时间为78min,流速为0.3μl/min。一级质谱离子扫描的质量范围为800~2000da,分辨率为120000,agc为2e5,最大it为100ms,排除时间15s;二级质谱离子窗口设置为2m/z,检测模式为轨道阱,agc为5e5,最大it为250ms,开启阶梯碎裂能量,hcd能量为30%±10%。
如前述的方法,步骤(6)所述的数据处理方法为:
a.手工累计ms1谱图,生成去卷积后的质谱图;
b.将电荷状态归一到单电荷,去除单同位素峰以外的其它同位素峰,得到肽段信号;
c.生成信号列表,根据y1值,计算肽段质量;
d.用上述单同位素峰质量减去肽段质量,即为候选的糖型;去卷积后的峰强度对应前述糖型的丰度。
本发明具有以下有益效果:
首先,本发明使用超滤方法快速得到蛋白糖肽,再通过亲水作用色谱富集得到完整n-糖肽,最后酸法快速去除唾液酸得到去唾液酸的n-糖肽。相比以往的方法(使用超滤管辅助酶切法进行蛋白质组定量研究,或采用pngasef酶去除n-糖链之后对去糖基化的肽段进行定量研究,或对富集得到的完整n-糖肽进行定性研究,总计耗时约24小时),本发明步骤简单省时(总计约12小时)、操作容易、成本低廉,可同时得到蛋白质组和糖蛋白质组(完整n-糖肽、去唾液酸n-糖肽)的定性定量信息。
其次,本发明的分析使用的质谱仪为orbitrapfusionlumos,对于肽段采用hcd-ms/ms模式,对于完整n-糖肽和去唾液酸n-糖肽采用sce-hcd-ms/ms模式。使得肽段骨架碎片相对完整,对于n-糖肽还含有丰富的糖碎片信息以及y离子(肽段骨架和糖链碎片形成的y离子)信息,利于后期准确定性定量分析。
再次,本发明使用xcalibur软件,可实现对糖蛋白完整n-糖肽以及去唾液酸的n-糖肽的相对定量,为完整n-糖肽定量提供了一种新的办法,并且去唾液酸处理能够降低完整糖肽的复杂度,避免唾液酸的影响,定量结果更为可靠。
本发明的方法成本低、时间短,可同时获取蛋白质组、完整n-糖肽、去唾液酸n-糖肽定量的三维信息,在新型生物标志物发现以及疾病的发生发展机制研究等方面具有良好应用前景。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过具体实施方式对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
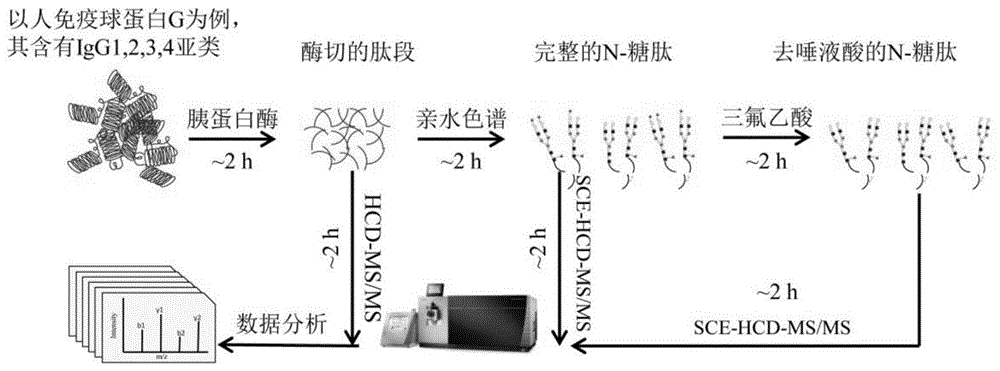
图1是整合蛋白质组和糖蛋白质组的定量分析流程图。
图2是igg的肽段一级谱图。
图3是igg的完整n-糖肽一级谱图。
图4是igg的去唾液酸n-糖肽一级谱图。
图5是igg的蛋白质组定量结果。
图6是igg的糖蛋白质组定量分析结果图;图中glycan(多糖)列的分子中,蓝色方块代表葡萄糖,绿色圆圈代表甘露糖,红色菱形块代表唾液酸,黄色圆圈代表半乳糖;#代表糖基化修饰位点;before代表完整糖肽;after代表去唾液酸的糖肽。
具体实施方式
本发明的实验流程如图1所示。
为使本领域技术人员更好地理解本发明的技术方案,下面结合附图对本发明做进一步详细描述。
缩写:iam,碘乙酰胺;tfa,三氟乙酸;acn,乙腈;abc,碳酸氢铵。
实施例1蛋白质igg的蛋白质组和糖蛋白质组样本制备
1.方法
(1)将100μg商品化的人源igg(sigma)溶于200μl的50mmol/l的abc溶液中,并在95℃加热10min进行变性。
(2)加入终浓度20mmol/l的dtt在56℃振荡反应45min,加入终浓度50mmol/l的iam在室温避光反应1h。
(3)反应液全部加入到10kd超滤管中,13000g离心15min×3次,每次用200μl的50mmol/l的abc冲洗。
(4)加入100μl的50mmol/labc和2gg胰蛋白酶(promega),在37℃振荡器中继续反应2h,13000g离心15min×3次,收集肽段,取1ug分装保存,其余冻干后-80℃备用。
(5)称取5mg的venusilhilic填料(博纳爱杰尔),先用0.1%tfa冲洗填料10min×3次,再用80%acn,0.2%tfa溶液平衡5min×3次。
(6)将步骤(4)中冻干的肽段使用80%acn,0.2%tfa溶液复溶,并与步骤(5)的填料混合,在室温旋转结合2h。
(7)然后转入到100μl移液枪头(c8固相萃取盘片作为筛板),3000g离心1min。
(8)用80%acn,0.2%tfa溶液再洗一次去除非特异结合的杂质,最后用0.1%tfa洗脱3次,得到纯化的完整n-糖肽。平均分成两管冻干,-80℃保存备用。
(9)将步骤(8)富集得到的纯化的完整n-糖肽取一管,加入200μl的0.2%tfa并80℃加热2小时。冻干后-80℃保存备用。
(10)加入10μl的0.1%的fa溶液重新溶解步骤(4)(8)(9)的肽段或糖肽,(4)中的肽段使用hcd-ms/ms分析,(8)和(9)糖肽使用sce-hcd-ms/ms分析。最后进行数据处理。
2.结果
如图2所示为本实施例中步骤(4)所获得的igg肽段一级谱图。由图可知肽段在色谱中的保留时间主要是在5~75分钟之间。
如图3所示为本实施例中步骤(8)所获得的igg完整n-糖肽一级谱图。由图可知完整n-糖肽段在色谱中的保留时间主要是在10~35分钟之间。
如图4所示为本实施例中步骤(9)所获得的igg去唾液酸的n-糖肽一级谱图。由图可知去唾液酸的n-糖肽段在色谱中的保留时间主要是在10~30分钟之间,与图3相比发生前移。经过去唾液酸化处理,其谱图复杂性与图3相比明显降低。
实施例2蛋白质igg的蛋白质组和糖蛋白质组质谱分析与数据处理
1.方法
(1)取实施例1中步骤步骤(4)(8)(9)的肽段、完整n-糖肽、去唾液酸的n-糖肽2μl进行质谱分析,每个样本重复分析三次,质谱仪为orbitrapfusionlumos质谱仪。
(2)色谱条件为:色谱柱:magicc18柱的内径为75μm,长度为15cm,c18粒径为3μm。流动相a液:0.1%(v)三氟乙酸的水溶液;流动相b液:0.1%(v)三氟乙酸的80%(v)的乙腈溶液;流动相b的线性梯度:5~32%;流动相的流速:0.3μl/min。
(3)对于蛋白质组分析的质谱条件为:质谱仪碎裂模式为hcd,时间为78min,流速为0.3μl/min。一级质谱离子扫描的质量范围为300~1400da,分辨率为120000,agc为5e5,最大it为50ms,排除时间18s;二级质谱离子窗口设置为1.6m/z,检测模式为离子阱,agc为5e3,最大it为35ms。
(4)对于糖蛋白质组分析的质谱条件为:质谱仪碎裂模式为hcd,时间为78min,流速为0.3μl/min。一级质谱离子扫描的质量范围为800~2000da,分辨率为120000,agc为2e5,最大it为100ms,排除时间15s;二级质谱离子窗口设置为2m/z,检测模式为轨道阱,agc为5e5,最大it为250ms,开启阶梯碎裂能量,hcd能量为30%±1o%。
(5)质谱分析获得的蛋白质组原始文件使用maxquant软件定量分析,参数设置为:a.酶切方式为胰蛋白酶;b.最大漏切位点为2;c.固定修饰为carboxyamidomethylation(c);d.可变修饰为acetyl(proteinn-term),oxidation(m),deamidation(nq);e.定量选择无标记定量(lfq);f.其它值均为默认值。
(6)质谱分析获得的原始文件使用xcalibur软件手工进行定性定量分析。先手工累计ms1谱图,并生成去卷积后的质谱图,将所有电荷状态归一到单电荷,去除单同位素峰以外的其它同位素峰。可以看多很多高质量肽段的信号,这些信号经输出后,生成的信号列表,用于计算igg糖肽段上的糖型,根据y1值,计算出肽段完整质量(mh+),用上述单同位素峰质量减去肽段质量,即为候选的糖型。将去卷积后的峰强度,赋予该糖型,即获得单个糖肽的所有糖型及丰度信息。
2.结果
如图5所示,igg含有四个亚类,分别为igg1,igg2,igg3,igg4,经过三次实验重复定量,结果表明igg1相对含量为71.68±0.41%;igg2相对含量为27.48±0.44%;igg3相对含量为0.20±0.01%;igg1相对含量为0.7±0.03%。变异系数均小于5%,表明定量重复性很好。
如图6所示,igg含有四个亚类igg1,igg2,igg3,igg4均含有完整的糖肽,其中igg3和igg4的糖肽段分子量一致,手工解析无法区别。经过三次实验重复定量,结果表明igg1的糖肽鉴定数量最多,高达26条具有相对定量信息,而igg2,igg3,igg4分别含有15,6,6条完整的糖肽。经过去唾液酸处理之后,异质性明显降低,从igg1,igg2,igg3、igg4分别定量到19,13,7,7条去唾液酸的糖肽。去唾液酸前后处理的糖肽定量信息有助于糖蛋白质组的准确分析,并且发现新的生物标志物。
综上,本发明可以简单快速有效地整合蛋白质组和糖蛋白组并实现定性定量分析,同时获得蛋白质、完整n-糖肽、去唾液酸的n-糖肽三维信息,有助于发现新型生物标志物,对于疾病发生发展的机制等研究提供实验依据。
- 还没有人留言评论。精彩留言会获得点赞!