水性全铜氧化还原液流蓄电池的制作方法
本公开涉及采用氧化还原液流蓄电池的储能,更具体地,涉及水性全铜蓄电池。
背景技术:
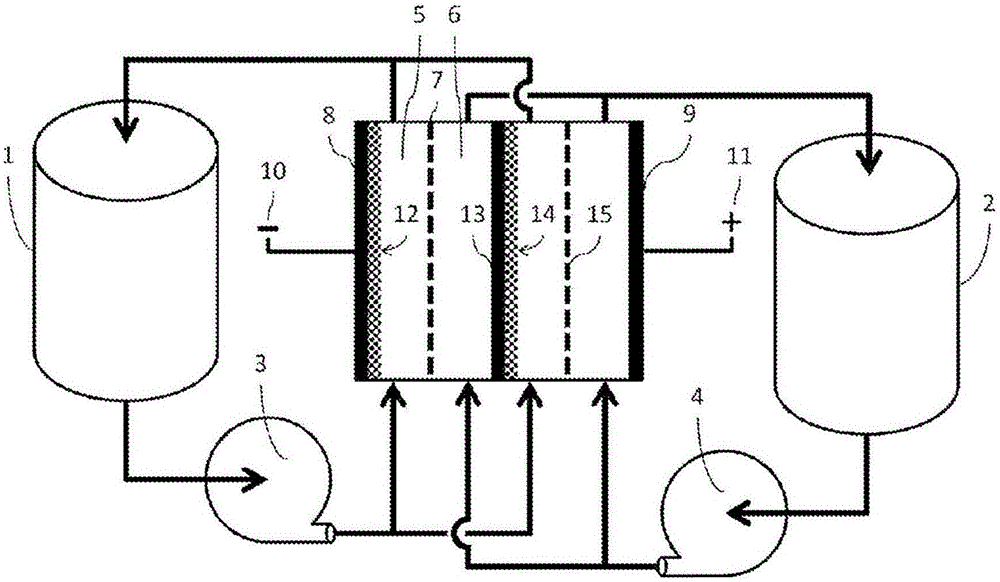
:在未来几十年中预期的对电的增长需求增加了开发用于由可再生能源例如风和日光进行能源生产的新技术的兴趣。但是,这些新的可再生能源的成功需要与竞争性储能设备的引入相结合,该竞争性储能设备用于负载均衡和调峰以致这些可再生能源能够与栅极连接。以这种方式,可以克服可再生能源的不可预期且间歇的产能行为的问题。对于电能存储,已示出电化学设备例如蓄电池和超级电容器与目前采用的其他储能系统相比,提供更高的效率。还原-氧化即氧化还原液流蓄电池(rfb)以化学的形式存储电能并且随后经由自发的逆氧化还原反应以电的形式分配存储的能量。氧化还原液流蓄电池是电化学存储设备,其中含有一个或多个溶解的电活性物质的电解质流经反应器电池,在此将化学能转化为电能。或者,能够使经放电的电解质流经反应器电池以致将电能转化为化学能。在液流蓄电池中使用的电解质通常由溶解于溶剂中的金属盐组成,将其存储在大的外部箱中并且根据施加的充电/放电电流将其泵送经过电池的每侧。通过泵送、重力自流进料、或者采用使流体移动经过系统的任何其他方法,能够使外部存储的电解质流经蓄电池系统。液流蓄电池中的反应是可逆的,并且能够在没有更换电活性材料的情况下将电解质再充电。因此氧化还原液流蓄电池的能量容量与总电解质容积例如存储箱的大小有关。在满功率下氧化还原液流蓄电池的放电时间也取决于电解质容积并且常常从几分钟变化到许多天。在各种用于储能的电化学设备中,与其他蓄电池技术相比,由于它们较高的容量,氧化还原液流蓄电池是海量存储的最佳选择之一。rfb通常采用两个在水性或有机介质中以高浓度可溶的氧化还原对,将它们存储在两个外部箱中并且泵送到电化学反应器中,在此将氧化还原对的一种物质转换为另一种,取决于对设备进行充电还是放电来存储或传输电子。电化学反应器可以由两电极电池的堆组成。两个电极通常由石墨双极板和碳毡组成。通过离子交换膜例如nafion将这些电极分离以避免正和负半电池电解质的混合。自1973年fe-cr液流电池的首次出现,已广泛地开发了多种rfb,包括杂化系统和化学再生氧化还原燃料电池。但是,只有铁-铬、全钒(vrb)、锌-溴和钠-聚硫醚(psb)电池已接近全面商业化。在这点上,电极中采用的不同材料、膜和电解质的成本的降低对于促进rfb在全球市场中的引入是必要的。以前在b.kratochvil和k.r.betty的文章(j.electrochem.soc.,121(1974)851854)和p.peljo,d.lloyd,n.doan,m.majaneva,k.kontturi的文章(pccp,16(2014)2831-2835)中已报道了基于乙腈的全铜氧化还原蓄电池,在w.w.porterfield,j.t.yoke的文章(inorganiccompoundswithunusualproperties,acspublications,washington,dc,第104页,1976)中已报道了基于离子液体的全铜氧化还原蓄电池,以及在d.lloyd,t.vainikka和k.kontturi的文章(electrochim.acta,100(2013)18–23)中已报道了基于低共熔溶剂的全铜氧化还原蓄电池。但是,由这些系统支持的电流还相当低。l.sanz,j.palma,e.garcía,m.anderson,j.的文章(powersources224(2013)278-284)公开了在1m的铜浓度下氯化物介质中cu(i)/cu(ii)氧化还原对的电化学可逆性的程度的研究。只讨论了正半电池反应。发现该氧化还原对的峰值电位分离的值与由钒氧化还原对显示出的那些相当,表明准可逆性行为。此外,观察到cu(i)/cu(ii)氧化还原对的表观电位向正得多的值的明显位移,达到由fe(iii)/fe(ii)氧化还原对显现出的实验电位,其也已被广泛地应用于液流电池中,例如在杂化全铁构造和更近期的fe-vrfb中。在全铜系统准备工业规模应用之前,需要解决已知的全铜系统中遇到的低电流问题。而且,由将不相似的元素用于两个电极反应所产生的跨越电池膜的交叉污染是忧虑所在,原因在于其降低稳定性并且缩短现有的rfb的寿命周期。仍需要可负担得起的工业规模氧化还原液流蓄电池设计,其能够提供技术上有用的能量效率,同时使用成本有效的电池材料。而且,该蓄电池的运转应该是环境上和职业上安全的并且可容易地扩大规模。技术实现要素:本公开的目的在于提供替代性低成本rfb。本公开的另一目的在于提供包括氧化还原对的rfb,所述氧化还原对的材料丰富、无毒并且在水中高度可溶。理想地,目的在于提供接近支持电解质的工作电位窗的阳极和阴极极限的氧化还原电位,其应该是高度传导且再循环简单的。本公开的又一目的在于提供能够提供适于工业规模设计和应用的效率的rfb。本公开中,铜物质的氧化还原过程适用于水性全铜氧化还原液流蓄电池设计,其中在混杂氧化还原液流构造中存在铜的三种氧化态。在两个半电池中采用相同的元素减少了跨越膜的交叉污染的问题,使得可使用简单且便宜的微孔分隔体。本公开的第一方面提供由权利要求1描述的水性全铜氧化还原液流蓄电池。在本公开的水性全铜rfb中,采用cu0-cu(i)-cu(ii)体系的化学以根据式1和2将电在蓄电池内存储和传送:正半电池反应:负半电池反应:在充电过程中在正半电池中将新的电解质转换为氧化态并且作为铜电沉积在负电极表面上。因此,放电过程中,将正半电池电解质中形成的铜离子再次转换为亚铜离子,而在负极侧发生铜沉积物的剥落。在本设计的公开中,这两个动力学上便捷的反应之间的电位差为约0.6至约0.7v,其与早期公开的结果一致。与通常使用的rfb化学组成例如公知的全钒或zn-br体系相比,本公开的水性全铜体系的电池电位低。但是,本公开表明,本公开的全铜体系的优异的动力学和简单性(即,不需要催化剂或离子交换膜)结合在水性介质中实现的电活性物质的高浓度使得该体系在能量密度、能量效率和每单位存储能量(wh)的成本方面同样具有吸引力。从经济的观点出发,本公开的全铜体系的功率密度足以用于工业规模应用。预期采用的材料的低成本和简单性抵消较大电池堆的成本的至少一部分。例如,在典型的全钒rfb中nafion膜和钒的组合使用是不经济的,因此降低了将这些体系在工业规模中使用的吸引力。在本公开的全铜体系中,可使用简单的分隔体,其成本通常比离子交换膜低20-100倍。较简单的分隔体例如微孔膜更好地适于大规模生产工艺,原因在于它们在电池装配过程中能够直接应用而无需预处理并且能够以卷状利用,该卷状能够为超过1米宽和1000米长。由于它们作为铅-酸蓄电池中部件的初步应用,因此它们在储能应用中的可使用寿命也有良好的记载。在本公开的体系中,由于较小的电池电位,式1和2的氧化还原过程都胜过析氯和析氢过程,因此不可能有气体析出。这是重要的简化并且两者消除了对电解质平衡机构的需要,并且安全地在整个充电状态(soc)范围中使较深的循环进行。关键地,与最常使用的元素钒相比,铜丰富、毒性较小并且可以以极高的纯度容易地获得。由于三种氧化态的使用,电解质的制备也是平常的。在放电状态下,在两个半电池中的电解质可以相同并且它们能够通过简单地使含有任何cu(ii)与cu(i)的比例的电解质与cu0反应而制备。此外,由于反应的动力学取决于碳材料,因此不需要催化剂。这不仅降低了体系的成本,而且通过除去额外的催化剂施用步骤而简化了生产。最后,这也使得能够更简单地预期电池的长期性能,原因在于避免了催化剂中毒的问题或其他可引起催化剂的长期失效的过程。最后,由于在宽温度范围例如5-70℃内没有发现电解质的稳定性的难题,因此将钒系统的热交换器去除。能够容易地在广泛的工业方法例如电解冶金法、或铜蚀刻中将该电解质再循环。在这些方法中,使用具有相似化学组成的铜溶液并且能够将废电解质直接送到相同的处理设施以将铜回收。因此,在蓄电池的寿命的末期,能够容易地将电解质的初期投资回收。相比之下,在更为异乎寻常的化学组成例如锌溴rfb中,不存在适于将废电解质直接处理的工业方法并且根据eu的蓄电池指令,制造商将必须开发它们自己的废电解质处理系统。附图说明图1a表示根据本公开的rfb构造的实例。图1b表示根据本公开的rfb构造的另一实例。图1c表示根据本公开的堆叠的rfb构造的又一实例。图2a和b分别表示铜(a)的沉积和剥落以及3mcu(i)溶液(b)中cu(i)/cu(ii)反应的循环伏安测定。图3a和b分别表示在40℃和60℃的温度下2-60ma/cm2的电流密度的范围中过电位的大小。图4a和b表示在40℃和60℃下的整体能量效率。图5表示在40℃下的全铜rfb的电流效率(ce)、电压效率(ve)和能量效率(ee)。图6表示在[cu]=3m;[cacl2]=4m;[hcl]=4m;t=40℃;i=20ma/cm2;fr=35ml/min下,全铜rfb的充电/放电循环的比较。图7表示在3m浓度的铜物质下全铜rfb的充电和放电循环的电流效率(ce)、电压效率(ve)和能量效率(ee)。图8表示根据本公开的另一电池构造。图9表示根据本发明的电池的详细的示意性构建。图10a和b分别表示在铂电极和玻璃碳电极下沉积和剥落反应的电流效率和密度的依赖性。图11a表示电流效率与充电和放电之间的休息时间之间的相关关系。图11b表示在60℃下完整的全铜rfb的电流效率与电流密度之间的相关关系。图12a表示图9中所示的rfb设计的极化曲线。图12b表示图9中所示的rfb设计的电流效率(十字)、电压效率(菱形)和能量效率(正方形)。图13a表示在图8中所示的rfb的43个循环过程中的电流效率(菱形)和可达到的soc范围(十字)。图13b表示在图8中所示的rfb的43个循环过程中充电(圆形)和放电(正方形)后的ocp值。具体实施方式术语电池意味着进行电化学能量转换的最小单位。电池通常由分隔体分隔以形成两个半电池。将几个电池一体化(串联或并联地电连接)以得到较高的电流或电压或两者的设备称为蓄电池。术语蓄电池可以指单一的电化学电池或多个电连接的电池,即电池堆。在液流蓄电池系统中可将这些电池堆叠在一起以实现所需的功率输出。本文中术语电池和蓄电池可互换使用。术语全铜意味着采用式1和2中所示的两个电池反应的电池。即,在负和正半电池中的电极反应分别为如下反应的电池:1.在负电极处的氧化还原反应为充电过程中cu+的还原以形成cu0(金属铜)和放电过程中cu0的氧化以形成cu+2.正电极处的氧化还原反应为充电过程中cu+的氧化以形成cu2+和放电过程中cu2+的氧化以形成cu+术语分隔体意味着将两个半电池电解质的混合最小化同时仍容许两个半电池之间的离子物质的充分的转移以使电流通过电池的任何材料。术语支持电解质意味着任何能够溶解于在蓄电池中使用的溶剂中以形成的化学物质,该离子物质将提高电池中两个电极之间的电流的离子传输而自身在正常运转过程中在任一电极处不经历氧化还原反应。支持电解质也能够作为配体源发挥功能以改善铜的溶解度、增加电池电位或者提高氧化还原反应的动力学。本公开提供水性全铜氧化还原液流蓄电池。该蓄电池包括以下部件:(i)至少一个第一半电池室,该第一半电池室包括第一电解质水溶液和第一,负电极,该第一电解质水溶液包含铜化合物和第一支持电解质,(ii)至少一个第二半电池室,该第二半电池室包括第二电解质水溶液和第二,正电极,该第二电解质水溶液包含铜化合物和第二支持电解质,(iii)位于该第一半电池室的外部的用于第一电解质的第一外部存储箱,(iv)位于该第二半电池室的外部的用于第二电解质的第二外部存储箱,(v)用于使电解质在半电池间往复循环的装置,和(vi)在第一半电池和第二半电池之间、将半电池溶液彼此分离的分隔体。这些半电池经构造以进行用于对该蓄电池充电和放电的氧化和还原反应。在例示的实施方案中,在本发明的蓄电池中,第一电解质和第二电解质初始是相同的,即,电解质溶液在初始0%充电状态下为相同的溶液。这通过需要只制备单一的电解质溶液而使箱溶液的制备简化,其又是容易制备的,原因在于任何cu(i)或cu(ii)化合物的混合物能够溶解在支持电解质溶液中,于是与金属铜反应以自发地形成只含有cu(i)和任选的痕量cu(ii)的溶液。该反应与放电过程中蓄电池中发生的反应基本上相同。在本发明的蓄电池的例示实施方案中,第一电解质和第二电解质在初始0%充电状态下在电解质溶液中主要包括cu+离子,任选地,只存在可忽略不计的cu2+离子。痕量或可忽略不计的浓度优选地意味着小于0.01m的cu2+离子的浓度。在本发明的蓄电池的例示实施方案中,第一电解质和/或第二电解质的铜化合物包括铜盐,优选地卤化铜盐,更优选地氯化铜盐。在本发明的蓄电池的例示实施方案中,第一电解质和第二电解质可通过向其中添加金属cu而制备。特别地,由于使用的cu+前体的污染,电解质溶液可含有痕量的cu2+或残留的氧,原因在于制备工艺可能引起氧化,添加一些金属cu以激发cu2+到cu+的自发反歧化反应是有利的。优选地,金属cu为细粉状,例如商购可得的铜粉。最优选地,铜粉具有小于425μm的晶粒尺寸和大于99.5%的纯度(基于痕量金属),其可由例如sigma-aldrich提供。在例示实施方案中,本发明的蓄电池的第一电解质和第二电解质还包括卤化物配体,形成支持电解质。在蓄电池中,第一支持电解质和/或第二支持电解质包括卤化铜盐以外的卤化物盐。这些盐,尤其是氯化物盐是最适合的铜的络合剂,并且络合物能够在水性介质中以非常高的浓度溶解。优选地,将氯化物盐,更优选地氯化钠、氯化钾、氯化锂、氯化铵、氯化镁、氯化氢和氯化钙、最优选地氯化氢和氯化钙用于形成富卤化物的支持电解质。使用的电解质的成本低,最优选的氯化氢或氯化钙的电解质是制备简单并且容易再循环。最优选地,支持电解质包括氯化氢以使ph稳定。电解质溶液的卤化物浓度优选为4-20m,更优选为8-15m,例如8-10m。该浓度适宜通过将氯化亚铜(cucl)和适合的支持电解质溶解于水而得到。由于高卤化物含量,尤其是氯化物含量,使一价铜离子(cu+)稳定并且铜能够高效率地经历两个氧化还原反应,氧化还原电位相差约0.65v。新的或0%soc电解质溶液的铜含量优选为1-4m,更优选为2-3m。起因于高铜溶解度前体的使用的高铜量有助于补偿较低的电池电位,优选地约0.6v。cu:cl比优选为至少1:3以确保实现尽可能大的电池电位。电解质的ph优选不大于2,更优选不大于1.5,以防止不溶性cu(oh)2物质的形成。为了采用这些反应,下述的电池、或电池的集合需要由适合的惰性电极材料和分隔体构建。在例示实施方案中,本发明的蓄电池中的第一电极和第二电极由惰性材料制成。惰性电极的作用在于提供反应能够发生的表面并且将这些反应中传输的电子传导到下一反应位点或外部电路。在另一例示实施方案中,其中将两个电池堆叠地配置,第一电池的第二电极和第二电池的第一电极为惰性材料的单一双极板的相对面,因此电流直接通过双极板而在两个电池之间经过。优选地,第一电极和第二电极选自由以下组成的组:铂;钛;不锈钢;碳-聚合物复合材料,例如炭黑-聚合物复合材料,膨胀石墨-聚合物复合材料例如来自sglcarbon的sigracet;和普通碳,或者它们的任意组合。更优选地,电极由碳,例如玻璃碳、玻璃碳碳糊、石墨或膨胀石墨箔制成。在商业应用中金属电极的使用通常受到限制,原因在于长期腐蚀问题,尤其是对于材料例如不锈钢。在构建具有双极电极的电池堆时,该问题变得特别明显。在例示实施方案中,所述分隔体的材料选自由以下组成的组:微孔分隔体,优选二氧化硅-pvc(聚氯乙烯)复合材料或二氧化硅-pe(聚乙烯)复合材料。或者,可使用阴离子或阳离子选择性传导材料例如离子交换膜,优地nafion;离子导电陶瓷,优选锂离子导电陶瓷。由于它们具有吸引力的性价比,因此最优选的材料为微孔材料或纳米孔材料。分隔体的作用在于防止两个半电池中电解质的混合和起因于cu2+与cu反应的电池的自发放电。分隔体材料最优选地选自为铅酸蓄电池应用开发的微孔材料和公知的材料例如商品聚合物-二氧化硅复合材料例如amersil或daramic。可提高本公开的蓄电池的运转温度以提高该蓄电池的性能。优选地,所述第一和第二电解质的温度为至少50℃以避免放电过程中铜沉积物的钝化。在该蓄电池的运转过程中,更优选地,该温度为至少55℃,最优选地至少60℃。在较高的温度下获得改善的溶解度和较好的电导率以及大规模传输。升高温度的要求很适于目标应用,原因在于通常需要重大的工程计划和成本以防止例如vrfb中的过热。在本公开的全铜蓄电池的情况下,运转温度的升高是高度有利的,相反是所需的。例如无需热交换器以将产生的过剩的热除去。在一个实施方案中,由图1a表示根据本公开的蓄电池。该蓄电池采用两种电解质,它们被分别存储在独立的外部箱1和2中。分别使用两个泵3和4将电解质传输到电池中。电解质溶液的循环必须保持由分隔体7分隔的两个半电池室,即负半电池5和正半电池6中足够的试剂浓度以防止电解质混合和自发放电发生。在充电过程中在惰性负电极8和正电极9处将两个半电池中的试剂还原或氧化。在放电过程中发生相反的情形,在负电极和正电极处发生试剂的氧化和还原。通过负端子10和正端子11将负电极和正电极连接至外部电系统。在根据本公开的水性全铜蓄电池的情况下,在负电极处发生式1的氧化还原反应。在充电过程中,将溶液中的cu+还原以形成金属cu,这在惰性负电极8上形成固体沉积物12。在放电过程中,将金属cu沉积物氧化以形成溶解的cu+离子。在全铜蓄电池中,发生式2的正电极反应。在充电过程中将cu+转化为cu2+,在放电过程中将cu2+转化回cu+。原则上,在将蓄电池完全放电时,两个半电池和存储箱中的电解质是相同的纯cu+的溶液。在本公开的另一实施方案中,使用根据图1b的多个电池,即液流蓄电池堆。该运行理念类似于图1a的单电池构造。存在相同的箱1和2以及泵3和4。通过位于该堆的端部的负电极8和正电极9将该堆仍与外部电系统的负端子10和正端子11连接。但是,该堆现在由以双极性构造运转的共用中央电极13串联连接的两个电池组成。在该双极性电极13的左手侧,根据式2的反应发生,在右手侧,根据式1的反应发生并且形成铜沉积物14。经过每个电极的总电流在整个堆中恒定。该构造中,在负端子10和正端子11处测定的堆的电压为图1a的基本电池乘以电池的数目所得的值。对于图1b的特定构造,将图1b中所述的基本概念的电池电压翻倍。在根据图1c的本公开的另一实施方案中,描绘了第三种可能的构造即堆叠构造。该构造中,通过泵3和4使存储箱1和2中的电解质再次循环。但是,在单极性电极的阵列处发生电化学反应。将每个负电极8和9或者正电极10和11分别与共用负或正母线(未示出)连接。将该负和正母线进而与外部电系统的负和正端子连接。在图1c中示出合计三个电池,在该阵列中每个正电极和负电极之间的电压差是恒定的,并且与图1a中的单电池概念中相同。电流与电池的数目成比例,因此与图1a相比高三倍。两个最外电极8和11中的电流将与图1a的那些相同,而两个中央电极将经历两倍高的电流。在本公开的例示实施方案中,提供蓄电池,其包括数目为2-1000的多个堆叠的电池。优选地,电池数目为至少20以得到约12v的电压;并且优选地,其为200以下,该设定经测试并且具有功能性。通过在液流蓄电池中采用堆叠的构造来改善电压效率。获得小于1.6ωcm2的面积比电阻(asr),其显著地低于对vrfb进行初期开发工作过程中报道的值。通过优化电极并且增加其表面积,可以得到更低的值。本公开的蓄电池能够提供对于两个电极过程都优异的电流效率,即使在高电流密度和酸度的极端条件下。在150macm2的电流密度下使该蓄电池循环时,可获得至少90%、优选地至少95%、例如98%的往返(roundtrip)电流效率。本公开的蓄电池的能量效率为至少70%,优选地至少72%。用本公开的设计实现的至少20wh/l的能量密度与传统的钒氧化还原液流蓄电池相当。在例示实施方案中,在40macm-2的电流密度下对于本公开的水性全铜蓄电池获得了72%的往返能量效率,其与对于锌-溴氧化还原液流蓄电池报道的值相似。在本公开的一个方面中,提供上述的水性全铜氧化还原液流蓄电池用于以化学形式存储电能并且以电的形式分配存储的能量的用途。具体地,储能非常适合于工业规模存储操作。特别地,在应用堆叠的电池构造时,储能容量满足工业应用的需要。以下参照实施例对本公开更详细地且具体地进行说明,实施例并不旨在限制本公开。实施例1-4电解质制备由氯化cu(i)(>99%纯度,acrosorganics)盐制备用于填充两个外部存储箱的cu(i)电解质。在不同的循环试验中铜的浓度从1m变化到3m。为了增加氯化物的浓度,将氯化钙(>95%纯度,scharlau)和hcl(37%panreac)在两个半电池中用作混合的支持电解质。在所有溶液中,酸和盐各自的浓度是相同的;在1m和3m铜浓度的电解质中分别为2m酸和4m盐。亚铜离子容易被氧氧化,因此为了使在电解质的制备过程中能够形成的铜离子减少,在与铜切屑(fluka,>99.0%)接触下在温和的加热下对溶液进行搅拌直至它们变为完全无色。但是,在电解质的制备中不需要进一步的程序。电池装配使用夹层式流动反应器(microflowcell,electrocell)构建根据图1a的单一液流电池,在两个半电池中具有10cm2活性面积的石墨电极。为了分别记录每个电极的过电位,将铂导线伪参比电极放入正半电池中。作为负半电池中的电极也测试了不锈钢和钛箔,以评价它们作为用于铜的电沉积的基材的性能。采用pvc-silica(amersils10)的纳米孔隙复合分隔体。分隔体的厚度为0.6mm并且孔隙率的大小为70%,孔径为0.08微米。泵和存储通过蠕动泵(masterflexl/seasyload)来控制流量并且管道由pvc(nalgene,3.6mm内径)制成,其特别适合使用浓hcl。使用水浴使气密密封的玻璃电解质外部存储箱恒温。将温度计插入箱的内部以监测电解质本体中的温度。此外,将磁力搅拌器放入箱中以保持物质的均匀混合。在注入箱内之前用氩气对电解质轻轻地进行吹扫。在实验过程中不能完全地避免氧经过pvc管道的扩散。循环试验在已将系统从0初期充电到50%充电状态(soc)后,以恒电流进行各种充电和放电循环实验。为了在宽范围的电流密度中确定充电过程和放电过程两者的过电位,改变温度和流量。将电位限制为在充电时升至0.9v并且在放电时降至0.3v。也进行恒电流下的充电和放电实验以研究大于20个循环中过程的稳定性和劣化。流量高到足以确保物质在电池室内的良好的对流(35ml/min),同时每个箱中电解质的容积为25ml。电流密度为20ma/cm2并且充电循环的持续时间为1小时,于是在每个循环中从50%至60%使soc变化10%。实施例1使用rfb测定过程中采用的相同的电解质(3mcucl,4mhcl/cacl2)和温度(60℃)对初期伏安研究进行测定,并且继续地采用相同的电解质和电极进行。参比电极为铜导线。为了简化解释并且使结果尽可能可理解,只在每个测定之间使电极旋转以更新电极前的溶液,否则电极是静止不动的。图2a和2b分别表示gc工作电极(5mm玻璃碳,pineresearchinstrumentationafe3t050gc)处的cu(i)/cu0和cu(ii)/cu(i)过程。该图分别描述了铜(a)的沉积和剥落以及3mcu(i)溶液(b)中cu(i)/cu(ii)反应的循环伏安测定。使扫描速率在0.2与0.02v/s之间变化。为了清楚,在图2a中只示出每秒钟扫描。箭头表示增加扫描速率的方向。负半电池反应对于玻璃碳(gc)电极上铜沉积的成核,看起来需要100mv左右的过电位。一旦成核发生,在使用的各种扫描速率之间的差异不明显。在剥落过程期间能够观察到轻微的扫描速率依赖性,另一个过程在较低的扫描速率下明显(在图2a中标记为b)。该效果表明在含有氯化物的溶液中铜的剥落通过两个阶段进行,即在铜表面上形成吸附的cucl沉积物的初始过程以及随后的[cucl2]-络合物的形成。放电过程中在负电极能够实现的极限电流密度可能与溶液中游离氯化物的传输局限性或cucl2-形成的动力学有关。考虑到在实际的rfb中计划的工作电流为20macm-2左右,因此在沉积过程中观察到的电流密度是有利的。将沉积和剥落的过程中经过的充电整合时,发现库伦效率为85±2%,这表示寄生损失。相比之下,将电位在-0.15v切换时,库伦效率增加到94±2%。正半电池反应图2b清楚地表示根据式1的反应具有便捷的动力学。也没有看到复杂的均相反应。使用randles-sevcik公式对于图2b中所示的每个阳极峰值电流确定cu(i)络合物的扩散系数,发现为1.47±0.03·10-6cm2s-1。使正半电池反应与析氯反应相差0.8伏特左右,因此析氯和析氧都没有发生。实施例2对于电流密度的宽范围研究温度和流量的影响。温度和流量条件是影响蓄电池在其运转过程中的性能的两个主要参数。因此,在蓄电池能够以合理的效率适当地充电和放电时确定这些变量的初始值是重要的。作为本公开的理念的证明,在下述实验中使用了2m/hcl/cacl2中1m浓度的cucl的电解质。在40和60℃下改变流量和电流密度,在初始预充电以在电解质中达到50%soc后进行10分钟的短充电和放电循环。将在2-60ma/cm2的电流密度的范围中充电或放电中的过电位的大小示于图3(a和b)中。该图表示全铜rfb;电极:石墨;电解质:1mcucl/2mcacl2/2mhcl;分隔体:amer-sils10;流量:(正方形)14ml/min;(圆形)35ml/min;(三角形)70ml/min;(星形)140ml/min;a)t=40℃;b)t=60℃的放电时的过电位。这些过电位表示充电/放电步骤之前电池的开路电位(ocp)与该充电/放电步骤期间电池的电位之差。也能够观察到温度和流量的影响。这两个参数直接影响电池的性能,原因在于在液流蓄电池的运转过程中使这些变量增大时使过电位显著地减小。在固定的温度下,由于反应器内对流的改善,因此能够在该系统中施加的电流密度随着流量升高而增大。温度升高也容许在较低的流量下使用较高的电流密度,这对于使泵的功率消耗最小化是重要的。在60℃下能够容易地施加20或30ma/cm2左右的电流密度,而在合理的流量下过电位并没有那么重要。图4(a和b)中示出的整体能量效率在2ma/cm2的低电流密度下接近100%并且独立于流量的大小。该图表示温度和流量对全铜rfb;电极:石墨;电解质:1mcucl/2mcacl2/2mhcl;分隔体:amer-sils10;流量:(正方形)14ml/min;(圆形)35ml/min;(三角形)70ml/min;(星形)140ml/min;a)t=40℃;b)t=60℃的能量效率的影响。但是,随着电流密度的十倍增加,其显著地减小,表明rfb的目前构造的操作限制。实施例3研究了温度对于循环稳定性试验的影响。在1m浓度的铜物质下体系的电压效率(ve)在40℃下为70%左右并且在60℃下稍高,其中能够实现80%,如表1中能够显示那样,表1表示在不同温度(i=10ma/cm2;流量35ml/min)下全铜rfb的电池电位。表1.温度(℃)ec(v)ocv(v)ed(v)ve(%)400,580,520,4272600,60,540,4880库伦效率和因此能量效率受到温度上升的显著影响。在60℃,在第三循环中电流效率(ce)降低到40%,表示起因于上述渗透(crossover)的体系的快速容量损失。因此,在该温度下没有达到能量效率(ee)和ce的目标值。但是,在40℃下,蓄电池的性能在大于20次循环中稳定,分别示出约80%和60%的ce和ee值,如能够在图5中观察到那样,该图表示在40℃;电极:石墨;电解质:1mcucl/2mcacl2/2mhcl;分隔体:amer-sils10;流量:35ml/min下全铜rfb的ce、ve和ee。运转温度不仅影响电池内反应的电化学性能,而且影响在负电极表面上形成的铜沉积物的结构和形态。在60℃下,铜沉积物更为紧密并且均质,具有清晰的五边形几何形状。晶粒尺寸约为50-100微米的范围,基于sem测定。在40℃下,由于颗粒倾向于形成聚集体,因此颗粒较小并且它们的形状不清晰。这些聚集体的尺寸为约100微米或更高。实施例4能够在该体系中应用的增加电流密度的对策之一是电极设计和结构。在这些实验中,将石墨负电极用没有任何预处理的不锈钢(a316)箔和钛箔(>99.6%纯度,goodfellow)替换。表面积保持10cm2。电解质为每个箱中40℃下的25ml的3mcucl/4mhcl/4mcacl2。循环以20ma/cm2的恒定电流在约50%的初始soc(预充电)下开始。由于金属表面上电沉积和剥落过程的改善,ce增加,如能够在图6中观察到那样,该图表示[cu]=3m;[cacl2]=4m;[hcl]=4m;t=40℃;i=20ma/cm2;fr=35ml/min下全铜rfb的充电/放电循环的比较。在全部情形下充电概况非常稳定。但是,在使用不锈钢作为负电极时观察到充电中略微的过电位。该效应归因于寄生腐蚀过程(主要在接触部),并且上石墨和钛电极上最小化。表2(电流密度为20ma/cm2且温度为40℃)中,由充电和放电循环的电位和持续时间的平均值计算三个体系的电流效率(ce)、电压效率(ve)和能量效率(ee),并且在温度、流量和电流密度的相同实验条件下将它们进行比较。如前所述,在使用金属电极时,ce明显改善。但是,在所有情形下ve非常相似,因此由于较高的ce值,在金属电极下总ee得到改善。表2.体系(t=40℃)i(ma/cm2)ce(%)ve(%)ee(%)βm石墨-石墨207060423m石墨-ss208857473m石墨-ti20905850因此,采用金属基材看起来对于铜的电沉积过程有利,特别是当使用耐化学性金属例如钛时。但是,一般的不锈钢的性能非常接近于由钛电极表现出的性能。将3m浓度的铜物质下全铜rfb的充电和放电循环的效率示于图7中。在20ma/cm2下效率在几乎50次循环中非常稳定,然后开始降低到83%ce、47%ve和40%ee的值。低效率不仅可归因于长循环过程中体系的化学组成的无效。而且,与在给定的电流密度下能够实现相比,反应器、连接部位的简单设计、氧通过pvc管线的扩散以及可观察到的经过分隔体的渗透限制了效率。实验后不锈钢电极的表面上形成的铜的沉积物的显微镜和sem像表明颗粒显著地小于(10-20微米)在石墨电极的表面上形成的颗粒并且层紧密得多。颗粒的结构和几何形状清晰。铜沉积物的形态直接影响电化学活性,更重要地,直接影响在氯离子存在下该金属的腐蚀行为。晶粒尺寸的减小导致改善的物理和机械性能例如粒间腐蚀和应力腐蚀开裂(scc)。因此,在使用金属基材时液流电池的ce的改善也能够归因于铜沉积物的较高的稳定性(由于它们的结构和较小的晶粒尺寸)。实施例5-9采用根据图8的电池构造进行进一步的试验。这些实验中,如下制备电解质:0%充电状态电解质将足以分别实现2m和8m的浓度的无水cucl(无水氯化铜(i)粉,97%,alfaaesa)和发烟hcl(37%,merck)称重到烧瓶中,并且用蒸馏水使其成为目标的体积。通过原始的cucl盐的污染或者制备过程中氧的侵入,该电解质不可避免地含有痕量的cu2+。在将电解质装载到电池中之前,通过添加少量的铜粉(99%,britishdrughouse)并且将烧瓶摇动1分钟左右能够将该污染物除去(此刻电解质应为无色)。在电化学电池的填充过程中仔细地将电解质从烧瓶倾倒以防止将任何铜粉转移。50%充电状态电解质在某些实验中,希望使用模拟50%充电状态(soc)下的条件的电解质来使体系初始化。在负半电池电解质的情况下,这通过使用与上述相同的方法(但是,使cucl浓度减小到1m)制备溶液来实现。在正半电池电解质的情况下,同样将cucl的浓度减小到1m并且添加另外的1m的cucl2(riedeldehaen,purum),得到cu2+和cu+等摩尔的溶液。在50%soc下制备正半电池电解质时,没有进行与铜粉的反应以防止cu2+还原为cu+。负电极反应的电流效率的评价为了独立地研究沉积和剥落反应的效率,用0%充电状态电解质的cu+电解质填充恒温且气密的玻璃电池。该电池用于进行三电极测定,工作电极为旋转圆盘电极(rde)顶端(5mm活性电极面积,pineinstruments,没有采用旋转,铂或玻璃碳活性电极材料),并且准参比电极和对电极都为2mm直径a级铜导线。将电解质剧烈地搅拌以确保将新的电解质连续供给到工作电极的表面。将少量的铜切屑(>99.0%,fluka)添加到该电池的底部以确保将形成的任何cu2+(例如由于氧渗透)转化为cu+。在开始搅拌15分钟后通常实现完全无色的电解质。通过使用autolabpgstat12恒电位仪从工作电极恒电流地沉积和然后剥落铜,从而评价沉积和剥落过程的电流效率。在剥落的过程中监测电极的电位,如果电位升高到高于0.45v,则中止剥落过程。如果由于钝化,铜沉积物的剥落不完全,则通过反复施加0.3v的恒电位一分钟的时间直至开路电位(ocp)回复到高于0.3v的值,来将电极回复到最初的原始状态。起因于cu2+的渗透的电流效率损失的评价为了开发成本有效的rfb,看起来需要用更为成本有效的材料例如微孔分隔体(其至少具有较低单位成本的量级)来替换昂贵的全氟离子交换膜。这些材料是非选择性的并因此在正半电池电解质中存在的cu2+离子将不可避免地经过分隔体扩散并且与负半电池中存在的铜反应,导致蓄电池的自放电。使用以前在rfb研究中已使用的商业铅酸蓄电池分隔体,即daramic(0.5mm普通微孔聚乙烯)。采用渗透性电池以研究渗透。通常将这些用于研究燃料电池膜中的相似的寄生过程,例如直接甲醇燃料电池中经过nafion的甲醇渗透。在燃料电池渗透性实验中不通常使用的两个电极将渗透性电池变形为极其简单且可靠的小型rfb,其具有仅5ml的电解质容积。该体系也具有直至95℃的范围内的精确温度控制和最小的腐蚀问题。在这些实验中,每个石墨电极(faber-castelltk9071,2mm,石墨复合材料)的面积接近分隔体的面积,分别为0.6cm2和0.5cm2。这类似于图9中所示的较大电池中的状况。通过用cu+和混合的cu+-cu2+电解质来填充负和正半电池(其模拟具有50%soc下的两种电解质的体系)来评价经过分隔体渗透的cu2+的速率。然后,在200s的初始充电步骤、然后放电下在5-200macm-2的电流密度的范围中使该电池循环。在每个电流密度下进行10次测定以在进入到下一电流密度之前使体系达到平衡状态。在这些测定过程中没有更换电解质。单电池rfb的构造和运转使用下述的简单方法,由成本有效且可广泛利用的材料制备具有18cm2的电极表面积的单电池rfb。将微孔分隔体材料在两个膨胀石墨箔电极(sglgroup,0.6mmsigracelltf6)之间压缩,将框型垫圈(硅橡胶,2mm,hexameroy,finland)插入分隔体和箔之间以产生电池室。通过在每个电池室的顶部和底部在电极中冲出的小开口的两条管线从这些室的端部将电解质引入和抽出。这些孔使得液体在电极后面的歧管中往复通过,其通过在橡胶片材(有机硅橡胶,4mm,hexameroy,finland)中切出两个大的矩形缝隙而形成。这些缝隙分别跨越开口的顶或底线并且位于每个半电池的入口和出口连接器的正下方。将该构造方法示于图9中。贮液池是两个气密且恒温的玻璃容器,每个填充有80ml的电解质。通过两个速度可程控的离心泵(iwaki,rd-12te24-n1v12)使电解质循环,这两个速度可程控的离心泵在它们的最低流量(0.22l/min,其为最大流量的2%)下运转。实施例5研究了沉积和剥落反应的效率。在图10a中显示了在三电极电池中的ptrde顶端上铜的沉积和剥落的电流效率和电流密度之间的依赖性。在20-125macm-2之间的电流密度下,沉积和剥落反应的往返电流效率,ηi,阴极,相对恒定,其值为98±3%。在超过125macm-2的电流密度下,在剥落过程中电极钝化并且电流效率急剧下降。这与循环过程后观察到的ocp值的相关性强,在高于125macm-2的电流密度下相对于铜导线准参比电极,电极显示出可忽略的电位差。这表明铜沉积物的不完全剥落。在较低电流密度下使剥落过程再活化时,其成功地完成并且使电极的表面回复到最初的原始状态。基于这些观察,看起来125macm-2的电流密度可能是由负电极表面反应所支持的最大值。这在125macm-2的电流密度下改变沉积和剥落过程的持续时间时得以确认,而在至多30分钟的沉积时间的范围内体系显示98±1%的稳定的电流效率。这些测定证实在全铜体系中大幅地避免了析氢的问题,并且在20-125macm-2的电流密度的宽范围内所需的负电极反应以良好的效率发生。这与以前对于基于锌沉积的rfb报道的结果(其中在低于50macm-2的电流密度下电流效率从95%降低到80%)相比特别有利。图10b中所示的玻璃碳电极处的结果证实在低电流密度下的效率差得多,这与铂电极形成鲜明的对比。这是由于在该材料上铜成核的低速率,由于沉积步骤的短的持续时间,导致惰性电极的不完全覆盖和局部铜岛状物的生长。在低电流密度下,存在少得多的产生的成核位点,并且由于它们具有比几何形状电极表面小的表面,因此在剥落过程期间它们变得更容易被钝化。如上所示,当使用较长沉积时间时,碳材料能够提供与铂同等良好的电流效率。实施例6.也将三电极电池用于进行测定,其中将100macm-2的充电电流密度施加60秒,然后将铂电极保持在零电流密度即ocp,以改变在铜沉积物的剥落之前的时间段。该方法模拟被充电和然后在放电之前在空闲状态下放置的蓄电池的负电极的作用。将电流效率和休息时间之间的相关关系示于图11a中。效率的降低表明存在着在铜电极处发生的缓慢的腐蚀过程,等同于0.1macm-2左右的寄生电流。该相对地可忽略的效果也可归因于氧向电池内的渗透,尽管在这点上不能将析氢完全地排出。该结果表明:在与先前对于锌或铁基rfb报道的值相比时,形成的铜沉积物在使用的电解质中极其稳定。实施例7.研究了cu2+通过分隔体渗透对电池的电流效率的影响。使用小型rfb,试验了cu2+通过分隔体的渗透影响电池的电流效率ηi的程度。图11b表示在低于50macm-2的电流密度下电流效率差的主要原因是cu2+通过分隔体的渗透,原因在于在较高电流密度下ηi单调地向98%的渐近线增大。在40、100和250macm-2的电流密度下,小型rfb的ηi分别为85.7、94.0和96.9%。实施例8.使用图9的优化电池设计对实际的全铜rfb的电压效率、ηv进行研究。将典型的极化曲线示于图12a中。在充电和放电过程中,电位与电流密度之间的关系为高度线性并且得到1.4-1.5cm2的面积比电阻(asr)。基于观察到的过电位,能够对优化的rfb估算ηv,将其示于图12b中。能够将这些结果与电流效率测定值结合以确定往返能量效率ηe,将其也示于图12b中。基于电解质在60℃下的高电导率,其为957mscm-1,将起因于欧姆损失的asr估算为0.35ωcm2,因此观察到的过电位的显著部分必须归因于电极处的活化过电位或浓度或者分隔体中的额外的欧姆损失。但是,1.5ωcm2的asr与在全钒rfb(vrfb)上初始开发工作过程中得到的4.5-5.4ωcm2的值相比有利。在30-40macm-2左右的电流密度下产生72%的ηe的峰,在较高电流密度下ηe的下降较小,并且电流密度翻倍至70macm-2导致ηe较为适度的降低至只有67%。相比而言,在广泛报道的锌-溴rfb中,典型的工作电流密度和ηe分别为20macm-2和75%。对于ηe,75%的值对于vrfb也并非不常见。因此,对于全铜rfb观察到的72%的ηe峰值在该技术开发的早期阶段看起来是合理的。在70macm-2下使全铜蓄电池运转时,在放电过程中实现37mw/cm2的功率密度。这是在20macm-2的典型条件下运转时在锌-溴rfb中实现的相同的功率密度。这暗示通过较低的欧姆损失、高沉积效率和便捷的反应动力学使全铜rfb中的低电池电位得以补偿。实施例9使用单电池rfb进行循环实验以证实能够在较长的时期内使全铜蓄电池有效地循环。将小型rfb装载电解质,即2mcucl且在0%soc下。然后,将该体系放置以在150macm-2的电流密度下循环,监测电池电位以防止过充电。用于充电和放电的电位截止极限分别为0.9和0.3v。在这些条件下在电池的整个理论soc范围内的完整充电-放电循环将需要4小时。图13a表示在头两个循环过程中充电的深度较高并且与不良ηi相关,这表示在施加的高电流密度下所述体系不能充分地放电到0%soc。推测这是由于cu2+的浓度变得太低以无法在低soc下维持放电过程。在第二循环后,在循环过程中可达到的soc范围显示出直至第26个循环温和地上升到最大值57%。在最后的13个循环过程中,直至最后的循环其较迅速地降低到46%。在头两个初始循环后,ηi为稳定的98.6±2.1%,直至第43个循环后人为地将循环终止。图13b表示在充电单调地从0.73降低到0.68v后的开路电位ocp。放电后的ocp在头两个循环过程中最初从0.57上升到0.59v,这与观察到的ηi的不良值良好地相关,然后直至第30个循环缓慢地降低回0.57v,其在该点在施加的剩余的循环过程中再次上升到0.58v。使用该蓄电池观察到的平均ocp为0.63v,其接近0.65v的理论电池电位。与其相比,对于在50%soc下将体系初始化的实验,在循环完成后ocp通常为0.68v。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1