电极和电化学器件以及制造电极和电化学器件的方法与流程
相关申请
本申请要求于2014年12月3日提交的、目前未决的62/086,717号美国临时专利申请的优先权。
背景技术:
金属-空气电池,特别是锂-空气,被认为是电池研究的诱人的目标。将大气中的氧用作一次或二次电池中的反应物之一会带来很多好处。这些包括更大的实际能量密度,充满电时提高的安全性,以及在制造中对原材料减少的需求。
然而,到目前为止,还没有技术能充分解决金属-空气电池的主要问题,具体地,空气电极的问题。环境温度下大气氧气的减少可能导致部分还原产物,例如过氧化物、超氧化物、过氧化氢自由基和/或羟基自由基,其可能会损害电池的其他部件。克服反应的缓慢的反应动力所需要的过电势可能导致电池的一些储存能量作为热量被释放,这是很实际的以及安全的考虑。给这样的电池充电可能甚至更加有问题。与放电相比,影响例如再充电中的过氧化物的氧化所需要的过电势可能会给电极带来更高的、更有破坏性的电势。
因为为电池充电要求影响金属氧化物(例如,过氧化锂)的氧化所需要的过电势高于反应所需的平衡电势,所以其他问题可能会产生。这样的高电势(与标准的氢电极相比通常大于1伏特)可创建高反应性的氧化性环境,其会损伤空气电极、电池溶剂、电解质和/或组成电池的其他材料。进一步的难题可包括可能由该过电势产生废热,其创建甚至更可能促进有害副反应的环境,破坏电池和/或缩短其使用寿命。由于这样的现象,高能量密度金属-空气电池(例如锂空气和钠空气电池)尚未实现它们的全部预期。
附图说明
具体的例子为了说明和描述的目的而被选择,并在附图中显示,形成说明书的一部分。
图1示出了本技术的双用气体扩散-析气电极的一个例子。
图2示出了本技术的电化学电池单元的一个例子的部件分解图。
图3a示出了本技术的电池的一个例子,其中电化学电池单元并联连接。
图3b示出了本技术的电池的一个例子,其中电化学电池串联连接。
图4示出了在二甲基亚砜中的0.1m硝酸锂中的石墨、铂、玻璃碳和硼掺杂的钻石电极的循环伏安图。
图5是以锂空气电化学电池为例的充电和放电期间随时间变化的电池单元电势曲线图。
图6是制造本技术的双用气体扩散-析气电极的一个方法的流程图。
图7示出了合并本技术的双用气体扩散-析气电极的电化学电池单元的例子。
具体实施方式
本技术涉及用于电池的电解单元或燃料电池的新型电极,以及相关的电解池,并且更具体地涉及双用气体扩散-析气电极。还描述了制造本技术的这种电极和电解池的方法。
在本说明书和所附的权利要求中,以下术语有如下所阐述的含义,其被认为是与本领域技术人员会对这些术语所理解的一致:
过电势:在某速率下驱动反应所需的超出热力学平衡的额外电势。过电势是绝对量,并且对于任何电极,驱动无论是氧化还是还原方向上的反应,在某种程度上是需要的。
内球反应(inner-spherereaction):电极与在反应中间物或产物与电极具有强相互作用的种类(species)之间的反应。这种反应包含参与电极反应的种类的特定吸附。内球反应还可包含作为对金属离子的配体桥的特别吸附的离子或配合基。
外球反应(outer-spherereaction):电极与其中的反应物和产物不与电极表面发生强烈反应的种类之间的反应。该反应通常离开电极有至少一个溶剂层的距离。
电化学电池:完整的电化学装置,包括两个电极、反应物、电解质、溶剂,以及可选的隔片(spacer)、集电器和催化剂以及壳体(case)。
sei:溶液电解质界面,例如形成于碱金属电极表面和非水溶剂的表面。
类钻石碳:一种天然的或合成的钻石,以及具有天然或合成钻石的至少一些性质的任何其他形式的碳,例如sp3结合碳原子。通常有7种目前已识别形式的类钻石碳,包括四面体非晶碳(ta-c)。类钻石碳的形式的区别之处在于sp3结合碳和石墨sp2碳的含量,并且可以包括氢、氮、金属和其他填充剂。类钻石碳可以是掺杂或不掺杂的。
本技术的双用气体溶解-析气电极可以包括类钻石碳的导电网络,以及催化剂。在至少某些例子中,类钻石碳包含多于50%的sp3结合碳原子。类钻石碳的导电网络具有至少约1000w/m·k的热导率。催化剂可以在氧化或还原的至少之一期间催化所需的反应。在用于内球反应的给定电流密度下,本技术的电极需要高于传统电极材料(例如石墨)至少0.3伏特的过电势。
在还原期间,本技术的电极充当气体扩散电极。气体扩散电极是这样设计的电极:气体可以用作在电极上的反应物,并且不参与的气体(例如空气中的氮气)可以连同所生成的任何产物气体一起扩散进和扩散出,以便不产生阻塞反应气体扩散的死层。在整个体积中,气体扩散电极理想地具有电学、离子(电解质)和气体进入之间的平衡。
在氧化期间,本技术的电极充当析气电极。析气电极是设计为具有高表面区域、电解质进入、并且供应在电极表面生成的气体易于从电极结构中逃离的电极。与气体扩散电极不同,其不需要辅助非反应气体扩散进和扩散出的结构,其中在该电极中的气体的唯一需要是其逃离。
图1示出了本技术的双用气体扩散-析气(gasevolution)电极100的一个例子。电极100可以包括类钻石碳102的导电网络(conductivenetwork),其可以包含至少一种催化剂104。根据应用,类钻石碳102的导电网络可以连接至电化学惰性衬底106。在一些例子中,该连接可以是类钻石碳102的导电网络形成于电化学惰性衬底106上的结果。可选地,本技术的双用气体扩散-析气电极100可以是在固态电解质的表面上的多孔结构中,其中该固态电解质接触催化剂和电学导电网络,并始终可用于气体进入,允许氧气被电解质中的离子还原,以及随后的还原产物的氧化。
在一些例子中,该电极可以具有从约20纳米到约5000微米的厚度。
绝缘衬底102可以是适用于气体扩散电极的电化学惰性材料。合适的电化学惰性材料的一些例子可以包括而不限于电学非导电钻石、类钻石碳或ta-c。电化学惰性衬底可以有至少约1000w/m·k的热导率。
类钻石碳102的导电网络可以进一步包含额外的组份,诸如以下中的一个或更多个:黏合剂108、润湿剂110或去湿剂112。
黏合剂可以用于将类钻石碳102的网络的成份结合在一起。合适的黏合剂的一些例子可以包括而不限于聚乙烯、环氧树脂、硅树脂或烧结聚四氟乙烯。
无论该双用气体扩散-析气电极是否与水溶剂和电解质或非水溶剂和电解质一起使用,类钻石碳102的导电网络中都可以包括润湿剂。该湿润剂可能是某种类型,并且其数量足以辅助类钻石碳的网络与溶剂和电解质之间的接触。在双用气体扩散-析气电极与水溶剂和电解质一起使用的应用中,润湿剂可以是亲水性材料。亲水性润湿剂的一些例子可以包括但不限于表面活性剂、纤维素纤维、二氧化硅颗粒或磺化聚苯乙烯。
此外,无论双用气体扩散-析气电极是否与水溶剂和电解质或非水溶剂和电解质一起使用,在类钻石碳102的导电网络中都可以包括去湿剂。去湿剂可能是某种类型,并且其数量可以防止电极的漏液(flooding)。在双用气体扩散-析气电极与水溶剂和电解质一起使用的应用中,去湿剂可以是疏水材料。疏水性润湿剂的一些例子可以包括而不限于特氟龙tm悬浮液或聚乙烯颗粒。
可选地,表面改性可以用作直接修饰类钻石碳的表面的预处理步骤。该预处理步骤,无论是通过暴露于气体、等离子体、湿化学、电化学或通过其他方法,都可以改变类钻石碳表面所暴露的功能团,并改变类钻石碳的润湿性。例如,可以通过事先在强碱中对类钻石碳预处理,接着用蒸馏水冲洗,来将类钻石碳的表面进行羟基终止。这将具有使该表面更具亲水性的效果。作为另一个例子,可以通过暴露于强酸将类钻石碳的表面进行氢终止,或通过在含氟离子的溶液中保持高电化学电势进行氟终止。这种处理将使表面更具疏水性。
本技术的电化学电池单元可以包括壳体、设置在该壳体中的电解质以及在该壳体中与电解质接触的双用气体扩散-析气电极。在电极放置(或生成)于与含有液态电解质的电池单元(cell)的分离器相对的这种例子中,一些电解质可能被导电网络通过毛细作用而占据。控制导电网络的组成可以防止电解质淹没导电网络的全部自由体积。当电解质将被导电网络占据时,气体进入、离子进入和电进入的三相点可形成贯穿导电网络的大部分体积。作为反应物或产物的气体可以自由地扩散进和扩散出导电网络的大部分体积,而离子进入电学导电部分和导电网络的催化剂的全部或大部分也被允许。这可在相对小的体积中允许大的有效反应表面。在作为气体扩散电极操作时,电极必须打开足够大以接受反应物气体并通过扩散一同移动非参与气体种类。在作为析气电极操作时,消除了对于气体扩散的需求,并且打开的电极的多孔部分也可完全用反应物和电解质填充,前提是存在用于产物气体逃离的路径。
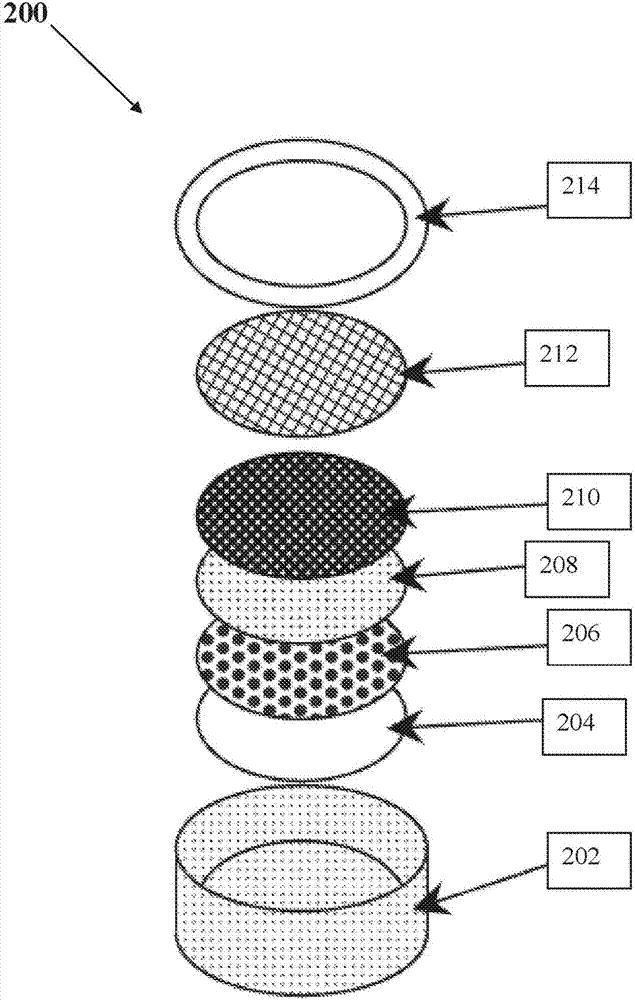
图2示出了本技术的金属-空气型电化学电池单元200的例子的部件分解原理图。电池单元壳体202可以封入其他部件:负极电流收集器204、负电极206、例如,锂金属箔片。在负电极上方,可以放置多孔的分离件208,在其上已经制造有正的双用气体扩散-析气电极210。分离件208的另一侧可能被浸泡在、或因此包含有溶剂和电解质。气体扩散层212,如金属泡沫或导电布,可以放置于在正的双用气体扩散-气体逸出电极210上,以保持所有组件之间的足够的接触力,并允许足够的气体和对双用气体扩散-气体逸出电极210的全部区域的电接入。这样的气体扩散层必须满足不被电解质湿润至其能参与到反应中的程度,或者,如果被浸湿,则以与气体扩散电极本身相同的电化学特性的方式被涂覆。例如,涂覆类钻石碳。定位环202可以被螺旋到壳体202中,以将所有的组件彼此对立。双用气体扩散-气体逸出电极210在分离件208中与溶剂和电解质接触,并且维持在该壳体202中,构成一个电极电池。
串联或并联使用本技术的多个电化学电池单元的电池可以允许改变输出电势和电流来匹配各种各样的应用。如图3a所示,电池300可以包括至少两个电化学电池单元,诸如电化学电池单元302和304。电化学电池单元可以并联电连接,如图3a所示。可选地,电池306可以包括至少两个电化学电池单元308和310,它们可以是串联电连接的,如图3b所示。
类钻石碳
本技术中使用的类钻石碳可以以给出预先确定的导电性的方式进行掺杂或合成。在下面进一步讨论的一些例子中,类钻石碳可以被掺杂。例如,类钻石碳可以是硼掺杂的钻石,或硼掺杂的类钻石碳。在其他的例子中,可以使用其他的掺杂剂,包括但不限于氮。
本技术中的类钻石碳可以是颗粒的形式。在一些例子中,所述颗粒的尺寸可以是约1微米到约2000微米。在其他例子中,所述颗粒的尺寸可以是约10纳米或以上。
本技术中的类钻石碳可以是鲁棒性的材料,以用于严苛的电化学环境中的电极中(即严苛的条件(诸如析氟)下的活动稳定性)。在一些例子中,类钻石碳可以有低于贵金属的溶解速率。例如,硼掺杂钻石在硫酸溶液中的电化学氧化溶解的报导数值通常低于0.5微克/安培·小时,相比而言优于贵金属,诸如铂、金和铱,其在大约1到10微克/安培·小时。作为另一个例子,在0.5m硫酸的电势循环中,铂溶解的例子可以高达130毫克/ah,而在0.1m硫酸中的恒电流氧化条件下的铂溶解的例子,已知的范围是从30到70微克/ah。相比之下,掺硼的钻石在1.3m硫酸中具有一般溶解率为0.3微克/ah。这种特性可以允许类钻石碳能够挨过金属-空气电池电极的恶劣环境,甚至是当为这种电池重新充电需要高的正的过电势来影响反应时。
本技术的类钻石碳也可以要求高的过电势用于内球反应。换句话说,类钻石碳可以在多数溶剂中具有宽的电化学“窗口”,意味着所述类钻石碳不通过电化学手段促进溶剂或电解质的分解。这可以归因于本技术的类钻石碳朝向内球电化学反应的格外的惰性。因此,尽管电极的催化剂辅助了期望的反应,但是,不需要的副反应将不大可能发生,因为类钻石碳可不促进任何其他的内球反应。
例如,图4是循环伏安图,表明了在二甲基亚砜中包含硝酸锂电解质的系统中,用于硼掺杂钻石(400)的高分解电压和低电流密度,其已经被用作锂氧电池中正电极的模型系统。如图所示,对于给定的电势,硼掺杂钻石的电流密度比任何所示的典型的电极材料(石墨(402)、铂(404)和玻璃碳(406))都要低5到50倍。这表明了在系统的该电势下操作时,硼掺杂钻石并不会促进不需要的副反应,并且可以直接适用于延长使用此溶剂/电解质系统的金属/空气电池的使用寿命。
实际上,在用于内球反应(包括任何不同类型的内球反应)的给定的电流密度下,使用本技术的类钻石碳的电极可能需要比通常使用的电极材料的大得多的过电势。例如,如果对电极应用适当高或低的电势,则在电化学应用中使用的所有溶剂(包括水)都可能会分解,即,可能会被氧化或还原为另一种物质。这被称为溶剂分解,而执行这一过程所需要的电势被称为分解电势(breakdownpotential)。
在一些例子中,在用于内球反应的给定的电流密度下,类钻石碳的电极可能需要比通常使用的电极材料(诸如石墨)的高至少0.3伏特(v)的过电势。此外,有机溶剂,例如乙腈,可以在存在氧气和含有氧的物质情况下被化学地或电化学地氧化为碳氧化物和氮氧化物。类似地,就像四丁基溴化铵离子被氧化一样,诸如四丁基四氟化硼的电解质可以被电化学地氧化为碳氧化物和氮氧化物。氯化铵也可以被氧化为氯气。因此,朝向溶剂或电解质被氧、过氧化物、氢氧化钠或超氧化物氧化的方向上,在给定的电流密度下,本技术中的类钻石碳可以具有比一般使用的电极材料(诸如石墨)超过0.3伏或更大的过电势。
图5是示出了与石墨相比,本技术中类钻石碳的一个实施例的过电势的曲线图。具体地,图5示出了具有包含下述材料的电极的四种锂空气电化学电池单元的功能:(1)石墨;(2)具有二氧化锰(mno2)催化剂的石墨;(3)本技术的硼掺杂钻石,以及(4)本技术中含有二氧化锰催化剂的硼掺杂钻石。所有上述电池单元在四甘醇二甲醚溶剂中使用0.1mlino3作为电解质。曲线图的第一部分示出了四种不同电池单元的放电,每个电池单元开始于在约3.1v和3.6v之间的开路电势。在图5中,每个电极的结果线示出为:(1)石墨由线502表示;(2)具有二氧化锰催化剂的石墨由线504表示;(3)本技术的硼掺杂钻石由线506表示;以及(4)本技术的具有二氧化锰催化剂的硼掺杂钻石由线508表示。
从线506中可以看出,一旦放电,包含有硼掺杂钻石电极的电池单元立即经受超过0.6v的过电势,这突出了bdd显示了对几乎所有电化学反应(内球反应)的迟缓的动力学。此外,如线508所示,一旦放电,具有硼掺杂钻石和二氧化锰催化剂两者的电池单元立即经受大约0.2v的过电势,显示了在这一电池单元配置中,二氧化锰催化剂事实上正在提高锂离子到过氧化锂(li2o2)的氧还原的反应动力。在整个放电阶段,线508的电池单元还显示了与线506的电池单元相比的显著增加(提升),在整个放电阶段,其电池单元电势高出后者约0.9v,清楚地示出了尽管硼掺杂钻石单独自身不促进反应,其也不妨碍催化剂的促进锂离子的氧还原的所需反应的功能。如线502所示,只具有用于其空气电极的石墨的电池单元显示了在放电上非常小的过电势(<0.1v),甚至小于与线508相关的电极,表明石墨虽然不是用于氧还原的催化剂,但也正在提供在电池单元中发生的不特定于采用锂离子的氧还原的副反应的途径,例如溶剂和电极自身的氧化。如线504所示,具有石墨和二氧化锰催化剂的电池单元在放电中显示了几乎无法察觉的过电势(<0.05v),以及与只有石墨(线502)的相比在放电的整个阶段中放电电势的增加(提高)。然而,差距只有约0.2v的提高,而具有硼掺杂钻石和催化剂(线508)的放电电势的提高是约0.8v。
在再充电时,可以看到同样的效果。由单独硼掺杂钻石组成的电极(线506)显示了最高的过电势,以及到达充电的电势上限(3.9v)的最快时间。线508的电极显示了长得多的再充电时间和较低的过电势。两个包含石墨的电极(线502和504)显示在很长时间内低于3.5的电势,远低于期望的反应,即li2o2的氧化期望所需的电势区域,这强烈地暗示石墨使能副反应,例如石墨电极自身的氧化和溶剂的氧化。
因为溶剂分解、电解质分解和涉及气态氧的氧化可能是内球的多阶反应,本技术的电极可以保护溶剂、电解质以及用来制造器件的材料。其效果可以是通过阻止对其他电池单元材料和组份造成损害的副反应来增加器件的寿命。
进一步地,本技术的类钻石碳可以具有高各向同性的导热性,因此可以防止放电尤其是充电中的过热。本技术的类钻石碳可以具有是铜或银超过四倍的导热系数,特别是当类钻石碳掺硼时。如上所述,在本技术的电极中,类钻石碳的导电网络具有至少约1000w/m·k的热导率。在某些实施例中,类钻石碳的导电网络可以有至少约2000w/m·k的热导率。在一些例子中,单晶钻石可以有超过2200w/m·k的热导率,并且某些合成钻石可以显示甚至更高的各向同性热导率。
在金属-空气电池的应用中,给金属-空气电池充电所需要的过电势使废热出现在空气电极上,并且将其驱散可以保护电池单元材料和部件免于不需要的副反应,所述副反应更可能发生在更高的温度下。本技术中用作电极中电气导电网络的类钻石碳,可以从电子、离子和气体聚集在一起的产生热量的精确点上去除废热。由于室温下氧的还原和过氧化物的氧化,例如,两者都具有显著的过电势,归功于这些反应过电势的更有效的废热移除可以允许更快的充放电速率或电流密度。
类似地,在高温条件下,本技术的类钻石碳的热稳定性可以有利于提高电池单元的循环寿命、放电速率和安全性。目前,大型的高放电率电池组设计通常需要液体或空气冷却系统来维持低于某限度的运行温度(例如小于75℃),以确保安全,并减少电池单元降解。本技术的电化学电池单元不会在升高的温度下促进副反应,并且因此在更高的温度下可以更安全。这可能降低或消除高充电和放电速率的冷却系统需求。
类钻石碳的一些例子通常可具有纯净形式下的低导电性。为了获得可接受的导电性,可以添加诸如氮和/或硼的掺杂剂。掺杂可允许类钻石碳材料用于电化学的目的,并且仍然保持着在本文讨论的内球反应的高过电势。改变类钻石碳中的掺杂剂或掺杂剂水平可以调节电极的性能,使理想电势范围以上或以下的反应变得更加迟缓。这可以有助于制造不太可能参与不需要的反应的电极,并且在延长电化学电池单元和系统的寿命上可以令人满意。对于四面体非晶碳来说,例如,高达约10%,例如包括从约5%到约10%的氮的掺杂水平可用于提高导电性。对于硼来说,约百万分之(ppm)100到约百万分之10000,包括例如从约百万分之500到约百万分之5000的掺杂水平,可以被用于获得接近金属类型的导电率。约5000ppm以上的硼掺杂水平可以危害类钻石碳的晶体结构,可能导致既不具有电化学鲁棒性也不具有可接受的用于不需要的反应的高过电势的石墨含量。使用较低水平(约100-500ppm)的硼掺杂类钻石碳可以导致可接受的导电电极,这是由于晶体中的硼的受主能级,不太可能参与期望的氧化还原电势以上或以下的不需要的反应。
催化剂
本技术的电极可以包含至少一种催化剂,并且可以使用两种或更多种催化剂的混合物。催化剂可以被包含在电极中,以促进一种或更多种所需的反应。当催化剂被添加到电极表面以促进特定的期望反应时,令人满意的是所选择的催化剂并不会也促进不需要的反应,诸如溶剂分解和电解质分解。例如,在某些应用中,诸如在金属空气电池中用作空气电极时,本技术的电极可以包括有助于减少氧气以及有助于过氧化物、氢氧化物、氧化物或超氧化物的氧化的催化剂。这种催化剂的一个例子是二氧化锰,当其被包含在本技术的电极中时,它可以辅助氧到过氧化物的还原和随后的过氧化物到氧的氧化。
电极和电化学电池单元
可采用多种方式制造本技术的双用气体扩散-析气电极,以及利用本技术的气体扩散-析气电极的电化学电池单元。
例如,通过沉积类钻石碳和共同沉积至少一种催化剂,电极可以制作在合适的惰性衬底上,诸如图1的衬底106。被沉积的材料可以作为油墨、粉末或喷雾被合并在配方中,进一步包括润湿剂和去湿剂。电极配方还可以包括孔隙形成剂,其将通过蒸发、流动或升华以在最终结构中留下空隙而工作。此外,诸如过氧化锂的材料可以包括在放电状态的电化学电池单元中,其在第一次充电时将产生期望的多孔结构。
这种电极可以通过其他方法,例如丝网印刷、脱膜或喷淋技术等制造。附加的类钻石碳或其他导电材料可以加入到所形成的电极中,如果需要的话,还可以添加附加的催化剂。还可以由润湿剂或去湿剂对电极进行额外的处理。
示例:气体扩散-析气电极和电化学电池单元的形成
图6所示的流程图例示了一种制备具有本技术的类钻石碳的气体扩散-析气电极的方法600。例示的方法600从步骤602开始,此时形成了含有类钻石碳、催化剂、黏合剂和任何其他需要的组份的水悬浮液。示例如,配方中可以添加孔隙形成剂,诸如萘粉末,如此在烧结过程中,其升华、熔化或蒸发,在电极中留下孔隙,然后其将允许气体进入。在步骤604,水悬浮液可以施加于基板(诸如多孔分离件),或者是涂覆有脱模剂的ptfe厚板上,然后使其在步骤606干燥以形成初步的电极。在干燥步骤606之后,可以在步骤608处在烤箱中烧结该初步的电极,这样ptfe就会熔化并流动,充当电极和催化剂颗粒的粘合剂。烧结步骤可以包括氮气吹扫的应用。在步骤610,所形成的电极可以被允许冷却。
在方法600的一个例子中,在步骤602,水悬浮液通过在小烧杯中通过电磁搅拌器混合2克20μm的硼掺杂钻石粉、0.5克20μm的二氧化锰粉、0.5克ptfe水分散体、0.2克的萘粉末以及2克的蒸馏水5分钟而形成。在步骤604,使用50μm的刮片将水悬浮液涂在3毫米厚的ptfe板上。在干燥步骤606中,将具有涂层的ptfe板放入125℃的烤箱中20分钟。在烧结步骤508中,在烤箱中应用氮气吹扫,并将温度升高到270℃并保持30分钟。然后,将温度升高到350℃并保持20分钟。随后,关闭烤箱,而继续氮气吹扫。当烤箱温度达到80℃时,通过将形成的电极从烤箱中取出并使其冷却到室温来实施冷却步骤610。
通过将其按压和转移到诸如聚乙烯电池分离件的期望的基板上,需要时也可以进行加热,根据图6的形成双用气体扩散-析气电极的一种方法可以合并到电化学电池单元中。
在可选的方法中,在室温或升高的温度下,水悬浮液可以被喷到加热或未加热的基板上。当在升高的温度下提供悬浮液时,由于溶剂的蒸发,将悬浮液喷洒到基板上的行为可以产生多孔的连续气体扩散电极结构。后续的烧结步骤,例如在烤箱中,可以允许悬浮液中的ptfe或其他粘合剂在基质中完全散开,并为电极创造理想的结合和湿润特性。
示例:锂空气电池单元的制造
包括本技术的双用气体扩散-析气电极的锂-空气电池,其包括类钻石碳和二氧化锰,使用以下材料制成:
·1个54×54×6mm的正方形聚乙烯,在中心有24mm×32mm×750微米的深磨矩形,在中心有12mm宽的孔(hole)以及在每个边上有两个螺丝(底部件)
·1个54×54×6mm的正方形聚乙烯,在中心有20×20mm的孔,并且在每个边有两个3.5mm宽的孔(中间件)
·1个54×12×6mm的矩形聚乙烯,在每个边具有2-4mm宽的孔以及穿过中心的针(顶部件)
·1个15mm直径、250微米厚的锂金属盘
·1个24×32mm、50微米厚的矩形铜金属
·1个20×20mm的矩形的涂覆有硼掺杂钻石的多孔掺杂硅晶圆
·1个54×54mm的正方形的聚乙烯,在中心有25×25mm的孔
·1个25×25mm、900μm厚的正方形滤纸
·200mg的15μm类钻石碳颗粒+20mg的1μm直径的二氧化锰颗粒
·3/8-英尺npt插塞和弹簧
·2个弹簧
·4个螺母
首先,将矩形的铜金属放置在底部的聚乙烯片上、研磨的正方形凹陷中。接下来,将聚乙烯正方形通过螺丝放置在底部片。将中间的组件放置在干燥的盒子里,并将该干燥的盒子密封,并用氩气冲洗,以防止在组装过程的其余阶段发生任何反应。使用镊子将锂盘放置在铜金属矩形的顶部。接着把滤纸放在锂盘上作为分离件。接着把电池单元中间的聚乙烯片放在滤纸顶部。使用1ml的注射器,将300μl具有电解质的溶剂应用于滤纸分离件,覆盖中间聚乙烯片中心的20×20mm孔所暴露的整个表面。然后将dlc和mno2颗粒倒在滤纸分离件上,使其均匀地散开在暴露的表面。接着将涂覆有多孔掺杂钻石的硅集电器放置在电极颗粒的顶部,平放并轻微向下按压以确保平坦接触。在螺丝上使用两个螺母来紧固和保护装配。接着在组件上放置具有中间针的顶部的50×12×6mm聚乙烯片。然后在每一个螺丝上放置一个弹簧,并在每一个螺丝上固定一个螺母,这样弹簧就被稍微压缩了。然后将ntp插塞和弹簧拧进电池单元的底部,用手拧紧。然后,打开干燥盒,允许空气吹送到完成的电池单元上以开始操作。
示例:双用气体扩散-析气电极的功用的使用
图7示出了使用本技术的双用气体扩散-析气电极的不同类型的电化学电池单元。
图7a示出了非质子锂氧气电池单元700。在放电过程中,锂金属负电极702被氧化以释放锂离子。接着这些离子迁移至正电极704(其为本技术的双用气体扩散-析气电极),并与气态氧发生反应,以形成不溶性的过氧化锂。再充电时,正电极704上的过氧化锂被氧化为氧气,而锂离子会迁移到负电极702,并在该处被还原为锂金属。该电池使用溶剂/电解质706,其包括极性、非质子溶剂(例如二甲基亚砜),以及电解质(例如四甲基六氟磷酸铵)。sei708生长在锂金属负电极和接触电解质之间。多孔分离件710浸入电解质中,并阻止两个电极之间的电接触。在该类型的电池上下文中,与石墨、炭黑或石墨粉相反,本技术的类钻石碳将不会受到过氧化锂的攻击,也不促进过氧化锂和电池中任何其他材料之间的任何反应,不受到充电电势的影响,也不促进电池单元部件、溶剂或电解质的任何电化学氧化。
图7b示出了水溶液锂氧气电池单元712。在放电过程中,锂金属负电极714被氧化以释放锂离子。接着这些离子穿过选择性锂离子渗透膜716迁移至正电极718(其为本技术的双用气体扩散-析气电极),并在此处与气态氧发生反应,以形成可溶性的氢氧化锂。再充电时,正电极718上的氢氧化锂被氧化为氧气,而锂离子会穿过选择性锂离子渗透膜716迁移到负电极714,并在该处被还原为锂金属。该电池使用水作为溶剂,以及诸如硝酸锂720的电解质。在该水电池的上下文中,本技术的类钻石碳可在水中具有宽的电势窗口,并且可以保护电池不发生溶剂分解。与其他溶剂相比,水的电化学电势窗口要小得多,并且与可能有更宽的电化学电势窗口的非水溶剂相比,扩展它和防止分解的能力可能是非常重要和值得关注的。
图7c示出了固态锂氧电池单元722。在放电过程中,锂金属负电极724被氧化以释放锂离子。然后,这些离子跨越人造sei726,穿过固态的锂离子可渗透电解质728迁移到正电极730(其为本技术的双用气体扩散-析气电极),在该处它们与气态氧发生反应,以形成不溶性的过氧化锂。再充电时,正电极730上的过氧化锂被氧化为氧气,而锂离子穿过固态的锂离子可渗透电解质728迁移到负电极724,在该处它们被还原为锂金属。这种电池使用固态电解质并且不需要溶剂。固态电解质,诸如在这种类型的电池中使用的那些,需要高得多的过电势来重新充电,从而将空气电极的电势提高至会氧化除最具鲁棒性的材料以外的一切的电势。因此,在这种类型的固态锂氧电池的上下文中,本技术的类钻石碳可以提供兼具电化学鲁棒性和良好的导热性两者的优点,其有助于移除电池的由再充电所需要的高过电势所生成的废热。
图7d示出了混合的非质子/含水锂氧电池单元732。其行为和功能兼具图7a和7b中所描述的前两种类型两者的属性。在放电过程中,锂金属负电极734被氧化以释放锂离子。接着这些离子跨越sei736,穿过非质子溶剂/电解质738,穿过选择性的锂离子渗透膜740、穿过水或质子溶剂及电解质(诸如水中的硝酸锂742),迁移到正电极744(其为本技术的双用气体扩散-析气电极),在该处它们与气态氧发生反应,以形成可溶性的氢氧化锂。再充电时,正电极744上的氢氧化锂被氧化为氧气,而锂离子穿过水或质子电解质742、穿过选择性的锂离子渗透膜740、穿过非质子溶剂和电解质738到达sei736,并最终迁移回到负电极734,在该处它们被还原为锂金属。此电池在膜的反面使用极性的非质子溶剂(诸如二甲基亚砜)以及电解质(诸如四甲基六氟磷酸铵),并在正面使用水作为溶剂以及电解质(诸如硝酸锂)。在混合的非质子/含水锂氧电池中,本技术的类钻石碳在水中可以有宽的电势窗口,并且可以保护电池不发生溶剂分解。
制备类钻石碳
类钻石碳可以多种方式制备。最常见的一种是,在真空室中将石墨靶氩溅射到衬底上,其可以电偏压在溅射源的30至100伏以下。氮或其他掺杂剂可以在室内合并(incorporate)为与石墨共溅射的气体或固体材料。薄膜可以向下平滑至分子水平,并且其厚度范围可以是从纳米到微米,尽管超过微米厚的薄膜可以被施压,而且容易从衬底上开裂。该材料的sp3性质可以是材料中碳化学键的范围为30%至70%,并且可以被拉曼光谱证实。
四面体无定形碳可以由过滤阴极真空电弧制备。碳离子可以在具有撞针和电弧供应的电弧中形成,并且离子穿过磁场和电场的弯曲路线移动。这些可以过滤掉未带电的种类。离子撞击衬底,通常会在低于电源的80到100伏的偏压下。通过在真空室的放电室中产生电离的氮离子束的方式,可以添加氮作为掺杂剂。典型的薄膜厚度与类钻石碳近似,并且薄膜的sp3含量可以是在80%到100%之间,通常是85-87%的sp3含量。未掺杂的薄膜是轻微的p型,但合并有7-12%氮会导致金属型导电性。
硼掺杂钻石可以通过化学气相沉积(cvd)制备。诸如硅的衬底可以植入纳米钻石籽晶,并放置于反应器中。可以将反应器加热至600℃到900℃,并填充包含约99%氢气、1%甲烷的气体混合物和硼源,诸如硼酸三丙酯。接着,可以由微波等离子体(低温,近似600℃)或热钨丝(需要更高的腔室温度,接近900℃)将气体分解成原子碎片。甲基的碎片可以开始沉积在衬底和籽晶上。过量的氢气和氢自由基可以破坏任何sp2键的形成,并且可以只允许sp3化学键存留,从而形成由几微米大小的钻石晶体组成的薄膜。高达约2000ppm的硼的加入可以导致类金属的导电性,因为p型硼被加入到晶体结构中至使其在晶体的能带结构中产生简并状态,在所有能级都使能导电的范围。与其他类型的类钻石碳一样,拉曼光谱可以对硼掺杂钻石的sp3性质进行验证。低的硼掺杂浓度(例如低于500ppm)可能会在与标准氢电极相比低于约0.3v的电化学电势区域中产生载体状态的不足。典型的反应器压力可以是约1到20torr。反应器气体成分的变化,即大量过量氩气(超过99%氩)中的甲烷可以产生晶体尺寸低于1微米的纳米晶薄膜。即使是在未掺杂的情况下,这种薄膜也可以是导电的。这种薄膜的导电机制可以是沿晶界(grainboundary)的sp2键域。
从上述内容中,将被领会到的是,尽管为了说明的目的在本文中描述了具体的例子,但可以做出不同的修改,而不脱离本公开的精神或范围。此外,上述各种实施例的描述包括一些对操作理论的讨论。尽管这些讨论包括被认为是主导实施例的操作的物理和/或化学机制,但本发明不应被解释为仅局限于所描述的具体机制所主导的实施例。因此,其目的是把上述的详细描述视为说明而非限制,并且可以理解的是,下述的权利要求,包括所有的等价物,意图具体地指出和明确地说明所要求保护的主题。
- 还没有人留言评论。精彩留言会获得点赞!