锂离子的电池电解质的制作方法
本发明涉及锂离子电池领域。
背景技术:
锂离子电池(二次电池)目前是可再充电电池领域中,尤其在便携式电子领域中的领先技术。传统的锂离子电池通常采用石墨阳极。电荷传输通过电解质进行,该电解质包括溶解在溶剂中的锂盐。在现有技术中已知各种电解质和电解质盐。目前常规的锂离子电池通常采用六氟磷酸锂(lipf6)。
在石墨阳极工作期间,发生电解质的还原分解。反应物可在电极上形成粘附的、与电绝缘的但传导锂离子的膜。合适的电解质诱导在电极上形成固态电解质中间相(sei)。固体电解质中间相随后阻止石墨与电解质进一步反应,并以此方式保护电解质免于进一步的还原分解,并防止阳极因溶剂的共嵌入而被破坏。特别是当使用石墨阳极时,这种膜的形成对于锂离子电池的可靠工作是必要的。在不形成固体电解质中间相的情况下,石墨阳极处于碳酸丙烯酯类电解质被溶剂的共嵌入破坏的情况下。
然而,溶剂碳酸丙烯酯(iupac名为4甲基-1,3-二氧戊环-2-酮)的还原分解不导致形成有效的固体电解质中间相。相反,由碳酸丙烯酯的共嵌入诱导的在石墨层内还原地诱导的气体析出导致活性材料的剥落和不可逆破坏。这限制了碳酸丙烯酯的利用率,虽然与用于锂离子技术的碳酸乙烯酯(iupac为1,3-二氧戊环-2-酮)相比,碳酸丙烯酯有更好的热学和物理化学性能。碳酸丙烯酯可用作在不形成sei和石墨剥落的情况下同样显示出还原分解的电解质的模型体系。
已经提出了通过使用高度浓缩的电解质来抑制石墨的剥落和溶剂的还原分解。然而,由于这种方式需要正常所需量的电解质盐的倍数,因此高度浓缩的电解质(也被称为“盐中溶剂”电解质)的使用并不经济。此外,浓度(通常>3mol·l-1)大大增加了电解质的粘度,这导致电导率和电池性能的显著降低。此外,将预期的是,工作温度的降低导致电解质盐的溶度积低于电解质溶剂中的电解质盐的浓度,这导致盐在电池内部的析出。此外,电解质的密度和因此的总质量以恒定的体积增大,并且增加电解质盐的添加。这同样导致电池的比能量密度(ah·kg-1)随着整个体系降低。
此外,已经提出了使用合适性能的添加剂。在商业电池中,特别地,碳酸亚乙烯酯(vc)和氟代碳酸乙烯酯(fec)在此是相关的。因此,需要可防止石墨剥落的其他试剂。
技术实现要素:
本发明的目的在于提供克服上述现有技术的缺点中的至少一个缺点的电解质。特别地,本发明的目的在于提供一种化合物,其有助于在石墨上形成固体电解质中间相,因此使包含碳酸丙烯酯的电解质的可逆循环成为可能。
该目的通过用于能量存储的电解质来实现,该电解质包括电解质盐和溶剂,其特征在于,溶剂包括通式(1)的至少一种化合物,通式(1)如下所示:
其中,
r1、r2、r3、r4相同或不同,并且独立地选自包括直链或支链的c1-6烷基、c2-6烯基、c2-6炔基、c3-6环烷基和苯基的组,在每种情况下未被取代或者被选自包括f、cn和被氟单或多取代的c1-2烷基的组的取代基单或多取代。
本发明的其他有利实施例可从从属权利要求和次要权利要求中推出。
令人惊奇地发现,通式(1)的四烷氧基乙烷在石墨电极上形成固体电解质中间相(sei)。因此,通式(1)的四烷氧基乙烷在电解质中的使用使得石墨电极被用在不能在石墨上形成有效的sei的溶剂(诸如碳酸丙烯酯)中。在此,四烷氧基乙烷可用作碳酸丙烯酯类电解质的唯一溶剂或sei添加剂或助溶剂。通式(1)的四烷氧基乙烷可形成稳定的固体电解质中间相,该固体电解质中间相可保护石墨阳极免于剥落,并保护碳酸丙烯电解质免于在300个充电和放电循环中连续还原分解。
除非另有说明,否则术语“c1-6烷基”或“c1-c6烷基”包括具有1-6个碳原子的直链或支链烷基。术语“c3-6-环烷基”指的是具有3至6个碳原子的环状烷基。除非另有说明,否则术语“c2-6-烯基”和“c2-6-炔基”包括具有2至6个碳原子并且在每种情况下至少一个双键或三键的直链或支链烯基或炔基。
自由基r1、r2、r3、r4可相同或不同。自由基r1、r2、r3、r4优选相同。
优选考虑c1-c5烷基。除非另有说明,否则优选的c1-c5烷基包括具有1至5个碳原子的直链或支链烷基,优选选自包含甲基、乙基、丙基、异丙基、丁基、异丁基、戊基、异戊基和新戊基的组。
烷基、烯基或炔基可以是未被取代的,或者是被单取代或多取代的,例如,双或三取代的。在此,烷基、烯基或炔基可在各种碳原子上(优选在相同的碳原子上)被多取代。取代基可以是氟或cn(腈)。在其中基团r1、r2、r3、r4被取代的实施例中,其优选被氟取代,例如,单氟化或多氟化或全氟化。c3-c6烷基取代基尤其可带有cf3基团。烷基、烯基、炔基或环烷基或苯基也可被小的氟取代的c1-2烷基(特别是cf3)单或多取代。
在优选的实施例中,r1、r2、r3、r4相同或不同,并且独立地选自包括未被取代的c1-c5烷基(优选c1-c3烷基)或苯基和被氟、cn或cf3单或多取代的c1-c5烷基(优选c1-c3烷基)或苯基的组。
另一方面,未被取代的化合物通常是便宜的,因此作为锂离子电池中的溶剂或助溶剂更经济。相对小的c1-c3烷基取代基尤其可以是未被取代的。在优选的实施例中,r1、r2、r3、r4相同或不同,并且独立地选自包括甲基、乙基、正丙基和异丙基的组,特别是选自甲基和乙基。
在优选的实施例中,通式(1)的化合物选自1,1,2,2-四甲氧基乙烷和1,1,2,2-四乙氧基乙烷之中。根据iupac命名法,1,1,2,2-四甲氧基乙烷也被称为1,1,2,2-乙烷四甲酸四甲酯,1,1,2,2-四乙氧基乙烷被称为1,1,2,2-乙烷四甲酸四乙酯。1,1,2,2-四甲氧基乙烷和1,1,2,2-四乙氧基乙烷具有以下通式(2)和(3):
特别地,已发现1,1,2,2-四甲氧基乙烷和1,1,2,2-四乙氧基乙烷非常适合作为碳酸丙烯酯的助溶剂,以在石墨上形成有效的sei,该sei有效抑制了碳酸丙烯酯共嵌入到石墨中。因此,对于锂离子技术而言,1,1,2,2-四甲氧基乙烷和1,1,2,2-四乙氧基乙烷特别适合作为助溶剂或sei添加剂或作为唯一溶剂。
在实施例中,溶剂可按照基于电解质溶剂的总重量、量为从重量百分比≥0.1%至重量百分比≤100%包含通式(1)的化合物。四烷氧基乙烷可用作唯一溶剂。此外,四烷氧基乙烷可用作sei添加剂。例如,溶剂可按照基于电解质溶剂的总重量、量为从重量百分比≥0.1%至重量百分比≤10%或从重量百分比≥1%至重量百分比≤5%包括通式(1)的化合物。四烷氧基乙烷可优选用作碳酸丙烯酯类电解质的助溶剂。电解质优选按照基于电解质溶剂的总重量的如下量包括通式(1)的化合物:从重量百分比≥10%至重量百分比≤80%,更优选地,从重量百分比≥20%至重量百分比≤50%,特别优选地,从重量百分比≥30%至重量百分比≤50%。以有利的方式,特别地,重量百分比为30%的1,1,2,2-四甲氧基乙烷或1,1,2,2-四乙氧基乙烷作为助溶剂可有效地抑制碳酸丙烯酯共嵌入到石墨中。在此,可使用相对少量的四烷氧基乙烷(诸如1,1,2,2-四甲氧基乙烷或1,1,2,2-四乙氧基乙烷)使该方法经济。
电解质包括:至少一种电解质盐,优选锂盐;和溶剂,其包括通式(1)的化合物。在此,通式(1)的化合物可以是溶剂。电解质还可包含其他溶剂。在这些优选的实施例中,通式(1)的化合物用作助溶剂。在其他实施例中,通式(1)的化合物可仅以小比例存在,然后与存在的其他溶剂相比,将被称为添加剂。溶剂用作电解质盐或锂盐的溶解介质。术语溶剂和溶解介质将在本文中被同义使用。
电解质可包含选自包括未氟化或部分氟化的有机溶剂、离子液体、聚合物基质及其混合物的组的溶剂。电解质优选包括有机溶剂,特别是环状或线性碳酸盐。在优选的实施例中,有机溶剂选自包括碳酸乙烯酯、碳酸甲乙酯、碳酸丙烯酯、碳酸二甲酯、碳酸二乙酯、乙腈、丙腈、3-甲氧基丙腈、戊二腈、己二腈、庚二腈、γ-丁内酯、γ-戊内酯、二甲氧基乙烷、1,3-二氧戊环、乙酸甲酯、乙酸乙酯、甲基磺酸乙酯、甲基膦酸二甲酯、线性或环状砜、对称或不对称的烷基磷酸酯及其混合物的组。
在优选的实施例中,溶剂选自包括碳酸丙烯酯、碳酸乙烯酯、碳酸甲乙酯、碳酸二甲酯、碳酸二乙酯及其混合物的组。特别地,电解质可包括不能导致形成有效的固体电解质中间相的溶剂(诸如碳酸丙烯酯)。优选考虑碳酸丙烯酯和碳酸丙烯酯与碳酸乙烯酯、碳酸甲乙酯、碳酸二甲酯和/或碳酸二乙酯的混合物,特别地碳酸丙烯酯与碳酸二甲酯的混合物。当使用这些溶剂时,添加根据本发明的化合物以形成有效的固体电解质中间相是特别有利的。特别地优选1,1,2,2-四甲氧基乙烷和1,1,2,2-四乙氧基乙烷作为助溶剂。
例如,优选基于电解质溶剂的总重量包含重量百分比为50%的1,1,2,2-四甲氧基乙烷和/或1,1,2,2-四乙氧基乙烷与重量百分比为50%的碳酸丙烯酯的混合物。同样优选包含1,1,2,2-四甲氧基乙烷和/或1,1,2,2-四乙氧基乙烷以及碳酸丙烯酯、碳酸二甲酯的重量比为1:1:1或1:2:2的混合物。这样的混合物可具有良好的电导率并且引起石墨电极的钝化。
除了形成有效的sei之外,另一个优点是与线性碳酸酯(诸如碳酸二甲酯和碳酸二乙酯)相比,使用四烷氧基乙烷可有助于通过提高自燃温度来提高电解质体系的本质安全性。因此,1,1,2,2-四甲氧基乙烷和1,1,2,2-四乙氧基乙烷的自燃温度分别为47℃-53℃和71℃,而碳酸二甲酯和碳酸二乙酯可分别在18℃和31℃的温度下自燃。此外,通过使用1,1,2,2-四甲氧基乙烷或1,1,2,2-四乙氧基乙烷作为助溶剂,可扩大能够使用电解质的温度窗口。因此,1,1,2,2-四甲氧基乙烷和1,1,2,2-四乙氧基乙烷的熔点分别为-24℃和-35℃,沸点分别为155℃和196°,然而碳酸二甲酯和碳酸二乙酯仅分别在5℃和-74℃的温度下熔化,但分别在91℃和126℃下沸腾。碳酸乙烯酯的熔点为36℃。
电解质也可以是聚合物电解质,聚合物电解质例如选自包括添加有电解质盐的聚环氧乙烷、聚丙烯腈、聚氯乙烯、聚偏二氟乙烯、聚(偏二氟乙烯-六氟丙烯共聚物)和聚甲基丙烯酸甲酯的组,或者可以是包括聚合物、上述有机溶剂和/或离子液体以及电解质盐的凝胶聚合物电解质。电解质同样可以由离子液体和电解质盐形成。
除了溶剂和至少一种通式(1)的化合物以外,本发明的电解质还包含至少一种电解质盐,特别是锂盐。电解质盐优选选自包括lipf6、libf4、liasf6、lisbf6、liclo4、liptcl6、lin(so2f)2、lin(so2cf3)2、lin(so2c2f5)2、lic(so2cf3)3、lib(c2o4)2、libf2(c2o4)和liso3cf3的组。锂盐优选选自lin(so2cf3)2(litfsi,双(三氟甲磺酰)亚胺锂)、lin(so2f)2(lifsi)和lipf6之中。电解质中的锂盐的浓度可以在常规范围内,例如,在≥1.0m至≤1.5m的范围内。使用相对少量的电解质盐使本发明的电解质较经济,特别是与“盐溶溶剂”电解质相比。
在优选实施例中,电解质包括通式(1)的化合物(特别地,1,1,2,2-四甲氧基乙烷和/或1,1,2,2-四乙氧基乙烷)、至少一种锂盐和碳酸丙烯酯或包含碳酸丙烯酯的有机溶剂的混合物。电解质可例如通过将通式(1)的化合物与碳酸丙烯酯混合或将通式(1)的化合物与包含碳酸丙烯酯的溶剂混合物混合并将锂盐引入溶剂中来制备。
电解质可另外包含至少一种添加剂,特别是选自包括sei形成剂、阻燃剂和过度充电添加剂。例如,电解质可包含通式(1)的化合物以及另外的sei形成剂,另外的sei形成剂例如选自包括氟代碳酸乙烯酯、氯代碳酸乙烯酯、碳酸亚乙烯酯、碳酸乙烯亚乙酯、亚硫酸乙烯酯、丙烷磺酸内酯(propanesultone)、丙烯磺酸内酯(propenesultone)、亚硫酸酯(优选亚硫酸二甲酯和亚硫酸丙烯酯、硫酸乙烯酯、硫酸丙烯酯、甲烷二磺酸亚甲酯(methylenemethanedisulfonate)、硫酸三亚甲基酯(trimethylenesulfate))、任选地被f、cl或br取代的丁内酯、碳酸苯乙烯酯、乙酸乙烯酯和碳酸三氟丙烯酯的组。例如,电解质可包含通式(1)的化合物以及选自包括碳酸乙烯酯、氟代碳酸乙烯酯和硫酸乙烯酯的组的其他sei形成剂。这些化合物可提高电池性能(例如容量、长期稳定性或循环寿命)。
通式(1)的化合物(特别地,1,1,2,2-四甲氧基乙烷和1,1,2,2-四乙氧基乙烷)是可商购的,或者可通过本领域技术人员将熟悉的方法来制备。
该电解质特别适用于电池或可再充电电池,特别是作为用于锂离子电池或可再充电锂离子电池的电解质。
本发明还提供了一种能量存储,特别是电化学能量存储,其选自包括根据本发明的电解质的锂电池、锂离子电池、可再充电锂离子电池、锂聚合物电池、锂离子电容器和超级电容器。
对于电解质的描述,参考以上描述。出于本发明的目的,术语“能量存储”包括一次和二次电化学能量存储装置,即电池(一次存储)和可再充电电池(二次存储)。在通常的语言用法中,可再充电电池经常用术语“电池”来指代,该术语经常用作统称术语。因此,除非另外指出,否则用于本目的的术语锂离子电池与可再充电锂离子电池同义地使用。出于本发明的目的,特别地,术语“电化学能量存储”还包括电化学电容器,诸如超级电容器。电化学电容器(在文献中也称为超级电容器)是电化学能量存储,与电池相比,电化学能量存储显示出更高的功率密度,而与常规电容器相比,电化学能量存储显示出更高的能量密度。
优选考虑二次电化学能量存储。特别地,能量存储是锂离子电池。能够表明的是,在石墨阳极上形成的固体电解质中间相在至少300个循环中是稳定的。这允许了可再充电电池的经济运行和电解质的使用。
特别地,能量存储可包括通式(1)的化合物和作为电极材料的碳(特别是石墨)和/或含碳酸丙烯酯的电解质。例如,优选考虑包含阴极、石墨阳极、隔膜(separator)和电解质的锂离子电池,该电解质包含重量比为1:1的通式(1)的四烷氧基乙烷(特别地,1,2,2,2-四甲氧基乙烷或1,1,2,2-四乙氧基乙烷)与碳酸丙烯酯,或包含1,1,2,2-四甲氧基乙烷和/或1,1,2,2-四乙氧基乙烷与碳酸丙烯酯和碳酸二甲酯的重量比为1:1:1或1:2:2的混合物,并且还优选1mlitfsi、lifsi或lipf6。
原则上,可使用本领域技术人员已知的并且通常用于诸如锂离子电池的能量存储中的所有电解质、溶剂、电解质盐和对电极。例如,锂金属、钛酸锂尖晶石(lto)和碳(特别是石墨)可用作阳极材料,磷酸铁锂(lfp)和锂镍锰钴氧化物(nmc)可用作阴极材料。
本发明还提供了一种在包括阳极、阴极和电解质的电化学电池的电极上形成固体电解质中间相的方法,其中,该电池使用本发明的电解质进行工作。
本发明还提供一种如下所示的通式(1)的化合物在能量存储中,特别地在选自包括锂电池、锂离子电池、可充电锂离子电池、锂聚合物电池、锂离子电容器或超级电容器的组的电化学能量存储中的用途:
其中:
r1、r2、r3、r4相同或不同,并且独立地选自包括直链或支链的c1-6烷基、c1-6烯基、c1-6-炔基、c3-6环烷基和苯基的组,在每种情况下未被取代或者被选自包括f、cn和被氟单或多取代的c1-2烷基的组的取代基单或多取代。
通式(1)的化合物可有利地用作电解质添加剂、溶剂或助溶剂,尤其用作在不添加添加剂、不能形成有效的sei的电解质中的电解质添加剂、溶剂或助溶剂。特别地,通式(1)的化合物可有利地用于包括作为电极材料的碳(特别是石墨)和/或含碳酸丙烯酯的电解质的能量存储中。对于通式(1)的化合物的描述,可参考以上描述。特别优选1,1,2,2-四甲氧基乙烷和1,1,2,2-四乙氧基乙烷。
附图说明
以下呈现了用于示出本发明的示例和附图。这里,附图示出为:
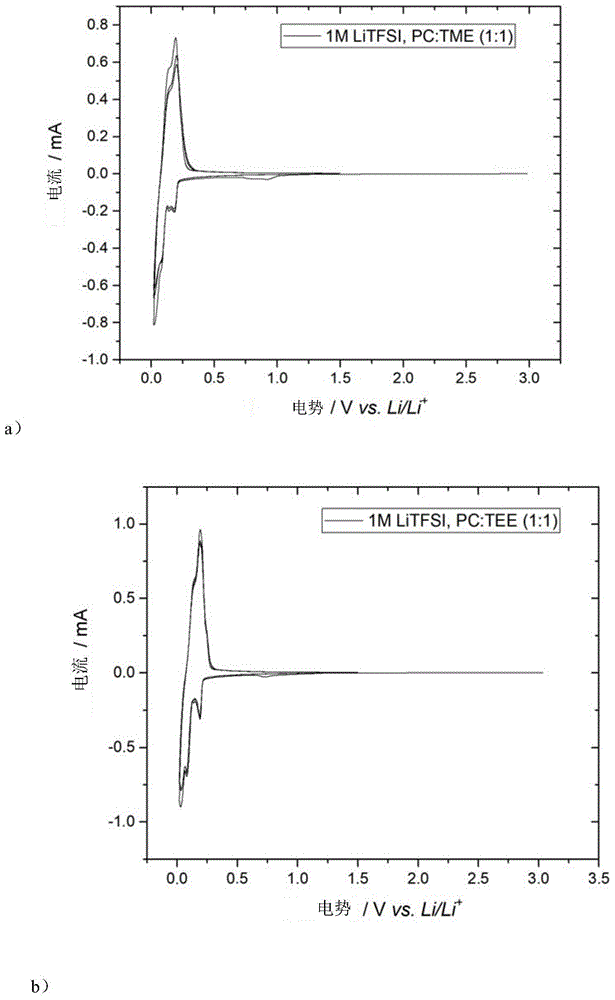
图1的图1a)中示出了在1,1,2,2-四甲氧基乙烷(tme)和碳酸丙烯酯(pc)的混合物中包含1mlitfsi的电解质的还原稳定性窗口,图1的图1b)中示出了在1,1,2,2-四乙氧基乙烷(tee)和碳酸丙烯酯(pc)的混合物中包含1mlitfsi的电解质的还原稳定性窗口。在每种情况下,相对于电势绘制电流。
图2示出了pt/li半电池中如下电解质的氧化稳定性窗口:每种电解质在1,1,2,2-四乙氧基乙烷和碳酸丙烯酯(pc)的混合物中或1,1,2,2-四甲氧基乙烷和碳酸丙烯酯(pc)的混合物中包含1mlitfsi,在pc和1,1,2,2-四甲氧基乙烷的混合物中包含1mlifsi。相对于电势绘制电流密度。
图3示出了limn2o4/li半电池中在碳酸丙烯酯和1,1,2,2-四乙氧基乙烷的混合物中包含1mlifsi的电解质的氧化稳定性窗口。
图4示出了石墨/li电池的如下电解质的充电和放电容量(左侧纵轴)和库仑效率(右侧纵轴)与充电/放电循环的次数的关系:该电解质在碳酸丙烯酯与1,1,2,2-四乙氧基乙烷的1:1混合物中包含1mlitfsi。
图5示出了lfp/石墨全电池中的如下电解质的充电和放电容量和库仑效率与充电/放电循环的次数的关系:该电解质在碳酸丙烯酯与1,1,2,2-四乙氧基乙烷的1:1混合物中包含1mlitfsi。
图6示出了nmc/石墨全电池中的如下电解质的充电和放电容量和库仑效率与充电/放电循环的次数的关系:该电解质在碳酸丙烯酯与1,1,2,2-四乙氧基乙烷的1:1混合物中包含1mlifsi。
图7的图7a)示出了如下电解质的电池电压过程与第一循环容量的关系:该电解质在碳酸丙烯酯与1,1,2,2-四乙氧基乙烷的1:1混合物中包含1mlitfsi。图7的图7b)示出了在该电解质中进行一个循环之后、表面的次级石墨颗粒的截面的扫描电子显微照片。
图8的图8a)示出了如下电解质的第一循环的电池电压过程与时间的关系:该电解质在含有重量百分比为2%的fec的碳酸丙烯酯包含1mlipf6。图8的图8b)示出了在该电解质中进行一个循环之后、石墨表面的扫描电子显微照片。
具体实施方式
实施例1
测定各个电解质中的1,1,2,2-四乙氧基乙烷的电导率
在1,1,2,2-四乙氧基乙烷中和在1,1,2,2-四乙氧基乙烷(tee)、碳酸丙烯酯(pc)和碳酸二甲酯(dmc)的混合物中测定litfsi(双(三氟甲磺酰基)酰亚胺锂(lin(so2cf3)2)的1m溶液的电导率。
为了制备电解质,首先对1,1,2,2-四乙氧基乙烷、重量百分比为50%的1,1,2,2-四乙氧基乙烷和重量百分比为50%的碳酸丙烯酯的混合物或者1,1,2,2-四乙氧基乙烷、碳酸丙烯酯和碳酸二甲酯的重量比为1:1:1的混合物的进行充电。在这些物质中溶解相应所需量的litfsi或lifsi(lin(so2f)2),从而获得浓度为1m的锂盐。以同样的方式,制备在碳酸丙烯酯中包含1mlitfsi或lipf6的对比电解质。
使用2电极电导率测量池(2-electrodeconductivitymeasurementcell,rhd仪器,gc/pt)在-35℃至+60℃的温度范围内检测电解质的电导率。为了这个目的,首先将电导率测量池加热至60℃并且以10℃至-30℃的温度梯度冷却电导池,并随后冷却至-35℃。以下的表1示出了在相应的溶剂混合物中在-35℃至+60℃的范围内的电导率。
表1:包含1,1,2,2-四乙氧基乙烷(tee)的各种混合物中的1mlitfsi和lifsi的电导率
如从表1中可看出的是,作为唯一溶剂的1,1,2,2-四乙氧基乙烷(tee)中的1mlitfsi在20℃下显示出2.2ms·cm-1的电导率,这低于碳酸丙烯酯中的4.1ms·cm-1的对比值。添加碳酸丙烯酯导致电导率显著增加,而tee、pc和dmc的混合物显示出电导率甚至略超过电导率为5.0ms·cm-1的pc中的1mlipf6对比体系。
实施例2
测定各个电解质中的1,1,2,2-四甲氧基乙烷的电导率
使用2电极电导率测量池(2-electrodeconductivitymeasurementcell,rhd仪器,gc/pt)在任意实施例1中所描述的-35℃至+60℃的温度范围内检测包含1,1,2,2-四甲氧基乙烷(tme)的电解质的电导率。
测定在1,1,2,2-四甲氧基乙烷(tme)中的litfsi的1m溶液的电导率、在每个情况下重量百分比为50%的tme和pc的混合物中的litfsi的1m溶液的电导率以及重量百分比为1:1:1的tme、pc和dmc的混合物中的litfsi的1m溶液的电导率、重量百分比为1:2:2的tme、pc和dmc的混合物中的litfsi的1m溶液的电导率。以下的表2示出了在相应的溶剂中在-35℃至+60℃的温度范围内的电导率。
表2:包含1,1,2,2-四甲氧基乙烷(tme)的各种电解质中的1mlitfsi电导率
如从表2中可看出的是,作为唯一溶剂的1,1,2,2-四甲氧基乙烷(tme)中的1mlitfsi在20℃下显示出1.8ms·cm-1的电导率,这稍微低于1,1,2,2-四乙氧基乙烷的电导率。添加碳酸丙烯酯和dmc导致电导率显著增加。
实施例3
使用石墨电极测定1,1,2,2-四甲氧基乙烷和1,1,2,2-四乙氧基乙烷的还原电化学稳定性和循环特性。
通过循环伏安法执行对半电池中的电解质的稳定性的测定。以这种方法,电极电压周期性地持续变化。为此目的,使用具有石墨复合电极(96%,350mah/g;1.1mah·cm-2)作为工作电极并且锂箔作为对电极和参比电极的三电极电池((
为了测定还原稳定性和循环特性,首先将工作电极和参比电极之间的电势从平衡电势(ocp)降低至0.025vvs.li/li+,随后再次从0.025vvs.li/li+增加至1.5vvs.li/li+。重复两次0.025vvs.li/li+与1.5vvs.li/li+之间的循环电势变化过程。前进速度为0.025mv·s-1。
检测在1,1,2,2-四乙氧基乙烷和碳酸丙烯酯的混合物中包含1mlitfsi的电解质(1mlitfsi,pc:tee(1:1))或在1,1,2,2-四甲氧基乙烷和碳酸丙烯酯的混合物中包含1mlitfsi的电解质(1mlitfsi,pc:tme(1:1))的电解质。通过将所需量的litfsi溶解在tee或tme中制备电解质。图1a)示出了包含重量百分比为1,1,2,2-四甲氧基乙烷(tme)的电解质的还原稳定性窗口,图1b)示出了包含重量百分比为50%的1,1,2,2-四乙氧基乙烷(tee)的电解质的还原稳定性窗口。在每种情况下相对于三个周期的电势绘制电流。如从图1a)和图1b)可看出的,包含重量百分比为50%的碳酸丙烯酯的电解质是稳定的,并且与石墨电极是相容的。这表明了即使在与碳酸丙烯酯1:1的混合物中,通过1,1,2,2-四甲氧基乙烷和1,1,2,2-四乙氧基乙烷也实现对石墨的有效钝化。从循环伏安图无法识别tme和tee的还原性分解。
实施例4
使用铂电极测定1,1,2,2-四甲氧基乙烷和1,1,2,2-四乙氧基乙烷的氧化电化学稳定性。
通过线性扫描伏安法在具有铂电极(
检测在1,1,2,2-四乙氧基乙烷和碳酸丙烯酯的混合物中包含1mlitfsi的电解质(1mlitfsi,pc:tee(1:1))或在1,1,2,2-四甲氧基乙烷和碳酸丙烯酯的混合物中包含1mlifsi的电解质(1mlitfsi,pc:tme(1:1))以及在pc和tme(1:1)的混合物中包含1mlitfsi的电解质。通过将所需量的litfsi或lifsi溶解在tee或tme中制备电解质。图2示出了电解质的氧化稳定性窗口。相对于电势绘制电流。如从图2可看出的,电解质稳定直至5vvs.li/li+。
实施例5
使用lmo电极测定1,1,2,2-四乙氧基乙烷的氧化稳定性
使用锂-锰氧化物作为工作电极检查在1,1,2,2-四乙氧基乙烷和碳酸丙烯酯的混合物中包含1mlifsi的电解质(1mlifsi,pc:tee(1:1))的氧化稳定性。如实施例4中所描述的通过线性扫描伏安法在
图3示出了电势vs.li/li+在3.2v至5v的范围内的电解质的氧化稳定性窗口。如图3中可看出的,对基于1,1,2,2-四乙氧基乙烷和碳酸丙烯酯的1:1混合物的电解质,通过至4.3vvs.li/li+的关断电压,完全脱锂而无另外的寄生法拉第反应的迹象是可能的。
实施例6
使用石墨电极检测循环稳定性
在使用锂电极和石墨电极(mcmb)的纽扣电池结构(hohsencorp.,cr2032)中执行对循环稳定性的检查。使用玻璃纤维无纺布作为隔膜。在从0.025v至1.5v的电压窗口中执行循环。在0.1℃下执行3个形成循环,还在0.25℃下执行3个调节循环,在0.5℃下执行3个调节循环,然后在1.0℃下进行41个充电/放电循环。在20.0℃±0.1℃下在电池测试仪系列4000(maccor)上执行以恒定电流的测量。
通过首先对溶剂混合物充电并将所需量的litfsi溶解在其中来制备在1,1,2,2-四乙氧基乙烷(tee)和碳酸丙烯酯(pc)中的每个的重量百分比为50%的混合物中包含1mlitfsi的电解质。
图4示出了石墨/li电池的充电和放电容量以及库仑效率与充电/放电循环的次数的关系。如从图4中可看出的,电解质在第一循环中显示出87.3%的高库仑效率,并且在整个循环期间显示出小的容量损失和>99.9%的高库仑效率。这表明了即使没有添加sei添加剂通过1,1,2,2-四乙氧基乙烷也对石墨表面进行了有效钝化。
作为对比电解质,并行地循环碳酸丙烯酯中的1mlitfsi溶液以及在包含重量百分比为50%的sei添加剂碳酸亚乙烯酯的碳酸丙烯酯中的1mlitfsi溶液。正如预期的,纯的碳酸丙烯酯显示出石墨电极在第一循环之后剥落。可逆的循环是不可能的。添加碳酸亚乙烯酯使得循环是可能的,但是电池即使在第一循环中也仅显示出79.6%的低库仑效率,并且在前20个循环内显示出快速的容量损失,这表明了碳酸亚乙烯酯不进行有效的钝化。相反,根据本发明的化合物在所检测的50个循环的整个循环时间中显示出>99.9%的高且恒定的库仑效率。
实施例7
检测在lfp/石墨全电池中的长期循环稳定性
同样地,在使用磷酸铁锂(lfp,83%,150mah/g;1.0mah/cm-2)和石墨电极(96%,350mah/g;1.1mah·cm-2)的纽扣电池结构(hohsencorp.,cr2032)中执行对全电池中的长期循环稳定性的检测。使用聚合物无纺布作为隔膜。在从2.5v至3.6v的电压窗口中执行循环。在0.1℃下执行3个形成循环,在0.33℃下执行3个调节循环,然后在1.0℃下进行320个充电/放电循环。在20.0℃±0.1℃下在电池测试仪系列4000(maccor)上执行测量。
通过首先对溶剂混合物充电并将所需量的litfsi溶解在其中来使用在1,1,2,2-四乙氧基乙烷(tee)和碳酸丙烯酯(pc)中的每个的重量百分比为50%的混合物中包含1mlitfsi的电解质。
图5示出了全电池的充电和放电容量以及库仑效率与循环的次数的关系。如从图5中可看出的,电解质在第一循环中显示出88.4%的库仑效率,并且在300个循环期间显示出>99.9%的高库仑效率。此外,该结果说明了与lep阴极材料相容。
实施例8
检测在nmc/石墨全电池中的循环稳定性
如实施例7中所描述的,使用锂-镍0.5-锰0.3-钴0.2氧化物阴极(nmc532)相对于石墨在1.0℃下以40个充电/放电循环重复全电池中的循环稳定性。在从2.8v至4.2v的电压窗口中执行循环。使用在1,1,2,2-四乙氧基乙烷和碳酸丙烯酯的1:1混合物中的1mlifsi作为电解质。
图6示出了nmc/石墨全电池的充电和放电容量以及库仑效率与循环的次数的关系。如从图6中可看出的,电解质在第一循环中显示出84.5%的库仑效率,并且在40个循环中显示出>99.5%的库仑效率。这说明了与nmc阴极材料具有良好的相容性。因此,本发明的电解质可与阴极材料在高达4.2v的关断电压下一起使用。
实施例9
在1,1,2,2-四乙氧基乙烷混合物中进行循环之后检查石墨表面
为了检查1,1,2,2-四乙氧基乙烷对石墨电极的钝化,在一个充电/放电循环之后,通过扫描电子显微镜检查电极的表面。
在具有纽扣电池结构(hohsencorp.,cr2032)的全电池中,相对于磷酸铁锂(lfp)阴极或锂-镍0.5-锰0.3-钴0.2氧化物阴极(nmc532)循环石墨阳极(96%,350mah/g;1.1mah·cm-2)。使用聚合物无纺布作为隔膜。在从2.5v至3.6v(lfp)或从2.8v至4.2v(nmc532)的电压窗口中执行充电/放电循环。在20.0℃±0.1℃下在电池测试仪系列4000(maccor)上执行测量。
使用在1,1,2,2-四乙氧基乙烷和碳酸丙烯酯的混合物中的1mlitfsi作为电解质。使用在包含重量百分比为2%的sei添加剂氟代碳酸乙烯酯(fec)的碳酸丙烯酯中的1mlipf6溶液作为对比电解质。
在已经执行了充电/放电循环之后,在每种情况下将石墨电极从电池中移出,并且通过使用蔡司
图7a)示出了针对如下电解质的电池(石墨/lfp电池)电压的过程与第一循环容量的关系:该电解质包含重量百分比为50%的1,1,2,2-四乙氧基乙烷和pc,图7b)示出了石墨表面(次级石墨颗粒的截面)的扫描电子显微照片。图7a)表明了在第一循环中,石墨中的li+离子可逆地嵌入/脱嵌是可能的。如从图7b)可看出的,在已经执行了充电/放电循环之后,石墨电极的表面是完整的。没有可识别的剥落迹象。
图8a)示出了第一循环的对比电池(石墨/nmc532,在含有重量百分比为2%的氟代碳酸乙烯酯的碳酸丙烯酯中包含1mlipf6)的电池电压与时间的关系。图8b)示出了在进行充电/放电循环之后、石墨表面的扫描电子显微照片。如从图8a)可看出的,观察到石墨中的li+离子的嵌入/脱嵌的可逆性大大降低。图8b)清楚地表明,即使在使用sei添加剂fec时,在碳酸丙烯酯中的一个充电/放电循环后,石墨电极的表面也显示出严重的剥落。
图7b)和图8b)的对比证实了与使用通常的sei添加剂相比,1,1,2,2-四乙氧基乙烷进行了有效的钝化,显示出了对石墨电极显著更好的保护。
总的来说,结果表明1,1,2,2-四乙氧基乙烷和1,1,2,2-四甲氧基乙烷可形成钝化保护层,该保护层在石墨表面上传导锂离子。此外,这两种化合物显示出令人满意的电导率和良好的氧化稳定性。此外,这些化合物能够在锂离子电池中稳定工作,且在300个循环中具有良好的循环稳定性。
形成本专利申请的基础的发明出现在由bmbf支持、支持号为3120034900的项目中。
- 还没有人留言评论。精彩留言会获得点赞!