一种用于农杆菌介导大豆子叶节转化的外植体选择方法及应用与流程
本发明属于生物技术领域,尤其涉及一种用于农杆菌介导大豆子叶节转化的外植体选择方法及应用。
背景技术:
大豆是重要的经济作物和油料作物,是食用植物油和植物蛋白的主要来源,在饲料加工和生物能源开发等领域均占有重要位置。转基因大豆产业化生产带来的良好社会效益和巨大经济效益推动了大豆转基因应用研究的迅猛发展,但受制于基因型依赖,大豆遗传转化依然是植物基因工程领域的难点之一。当前,农杆菌介导技术是应用于大豆遗传转化和转基因研究的主要技术方法,其中子叶节法因具有实验操作简单、外植体获得便利、转化周期较短等优点,是当前大豆转基因研究应用最广,转化效率最稳定的方法。
大豆子叶节外植体经器官发生途径获得再生植株,其中经组织培养诱导获得的不定芽源自具有再生能力的分生细胞,种子萌发过程中,子叶节外植体的分生细胞也在不断变化,不同状态的分生细胞其细胞活力存在差异,而细胞活力是影响转化再生的关键因素之一,通常靶细胞活力越强,其分生能力和生命力越旺盛,与农杆菌的互作能力越强,有助于转化细胞的获得和再生。因此,研究不同生长状态子叶节外植体分生细胞的活力及其对农杆菌的敏感性,有助于提高大豆遗传转化的效率。
技术实现要素:
本发明的一个目的是提供一种制备大豆目标子叶节外植体的方法。
本发明提供的方法,包括如下步骤:
1)检测待测大豆种子在6个萌发状态下子叶节外植体的瞬时转化率和丛生芽率,选择满足如下A和B,作为外植体制备候选萌发时期;
A为6个萌发状态下子叶节外植体的瞬时转化率中显著高的某个萌发状态或某几个萌发状态;
B为6个萌发状态下子叶节外植体的丛生芽率中显著高的某个萌发状态或某几个萌发状态;
2)检测待测大豆种子在所述外植体制备候选萌发时期下子叶节外植体的稳定转化率,选择所有候选萌发时期子叶节外植体的转化率显著高的某个候选萌发时期或某几个候选萌发时期,作为外植体制备时期;
3)对所述外植体制备时期的待测大豆种子截取子叶节,得到待测大豆目标子叶节外植体;
上述显著为0.05水平的显著性检验,即P<0.05。
所述6个萌发状态为如下(1)-(6):
(1)Y状态:子叶呈白色(根据The RHS Colour Chart描述,该颜色为White Group 155A或155B),下胚轴包裹在种皮中;
(2)YL状态:子叶呈白色,下胚轴突破种皮且呈白色;
(3)HG状态:子叶呈白色,下胚轴突破种皮且呈黄绿色(根据The RHS Colour Chart描述,该颜色为Yellow-Green Group 145A或144B)。
(4)HG+CG状态:子叶近下胚轴处呈黄绿色其余部分呈白色,下胚轴突破种皮且呈绿色(The RHS Colour Chart描述Green Group 143B或143C);
(5)CG状态:子叶全部呈黄绿色,下胚轴突破种皮且呈绿色;
(6)G状态:子叶叶边缘呈墨绿色(根据The RHS Colour Chart描述,该颜色为Green Group 139A),下胚轴突破种皮且呈绿色;
选取处于如下6种萌发形态的种子为从萌发开始至148h这个时间段选取。
上述方法中,步骤1)中,所述检测待测大豆种子在6个萌发状态下子叶节外植体的瞬时转化率的方法包括如下步骤:将报告基因分别转入6个萌发状态下子叶节外植体,得到每个萌发状态对应的转基因外植体,检测所述转基因外植体中转入报告基因的外植体,计算所述每个萌发状态对应的转基因外植体中转入报告基因的外植体与所述每个萌发状态下子叶节外植体的数量比或数量百分比,得到每个萌发状态下子叶节外植体的瞬时转化率;
所述检测待测大豆种子在6个萌发状态下子叶节外植体的丛生芽率的方法包括如下步骤:用农杆菌分别侵染6个萌发状态下子叶节外植体,得到每个萌发状态对应的转染后外植体,将所述每个萌发状态对应的转染后外植体进行丛生芽诱导培养,得到每个萌发状态对应的丛生芽诱导后外植体;检测所述丛生芽诱导后外植体中带有丛生芽的外植体,计算所述每个萌发状态对应的丛生芽诱导后外植体中带有丛生芽的外植体与所述每个萌发状态下子叶节外植体的数量比或数量百分比,得到每个萌发状态下子叶节外植体的丛生芽率;
步骤2)中,所述检测待测大豆种子在所述外植体制备候选萌发时期下子叶节外植体的稳定转化率的方法包括如下步骤:将外源基因分别转入每个候选萌发时期下子叶节外植体,得到每个候选萌发时期对应的转染后外植体,将所述每个候选萌发时期对应的转染后外植体依次进行丛生芽诱导培养、再生芽诱导培养和生根培养,得到再生植株,检测再生植株中转入外源基因的再生植株,计算每个候选萌发时期对应的再生植株中转入外源基因的再生植株与所述每个候选萌发时期下子叶节外植体的数量比或数量百分比,得到每个候选萌发时期下子叶节外植体的稳定转化率。
上述方法中,
所述报告基因为GUS;
或,所述农杆菌为根癌农杆菌,具体为EHA105;
或,所述外源基因为EPSPS基因;
或,所述外源基因通过表达其的载体GR16导入外植体,
或,所述待测大豆的品种为Jack、中黄10号或水里站。
上述方法中,所述检测所述转基因外植体中转入报告基因的外植体的时间为将外源基因转入6个萌发状态下子叶节外植体的第3天;
或所述检测所述丛生芽诱导后外植体中带有丛生芽的外植体的时间为所述诱导培养第15-30天。
本发明另一个目的是提供一种选择大豆子叶节外植体制备候选萌发时期的方法。
本发明提供的方法,包括上述方法的步骤1)。
本发明第三个目的是提供一种选择大豆子叶节外植体制备时期的方法。
本发明提供的方法,包括上述方法的步骤1)-2)。
本发明第四个目的是提供一种制备大豆子叶节外植体的试剂盒。
本发明提供的试剂盒,包括参数采集系统和可读性载体;
所述参数采集系统包括采集所述可读性载体中涉及的子叶颜色、下胚轴颜色和形态的参数采集设备和参数采集试剂;
所述可读载体记载如下6种种子萌发形态:
(1)Y状态:子叶呈白色(根据The RHS Colour Chart描述,该颜色为White Group 155A或155B),下胚轴包裹在种皮中;
(2)YL状态:子叶呈白色,下胚轴突破种皮且呈白色;
(3)HG状态:子叶呈白色,下胚轴突破种皮且呈黄绿色(根据The RHS Colour Chart描述,该颜色为Yellow-Green Group 145A或144B)。
(4)HG+CG状态:子叶近下胚轴处呈黄绿色其余部分呈白色,下胚轴突破种皮且呈绿色(The RHS Colour Chart描述Green Group 143B或143C);
(5)CG状态:子叶全部呈黄绿色,下胚轴突破种皮且呈绿色;
(6)G状态:子叶叶边缘呈墨绿色(根据The RHS Colour Chart描述,该颜色为Green Group 139A),下胚轴突破种皮且呈绿色;
上述试剂盒中,
所述参数采集设备包括种子萌发容器;
所述参数采集试剂包括用于种子萌发的培养基或培养体系。
上述试剂盒中,所述参数采集设备包括种子萌发容器;
所述参数采集试剂包括用于种子萌发的培养基或培养体系。
上述的试剂盒在制备大豆子叶节外植体中的应用也是本发明保护的范围。
上述的试剂盒中的所述可读性载体或所述参数采集系统在制备大豆子叶节外植体中的应用也是本发明保护的范围。
上述的试剂盒中的所述可读性载体或所述参数采集系统在选择大豆子叶节外植体制备的种子候选萌发时期中的应用也是本发明保护的范围。
上述方法或上述的试剂盒中的所述可读性载体或所述参数采集系统在大豆转基因研究或转基因大豆培育中的应用也是本发明保护的范围。
本发明的实验证明,将外源基因导入处于不同种子萌发状态的某品种大豆子叶节中,选取稳定转化效率显著高的状态,为该品种大豆子叶节外植体最佳制备期。现有的方法仅选择大豆某一萌发时期的子叶节外植体,会造成外植体选取的不全面。本发明的方法选取的外植体全面,有助于提高大豆遗传转化的效率。
附图说明
图1为大豆品种外植体状态分类示意图。
其中,图1A为Jack品种外植体状态分类示意图;图1B为中黄10号品种外植体状态分类示意图;图1C为水里站品种外植体状态分类示意图。
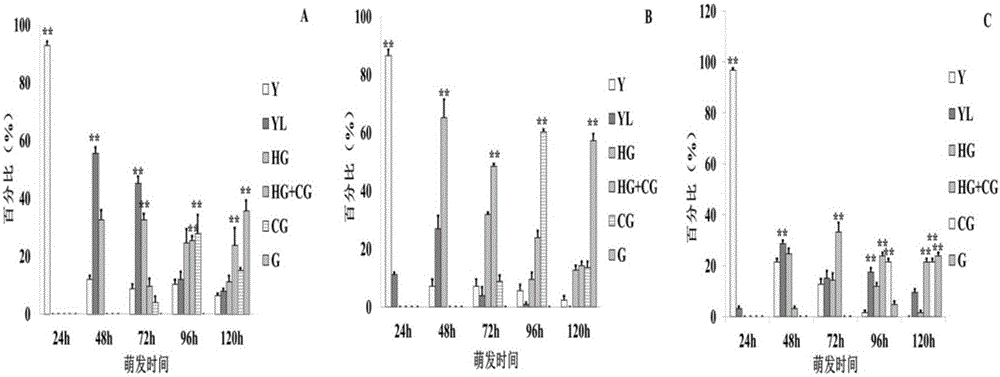
图2为大豆品种外植体状态随萌发时间变化趋势图:
其中,图2A为Jack品种外植体状态随萌发时间变化趋势图;图2B为中黄10号品种外植体状态随萌发时间变化趋势图;图2C为水里站品种外植体状态随萌发时间变化趋势图。
图3为Jack、中黄10号和水里站三个品种在两种外植体制备方法条件下不同状态外植体瞬时转化效率差异分析结果图。
图4为Jack品种瞬时转化效率、丛生芽率、稳定转化效率分析结果图;
其中图4A为Jack品种不同状态外植体瞬时转化效率分析结果图;图4B为Jack品种不同状态外植体丛生芽率分析结果图;图4C为Jack品种不同状态外植体稳定转化效率分析结果图。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中所采用的外植体制备方法传统的划痕法(S)记载在如下文献中:Hinchee M A W,Connor-Ward D V,Newell C A,McDonnell R E,Sato S J,Gasser C S,Fischhoff D A,Re D B,Fraley R T,Horsch R B.Production of transgenic soybean plants using Agrobacterium-mediated DNA transfer.Biotechnology.1988,6:915–922;
下述实施例中所采用的外植体制备方法超声波与表面活性剂协同处理法(B+C)记载在如下文献中:Guo B F,Guo Y,wang J,et al.Co-Treatment with Surfactant and Sonication Significantly Improves Agrobacterium-mediated Resistant Bud Formation and Transient Expression Efficiency in Soybean.Journal of Integrative Agriculture.2014,Doi:10.1016/S2095-3119(14)60907-2。
下述实施例中所用数据分析软件为SPSS。
下述实施例中的Jack记载在如下文献中:Venkata S.Tavva,Yul-Ho Kim,Isabelle A.Kaganetal.,Plant cell rep(2007)26:61-70.Increasedα-tocopherol content in soybean seed overexpressing the Perillafrutescensγ-tocopherolmethyltransferase gene;
下述实施例中的中黄10号记载在如下文献中:<<中国大豆品种志>>,邱丽娟、王曙明主编,中国农业出版社,2007;
下述实施例中的水里站品种记载在如下文献中:《中国大豆品种资源目录》,中国农业科学院油料作物研究所主编,农业出版社,1982;
上述品种公众可从中国农业科学院作物科学研究所获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
下述实施例中的pSoy17记载在如下参考文献:杨晓凤,卢涛,周正剑,等.α-硫辛酸对大豆农杆菌介导GUS瞬时表达和芽诱导的影响.大豆科学.2011,30(4):552-556;公众可从中国农业科学院作物科学研究所获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。pSoy17载体含有GUS基因。
下述实施例中的GR16记载在如下参考文献:华中农业大学.改造合成的苏云金芽孢杆菌杀虫晶体蛋白基因Cry1C*.中国:1483823A.2004-03-24;公众可从中国农业科学院作物科学研究所获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。GR16载体含有EPSPS除草剂抗性基因。
下述实施例中的根癌农杆菌菌株EHA105记载在如下文献中:XQ Wang,X Shen,HE Yun-Mian,et al.An Optimized Freeze-thaw Method for Transformation of Agrobacterium Tumefaciens EHA105and LBA4404.Pharmaceutical Biotechnology.2011,18(5):382-386;公众可从中国农业科学院作物科学研究所获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
下述实施例中的萌发培养基按照如下方法配置,B5粉3.2g,蔗糖30g,加水定容至1L,用5M KOH调节PH至5.85,琼脂8g;121℃,20min高压灭菌后分装。
下述实施例中的重组菌浸染外植体的共培养培养液按照如下方法配置:B5粉0.32g/L,MES 3.9g/L,蔗糖30g/L,6-BA 1.67mg/L,PH为5.45,琼脂8g/L。121℃,20min高压灭菌,加入过滤除菌的GA3 0.25mg/L,乙酰丁香酮39mg/L。4℃冰箱中备用。
下述实施例中的共培养基按照如下方法配置::B5粉0.32g/L,MES 3.9g/L,蔗糖30g/L,6-BA 1.67mg,PH为5.45,琼脂5.4g/L。121℃,20min高压灭菌,加入过滤除菌的GA3 0.25mg/L,乙酰丁香酮39mg/L。
下述实例中的GUS染色液的配置方法如下:称15mg X-Gluc,用N,N-二甲基甲酰胺溶解,溶解后添加至GUS stain buffer母液中定容至30ml,得到染色液。其中,200ml GUS stain buffer母液按照如下方法配制:取NaH2PO4.2H20 3.12g,0.5M EDTA 9.30g,20%Triton X-100 1ml,用水定容至200ml,pH=8.0(调pH时用NaOH固体粉末调节,加到7.7-7.8时缓慢加,pH值要准确)。
下述实施例中的芽诱导培养基的配置方法如下:B5粉0.32g/L,蔗糖30g/L,MES0.6g/L,6-BA 1.67mg/L,PH为5.75,琼脂8.4g/L。121℃,20min高压灭菌,加入过滤除菌的噻孢霉素150mg/L,羧苄青霉素250mg/L,筛选剂草甘膦15mg/L。
下述实施例中的芽伸长培养基按照如下方法配置:MS粉4.3g/L,MES 0.6g/L,蔗糖30g/L,B5有机10ml/L,天冬氨酸50mg/L,谷氨酰胺50mg/L,PH为5.7,琼脂9.23g/L。121℃,20min高压灭菌,加入过滤除菌的IAA 0.3mg/l,GA3 0.5mg/L,噻孢霉素150mg/L,羧苄青霉素350mg/L,筛选剂草甘膦3mg/L,。
下述实施例中的再生苗生根培养基按照如下方法配置:MS粉4.3g/L,MES0.6g/L,蔗糖30g/L,B5有机10ml/L,天冬氨酸50mg/L,谷氨酰胺50mg/L,PH为5.7,琼脂9.23g/L。121℃,20min高压灭菌。
下述实施例中农杆菌侵染外植体方法如下:每个三角瓶中放30-40个制备的叶节外植体,加入含有重组菌体的侵染液35ml-45ml,使大豆子叶节外植体浸没在侵染液中,再24℃培养30min,得到侵染后的外植体,期间并不时地轻摇三角瓶以使重组根癌农杆菌和外植体充分接触。
下述实施例中的萌发条件为温度25℃,光强3000lx,D/N为16h/8h。
实施例1、大豆子叶节外植体最佳种子萌发时期选择
一、大豆子叶节外植体制备的最佳种子萌发时期的选择
1、对不同萌发阶段种子进行分类
根据种子萌发后子叶和下胚轴颜色及状态差异设定种子萌发形态标准如下:
(1)Y状态:子叶呈白色(根据The RHS Colour Chart描述,该颜色为White Group 155A或155B),下胚轴包裹在种皮中;
(2)YL状态:子叶呈白色,下胚轴突破种皮且呈白色;
(3)HG状态:子叶呈白色,下胚轴突破种皮且呈黄绿色(根据The RHS Colour Chart描述,该颜色为Yellow-Green Group 145A或144B)。
(4)HG+CG状态:子叶近下胚轴处呈黄绿色其余部分呈白色,下胚轴突破种皮且呈绿色(The RHS Colour Chart描述Green Group 143B或143C);
(5)CG状态:子叶全部呈黄绿色,下胚轴突破种皮且呈绿色;
(6)G状态:子叶叶边缘呈墨绿色(根据The RHS Colour Chart描述,该颜色为Green Group 139A),下胚轴突破种皮且呈绿色;
将大豆Jack品种、中黄10号品种和水里站品种的种子在萌发培养基中培育,每个品种种子100粒。按照上述种子萌发形态标准对不同品种种子从开始萌发至萌发148h这段时期的种子形态进行分类,结果如图1所示,其中A为Jack、B为中黄10号、C为水里站。
对相同萌发时间、不同状态的种子数量进行统计,结果如图2所示,A为Jack、B为中黄10号、C为水里站,纵坐标为某一萌发时间下处于某萌发状态的种子数占在此萌发时间下所有种子数量的百分比;可以看出,虽因品种、种子活力不同,不同状态外植体的比例有所差异,但趋势相同,即随萌发时间增加,外植体状态发生显著变化,依次出现Y、YL、HG、HG+CG、CG、G六种状态,且相同时间条件下,存在至少一种外植体状态,其数量显著高于其它状态外植体。表明,在一定程度上,可用外植体萌发状态来指示萌发进程,进而可以作为指标,指示外植体制备的最佳时期。
2、利用报告基因瞬时表达及丛生芽率选择子叶节外植体制备的候选种子萌发形态
分别选取大豆Jack品种、中黄10号品种和水里站品种的六种萌发形态Y、YL、HG、HG+CG、CG、G种子;
每种状态均采用如下两种方式制备子叶节外植体:
A、传统的划痕法;
B、超声波与表面活性剂协同处理法。
1)瞬时表达报告基因GUS
将表达GUS基因的载体pSoy17转入农杆菌EHA105中,得到重组菌;再将重组菌侵染上述1)制备的各种子叶节外植体,侵染3天后,得到转基因外植体,将转基因外植体GUS染色,统计瞬时转化率。
每个萌发状态下子叶节外植体的瞬时转化率=每个萌发状态对应的转入GUS外植体的数量/每个萌发状态下子叶节外植体的数量
结果如图3所示,Z-S为pSoy17侵染中黄10号品种由划痕法制备的外植体;Z-B+C为pSoy17侵染中黄10号品种由超声波与表面活性剂协同处理法制备的外植体;J-S为pSoy17侵染Jack品种由划痕法制备的外植体;J-B+C为pSoy17侵染Jack品种由超声波与表面活性剂协同处理法制备的外植体;Slz-S为pSoy17侵染水里站品种由划痕法制备的外植体;Slz-B+C为pSoy17侵染水里站品种由超声波与表面活性剂协同处理法制备的外植体;横坐标为种子不同萌发状态,纵坐标为染色率(瞬时转化效率)=该品种在某萌发状态的染色外植体数/该品种在该萌发状态的所有外植体数;可以看出,在分别利用传统的划痕法和超声波与表面活性剂协同处理法制备外植体的条件下,各品种不同状态外植体的瞬时转化效率具有相同的趋势,即水里站品种外植体所有的制备方法下在Y状态的瞬时转化效率效率显著高;中黄10号品种外植体所有的制备方法在HG、HG+CG、CG状态下瞬时表达外源基因效率显著高(同上);Jack品种外植体所有的制备方法在HG、HG+CG、CG状态下瞬时表达外源基因效率显著高(同上)(图4A)。
2)外植体再生丛生芽率
用农杆菌EHA105侵染上述1(A)法制备的六种萌发形态Y、YL、HG、HG+CG、CG、G的Jack品种子叶节外植体,将侵染3天后的外植体分别置于含有0mg/l草甘膦的丛生芽诱导培养基中,丛生芽诱导培养30天,得到丛生芽诱导后外植体。
每个萌发状态下子叶节外植体的丛生芽率=每个萌发状态对应的带有丛生芽的外植体数量/每个萌发状态下子叶节外植体的数量。
结果如图4B所示,可以看出,Jack品种的HG状态下制备外植体丛生芽率显著高,但其余几个状态也有比较高的丛生芽率。
选取瞬时转化率显著高的状态和丛生芽率显著高的状态均作为外植体制备候选萌发时期,如Jack品种HG、HG+CG、CG为外植体制备候选萌发时期。
3、利用稳定表达外源基因EPSPS选择子叶节外植体制备的最佳种子萌发形态作为外植体制备时期
以Jack品种为例,具体如下:
1)子叶节外植体的制备
分别选取大豆Jack品种的外植体制备候选萌发时期HG、HG+CG、CG采用划痕法(S)制备子叶节外植体。以其他状态Y、YL、G作为对照。
2)稳定表达EPSPS基因
将表达EPSPS基因的载体GR16转入农杆菌EHA105中,得到重组菌;再将重组菌侵染上述1)制备的各种子叶节外植体,将侵染3天后的转染后外植体分别置于含有15mg/l草甘膦的丛生芽诱导培养基中,丛生芽诱导培养30天,得到丛生芽诱导培养后外植体;将丛生芽诱导培养后外植体在芽伸长培养基中芽伸长诱导培养30天,得到芽伸长诱导培养后外植体;将芽伸长诱导培养后外植体在再生苗生根培养基中生根培养30天,得到再生植株。
分别提取不同萌发状态得到的再生植株的基因组DNA,检测目标基因,用LEP-eF2,LEP-eR2引物对草甘膦抗性基因EPSPS进行扩增:
LEP-eF2:5’-ATGACCCCGGCCCCAGCT-3’(序列1)
LEP-eR2:5’-ACCACCATCAATCTCGAAACG-3’(序列2);目的条带大小为1337bp。
PCR扩增出与预计的EPSPS基因大小相符的条带,同时测序结果也与EPSPS基因相一致,则认为该植株为转入外源基因的再生植株(阳性植株)。
统计每个候选萌发时期下子叶节外植体的稳定转化率=(每个候选萌发时期对应的转入外源基因的再生植株的数量/每个候选萌发时期下子叶节外植体的数量)*100%。
结果如图4C所示,可以看出,Jack品种的候选种子萌发状态HG、HG+CG、CG中HG+CG状态下制备外植体转化效率显著高,且也高于对照的萌发状态Y、YL、G,因此HG+CG为Jack品种的最佳种子萌发形态,作为外植体制备时期。
因此,可以根据如下方法确定大豆种子子叶节外植体制备时期:
1)检测待测大豆种子在6个萌发状态下子叶节外植体的瞬时转化率和丛生芽率,选择满足如下A和B,作为外植体制备候选萌发时期;
A为6个萌发状态下子叶节外植体的瞬时转化率中显著高的某个萌发状态或某几个萌发状态;
B为6个萌发状态下子叶节外植体的丛生芽率中显著高的某个萌发状态或某几个萌发状态;
2)检测待测大豆种子在所述外植体制备候选萌发时期下子叶节外植体的稳定转化率,选择所有候选萌发时期子叶节外植体的转化率显著高的某个候选萌发时期或某几个候选萌发时期,作为外植体制备时期;
3)对所述外植体制备时期的待测大豆种子截取子叶节,得到待测大豆目标子叶节外植体;
所述6个萌发状态为如下(1)-(6):
(1)Y状态:子叶呈白色(根据The RHS Colour Chart描述,该颜色为White Group 155A或155B),下胚轴包裹在种皮中;
(2)YL状态:子叶呈白色,下胚轴突破种皮且呈白色;
(3)HG状态:子叶呈白色,下胚轴突破种皮且呈黄绿色(根据The RHS Colour Chart描述,该颜色为Yellow-Green Group 145A或144B)。
(4)HG+CG状态:子叶近下胚轴处呈黄绿色其余部分呈白色,下胚轴突破种皮且呈绿色(The RHS Colour Chart描述Green Group 143B或143C);
(5)CG状态:子叶全部呈黄绿色,下胚轴突破种皮且呈绿色;
(6)G状态:子叶叶边缘呈墨绿色(根据The RHS Colour Chart描述,该颜色为Green Group 139A),下胚轴突破种皮且呈绿色。
二、大豆子叶节外植体制备
截取上述Jack品种的HG+CG萌发状态种子的子叶节,得到大豆目标子叶节外植体。
实施例2、大豆子叶节外植体的应用
将表达EPSPS基因的载体GR16转入农杆菌EHA105中,得到重组菌;再将重组菌转染实施例1制备的Jack品种目标子叶节外植体(HG+CG萌发状态种子的子叶节),将侵染3天后的外植体置于含有15mg/l草甘膦的丛生芽诱导培养基中,诱导培养30天,得到带有丛生芽外植体;将带有丛生芽外植体在芽伸长培养基中培养30天时间,得到带有伸长苗外植体;将带有伸长苗外植体在再生苗生根培养基中培养生根培养30天,得到再生植株。
分别提取再生植株的基因组DNA,检测目标基因,用LEP-eF2,LEP-eR2引物对草甘膦抗性基因EPSPS进行扩增:
LEP-eF2:5’-ATGACCCCGGCCCCAGCT-3’(序列1)
LEP-eR2:5’-ACCACCATCAATCTCGAAACG-3’(序列2);目的条带大小为1337bp。
PCR扩增出与预计的EPSPS基因大小相符的条带,同时测序结果也与EPSPS基因相一致,则认为该植株为阳性植株。
统计子叶节外植体的稳定转化率=(转入外源基因的再生植株的数量/子叶节外植体的数量)*100%。
结果如图4C,可以看出,得到1.8%的转化率。
- 还没有人留言评论。精彩留言会获得点赞!