一种乌菜游离小孢子培养方法与流程
本发明属于生物技术领域,涉及一种乌菜游离小孢子培养方法。
背景技术:
游离小孢子培养是在花药培养基础上发展起来的一项新兴技术,是植物细胞工程领域最活跃的研究课题之一。通过游离小孢子培养技术可获得单倍体、双单倍体,单倍体及双单倍体在作物育种上极为珍贵。常规育种获得一个遗传稳定的自交系一般需要5-8年的时间,而利用小孢子培养技术只需要1-2年,故在许多作物中均开展了游离小孢子的研究工作。
乌菜是十字花科芸薹属芸薹种白菜亚种的一个变种,其游离小孢子培养存在难诱导出胚状体和胚状体诱导率非常低的问题,而与乌菜亲缘关系较近的大白菜在游离小孢子培养中易诱导出胚状体且诱导率普遍较高。目前研究中多有报道,基因型是决定游离小孢子培养能否诱导出胚和诱导率高低的关键因素,为提高乌菜游离小孢子培养胚状体诱导率,现提供一种方法。
技术实现要素:
本发明的目的在于提供一种乌菜游离小孢子培养方法。
本发明的目的可以通过以下技术方案实现:
一种乌菜游离小孢子培养方法,该方法包括下述步骤:
(2)将萌动的杂交种子F1低温春化后播种于穴盘,待3-4片真叶时,移栽至大田中,初花至盛花期,取适宜大小的花蕾进行游离小孢子培养,得再生植株。
所述步骤(2)中游离小孢子培养步骤为:
取材:以F1作为材料,在初花至盛花期,于晴天上午8:00-10:00选取健壮无病虫害植株上的花蕾,置于载玻片上,滴2滴苏木精染液,用镊子和解剖针破碎花蕾,去除萼片、花药等组织,盖上盖玻片,光学显微镜下观察单核靠边期小孢子,确定小孢子处于单核靠边期比例较高时花蕾的大小,以此大小为标准进行取材。
消毒:将选取的花蕾放入25mL无菌小烧杯中,首先用70%的酒精7-10mL消毒30s,其次用2.5%的NaClO溶液约10mL消毒5min,然后用无菌水冲洗3次;
小孢子纯化:消毒后,于上述小烧杯中加入蔗糖质量浓度为130g/L的B5无菌液体培养基(pH5.8、116℃高温高压灭菌30min)约8mL,用玻璃棒轻轻挤压使小孢子游离出来,350目滤网过滤,收集滤液于15mL旋盖离心管中,转速1000rpm离心3min,弃上清,重复2次,最后加入蔗糖质量浓度为130g/L的NLN无菌液体培养基(NLN-13,pH5.8,0.22μm孔径的无菌滤膜过滤灭菌),使小孢子密度达到1×105-2×105个/mL(使用血球计数板计数),即获得小孢子悬浮液。
培养:将小孢子悬浮液分装于直径6cm的培养皿中,每皿约3.5mL,用Parafilm封口膜密封后,立即置于33℃黑条件下暗培养24h;然后,转入25℃黑暗条件下培养,有肉眼可见的胚出现时,将培养皿转移到转速60rpm的摇床上继续暗培养至形成子叶型胚状体;平均每个花蕾诱导出12.53个胚;
所述步骤(2)中再生植株成苗步骤为:
植株再生:暗培养20d左右形成子叶型胚状体,挑选子叶型胚转接入添加30g/L蔗糖、8g/L琼脂,pH5.8、116℃高温高压灭菌30min的MS无菌固体培养基中,在25℃、光照14h/d条件下培养,形成再生植株;
再生植株生根:将胚状体萌发形成的幼苗接种到添加30g/L蔗糖、6g/L琼脂、1mg/L6-BA、0.1mg/LNAA,pH5.8、116℃高温高压灭菌30min的MS无菌固体培养基中,在25℃、光照14h/d条件下培养,获得完整植株。扩繁、驯化移栽至田间。
本发明的有益效果:本发明将乌菜与游离小孢子培养胚状体诱导率较高的大白菜材料进行杂交,为乌菜引入大白菜的遗传物质,有效改善了乌菜供体植株基因型,提高乌菜游离小孢子培养胚状体诱导率,拓宽乌菜育种遗传基础,提高乌菜育种效率。
附图说明
为了便于本领域技术人员理解,下面结合附图对本发明作进一步的说明。
图1为本发明小孢子膨大示意图;
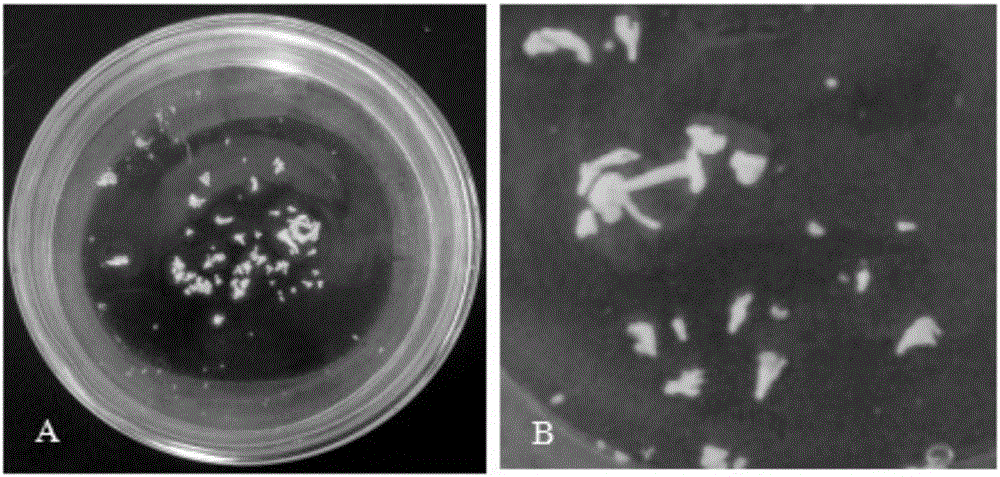
图2为本发明子叶型胚状(A、B)示意图;
图3为本发明胚状体再生植株示意图;
图4为本发明再生植株扩繁示意图;
图5为本发明再生植株田间移栽示意图。
具体实施方式
下面结合附图与实例对本发明作进一步的说明,但不以任何方式对本发明加以限制,基于本发明教导所做的任何变更或改进,均属于本发明的保护范围。
一种乌菜游离小孢子培养方法,该方法包括下述步骤:
(1)选择游离小孢子培养胚状体诱导率较高的大白菜材料,与待培养的乌菜材料进行杂交,得杂交种子F1,为乌菜引入大白菜的遗传物质,拓宽乌菜遗传基础;
(2)将萌动的杂交种子F1播种于穴盘,待3-4片真叶时,移栽于大田中,初花至盛花期,取适宜大小的花蕾按常规方法进行游离小孢子培养,得再生植株;
游离小孢子培养技术步骤:
(1)取材:以乌菜和大白菜的杂交一代F1作为材料,在初花至盛花期,于晴天上午8:00-10:00选取健壮无病虫害的植株上的花蕾,置于载玻片上,滴2滴苏木精染液,用镊子和解剖针破碎花蕾,去除萼片、花药等组织,盖上盖玻片,光学显微镜下观察单核靠边期小孢子,确定小孢子处于单核靠边期比例较多时花蕾的大小,以此大小为标准进行取材。
(2)消毒:将选取的花蕾放入25ml无菌小烧杯中,首先用70%的酒精7-10ml消毒30s,其次用2.5%的NaClO溶液约10ml消毒5min,然后用无菌水冲洗3次;
(3)小孢子纯化:消毒后,于上述小烧杯中加入蔗糖质量浓度为130g/L的B5无菌液体培养基约8ml,用玻璃棒轻轻挤压使小孢子游离出来,350目滤网过滤,收集滤液于15mL旋盖离心管中,转速1000rpm离心3min,弃上清,重复2次,最后加入蔗糖质量浓度为130g/L的NLN(NLN-13,0.22μm孔径的无菌滤膜过滤灭菌,pH5.8)液体无菌培养基,使小孢子密度达到1×105-2×105个/mL(使用血球计数板计数),即获得小孢子悬浮液。
(4)培养:将小孢子悬浮液分装于直径6cm的培养皿中,每皿3.5ml,用Parafilm封口膜封口,立即置于33℃黑暗培养24h;然后,转入25℃黑暗条件下培养(图1),12d有肉眼可见的胚出现时,转移到转速60rpm的摇床上继续暗培养至形成子叶型胚状体(图2);平均每个花蕾诱导出6-8个胚,最高达12.53个;
(5)植株再生:胚状体生长20d左右,挑选子叶型胚转接入添加30g/L蔗糖、8g/L琼脂、pH为5.8、116℃高温高压灭菌30min的MS培养基中,在25℃光照14h/d条件下培养,形成再生植株;未直接成苗而形成愈伤组织的胚状体转接到添加1mg/L6-BA的上述培养基上,使其继续发育成苗(图3)。
(6)再生植株生根:将胚状体萌发形成的小苗接种到添加30g/L蔗糖、6g/L琼脂、1mg/L6-BA、0.1mg/LNAA、pH为5.8、116℃高温高压灭菌30min的MS生根培养基中,在25℃、光照14h/d条件下培养,获得完整植株,扩繁、驯化移栽至田间(图4、图5)。
本发明材料选用乌菜与大白菜的杂交一代F1进行游离小孢子培养,相比于直接进行乌菜游离小孢子培养,F1引入了大白菜的遗传物质,提高乌菜游离小孢子培养胚状体诱导率,解决了胚诱导频率低的技术问题,拓宽乌菜育种遗传基础,提高乌菜育种效率。
以上内容仅仅是对本发明所作的举例和说明,所属本技术领域的技术人员对所描述的具体实施例做各种各样的修改或补充或采用类似的方式替代,只要不偏离发明或者超越本权利要求书所定义的范围,均应属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!