一种细胞冻存液及其应用的制作方法
本发明涉及一种细胞冻存液及其应用,属于细胞生物技术领域。
背景技术:
间充质干细胞是干细胞家族的重要成员,其在体内或体外特定诱导条件下,可分化为脂肪、骨、软骨、肌肉、肌腱、韧带、神经、肝、心肌、内皮等多种组织细胞,为临床治疗各种疾病,如神经系统疾病、肾病、自身免疫性疾病、恶性肿瘤等提供了新的途径。间充质干细胞主要包括骨髓间充质组织干细胞、脂肪间充质干细胞和脐带间充质干细胞,目前研究最为广泛是骨髓间充质干细胞,但随着供体年龄的增长及身体健康状况的差异,骨髓间充质干细胞在数量、扩增及分化能力上出现明显下降趋势,且骨髓提取操作及过程中存在病毒、细胞感染的可能,使其研究和应用受到一定限制。与骨髓间充质干细胞相比,医疗废弃物新生儿脐带的脐带间充质干细胞具有来源丰富、成本低、对捐赠者无损伤及不涉及伦理问题等优势,因而成为未来干细胞在医疗应用上更具有潜力的理想选择。
通常的干细胞冻存液中含有dmso和血清。dmso虽作为细胞渗透性冷冻保护剂,但当干细胞用于临床其所存有的细胞毒性是不容被忽视的;血清存在病原菌污染的可能,其批次不稳定且具有免疫原性。因此研发出一种无dmso(二甲基亚砜)和血清的脐带间充质干细胞冻存液是很有必要的。
技术实现要素:
本发明的目的在于克服现有技术的不足之处而提供一种能较好地保护细胞活性的细胞冻存液及其应用。
为实现上述目的,本发明采取的技术方案为:一种细胞冻存液,其包括基本培养基、丙三醇、脯氨酸、四氢甲基嘧啶羧酸和右旋糖酐,所述基本培养基、丙三醇和四氢甲基嘧啶羧酸的体积比为基本培养基:丙三醇:四氢甲基嘧啶羧酸=100:20-50:15-30;所述基本培养基的体积与脯氨酸和右旋糖酐的质量的比为基本培养基:脯氨酸:右旋糖酐=100ml:5-15g:5-20g。
本发明中,四氢甲基嘧啶羧酸可作为渗透剂保护细胞免受高盐损伤而充当冷冻保护剂。本发明的细胞冻存液不含血清,避免了病原菌的污染;且其不含dmso,避免了dmso的细胞毒性。本发明的细胞冻存液由纯化学物质组成,成分稳定,批次间稳定性好。研究表明,采用本发明细胞冻存液冻存的细胞复苏后细胞活力显著增强。
本发明的细胞冻存液可按照下述方法制得:按照每500ml基本培养基中加入20-50ml丙三醇、15-30ml四氢甲基嘧啶羧酸、5-15g脯氨酸和5-20g右旋糖酐的比例,将丙三醇、脯氨酸、四氢甲基嘧啶羧酸和右旋糖酐加至基本培养基中,混匀,得到所述细胞冻存液。
作为本发明所述细胞冻存液的优选实施方式,所述基本培养基、丙三醇和四氢甲基嘧啶羧酸的体积比为基本培养基:丙三醇:四氢甲基嘧啶羧酸=100:25-45:17-25;所述基本培养基的体积与脯氨酸和右旋糖酐的质量的比为基本培养基:脯氨酸:右旋糖酐=100ml:6-14g:7-15g。研究表明,采用该优选的细胞冻存液进行冻存,细胞复苏后活力更好。
作为本发明所述细胞冻存液的优选实施方式,所述基本培养基、丙三醇和四氢甲基嘧啶羧酸的体积比为基本培养基:丙三醇:四氢甲基嘧啶羧酸=100:40:25;所述基本培养基的体积与脯氨酸和右旋糖酐的质量的比为基本培养基:脯氨酸:右旋糖酐=100ml:10g:15g。申请人比较了本发明细胞冻存液中各组分不同用量对冻存细胞的影响,结果意外发现,采用包含该特定配比组分的细胞冻存液冻存的细胞,复苏后活力显著高于包含其他配比组分的细胞冻存液。
作为本发明所述细胞冻存液的优选实施方式,所述基本培养基为dmem。dmem培养基是一种含各种氨基酸和葡萄糖的培养基,是在mem培养基的基础上研制的。dmem的特点主要包括以下方面:(1)氨基酸含量为依格尔培养基的2倍,且含有非必需氨基酸,如甘氨酸等;(2)维生素含量为依格尔培养基的4倍;(3)含有糖酵解途径中的重要物质--丙酮酸;(4)含有微量的铁离子。
作为本发明所述细胞冻存液的优选实施方式,所述基本培养基为h-dmem。
另外,本发明还提供了上述细胞冻存液在细胞冻存中的应用。
作为本发明所述应用的优选实施方式,所述细胞冻存液用于冻存间充质干细胞。
作为本发明所述应用的优选实施方式,所述间充质干细胞为脐带间充质干细胞。
作为本发明所述应用的优选实施方式,所述脐带间充质干细胞的制备方法包括以下步骤:
(1)采用清洗液、生理盐水依次清洗脐带数次,然后将脐带的羊膜动静脉管剥离,保留华通氏胶体;
(2)向步骤(1)所得华通氏胶体中加入生理盐水,离心,去上清,得到组织沉淀;
(3)向步骤(2)所得组织沉淀中加入脐带间充质干细胞无血清培养基,进行培养,得到脐带间充质干细胞。
作为本发明所述应用的优选实施方式,所述应用包括以下步骤:
(a)取待冻存细胞,加入胰蛋白酶消化,弃去消化液后加入培养液,离心后去上清,得到细胞沉淀;
(b)向步骤(a)所得细胞沉淀中加入所述细胞冻存液,混匀后梯度降温至-80℃,再移入液氮中保存。
与现有技术相比,本发明的有益效果为:本发明提供了一种不含血清和dmso的细胞冻存液,避免了病原菌的污染和dmso的细胞毒性。本发明的细胞冻存液由纯化学物质组成,成分稳定,批次间稳定性好。并且,采用本发明细胞冻存液冻存的细胞复苏后细胞活力显著增强。
附图说明
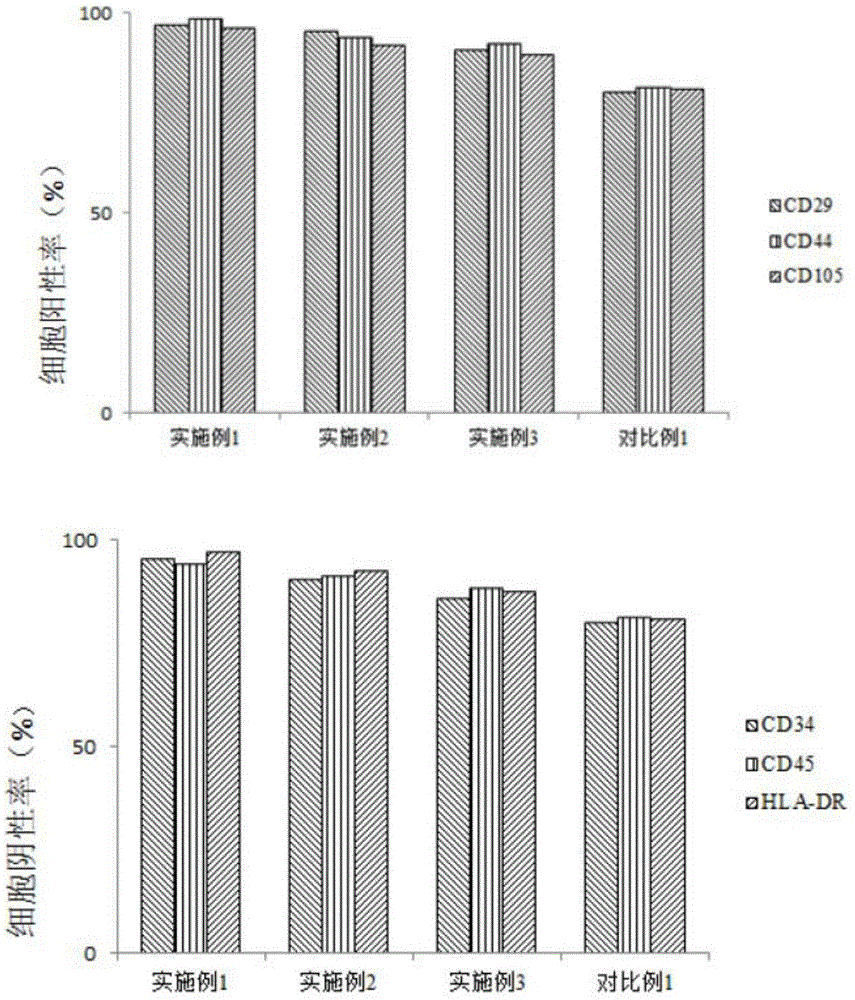
图1为本发明效果例2采用流式检测实施例1~3以及对比例1细胞冻存液冻存细胞复苏后的表面标记抗原的结果图;
图2为本发明效果例3测试实施例1细胞冻存液冻存的脐带间充质干细胞复苏后向成骨细胞分化的结果图。
具体实施方式
为更好地说明本发明的目的、技术方案和优点,下面将结合附图和具体实施例对本发明作进一步说明。
下述实施例中,脐带间充质干细胞的制备方法为:
(一)脐带间充质干细胞的分离
(1)在超净台中取出运输液中的脐带,放于60cm2的培养皿中,用清洗液洗涤数遍以去除脐带表面的血液;
(2)将清洗后的脐带,剪成2-3cm长的小段于60cm2的培养皿,用清洗液逐个洗涤数遍,以去除残留在里面的血液;
(3)每一段再经无抗0.9%的无菌生理盐水清洗数遍,将羊膜动静脉管剥离,只保留华通氏胶体;
(4)将所有的华通氏胶体移至50ml离心管中,加入1-2倍的生理盐水,用剪刀将其剪碎,800g,离心5min;
(5)弃去上清,将组织沉淀平均分于60cm2的培养皿中,待其贴壁加入8ml脐带间充质干细胞无血清培养基,放于37℃,5%二氧化碳培养箱培养。
(二)脐带间充质干细胞的培养
(1)当培养上述脐带块2d,对其进行半换液处理即加入4ml新鲜培养基;
(2)培养4d,组织块周边会有间充质干细胞克隆出现,可记为p0代,进行全换液处理;
(3)培养5-6d,间充质干细胞融合度达到90%,弃去脐带组织块和原有培养液,2ml生理盐水洗涤一次,弃去;
(4)加入2ml0.25%胰酶,放于培养箱中消化30s,加入2ml盐水进行稀释消化液,轻轻吹到细胞使其脱落;
(5)上述(4)所制得的细胞悬液经100μm滤网过滤以去除残余的组织碎片,300g,离心5min,弃去上清,加3ml新鲜培养基重悬细胞沉淀,并以1:3的比例进行传代,可标记为p1代。
实施例1
本发明细胞冻存液的一种实施例,本实施例的细胞冻存液由基本培养基、丙三醇、脯氨酸、四氢甲基嘧啶羧酸和右旋糖酐组成,所述基本培养基、丙三醇和四氢甲基嘧啶羧酸的体积比为基本培养基:丙三醇:四氢甲基嘧啶羧酸=100:40:25;所述基本培养基的体积与脯氨酸和右旋糖酐的质量的比为基本培养基:脯氨酸:右旋糖酐=100ml:10g:15g。
本实施例细胞冻存液的制备方法为:按照本实施例所述比例,将丙三醇、脯氨酸、四氢甲基嘧啶羧酸和右旋糖酐加至基本培养基中,混匀,得到所述细胞冻存液。
实施例2
本发明细胞冻存液的一种实施例,本实施例的细胞冻存液由基本培养基、丙三醇、脯氨酸、四氢甲基嘧啶羧酸和右旋糖酐组成,所述基本培养基、丙三醇和四氢甲基嘧啶羧酸的体积比为基本培养基:丙三醇:四氢甲基嘧啶羧酸=100:20:15;所述基本培养基的体积与脯氨酸和右旋糖酐的质量的比为基本培养基:脯氨酸:右旋糖酐=100ml:5g:5g。
本实施例细胞冻存液的制备方法同实施例1。
实施例3
本发明细胞冻存液的一种实施例,本实施例的细胞冻存液由基本培养基、丙三醇、脯氨酸、四氢甲基嘧啶羧酸和右旋糖酐组成,所述基本培养基、丙三醇和四氢甲基嘧啶羧酸的体积比为基本培养基:丙三醇:四氢甲基嘧啶羧酸=100:50:30;所述基本培养基的体积与脯氨酸和右旋糖酐的质量的比为基本培养基:脯氨酸:右旋糖酐=100ml:15g:20g。
本实施例细胞冻存液的制备方法同实施例1。
实施例4
本发明细胞冻存液的一种实施例,本实施例的细胞冻存液由基本培养基、丙三醇、脯氨酸、四氢甲基嘧啶羧酸和右旋糖酐组成,所述基本培养基、丙三醇和四氢甲基嘧啶羧酸的体积比为基本培养基:丙三醇:四氢甲基嘧啶羧酸=100:25:17;所述基本培养基的体积与脯氨酸和右旋糖酐的质量的比为基本培养基:脯氨酸:右旋糖酐=100ml:6g:7g。
本实施例细胞冻存液的制备方法同实施例1。
实施例5
本发明细胞冻存液的一种实施例,本实施例的细胞冻存液由基本培养基、丙三醇、脯氨酸、四氢甲基嘧啶羧酸和右旋糖酐组成,所述基本培养基、丙三醇和四氢甲基嘧啶羧酸的体积比为基本培养基:丙三醇:四氢甲基嘧啶羧酸=100:45:25;所述基本培养基的体积与脯氨酸和右旋糖酐的质量的比为基本培养基:脯氨酸:右旋糖酐=100ml:14g:15g。
本实施例细胞冻存液的制备方法同实施例1。
对比例1
本对比例的一种细胞冻存液,其由下述体积百分比的组分组成:10%dmso(二甲基亚砜)和90%fbs(胎牛血清)。
对比例2
本对比例的一种细胞冻存液,其与实施例1细胞冻存液的区别仅在于:本对比例的细胞冻存液不含丙三醇。
对比例3
本对比例的一种细胞冻存液,其与实施例1细胞冻存液的区别仅在于:本对比例的细胞冻存液不含脯氨酸。
对比例4
本对比例的一种细胞冻存液,其与实施例1细胞冻存液的区别仅在于:本对比例的细胞冻存液不含四氢甲基嘧啶羧酸。
对比例5
本对比例的一种细胞冻存液,其与实施例1细胞冻存液的区别仅在于:本对比例的细胞冻存液不含右旋糖酐。
对比例6
本对比例的细胞冻存液由基本培养基、丙三醇、脯氨酸、四氢甲基嘧啶羧酸和右旋糖酐组成,所述基本培养基、丙三醇和四氢甲基嘧啶羧酸的体积比为基本培养基:丙三醇:四氢甲基嘧啶羧酸=100:15:10;所述基本培养基的体积与脯氨酸和右旋糖酐的质量的比为基本培养基:脯氨酸:右旋糖酐=100ml:3g:3g
本对比例细胞冻存液的制备方法同实施例1。
对比例7
本对比例的细胞冻存液由基本培养基、丙三醇、脯氨酸、四氢甲基嘧啶羧酸和右旋糖酐组成,所述基本培养基、丙三醇和四氢甲基嘧啶羧酸的体积比为基本培养基:丙三醇:四氢甲基嘧啶羧酸=100:55:35;所述基本培养基的体积与脯氨酸和右旋糖酐的质量的比为基本培养基:脯氨酸:右旋糖酐=100ml:20g:25g
本对比例细胞冻存液的制备方法同实施例1。
效果例1细胞活力检测
本效果例采用实施例1~5和对比例1~5的细胞冻存液,按照下述方法进行细胞冻存、复苏实验及mtt检测。
(一)细胞冻存过程:
1)待脐带间充质干细胞(p1代)融合度达到90%,弃去原有培养基,加入ph7.0的pbs洗细胞表面一次,弃去;
2)加入0.25%胰蛋白酶液消化30s,弃去,加入2mldmem培养液,用移液枪轻轻吹打使细胞脱落,将细胞悬液移至15ml离心管中,离心1000rpm,离心3min,弃上清,加入pbs洗细胞两次,细胞沉淀加入实施例1-4所制备的冻存液5ml,混匀,分装至冻存管内,每管1.5ml;
(二)细胞冷冻
将冻存管移至程序降温盒中放于4℃,30min;然后放入-20℃,2h;再放入-80℃,8h;最后移入液氮中保存;分别冻存4个月。每组3个重复。
(三)细胞复苏
每组各取出1管快速置于37℃水浴中,直至细胞悬液完全融化,移至15ml离心管中,然后3倍dmem培养液稀释,1000rpm,离心5min,离心去除上清液,再重复3次。
(四)mtt细胞活性检测
按照mtt法检测实施例1-5以及对比例1~5所得到的脐带间充质干细胞所制得的脐带间充质干细胞的增殖情况。结果如下表1所示:
表1
其中,实施例1制得的细胞的活力显著高于实施例2~5(p<0.05)且与各实施例与对比例1~7相比差异明显(p<0.05),说明本发明研究的冻存液各组分之间具有协同作用,相比含血清的冻存液能更好地保护细胞活性,且实施例1的效果最佳。
效果例2流式表型检测
本效果例采用流式检测实施例1~3以及对比例1细胞冻存液冻存细胞复苏后的表面标记抗原,检测的具体步骤如下:
1)将实施例1-3、对比例1所制备的细胞冻存液,按照实验例1复苏细胞所制得的各脐带间充质干细胞进行扩增培养;
2)当细胞融合度达到90%时,0.25%胰酶消化并收集细胞,分装于1.5mlep管中,每份细胞数为2×105个;
3)细胞重悬于1mlpbs中洗涤2次,200g,离心5min;
4)离心弃去上清液,加入200μl鼠源cd29、cd44、cd105、cd34、cd45、hla-dr一抗抗体(稀释度为1:100)常温下孵育30min;
5)1mlpbs洗涤,分别与fitc标记二抗igg(稀释度为1:2000)常温避光孵育1h;
6)pbs洗两次后,弃去pbs,根据细胞量加入适量的pbs重悬细胞,利用流式细胞仪检测。
其中,对实施例1~3、对比例1制得脐带间充质干细胞的检测结果如图1所示。通过流式细胞仪分析显示,实施例1中的阳性蛋白cd29、cd44、cd105和阴性cd34、cd45、hla-dr蛋白要比实施例2-3,对比例1中的表达量高;说明实施例1~3所制备的脐带间充质干细胞特异性好,且实施例1最佳。
效果例3成骨细胞诱导及检测
本效果例研究了实施例1细胞冻存液冻存的脐带间充质干细胞复苏后向成骨细胞分化的结果,研究的具体步骤为:
1)1ml0.1%明胶包被6孔板,置于二氧化碳培养包被30min;
2)将实施例1冻存液中冻存4个月复苏制得的间充质干细胞传至3代,当细胞融合度达到80%-90%时,用0.25%的胰酶消化;
3)离心,弃去上清,脐带间充质干细胞重悬细胞,细胞计数板计数,以每孔2×104接种于已制备好的六孔板中,补加脐带间充质干细胞培养液到2ml;
4)当细胞融合度达到60-70%时,弃去脐带间充质干细胞培养液,向六孔板中加入2ml成骨细胞诱导培养基。
5)每隔3d,更换新的成骨细胞诱导培养基。
6)诱导2周,可进行半数换液;
7)将诱导好的成骨细胞,弃去细胞培养液,每孔加入2mlpbs洗2次,加入2ml4%多聚甲醛室温固定30min;
8)弃去固定液,每孔加入2mlpbs洗2次,加入1ml茜素红染色5min;
9)弃去茜素红染液,每孔加入2mlpbs洗2次,弃去,镜下观察,拍照如图2所示。
由图2可见,细胞表面已经被茜素红染液染成深红色,说明细胞已经向胞外分泌骨基质,可见细胞具有成骨分化潜能。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
- 还没有人留言评论。精彩留言会获得点赞!