一种酶的应用技术及其改善了消化性的药食用动物胶的制作方法
本发明涉及食品、保健品领域,具体地涉及发展酶的应用技术而获得的一种口服药食用动物胶产品及其制法和组合应用。
背景技术:
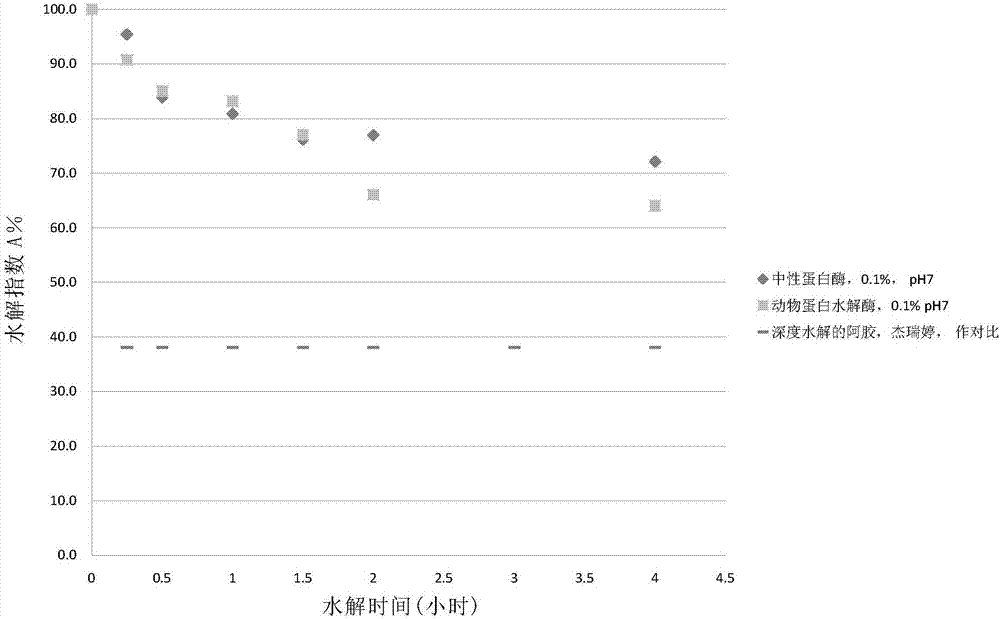
:阿胶,俗称驴皮胶,系驴皮去毛后用清水熬制而成的黑色胶块。按传统的中医理论,阿胶能滋阴、润肺、补血、止血、调经、安胎和祛风等,现代药理实验与临床应用也进一步肯定了前人的药效认识(如补血、止血、抗休克、促进钙的吸收与储存以及提高免疫功能等)。阿胶的基本成分是驴皮胶原纤维的降解产物,其分子量在8万~20万道尔顿的相当宽的范围内分布,同时阿胶还含有大量钙质和多种微量元素。经典阿胶(传统阿胶)虽然有近2000年成功临床实践的支持,也确有特色疗效,但临床实践的历史也同样指出其存在重要缺陷,如难以消化,尤其是对体弱病人而言。例如,。现代人体消化研究表明,阿胶难以消化主要是因为其蛋白分子量大,胃肠负担过重。因此,对于体弱病人、消化酶缺乏人群,阿胶药效无法得到充分发挥。随着蛋白深度酶解工业技术(例如胶原蛋白的深度水解)的发展以及冷冻干燥技术的发展,使用该技术制备深度水解的阿胶产品以解决阿胶难以消化的问题已经成为近十多年来一个新的研究热点。但是,最大保留传统阿胶特色并非目前阿胶工业深度水解的考量,具体地,现有深度水解产品并非以肠胃的实际消化潜力为度,而仅仅在追求相当深程度的工业水解,这导致实际深度水解产物已经趋近于一般胶原蛋白和明胶的水解混合物,这同其他动物皮胶的水解成分已经十分接近甚至相同。因此,除少数特别应用有效外,面对广泛的消费人口,该深度水解所得阿胶产品的保健效果均显著下降,无法达到传统阿胶所具有的共同特征性:那么多不同人服用后都有保健效果。此外,虽然蛋白的酶水解技术和冷冻干燥技术已经日趋成熟,但是其生产成本仍然是非常高的,而作为原料本身的传统阿胶已经价值非凡,经过高成本的加工之后,所得产品的药用价值有所降低而价格却更加高昂,这将会极大地影响其适用性和市场竞争性。与阿胶类似,鹿角胶和龟甲胶等不易消化的药食用动物胶也存在类似的问题。因此,本领域急需开发一种新的口服药食用动物胶产品以及一种新的适宜传统药食用动物胶的补充蛋白酶制剂,以及它们的制法和组合应用。应该尽量避免改变传统药胶的特色,或仅作最小改变以使所得产品不偏离传统药用动物胶特色太远,佐以补充蛋白酶的运用保证了传统药用动物胶的特色,又能使所得药食用动物胶产品更易于消化适用,提高了总药效,且经济成本合算。为此,打技术组合“拳”以代替前几年效果不彰的单一深度水解技术将应是个可行的路子。从现代医药的角度看,药食用动物胶的消化吸收问题实际就是其总生物有效性(totalbioavailability)的问题。改进其生物有效性,不仅提高了其总药效(efficacy),也节约了稀有珍贵动物的资源。这就有待于发明新的酶技术产品,巧妙地发展和直接利用蛋白酶技术,走技术组合“拳”的路子,而非极端且单一的深度水解。其实工业深度水解的阿胶(如杰瑞婷)还是有其它用处的,比如可以作为不同程度水解产物的对照标准品,或像掺沙子似的掺合到传统阿胶里。以现代药业看,如果药食用动物胶总的生物有效性的问题未能妥善解决,那么该药物制剂还仍然是个未完成式。“深度水解”的阿胶技术虽然满足了某些定义的发明特征的要求,而作为一个好的技术专利而火了一阵,但它只能满足少数特定病例的要求。它单一而不可调节,却未能具备传统阿胶所具备的“一个技术通过调节能满足不同人群的多重需要”这一中药的共同特征,未能通过实践的把关。这是一不可忽视的技术背景。有鉴于这是中医药方面的改进,而传统药食动物胶已经表现出了的那种中医药所具有的技术弹性的,多元可调节的,广延多变的,多重可选择的,各种个性均能适应的,随人随时可变“有求必应”式的,合成性特征。这种合成性特征或组合共性在本研发中也必须得到体现,否则就不能算是成功的研发。从分子量“光谱”角度来看,传统阿胶与深度水解的阿胶各自代表了该分子量谱系的两个极端的“各执一端”。在该两极端之间的广阔谱带,可能是未来的既能保持传统阿胶特色又能改进其消化吸收性的新产品开发带。尤其是在靠近传统阿胶附近的谱带,即适度水解的,部分酶解的,或体内帮助酶解的阿胶,是应该首先考虑的。而适度水解,部分酶解,或体内帮助酶解却有一定的技术难度(1)需要快速灵敏的酶解质控手段;(2)稳定重复性要好,总满足同一标准;(3)需在非“酶适条件“下求得较快的稳定的酶解;(4)具有可调节性,不断适应众多口服者的需求。这就好似水煮鸡蛋,各人适度水煮的鸡蛋总比一个深度水煮的鸡蛋(煮半小时或更长时间)更需要技术和调节,更需要有好的重复性。又好像用桶到井中打水,每次吊满一桶水上来并非难事,但要每次都吊出近似相同体积刻度的半桶水上来却非易事。适度水解的水解度一般在初始的dh=0.5%-3%快速改变范围内,相对于深度水解dh=10-20%的慢速改变范围,适度水解的质控和重复性需要技术。国外先发展了深度水解,后出现适度水解。非“酶适条件“下的蛋白酶技术的研发。上述难点一般未见于深度水解的阿胶,尤其第3点。盖各种蛋白酶都有各自的最佳ph和最佳温度范围,其“酶适条件“具明载于教科书等,一般没有什么因素妨碍工业罐水解遵循这些最佳酶适条件。然而,体内帮助酶解,或发展出服用前即时地部分地体外帮助酶解,却必须发展出非”酶适条件“下的酶技术。例如要在,非最佳ph(肠胃液,食前水溶液),非最佳温度(37℃),多重干扰抑制因素(肠胃条件,同时摄入复配的药食等),某些人体对某些酶的过敏或抑制;非简单水溶液(大量的黄酒使用于口服动物胶)等条件下得到快速,抗干扰,稳定的酶解。这就既要借助于大量筛选组合酶,又要在补充口服酶基础上,发展出相比略为简单可控的服前部分酶解技术。这些既需发展底物又需发展酶技术的考量就注定了本发明必是一个底物与酶双方向的,二维的研发。有鉴于这是一个底物(药食用动物胶,s)与酶(蛋白酶,e)互相作用的二维研发问题,从本研发的一开始,就既向着发展酶技术用以改进药胶底物s的方向发展,也同时向着直接改进酶应用技术e的方向发展。其未曾想周到的一个困难在于:这些通过分解而演绎出的配方参数或发明条条,还必须能够重新组合归纳起来,条理清楚,方才能提供给中医生作出随人随时,伸缩自如的调节而发挥药效。否则就没有实用价值。简而言之,如果研发的技术像深度水解那样地简单,则缺乏实用价值。如果研发成多个发明涵盖广面,若这些发明不能有机地组合归纳起来,也还是没有实用价值。最后,上述的组合共性与上述的s,e的双重研发走到了一起,那就是s×e个新的产品与应用方法的组合发明。技术实现要素:本发明的目的在于发展蛋白酶应用技术,用以改善传统药食用动物胶的消化吸收性,即提升其总的生物利用度或生物有效性。本发明的第一方面,提供了一种口服药食用动物胶产品,所述产品包含第一包装和第二包装,其中,所述第一包装包含药食用动物胶,所述第二包装包含有本发明的适用于药食用动物胶的蛋白酶制剂。本发明的第一方面之一,提供了一种口服的适度水解了的药食用动物胶产品在另一优选例中,所述第一包装内为本发明的适度水解了的药食用动物胶(即表1-1中,第1列,第三行)。在另一优选例中,所述第一包装内为传统药食用动物胶,包装于第三包装内。在另一优选例中,所述产品包含本发明适度水解了的药食用动物胶和任选的本发明的蛋白酶制剂。在另一优选例中,所述第二包装内为本发明的包括蛋白酶组合酶在内的补充蛋白酶制剂(即表1-1中,第一行第3列)。在另一优选例中,所述第二包装为本发明的蛋白酶肠溶制剂。在另一优选例中,所述药食用动物胶和所述蛋白酶的质量比为10-1000:1。在另一优选例中,所述药用动物胶和所述蛋白酶的质量比为20-500:1,较佳地30-400:1,更佳地40-300:1。在另一优选例中,所述药食用动物胶选自下组:阿胶、鹿角胶、龟甲胶、黄明胶、或其组合。在另一优选例中,所述药食用动物胶的水解度dh为0-20%,较佳地0-10%,更佳地0-5%,最佳地0-3%,最佳地0.3-3%。在另一优选例中,所述“水解度”以未水解的传统药食用动物胶的酶解度dh为0%。(即表1-1中第二行第1列)。在另一优选例中,所述本发明的适度水解的药食用动物胶选自下组:适度水解的阿胶、适度水解的鹿角胶、适度水解的龟甲胶、或其组合。在另一优选例中,所述“适度水解”指所述药食用动物胶的水解度dh为0-10%,较佳地0-5%,更佳地0.3-3%。在另一优选例中,所述适度水解的阿胶即为轻阿胶,所述轻阿胶包含未酶解的阿胶、浅度水解的阿胶和深度水解的阿胶。在另一优选例中,所述轻阿胶中,所述未酶解的阿胶、所述浅度水解的阿胶和所述深度水解的阿胶的质量比范围为0-100:0-100:0-100,较佳地1-15:1-20:1-10,较佳地1-6:1-6:1-6。在另一优选例中,所述未酶解的阿胶的分子量为m1,80kd<m1≤200kd,和/或水解度dh=0。在另一优选例中,所述浅度水解的阿胶的分子量为m2,10kd<m2≤50kd,和/或dh<2%。在另一优选例中,所述深度水解的阿胶的分子量为m3,2kd<m3≤10kd,和/或dh>8%。在另一优选例中,所述适度水解的阿胶由现有的传统阿胶生产流程之末加入酶水解步骤而制备,方法如下述:(1)在现有传统阿胶熬制完成时,添加适量水分,并降温到50℃左右。(2)添加适量蛋白酶,优取猪胰蛋白酶,碱性蛋白酶,中性蛋白酶,动物蛋白水解酶,酶与阿胶干重比为0.1-5%。(3)搅拌酶解,连续观测水解度dh,或观测间接水解指数a%。(4)当dh达到1-3%左右,或a%达到70%-45%上下时,升温杀酶终止酶解,并蒸去多余水分,直接得到各种不同侧重分子量范围的适度水解阿胶产品。在另一优选例中,所述浅度水解的阿胶或所述深度水解的阿胶是采用如下方法分别制备的:a-1)提供包含阿胶和蛋白酶的水溶液,优选地,蛋白酶优取猪胰蛋白酶、动物蛋白水解酶、碱性蛋白酶、中性蛋白酶、或其组合;a-2)在搅拌条件下,所述水溶液进行水解反应,并观察水解度dh或a%,直到所要的的dh或a%;a-3)将步骤a-2)所得反应产物升温至酶灭活温度,相继得到所述浅度水解的阿胶或所述深度水解的阿胶溶液。a-4)除去溶液中盐分,再通过简单蒸发,或喷雾干燥,或冷冻干燥去除水分,分别得到浅度水解阿胶或深度水解阿胶,备用。在另一优选例中,步骤a-1)所述水溶液还包含醇类溶剂。在另一优选例中,步骤a-1)所述水溶液的ph为4-10,较佳地为4-9,取决于所使用的酶。在另一优选例中,步骤a-1)所述水溶液中,所述阿胶和所述蛋白酶的质量比为10-600:1,较佳地20-500:1,更佳地30-400:1。在另一优选例中,在进行步骤a-2)时,同时伴有对反应混合溶液中阿胶的水解指数的动态检测,以确定其水解度dh,或检测间接指示水解度的水解指数a%。在另一优选例中,步骤a-2)所述水解反应的反应温度为25-65℃,较佳地30-60℃,取决于所使用的酶。在另一优选例中,步骤a-2)所述水解反应的反应时间为0.2-5小时,取决于所使用的酶和酶解温度。在另一优选例中,步骤a-3)所述酶灭活温度为80-100℃。在另一优选例中,所述第一包装内还含有甜味剂等一般辅料。在另一优选例中,所述适度水解的药食用动物胶可以直接服用(即表1-1中,第2列,第三行)。在另一优选例中,所述适度水解的药食用动物胶也可以配伍本发明蛋白酶制剂而服用,服用方法参见本发明第六方面(即表1-1中,第3列,第三行)。本发明的第一方面之二,还提供了一种本发明的适用于药食用动物胶的蛋白酶制剂(第二包装内)。本发明所研发的酶技术及其应用(indication)特征是:在非“酶适条件“下的蛋白酶技术。其酶制剂特征是:研发有多组的蛋白组合酶可供选择,能在较苛刻(例如黄酒),或生理条件(ph,温度,干扰)下均能有效地酶解药食用动物胶。在另一优选例中,所述第二包装中的蛋白酶制剂选自下组:胃蛋白酶、胰蛋白酶、碱性蛋白酶、中性蛋白酶、角蛋白酶、木瓜酶、动物蛋白酶、菠萝酶、酸性蛋白酶、无花果酶、或其组合。在另一优选例中,所述蛋白酶制剂选自下组:胃蛋白酶、胰蛋白酶、碱性蛋白酶、中性蛋白酶、角蛋白酶、或其组合。在另一优选中,所述组合蛋白酶包括有肠组合酶,单酶,双酶,三酶,四酶,以及更多;还有胃组合酶,单酶,双酶,三酶等。在另一优选例中,所述蛋白酶在生理或其他条件下,能有效、稳定地水解传统的,或复合的,或适度水解了的药食用动物胶。在另一优选例中,所述第二包装包含1-6种蛋白酶,较佳地1-4种,更佳地1-3种。在另一优选例中,按所述第二包装所包含蛋白酶的总重量计,其中各种蛋白酶的含量分别为1-99wt%,较佳地3-90wt%,更佳地5-80wt%,更佳地5-60wt%,最佳地5-30wt%。在另一优选例中,所述第二包装中补充酶为4酶肠组合蛋白酶,包含猪胰蛋白酶、碱性蛋白酶、角蛋白酶、中性蛋白酶,其质量比为3-10:5-10:5-10:3-10,较佳地3-5:4-8:4-8:3-5。肠液条件或中性条件为其优选。在另一优选例中,所述第二包装中所述补充酶为3酶肠组合蛋白酶,包含猪胰蛋白酶、碱性蛋白酶和中性蛋白酶,所述胰蛋白酶、所述碱性蛋白酶和所述中性蛋白酶的质量比为2-10:3-10:3-10,较佳地3-5:4-8:5-8。肠液条件或中性为其优选。在另一优选例中,所述第二包装内含有胃组合酶和肠组合酶。所述胃组合酶包含有:猪胃蛋白酶,木瓜酶,菠萝酶,酸性蛋白酶,其质量比为:6-12:2-5:1-3:1-3。胃液条件或较酸性条件为其优选。另一优选例中,所述第二包装内还含有甜味剂等一般药食辅料。在另一优选例中,所述产品还包含第三包装,所述第三包装包含醇类溶剂。在另一优选例中,所述醇类溶剂为乙醇浓度为1-30%的黄酒溶液,较佳地5-15%,优选为10%。在另一优选例中,所述蛋白酶对所述药食用动物胶的消化促进作用在体内进行(即表1-1中的第3列的3个应用)。在另一优选例中,所述第一包装中的所述药食用动物胶优选地在服用前使用所述第三包装中的醇类溶剂进行预处理后,再和所述第二包装中的蛋白酶制剂一起服用。所述本补充蛋白酶制剂产品中的多种组合蛋白酶,它们能组合地抵御消化系统中可能的酶抑制因子;和/或,减低过敏体质者对某种酶的可能的过敏或依赖;和/或,能为某些体虚者配分蛋白酶的总剂量(totaloraldose),例如在胃酶与肠酶之间的配比,或食用前酶解与摄入酶之间的配比,或酶品种与剂量之间的搭配;和/或,甚至在较为苛刻的条件(例如常见的配伍黄酒,内含乙醇溶剂)下,也都能达到保持较稳定的酶活性。在另一优选例中,所述蛋白酶制剂可有效、稳定地水解药食用动物胶和/或食用蛋白。本发明的第二方面提供本发明产品建议的包装方法。本方法提供了一种本发明第一方面所述口服药食用动物胶产品的包装制备方法,所述方法包括如下步骤:1)提供药食用动物胶、蛋白酶和任选的醇类溶剂;2)封装所述药食用动物胶得到第一包装,封装所述本发明蛋白酶得到第二包装,和任选地封装所述醇类溶剂得到第三包装;3)组合所述第一包装、所述第二包装和任选的第三包装,得到本发明第一方面所述口服药用动物胶包装产品。在另一优选例中,所述第一产品包装包括有:第一包装a,本发明适度水解的药胶;第一包装b,传统的药食用动物胶;第一包装c,本发明食用蛋白和营养物与药胶的复合营养品。在另一优选中,所述2个含第一包装a的适度水解药胶的组合均可直接服用(即表1-1,第三行,2个应用)。在另一优选中,所述第二包装酶与第一包装b的传统药胶的组合可选择直接服用,或选择在服用前作即时的部分酶解,尔后服用(即表1-1,第二行,分别2个应用)。在另一优选中,把所述药食用动物胶与食用蛋白营养物复配的复合营养品封装入第一包装c直接口服。或把第一包装c与第二包装酶组合成组合产品,直接口服,和/或,服前作即时部分酶解后服用(即表1-1,第四行,分别3个应用)。本发明的第三方面,提供了一种本发明的复合营养品。所述复合营养品包含本发明第一方面所述的口服药食用动物胶产品或由本发明第一方面所述的口服药食用动物胶产品制成。在另一优选中,所述口服药食用动物胶还包括了传统阿胶,传统鹿角胶和传统龟甲胶。在另一优选例中,所述复合营养品还包含味觉调剂。在另一优选例中,所述味觉调剂选自下组:蜂蜜、甘草、甜味剂、或其组合。在另一优选例中,所述复合营养品还包含选自下组的成分:胶原蛋白、骨胶原、水解胶原蛋白、乳清蛋白、干酪素等酪蛋白、奶粉、食用明胶、水解蛋白、游离大豆蛋白、螺旋藻、牛初乳、羊胎盘、蜂胶、蜂乳、或其组合。(即表1-1,第1列,第四行)在另一优选例中,所述复合营养品还包含亚铁盐,优选地其含量为0.2-3wt%,更优选地为0.5-2wt%,按所述复合营养品的总重量计。在另一优选中,所述总的药食用动物胶在所述复合营养品中占比0-100%。在另一优选中,本发明复合营养品可以直接服用(即表1-1中,第2列,第四行)。在另一优选中,本发明复合营养品可以与本发明蛋白酶制剂复配服用。服用方法如以下第四方面和第六方面所述(即表1-1中,第3,4列,第四行)。本发明的第四方面,本发明蛋白酶制剂的应用(indication)之一。在另一优选例中,所述蛋白酶制剂如本发明第一方面所述。本发明提供了一种使用本发明的蛋白酶制剂对传统药食用动物胶作服用前即时酶解的酶应用方法,以取得部分酶解的药食用动物胶后再作口服(即表1-1,第4列的2-3个应用)。该应用是对口服补充蛋白酶的延伸发展,卑能既减少干扰又可调节温度。在另一优选例中,所述体外即时酶解处理包括如下步骤:i)将传统药食用动物胶溶液和蛋白酶制剂进行复配,在室温至60℃条件下,温热适当时间;和/或,然后升温祛酶活;ii)将i)所述传统药食用动物胶使用蛋白酶制剂进行即时酶解处理以后得到的部分水解了的药食用动物胶直接口服。这是本发明的非“酶适条件”下的酶技术的应用(indication)之一(即表1-1中,第4列,第二行)。所述方法包括步骤:i)在服用前,提供阿胶,或鹿角胶,或龟甲胶的水溶液或黄酒溶液;ii)步骤i)所述溶液内加入第二包装蛋白酶,得到第一反应液,并加热到适当的第一温度;iii)在第一温度范围内,所述第一反应液进行水解反应,得到第二反应液;iv)升温所述第二反应液至第二温度,杀酶中止反应,得到待服用的部分水解了的动物胶溶液。在另一优选例中,i)所述的动物胶溶液可以是传统药食用动物蛋白溶解于5-30倍的水,或黄酒中的溶液,例如传统阿胶食用的痒化法,传统法,阿胶粥,各种阿胶汤,阿胶酒,多种阿胶蜂蜜水等饮用补品,等等。在另一优选例中,所述第一反应液中阿胶,或鹿角龟甲胶,与补充蛋白酶制剂的质量比为10-500:1,较佳地20-200:1,更佳地30-100:1。在另一优选例中,当所述第一反应液是鹿角胶或龟甲胶溶液时,所述第二包装中的蛋白酶含有角蛋白酶,角蛋白酶与动物胶底物干重比为0.2-5%。在另一优选例中,所述第一温度为室温-65℃,较佳地40-60℃。在另一优选例中,步骤iii)所述水解反应的反应时间为0.2-6小时,较佳地0.4-4小时。酶解时间或温度由食用者自己掌握,以服用后不腻食,刚好能消化为度。在另一优选例中,步骤i)所述溶液可用小苏打或食用酸调ph,然后在步骤iv)中再加食用酸或小苏打把ph调回中性。在另一优选例中,所述第二温度为80-100℃。在另一优选例中,所述服前即时部分水解了的传统药胶制品中,可添加甜味剂等一般药食辅料。本发明所述的蛋白酶制剂包含了所述蛋白酶及其组合酶,和适当的药食用辅料。所述制剂的剂型包括了胶囊,片剂,可分割的片剂,粉剂,肠溶胶囊,肠溶颗粒,缓释剂型,乳化液,悬浮剂,或其组合。所述蛋白酶与底物药食用动物胶的质量比例,es,的范围是;0.1-10%,优选0.1-5%。以上都说明:若要克服传统阿胶难以消化的难题,并不一定需要较极端且单一的工业上的深度酶解。而巧妙地发展和利用蛋白酶技术,打技术组合“拳”,适度地水解阿胶,或传统阿胶佐以补充蛋白酶制剂,或传统阿胶在食用前作即时的部分酶解,或药食用蛋白与日常营养品配伍口服,也都能达到同样的消化效果的改善。提高了总药效,且能避免改变传统药胶的特色,或仅作最小程度的改变。本发明的第五方面,提供了一种新颖的,简单快速而又灵敏的蛋白水解程度检测方法。在另一优选例中,水解度的控制可藉由观察水解指数a%而达到。a是brodford蛋白定量测定法中,加入考马斯亮蓝后的光吸收a595。在蛋白水解过程中,虽然总蛋白浓度不变,但我们发现a595随蛋白分子之水解断裂而迅速下降。a%度量了a595的相对变化,它间接地指示了蛋白水解的水解度dh,尤其在蛋白适度水解范围内灵敏。这是首次采用的新检测方法。在本发明中,蛋白水解程度dh的质量控制通过采用一种本发明的灵敏方法而达到,其特征是一种由bradford考马斯亮蓝法发展来的快速测定蛋白水解程度的分析方法,以a%为其水解指数,能灵敏地指示低水解度的,适度水解的蛋白水解程度dh。本发明的第六方面,提供了本发明蛋白酶制剂的应用(indication)之二。本发明提供了一种能帮助口服传统药食用动物胶消化吸收的补充蛋白酶制剂和使用方法(即表1-1中,第3列,第二行)。所述方法包括如下步骤:i)将传统药食用动物胶溶解于适当溶剂或溶液中;和/或,与蛋白酶制剂进行复配后服下;和/或ii)将上述药食用动物胶溶液与蛋白酶制剂分别服下。所述补充蛋白酶制剂将在胃肠中帮助进行处理,以得到适宜的水解了的药食用动物胶,起到帮助消化吸收的作用。本发明提供了所述蛋白酶制剂的一种应用:把第一包装中的所述传统药食用动物胶优选地在服用前进行溶解预处理后,再和所述第二包装中的蛋白酶制剂一起服用。使所述蛋白酶作为酶补充制剂对所述传统药食用动物胶的消化促进作用在体内进行。本发明所述的补充蛋白酶制剂,所述制剂包含了所述蛋白酶及其适当组合酶,和适当的药食用辅料。所述制剂的剂型包括了胶囊,片剂,可分割的片剂,粉剂,肠溶胶囊,肠溶颗粒,缓释剂型,乳化液,悬浮剂,或其组合。所述蛋白酶与底物药食用动物胶的质量比例,es,的范围是;0.1-10%,优选0.1-5%。应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。附图说明图1为深度水解时,实施例1-2中各种蛋白酶(50℃,5wt%)的作用下,传统阿胶随着水解时间的水解指数变化。图2为浅度适当水解时,在实施例2-1中中性蛋白酶或动物蛋白酶(35℃,0.1wt%)作用下,传统阿胶随着水解时间的水解指数变化。图3为浅度适当水解时,实施例2-1中在碱性蛋白酶(35℃,0.5wt%,ph8.5)或0.5%木瓜酶或0.5%菠萝酶(0.5%,ph6)的作用下,传统阿胶随着水解时间的水解指数变化。图4为实施例4-1中部分双酶制剂在肠道中(37℃,ph6.8)对传统阿胶的帮助水解,并描述了水解指数随着水解时间的变化。这几个双酶组合包括了0.1%猪胰蛋白酶分别与2%的中性蛋白酶,动物蛋白酶,碱性蛋白酶,木瓜酶,菠萝酶的组合。图5为实施例4-1中部分三酶组合蛋白酶制剂在肠道中(37℃,ph6.8)对传统阿胶的水解作用。这几个三酶组合包括了猪胰蛋白酶0.25%,碱性蛋白酶0.8%,中性蛋白酶0.5%或0.8%,木瓜酶0.5%。图6为实施例4-1中部分蛋白酶制剂(四酶组合,37℃ph为6.8)对传统阿胶的水解指数随着水解时间的变化。四酶组合:胰蛋白酶(胰)+碱性蛋白酶(碱)+中性蛋白酶(中)+木瓜酶(木)图7为实施例4-1中部分蛋白酶制剂(单酶,双酶,三酶,四酶等组合)对传统阿胶的水解指数随着水解时间的变化的比对。图8为传统阿胶、鹿角胶和龟甲胶分别在表2或表3所列胃肠联合组酶(37℃)作用下的水解。胃蛋白酶es均为3.2%,ph1.2-2,肠组合酶在图中标出;ph6.8;胃内消化时间坐标t<0.图9分别比较了传统鹿角胶在37℃胃内的酶水解(ph1.2-2,2wt%胃蛋白酶)、和肠液内的酶水解(ph6.8,2wt%角蛋白酶、或0.1wt%胰蛋白酶,或肠组合酶:0.4wt%胰蛋白酶+1wt%角蛋白酶+1wt%碱性蛋白酶)。图10分别比较了传统龟甲胶在37℃胃液内的水解(2wt%胃蛋白酶,ph为1.2-2)、在肠液内的水解(ph6.8,0.1wt%胰蛋白酶,或2wt%角蛋白酶,或肠组合酶:0.4wt%胰蛋白酶+1wt%角蛋白酶+1wt%碱性蛋白酶)。图11为模拟肠道条件下,传统阿胶与实施例3-2表1所列轻阿胶产品1、2和3分别在实施例4-1表2所列单酶补充制剂2(0.1wt%胰蛋白酶)作用下随着水解时间的水解程度的变化情况(以深度水解的杰瑞婷作为空白对照)。图12为模拟肠道条件下,传统阿胶与实施例3-2表1所列轻阿胶产品1、2和3分别在实施例4-1表2所列蛋白酶制剂0.25%胰蛋白酶,或肠组合酶制剂5(0.3wt%胰蛋白酶+0.6wt%中性蛋白酶+0.6wt%碱性蛋白酶)作用下随着水解时间的水解程度的变化情况(以深度水解的杰瑞婷作为空白对照)。图13为模拟肠道条件下,传统阿胶与实施例3-2表1所列适度水解阿胶(即轻阿胶)产品4,5和6分别在实施例4-1表2所列蛋白酶制剂0.25%胰蛋白酶或肠组合酶制剂5(0.3wt%胰蛋白酶+0.6wt%中性蛋白酶+0.6wt%碱性蛋白酶)作用下随着水解时间的水解程度变化情况(以深度水解的杰瑞婷作为空白对照)。图14为阿胶水溶液(100mg/ml)和阿胶黄酒溶液(100mg/ml)在服用前分别水解0.5-5小时,它们随着水解时间的水解程度变化情况。组合酶取自猪胰蛋白酶,碱性蛋白酶,中性蛋白酶,和角蛋白酶,温度t>50℃。图15为鹿角胶和龟甲胶的水溶或黄酒溶液,(100mg/ml),应用近似于表4的组合酶2以达到食用前即时的适度水解的实验结果。组合酶:猪胰蛋白酶1%,碱性酶1%,角蛋白酶1%,中性蛋白酶0.5%,温度t>50℃。图16为食用蛋白服用前即时的部分酶解。食用蛋白:乳清蛋白或牛白蛋白水溶液,或牛奶,豆浆,55℃,使用5个蛋白酶的组合酶。或,食用蛋白:10%明胶,或5%鸡白蛋白水溶液,45℃,使用动物蛋白水解酶,es:2%。图17为食用蛋白在肠液条件下,补充组合蛋白酶的酶促水解。食用蛋白:干酪素casein,分离大豆蛋白,牛奶,豆浆。酶分别取自猪胰蛋白酶,碱性蛋白酶,中性蛋白酶,角蛋白酶的单酶,二酶组合,三酶组合,或四酶组合,es:1-3%。具体实施方式本发明所研发的酶技术是:在某种非“酶适条件“下的蛋白酶技术的开发。本发明人经过长期而深入的研究,意外地发现了有关的组合酶和水解程度检测方法并成功制备得到一种新型的口服药食用动物胶产品,和发展出一种新的适宜药胶的包括多种组合酶的补充蛋白酶制剂(e)及其组合。同时也无意中把各具局部共性的,不可分割的多重的一个个局部的子发明,有机地组合成了网络状的似行列式,如表1-1。那是一个药胶的处方集合群,纵横交错都是一个个因人而异的处方组合。从而意外地发现了一种能表达中药组合共性的一种现代表达方式。这种组合共性就是中医药所具有的那种技术伸缩弹性,多元可调节性,广延多变可选择的,各个性均能适应的,合成性特征。从演绎到归纳,把演绎分解所得的一个个局部共性的行与列,最后归纳成一个对不同人,不同健康诉求均能“有求必应”似的共性组合。若以一个现代式来表达,则是:∑j(局部子发明)j=一个配方集合群=一个“有求必应”可调的处方∑j是“各子加和”的意思,“有求必应”:对不同人不同健康诉求都能通过调节而满足之所述适度水解产品在人体内易于消化,且可最大限度地保留传统药用动物胶的特色。具体地,本发明人通过将制备所得适度水解的,或与营养品复合的药食用动物胶,或将传统药食用动物胶(s)在食用前使用本发明酶制剂作即时的部分酶解,或在直接食用的过程中与本发明的补充蛋白酶制剂进行复配摄入,得到所述口服药食用动物胶诸多e×s个新的产品和使用方法组合,表1-1拟行列式。所述蛋白酶及其组合酶制剂在生理或其他限制条件下,能有效,稳定地水解传统的或适度水解了的药食用动物胶。因而所述新的产品及其使用方法组合可有效克服传统药用动物胶难以消化的缺点。且避免了市售的深度水解的药用动物胶的过度工业水解所造成的营养成分可能缺失的缺陷。因此,使用本发明的适度水解的药用动物胶产品,和/或补充蛋白酶制剂时,可增加所需人群的进补时间和进补量,从而得到更优的进补效果,提高了药效。在此基础上,发明人完成了本发明。术语在本发明中,“口服药用动物胶产品”或“药食用动物胶产品”或简称的“药胶”、“动物胶”均可互换使用。在本发明中,“蛋白酶”和“蛋白酶制剂”可互换使用。在本发明中,“酶解”和“水解”可互换使用,均指酶促水解的过程。如本文所用,“传统阿胶”、“传统鹿角胶”和“传统龟甲胶”分别指对应传统胶的胶块,其分子量约为100-200kd。在本发明中,所述传统药食用动物胶为水解度de=0%或水解指数a%=100的药胶。如本文所用,“深度水解的阿胶”指完全工业酶解的阿胶,具体是指分子量为2~10kd的阿胶,即类似于市场上“杰瑞婷”的水解阿胶粉。如本文所用,“浅度水解的阿胶”指工业水解到特定中间程度的阿胶,具体是指分子量为10~50kd的阿胶。如本文所用,胰蛋白酶、碱性蛋白酶、中性蛋白酶、角蛋白酶、胃蛋白酶、木瓜酶、动物蛋白酶(或动物蛋白水解酶)、菠萝酶、酸性蛋白酶、无花果酶等均为本药食领域常规使用的酶。如本文所用,“黄酒”是指一般市售黄酒,其乙醇含量约为10%,即约为10度。如本文所用,“杰瑞婷”指北京华达杰瑞生物技术有限公司所生产的深度水解的阿胶粉,经测定其水解指数a%≈38%上下,水解度dh%>8,为本发明所采用的蛋白深度水解的参比物。如本文所用,“水解深度”、“水解度”、“酶解深度”或“酶解度”可互换使用。在本发明中,各种酶的重量百分数均以实验对应的药用动物胶的总重量计,即为酶与底物的百分质量比es。药胶产品与蛋白酶技术子发明的似行列式组合归纳既要保持传统药食动物胶的传统特色,又要克服其难消化的缺憾,还要适应广泛人口的不同需求,其最佳选择将是走组合“拳“技术的路子,即本发明的药胶产品与蛋白酶技术的似行列式组合技术。要改进药食用动物胶的消化吸收性,必须从创新改进酶技术的应用着手,为此,在改进酶技术的方面,本发明提供了一种新的包括多种组合酶在内的,并适宜于包括传统药胶在内的食用药胶的,口服补充蛋白酶制剂产品及其应用方法。还提供了一种,包括传统药胶在内的药食用动物胶在服用前作即时的部分酶解的,新的酶技术。本发明还提供了适度酶水解的技术,使所得适度水解药胶产品能避免像深度水解那样改变传统药胶的传统特色,仅作最小改变使其不偏离传统药食用动物胶太远,从而保证了传统药食用动物胶的特色效果。又能使所述适度水解的药食用动物胶产品更易于消化适用,提高了总药效。基于本酶技术创新改进的得益,本发明还提供了食用蛋白和营养物与药食用动物胶之间复配的复合营养品。使药食用动物胶有所稀释,调节胃口,佐之以本发明的蛋白酶补充制剂和食前即时部分酶解技术,使便于消化。又使一般日常营养品随之补充了多元的药食用动物胶新营养元素,提高了总药效,且经济成本合算。所述本补充蛋白酶制剂产品中的多种组合蛋白酶,它们能组合地抵御消化系统中可能的酶抑制因子;和/或,减低过敏体质者对某种酶的可能的过敏或依赖;和/或,能为某些体虚者配分蛋白酶的总剂量(totaloraldose),例如在胃酶与肠酶之间的配比,或食用前酶解与摄入酶之间的配比,或酶品种与剂量之间的搭配;和/或,甚至在较为苛刻的条件(例如常见的配伍黄酒,内含乙醇溶剂)下,也都能达到保持较稳定的酶活性。所述的搭配或配比等,均可由服用者自己,或生产者的售后服务指导下,或医师指导下作出调节。有利于进补药物的个性化配比调节,体现了中医药随人随时调节的特征。使珍贵中药的食用能做到精细化,高效化,现代化,从而改善过去较简单的做法。从酶与底物的作用来看,本发明从蛋白酶制剂和酶作用后的底物药胶的两个方面都做了新的子发明式的技术改进。它们构成一种完整配套的似行列式组合归纳。它产生4×4系列,和3×3=9个组合应用,其中7个组合应用是较有意义的。为便于说明本发明的多个组合方面,兹列表如下表1-1。唯如此归纳,才能方便中医师作出上述随人随时的调节,才能使本发明具有实用性。而表1-2与表1-1基本相同,但增列了深度水解的阿胶,以便于传统的,深度水解的,本发明的3种之间的比对。表1-1所述药食用动物胶产品与所述补充蛋白酶之间的4×4系列注1:“药胶”指药食用动物胶。传统药食用动物胶在第一包装b内。注2:“酶”指本发明的包括组合酶在内的补充蛋白酶制剂,第二包装。注3:“食前部分酶解”指本发明的新的酶应用方法。注4:“适度水解药胶”指本发明的适度水解的药食用动物胶,第一包装a,共有两种制备方法。注5:“药胶与蛋白等营养品复配的复合营养品“指本发明的药食用动物蛋白与食用蛋白及其它营养元素的复配产品,第一包装c。表1-2深度水解阿胶,传统胶传统服用,本发明技术的比较注:表1-2比表1-1多列出了深度水解阿胶,以便对比,其余同表1-1。目前,待食阿胶的水(或黄酒)溶液虽可加热调节温度,但一般却不能调节食用的ph,也不能弃除黄酒,这就限制了许多蛋白水解酶的使用。而口服补充蛋白消化酶,则条件更苛刻,它既不能改变体内ph也不能改变温度(胃液ph1.2-2,肠液ph6.8,体温37℃)。然而,适度水解和口服补充蛋白酶却仍然要求相当的酶解速度以便在短时间内达到适当的酶解深度。这样,食前适时地部分酶解和口服补充酶制剂的研究就指向了,如上所述的:需要发明新的多酶组合技术,包括胃组合酶,肠组合酶,以及胃肠联合组酶。上述表1-1是个似行列式,它把一个个具有共同特征的子发明(每一元素,每一行或列)有机地组合到了一起。它是个有机的药胶配方集合群,随中医师选择调节,从而满足了中药”随人随时可调“的共同特征。因为在实验中比照着传统中药“不管什么人,什么健康需求,只要在本药范围内的都能因人而异的调整而有效“的特征,无意中自然而然地还原出了上述结果。化学元素的周期表,核苷酸的4×4表,也都可看作类似的似行列式。前者的纵横交错都对应着一组组元素的集合,后者则对应着一组组氨基酸的集合。可以预期,随着更多研究的投入,还将发展成5×5,6×6等的似行列式,将不仅纵横方向,而且对角线,斜角方向都将对应着一组组随人应变的具体配方的集合。通常,鹿角胶和龟甲胶含有较多的蛋白β-结构,其蛋白颗粒在水中若温度不高就不易散开、不易水解。在本发明中,在服用前对所述药用动物胶进行适度水解可进一步促进其在体内的消化吸收。典型地,当所述药用动物胶含有一定量的适度水解的药用动物胶时,将可进一步促进其在体内的消化吸收。应理解,本发明中,水解指数a%越小,水解程度越深,即dh数值越大。本发明所述的蛋白酶制剂,所述制剂包含了所述蛋白酶和适当的药食用辅料。所述制剂的剂型包括了胶囊,片剂,可分割的片剂,粉剂,肠溶胶囊,肠溶颗粒,缓释剂型,乳化液,悬浮剂,或其组合。所述蛋白酶与底物药食用动物胶的质量比例,es,的范围是;0.1-10%,优选0.1-5%。本发明所研发的酶技术是:在某种非“酶适条件“下的蛋白酶技术的开发。与现有药食用动物胶产品相比,本发明的蛋白酶制剂与药胶的技术组合“拳“具有以下主要优点:(1)所述适度水解药用动物胶产品直接服用,或配伍所述酶后服用,都易于消化,同时可最大程度地保留,和最小程度的改变,传统药用动物胶的成分;(2)所述补充蛋白酶制剂可直接配伍传统药食用动物胶服用,促进传统胶的消化和吸收;(3)所述适度水解的药用动物胶产品,其制备方法可在中性条件下进行,更加安全环保;其平均分子量可在生产过程中质控,可控制在接近传统胶直到深度水解胶之间的广阔范围内某几个优选点。例如,妇女补经血的,或健身美容的,或补气虚缓减咳嗽的阿胶的最佳分子量范围可能是不同的。(4)所述酶制剂中的组合酶能组合地抵御消化系统中可能的酶抑制因子,和/或,减低过敏体质者对某种酶的可能的过敏或依赖,和/或,利于体虚或长期服用药胶者时进行配分,和/或,在常见的口服配伍黄酒(内含口服乙醇溶剂)中,也都能保持较稳定的酶活性。(5)应用所述蛋白酶制剂对服用前的传统药用动物胶可进行即时的部分水解的处理,可增强药胶的易消化吸收性,使其适应各种层次的需求;所述酶解方法也适用于一般食用蛋白。(6)补充蛋白酶的品种和剂量配比、酶直接摄入或用于食前部分水解的选择,药胶直接摄入或作食用前即时部分酶解的选择,食前酶解的温度和水解时间长度等均可由服用者自己,产品售后服务指导下,医师指导下作出调节,因而有利于进补药物的个性化,珍贵药物服用的细致化,体现中医药“随人随时调节”的传统,提高了总药效。(7)药食用动物胶与食用蛋白营养物的复合营养品,复合了双方的优点,也较更易消化,有利于进补日常化。本发明的补充蛋白酶制剂,和食前作即时部分水解的酶技术对药食用动物胶和食用蛋白都适用。从表1-1似行列式的角度看,以上1,2,4,5,7每个子发明都分别是似行列式里的某一个元,或某一列,某一行。它们每个确有自己的局部共性,类似于”西药“。但其局部共性通过表1-1组合成了似行列式后,就出现了上述的3,6等的特征:即中医药的“通过调节,有求必应”性。这就像第一辆发明的自行车,也许硬拆开后的每一个零件都有其各自专利特征。唯有机地组合了起来后,那些专利特征找不到了,但它却产生出一辆意想不到的通过调节而有求必应的多适应性(男女,老少,儿童,负载,日夜,快慢,直弯行等)的车子。本发明对中药的某些创新研发有启发意义:牵一而动十,但它们最终需是组合的,多适应性的而又不可拆分的。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。实施例1-1制备深度水解的阿胶在较为温和的条件下开始水解,然后升温。在37℃下,提供传统阿胶浓度为100mg/ml、ph为6.8的阿胶水溶液,加入2wt%的动物蛋白水解酶(酶活1500u/g,下同)或加入表2中的组合酶(如0.3%猪胰蛋白酶,0.6%碱性蛋白酶,0.6%中性蛋白酶的组合酶)。水解2-4小时左右,直到水解指数a%达到50%上下(当采用组合酶时,达到40%上下)。然后升温至50℃继续水解约1小时左右(当采用组合酶时,约15-30分钟)。停止水解,沸水浴杀酶,水解指数a%达到38%左右或38%以下(杰瑞婷指数),冷冻干燥,得到深度水解的阿胶(分子量为5-10kd),备用。实施例1-2制备深度水解的阿胶,50℃快速酶促反应法在50℃的水解温度条件下,提供传统阿胶浓度为100mg/ml的水溶液,分别加入5wt%的木瓜酶、5wt%的菠萝酶(溶液ph均为5.5-6)、5wt%的中性蛋白酶(酶活为200u/mg,下同,溶液ph为7)、5wt%的动物蛋白水解酶(酶活为1500u/g,下同,ph为7)、5wt%的碱性蛋白酶(酶活为200u/mg,下同,ph为8.5-9),水解2-4小时(当使用菠萝酶时,需水解更多时间),将酶灭活后,冷冻干燥,主要得到深度水解的阿胶(2-10kd)产品,备用。图1为深度水解时,在实施例1-2中各种蛋白酶(50℃,5wt%)作用下,阿胶随着水解时间的水解指数变化。从图1可以看出,在该水解条件下,除了菠萝酶外,都能在2-4小时达到深度水解。实施例2-1制备浅度水解的阿胶,单酶催化水解法在较为温和的条件下进行有限水解。在35℃下,提供传统阿胶浓度为100mg/ml的水溶液,向其中分别加入0.1-0.5wt%的木瓜酶或0.1-0.5wt%的菠萝酶并均保持ph=6、0.1-0.5wt%的中性蛋白酶或0.1-0.5wt%的动物蛋白水解酶或0.1-0.5wt%胰蛋白酶并均保持ph=7、0.1-0.5wt%的碱性蛋白酶并保持ph=8,水解30-60分钟,待水解指数a%达到70-80%或水解度hd达到1-2%上下时,将酶灭活,冷冻干燥,主要得到浅度水解的阿胶(50kd上下,凝胶电泳观察得,下同),备用。图2为浅度水解时,在实施例2-1中中性蛋白酶或动物蛋白酶(35℃,0.1wt%)作用下,传统阿胶随着水解时间的水解指数变化。图3为浅度水解时,实施例2-1中在碱性蛋白酶(35℃,0.5wt%,ph8.5)或0.5%木瓜酶或0.5%菠萝酶(0.5%,ph6)的作用下,传统阿胶随着水解时间的水解指数变化。从图3可以看出:通过调整所使用的酶的类型和反应参数可以对传统阿胶的水解指数实现可控调节。实施例2-2制备浅度水解的阿胶,组合酶催化水解法在较为温和的条件下进行有限水解。在37℃下,提供传统阿胶浓度为100mg/ml、ph为6.8的阿胶水溶液,加入2wt%的动物蛋白水解酶或表3中的组合酶(如双酶组合1-6中任一种或多酶组合1-9中任一种)。水解20-30分钟左右,待水解指数a%达到70-80%或水解度hd达到1-2%上下,即停止水解。沸水浴杀酶,冷冻干燥,主要得到浅度水解的阿胶(50kd上下),备用。实施例3-1在传统阿胶的生产过程中加入适度酶水解步骤,直接生产各种适度水解的阿胶(即轻阿胶)按照传统的方式熬制阿胶,把生产过程中即将完成的新鲜经典阿胶(一般经数天熬制即将结束时)降温到50℃上下,加入适量的水和约0.1-5%的酶(例如胰蛋白酶、动物蛋白水解酶、中性蛋白酶、碱性蛋白酶或木瓜酶,或本发明的组合酶(如表3双酶组合1-5或多酶组合1-5中任一种)),尽量减少加入ph调节剂,然后搅拌水解。在水解的同时,不断进行动态的水解深度检测。当达到适当的酶解深度时,例如水解指数a%达到45-85%或水解度hd达到1-3%上下,升温灭活酶,并蒸除多余水分,直接得到各种不同程度的适度水解了的阿胶,即轻阿胶产品。本实验中用2wt%动物蛋白水解酶或2wt%组合酶(表3双酶组合1-5或多酶组合1-5中任一种),在水溶液中模拟了该水解过程,冷冻干燥后得到预期的一种轻阿胶产品。经水解度dh检测,上述阿胶的水解度在2-5%,即蛋白适度水解范围内某程度的适度水解产品。初步的凝胶电泳分析指出其蛋白主要成分在20-50kd上下。适度水解的平均分子量取决于控制的水解条件,可在100kd以上至10kd的范围内选择,可接近于传统胶直到接近于深度水解。可以有几类不同分子量的产品,以适应不同市场和不同病家的需要。上述结果表明:经放大实验后该工业制备流程可行。不同水解程度的适度水解的阿胶可藉由干重,含水量,总蛋白,和a%的检测而设定。其产品对应的平均分子量可用多种方法测定比对,从而固定水解工艺gmp,可以生产出多品种平均分子量各不相同的适度水解的动物胶产品。实施例3-2通过混合法配制广谱分子量的阿胶(即轻阿胶或适度水解阿胶)产品将深度水解的阿胶(即实施例1所得深度水解的阿胶或“杰瑞婷”阿胶)、与实施例2所得浅度水解的阿胶,和未酶解的传统阿胶,3种阿胶产品按照表1所列配比进行混配,形成广谱分子量的阿胶,或曰轻阿胶产品。表2适度水解的阿胶(轻阿胶)产品之几种注:比例范围依次可以是0-100:0-100:0-100,上述表2所列是较优选范围内的几种比例。实施例4-1一种能促进阿胶(传统阿胶或轻阿胶)消化的口服补充酶制剂表3列出实验中将几种酶或其组合进行配比的部分配比情况。将它们分别制成独立制剂,就可形成能促进阿胶(包括传统阿胶和适度水解的阿胶)消化的口服补充酶制剂。表3注:水解条件:37℃,模拟胃液,或模拟肠液中。杰瑞婷:深度水解阿胶,a%≈38%进一步在如下水解条件下体外观察上述蛋白酶制剂对传统阿胶的水解效应:37℃,模拟胃液(ph为1.2,氯化钠浓度为2mg/ml)或模拟肠液(ph为6.8,0.05m磷酸钠缓冲液)。具体地,在37℃和模拟肠液中,加入传统阿胶或轻阿胶,浓度100mg/ml,接着分别补充各种适合的单酶、它们的双酶搭配或多酶组合,质量比在0.1-3%之间(见表3)。以杰瑞婷作为比对标准,表3同时列出了上述水解反应的部分试验结果。从表3所列助消化效应的结果可以看出:补充蛋白酶制剂确实有助于帮助阿胶在体内的消化,其中以单酶制剂3,双酶制剂3,组合酶制剂1和5为佳。图4为实施例4-1中部分双酶制剂在肠道中(37℃,ph6.8)对传统阿胶的帮助水解,并描述了水解指数随着水解时间的变化。从图4可以看出,假如肠内尚有0.1%胰蛋白酶的活性,则补充2%的中性蛋白酶或碱性蛋白酶则能有效地进一步帮助消化。倘若肠内胰蛋白酶不足0.1%,则需补充该双酶组合。图5为实施例4-1中部分三酶组合蛋白酶制剂-在肠道中(37℃,ph6.8)对传统阿胶的水解作用。它描述了其水解指数随着水解时间的变化。从图5可以看出,该三酶组合在肠道中能在3-4小时内帮助阿胶消化掉。图6为实施例4-1中部分蛋白酶制剂(四酶组合,37℃ph为6.8)对传统阿胶的水解指数随着水解时间的变化。从图6可以看出:在肠道里2-4个小时,传统阿胶就可以被四酶组合有效地水解消化。图7为实施例4-1中部分蛋白酶制剂对传统阿胶的水解指数随着水解时间的变化。从图7可以看出:0.3-0.5%胰蛋白酶,或三酶组合(胰蛋白酶0.3-0.5%+0.3-0.6%碱性蛋白酶和中性蛋白酶),或四酶组合(在三酶组合基础上增加木瓜酶)均可有效地水解消化阿胶。进一步的实验表明:0.3-0.5wt%的胰蛋白酶,或0.2-0.5wt%胰蛋白酶与0.5-1wt%碱性蛋白酶的二酶组合,或0.2-0.8wt%胰蛋白酶、0.5-1.5wt%碱性蛋白酶与0.5-1.5wt%中性蛋白酶的三酶组合,或胰蛋白酶、碱性蛋白酶、中性蛋白酶和木瓜酶各0.2-0.6wt%的四酶组合,都能在肠道2-4个小时内使传统阿胶消化到杰瑞婷的程度,其中以多酶组合为佳。与补充单酶相比,补充多酶组合能使酶解的效果更趋稳定有效,更能适应和平衡肠道内可能的诸多因素。组合酶能组合地抵御消化系统中可能的酶抑制因子,和/或,减低过敏体质者对某种酶的可能的过敏或依赖,和/或,蛋白酶的总剂量(totaloraldose)用于体虚者或长期服用者时可以进行调节配分:例如在酶品种与剂量之间调节配分,在胃酶与肠酶之间调节配比,或在食前酶解与摄入酶量之间调节配比,,和/或,甚至在较为苛刻的条件(例如常见的配伍黄酒,内含乙醇溶剂)下,也都能保持较稳定的酶活性。上述实验结果进一步表明1-3wt%蛋白酶制剂(以阿胶的重量计)的补充量可以在体内帮助消化阿胶(包括传统阿胶和适度水解的阿胶)。以每天摄取5-10克阿胶计算,酶的补充总量约在50–300mg。在实际的操作过程中,这些蛋白酶制剂既可以与阿胶混合制成适当的复合制剂品口服,也可以分别制成独立的酶胶囊、肠溶胶囊或肠溶颗粒口服,或制成适当的片剂产品口服。也可以在药胶服用前对药胶溶液作即时的部分酶解,尔后服用。实施例4-2一种能促进传统阿胶消化的口服胃肠联合组酶制剂本实施例提供一种胃蛋白酶与肠蛋白酶分装的联合组酶,该联合组酶能有效促进传统阿胶在胃肠道里的二阶段连续酶解。具体地,口服传统阿胶在补充了胃蛋白组合酶(按所服用传统阿胶的用量计,例如补充3.2wt%的胃蛋白酶或其组合)的胃液(胃酸性介质,ph为1.2))中首先发生初步的酶促水解。在一定时间后,它离开胃部,在肠道(ph为6.8)里又受到肠道补充蛋白酶(例如补充0.3%胰蛋白酶+0.6%碱性蛋白酶+0.6%中性蛋白酶的三酶组合)的进一步酶促水解。通过水解程度的检测发现:该胃肠联合组酶对传统阿胶的二阶段(分阶段)水解效果最佳,传统阿胶可以在相当于正常食物消化过程里(胃0.5-1小时,肠0.5-1小时)很容易地水解成深度水解的阿胶,即相当于杰瑞婷的阿胶肽,见图8。在实际应用中,胃肠联合酶制剂可以分别灌装成两粒分装的胶囊,其一粒是普通胃溶胶囊,内装2-5%胃蛋白酶或其组合酶(例如胃蛋白酶与木瓜酶,菠萝酶的1/0.3/0.3的组合酶);另一粒是肠溶胶囊或肠溶颗粒,内装肠组合酶制剂;在使用时,同时服下上述两粒胶囊即可。此外,该胃肠联合酶制剂也可以采用双层胶囊,其内层是肠溶胶囊和肠溶颗粒,内装肠组合酶制剂(如表3);其外壳是普通胃溶胶囊,在外壳内灌入胃蛋白酶或其组合酶2-5wt%;在口服后,普通胶囊(即外层胶囊)先在胃里溶解,释放出胃蛋白酶组合,待进入肠道后,肠溶胶囊或肠溶颗粒溶解,释放出肠组合酶制剂,进一步酶解传统阿胶为深度水解的阿胶。实施例5一种能帮助传统鹿角胶和龟甲胶消化的补充酶制剂经研究发现:角蛋白酶(酶活100000u/g,下同)是一种能帮助角蛋白消化的有效补充酶。这是由于角蛋白的特定结构,它含有相当多的β-结构。按照表4所列将几种酶或其组合进行配比,并另行制成独立制剂,得到能帮助传统鹿角胶和龟甲胶消化的口服补充酶制剂。水解条件:37℃,模拟胃液(ph为1.2,氯化钠2mg/ml)或模拟肠液(ph为6.8,0.05m磷酸钠缓冲液)中。表4实施例5-1一种能促进传统鹿角胶或龟甲胶消化的口服补充酶制剂同实施例4-1,区别在于:将传统阿胶替换为鹿角胶或龟甲胶,并采用表4的单酶或组合酶,例如组合酶1。实施例5-2一种能促进传统鹿角胶,或龟甲胶,消化的口服胃肠联合组酶制剂同实施例4-2,区别在于:将传统阿胶替换为鹿角胶或龟甲胶,并采用表4胃肠组合酶制剂1或2。图8为传统阿胶、鹿角胶和龟甲胶分别在表3或表4所列胃肠联合组酶(37℃)作用下随着胃肠内消化时间的水解程度的变化。具体而言,该胃肠二阶段酶促消化实际上就是胃内形成部分水解的阿胶及其后续的肠道内进一步消化的过程。从图8可以看出:传统阿胶在表3胃肠联合组酶的作用下,经1.5-2小时即可达到杰瑞婷所对应的深度水解;鹿角胶和龟甲胶同样也得到接近于较深水解的效果。表4右端同时列出了上述二阶段酶促水解反应的部分试验结果。从表4所列结果可知:含有0.1-1wt%的胰蛋白酶、0.5-2wt%的角蛋白酶和0.5-2wt%的碱性蛋白酶的肠道组合酶较其它的酶具有更佳的酶促水解效果。进一步地,将该组合酶与3wt%胃蛋白酶(或3%胃蛋白酶与0.5%木瓜酶的组合酶)联用则能使消化效果更佳更稳定,见图8。图9分别比较了传统鹿角胶在胃内的酶水解(ph1.2-2,2wt%胃蛋白酶)、肠道内的酶水解(ph6.8,2wt%角蛋白酶、或0.1wt%胰蛋白酶)和肠组合酶水解(肠组合酶:0.4wt%胰蛋白酶+1wt%角蛋白酶+1wt%碱性蛋白酶)。在37℃、模拟胃或肠液条件下水解程度随着水解时间的变化情况。从图9可以看出:2%角蛋白酶水解效果较好,肠组合酶的水解效果最佳。图10分别比较了传统龟甲胶在胃液内的水解(2wt%胃蛋白酶,ph为1.2)、在肠液内的水解(ph6.8,0.1wt%胰蛋白酶或2wt%角蛋白酶),和肠组合酶水解(肠组合酶:0.4wt%胰蛋白酶+1wt%角蛋白酶+1wt%碱性蛋白酶)。在37℃和模拟胃或肠液条件下随着水解时间的水解程度变化情况。从图10可以看出:2%角蛋白酶水解效果较好,肠组合酶的水解效果最佳。制备适度水解的鹿角胶或龟甲胶虽然上述实验是在37℃和ph6.8温和条件下的酶水解,但若在传统生产鹿角胶,龟甲胶的流程末端,追加一个适度水解的步骤,利用角蛋白酶、碱性蛋白酶、胰蛋白酶或其组合酶,在45-55℃、接近中性的条件下水解适当时间,则可生产出适度水解的鹿角胶或龟甲胶。进一步地,在口服时将上述组合酶或其与胃蛋白酶联用制成的胃肠联合组酶制剂,与上述适度水解的鹿角胶或龟甲胶配伍使用,或与传统鹿角胶或传统龟甲胶配伍使用,则更可有效地改善鹿角胶和龟甲胶在体内的水解消化。综上所述,1-3wt%的肠酶补充量可以在体内帮助消化鹿角胶和龟甲胶。以每天摄取10-20克鹿角胶或龟甲胶计算,肠酶的补充总量约在100–600mg即可。在实际应用中,这些酶可以另行制成独立的酶胶囊、胃溶胶囊(增添胃蛋白酶部分)、肠溶胶囊、肠溶颗粒或适当片剂产品口服。实施例6-1轻阿胶与蛋白酶制剂的混合复配按照表5所列配比将轻阿胶(见实施例3-2表2)与蛋白酶制剂(见实施例4-1表3)进行混合复配,形成易消化的阿胶制剂。表5混合阿胶制剂产品的配比上表5中,组合酶可优选表3里的组合酶1、5、9等。应理解,为保持补充的肠蛋白酶的活性,这样的阿胶复配剂需要灌装肠溶胶囊或制成肠溶颗粒,口服。实施例6-2阿胶与补充蛋白酶分别独立的制剂同实施例6-1,区别在于:在本实施例中,上述实施例6-1中的轻阿胶与补充蛋白酶不作混合,而是分别单独制剂,其配伍将更科学,助消化效果更好。具体地,肠用补充蛋白酶装入肠溶胶囊或制成肠溶颗粒,既可与轻阿胶复配口服,也可以与传统阿胶复配口服,并还可以因人而异地对补充酶的品种和摄入量作个性化调节,以不腻滋,恰好能够消化为度。实施例7体外观察实施例3表2所述阿胶产品在实施例4表3所述组合酶作用下的水解效益在37℃的条件下,在模拟肠液(37℃,ph为6.8,0.05m磷酸钠缓冲溶液)中,使用实施例4-1表3所列蛋白酶制剂,分别将100mg/ml实施例3表2得到的轻阿胶产品与传统阿胶进行等量消化模拟比对,就水解速度看,实验证明蛋白酶对轻阿胶产品的作用效果优于传统阿胶。图11为模拟肠道条件下,传统阿胶与实施例3-2表2所列轻阿胶产品1、2和3分别在实施例4-1表3所列单酶补充制剂2(0.1wt%胰蛋白酶)作用下随着水解时间的水解程度的变化情况(以深度水解的杰瑞婷作为空白对照)。从图11可以看出:在0.1%胰蛋白酶(一般消化条件,或轻度缺乏胰蛋白酶)条件下,就易于水解消化而言,适度水解的阿胶,即轻阿胶,明显优于传统阿胶。图12为模拟肠道条件下,传统阿胶与实施例3-2表2所列轻阿胶产品1、2和3分别在相同条件下的水解:(a)实施例4-1表3所列蛋白酶制剂单酶-3(0.3%胰蛋白酶)+传统阿胶;(b)肠组合酶制剂5(0.3wt%胰蛋白酶+0.6wt%中性蛋白酶+0.6wt%碱性蛋白酶)+传统阿胶,或+轻阿胶产品1,2和3。酶作用下随着水解时间,水解程度变化加深(以深度水解的杰瑞婷作为对照)。从图12可以看出:在补充了足够蛋白消化酶或组合酶制剂的条件下,传统阿胶更易于水解消化,但适度水解的阿胶(即轻阿胶产品)仍然比传统阿胶更易消化。图13为模拟肠道条件下,传统阿胶与实施例3-2表1所列适度水解阿胶(即轻阿胶)产品4,5和6分别在相同条件下,(a)传统阿胶+实施例4-1表2所列单酶-3(胰蛋白酶0.3%),(b)传统阿胶或轻阿胶+肠组合酶制剂5(0.3wt%胰蛋白酶+0.6wt%中性蛋白酶+0.6wt%碱性蛋白酶),随着水解时间的水解程度变化情况(以深度水解的杰瑞婷作为空白对照)。从图13可以看出:适度水解的阿胶(即轻阿胶,如比例1:6:1)较比例为1:2:1的轻阿胶更易于水解。在补充消化酶的帮助下,该轻阿胶(如比例1:6:1)可在1小时内水解消化。换言之,在相同的情况下,所有酶促水解过的广谱分子量阿胶(即适度水解的阿胶,或曰轻阿胶)在肠道条件下都比传统阿胶早先达到深度水解标准。实施例8对阿胶溶液进行服用前的预处理,利用组合蛋白酶作即时酶解以达到部分水解后再服用分别提供传统阿胶的水溶液(阿胶浓度为100mg/ml,即1/10,或其1/5较浓溶解液)和传统阿胶的黄酒溶液(阿胶浓度为100mg/ml,即1/10,或其1/5较浓溶解液,一般黄酒约含10%乙醇),一般无须ph调节,加入表3中的组合酶,如组合酶1-5,然后加热到50-60℃。维持0.5-4小时后升温灭活,即可得到不同程度的部分水解阿胶以供服用。服用前即时预处理过程中,阿胶的水解程度取决于水解时间的长短,具体地水解程度(或水解时间)由服用者自己掌握,以不腻滋,刚好适应自己的消化需要为足。本实验中,应用了表3的肠组合酶1和5的近似组合作适度水解。共作了两次实验,第一次各加入组合酶a:胰蛋白酶0.35%,碱性蛋白酶0.35%,中性蛋白酶0.5%(总1.2%),第二次各加入组合酶b:胰蛋白酶1%,碱性蛋白酶1.2%,中性蛋白酶0.8%(总3%),a,b各自水解结果互相接近。由于黄酒中含约10%乙醇,其水解速度总较相应的水溶液为慢。图14为阿胶水溶液(100mg/ml,55℃,三酶组合:1.2wt%)和阿胶黄酒溶液(100mg/ml,52℃,三酶组合:3wt%)在服用前分别水解4-5小时,它们随着水解时间的水解程度变化情况。此外,如果需要,阿胶溶液的食前水解也可以在调节ph的条件下进行。例如用食用小苏打(或醋酸、柠檬酸等食用酸)调高(或调低)ph,加速碱性蛋白酶(或木瓜酶等)的酶促水解。水解中断后用食用酸(或食用苏打)再把ph调回中性以便口服。如果需要,还可适当加入味觉调剂,如蜂蜜、甘草、甜味剂等。如果服用者需要,食前适度水解后的阿胶仍然可以复配表3中的组合蛋白酶制剂服用,以进一步帮助消化。其总效果与实施例4-2的胃肠联合组酶的效果相当。以上都说明:若要克服传统阿胶难以消化的难题,并不一定需要较极端的工业深度酶解。而巧妙地利用蛋白酶,适度地水解阿胶,或传统阿胶佐以补充蛋白酶制剂,或传统阿胶在食用前作即时的部分酶解,也都能达到同样的消化效果的改善。提高了药效,且能避免改变传统药胶的传统特色,,或仅作最小改变。实施例9新颖的蛋白水解程度的检测方法,水解指数a%及其与蛋白水解度dh之间的对应关系在阿胶的水解过程中,简单快速而准确地测定阿胶的水解程度是非常关键的。具体地,本发明中应用的水解指数a%与bradford方法中蛋白的特定系数有关,并且本发明以水解指数a%作为阿胶的水解程度的监控指数,它尤其对蛋白的低度水解,适度水解灵敏。更具体地,所述水解指数a%是采用以下新方法测定的:经典的测定蛋白含量的考马斯亮蓝法,由bradford于1976年发明。该方法在595nm分别测定未知蛋白溶液和已知浓度的牛血清白蛋白溶液的光吸收a595,并以牛血清白蛋白作标准,从而对未知蛋白定量。该方法近似地服从beer定律:其中a595是595nm处的光吸收,是比例常数。l是吸收池的长度,一般5mm或10mm。一般地,€在一定浓度范围内是常数,a595与蛋白浓度c在一定范围内有线性关联。虽然,在蛋白水解过程中蛋白总浓度c是保持不变的,其光吸收a595似乎也应保持不变。然而我们意外地发现其光吸收a595却持续下降。从角度来看,即a595却与表现出某种关联。这是因为虽然蛋白总浓度c不变,由于其肽键不断的水解断裂,其平均分子量却在不断地变小,这导致蛋白分子与考马斯亮蓝g250染料之间的络合被削弱,数值减少,a595减小。直到水解到平均几个kd及其以下的短肽,其染料络合微弱到可以忽略不计,趋于零,a595也随之趋于零。上述发现让我们发明了一个文献上从未见报道的简单快速测定蛋白水解程度的新方法,即在保持蛋白总浓度不变的条件下,通过测定其€数值的变化来评估其水解程度:其中(a595)t是在水解过程中t时刻的光吸收,(a595)0是水解开始点时刻(时间0点)的光吸收。在水解初始的过程中a%快速下降,降到50%(对应水解度dh=3%上下)后a%缓慢地持续下降,曾测得a%最后下降到10%及其以下的水解深度。实验证明,该水解指数a%与经典水解度dh之间存在简单关联关系。除了简单快速之外,该方法的价值还在于其a%与蛋白平均分子量的变化相关联,它特别对适度水解(水解度dh:1-3%)灵敏。因为在这个水解阶段,蛋白平均分子量剧烈变化,单位时间内其平均分子量的绝对差值巨大。然而,蛋白水解度dh量度的是一个个肽键的断裂。例如,对分别两个平均分子量200kd和5kd的蛋白而言,同样三个肽键的逐次断裂,其结构改变的程度是不同的。前者从200kd变成100kd又变成50kd,结构改变巨大,a%下降剧烈。而后者从5kd变成2.5kd又变成1.25kd,a%变化微小,其结构改变的意义一般也不大。故该新方法有其独到之处,它补充了经典的蛋白水解度测定方法。得益于该简单快速且对适度水解灵敏的新检测方法的意外发现,适度水解药胶的研发取得了成果。具体方法是:100mg考马斯亮蓝g250溶解于20ml乙醇(95%),加50ml磷酸(85%),水稀释到500ml,转移到棕色瓶中置于冰箱待用。于两个5mm吸收池中分别加入1.00ml上述考马斯亮蓝溶液,其一再加入0.100ml经适当稀释的蛋白溶液作为待测样品,另一加入0.100ml水作为参比,二者溶液都分别以滴管头鼓气搅拌混合。在混合后10-25分钟时间区间内,定时测定在595nm波长的光吸收。在精细测定中,为克服吸收池之间的差异,在样品池每次加入0.100ml待测蛋白样品之前,先测量一次其本底吸收(a595)本底。然后从样本吸收(a595)s中减去,其差值(a595)s–(a595)本底作为(a595)t或(a595)0。本发明中采用甲醛法系统地测定了阿胶,牛奶和大豆蛋白的蛋白水解度dh,以及其与水解指数a%之间的对应关系。具体地,本发明的浅度适当水解、适度水解、直到类似“杰瑞婷”的深度水解,分别对应着阿胶的蛋白水解度dh为1-2%、3-5%、直到接近5-10%或10%以上(即“杰瑞婷”深度水解)。由于阿胶的胶原蛋白中含有较多脯氨酸和羟基脯氨酸,因此,阿胶的实际水解度dh较甲醛法测定的dh数值应高些。表6-1为阿胶的蛋白水解度dh和水解指数a%的对应关系列表。表6-1dh%02.22.94.25.56.68.19.2a%10054514539383634表6-2为牛奶和豆浆的蛋白水解度dh和水解指数a%的对应关系列表。表6-2注:实际水解度dh比本甲醛法测定值dh应高些。从表6-1可以看出:水解指数a%在阿胶蛋白适度水解(即dh为0-3%上下)的dh范围内比较灵敏,并且能被快速测定。这对工业上蛋白适度水解过程的检测监控将有意义。作为一种迅速检测的手段,本发明的a%水解指数可作为中间速捡质控方法(intermediatemethod,cmc)。从而使生产过程中的水解程度可追踪,可控。例如,在传统的药食用动物胶的生产过程里,可以把众多批次的传统胶的平均a595设为a%=100%。在日常的生产过程中,连续观察单位体积的干重,含水量,总蛋白,和a595的变化,直到追踪的a%达到,例如:200%,150%,120%,110%,105%等,即指示水解生产接近完成。其产品对应的平均分子量可用多种方法测定比对,从而固定水解工艺gmp,可以生产出批次一致的动物胶产品。一般地,平均分子量超出平均值的传统动物胶产品,>200kd,或例如a%为105%,110%,120%甚至150%或以上,传统上被认为是未成熟的药胶产品。但由于本酶技术的开发,这些传统上未成熟的药胶产品的消化问题可以有一定程度的解决,从而成为“超传统动物胶”,也许这种胶对某些需要“消化系统激励+进补”的人士有医疗价值。实施例10对鹿角胶或龟甲胶溶液进行服用前的预处理,利用组合蛋白酶作即时酶解以达到部分水解后再服用分别提供传统鹿角胶的水溶液(鹿角胶的浓度为100mg/ml)、传统鹿角胶的黄酒溶液(鹿角胶的浓度为100mg/ml、黄酒的浓度为10%乙醇)、传统龟甲胶的水溶液(龟甲胶的浓度为100mg/ml)和传统龟甲胶的黄酒溶液(龟甲胶的浓度为100mg/ml、黄酒的浓度为10%乙醇),一般无须ph调节,分别加入表4中的组合酶,并加热到50-60℃并维持0.5-5小时后升温灭活,得到不同程度部分水解的鹿角胶或龟甲胶以便服用。鹿角胶或龟甲胶的水解深度取决于水解时间的长短,由服用者自己,或药胶售后服务的指导或医师指导下,掌握,以不腻腹,刚好适应自己的消化需要为足。图15的实验中,应用了近似于表4的组合酶2以达到食用前即时的部分水解。对鹿角胶和龟甲胶的水溶液和黄酒溶液均分别作了两次试验。第一次实验分别加入组合酶c:胰蛋白酶0.35%,碱性蛋白酶0.35%,角蛋白酶0.35%,中性蛋白酶0.18%(总1.2%)。第二次实验分别加入组合酶d:胰蛋白酶1%,碱性蛋白酶1%,角蛋白酶1%,中性蛋白酶0.5%(总3.5%),c,d的水解结果互相接近。由于黄酒中约含10%乙醇,其水解速度总较相应的水溶液为慢。此外,如果需要,鹿角胶或龟甲胶溶液的食前水解也可以在调节ph的条件下进行,例如用食用小苏打(或醋酸,柠檬酸等食用酸)调高(或调低)ph,加速碱性蛋白酶(或木瓜酶等)的酶促水解。水解中断后用食用酸(或食用苏打)再把ph调回中性以便口服。如果需要,还可适当加入味觉调剂,如蜂蜜、甘草、甜味剂等。如果服用者需要,食前适度水解后的鹿角胶或龟甲胶仍然可以复配表4中的组合蛋白酶服用,以进一步帮助消化。其总效果与实施例4-2的胃肠联合组酶的效果相当。实施例11阿胶与其它食用蛋白的复配广谱分子量的阿胶(即适度水解了的阿胶,或轻阿胶)实际上利用了易于消化吸收的浅度/深度水解的阿胶对传统阿胶进行了稀释。同样地,其它易于消化吸收的动物蛋白,甚至植物蛋白也可以对传统阿胶作类似稀释,再补充以口服蛋白酶制剂品,和/或食用前即时的部分酶解,而服用。虽然药胶浓度被稀释了,但进补的周期延长,并可做到进补日常化,使摄入量增加,也可以达到提高其可消化吸收性,保留其疗效的效果。具体地,将实施例3中获得的广谱分子量的阿胶或传统阿胶,打粉过筛后,与易于消化的来源于鱼等动物的胶原蛋白或食用明胶,或与来源于奶源的乳清蛋白、干酪素等酪蛋白或奶粉,甚至来源于植物源的大豆水解蛋白等混合,并可适当添加总重量的0.1-1%的亚铁盐。按复配后总重量中的阿胶的重量计,则可制成阿胶含量为5–35wt%,或复配蛋白含量占35wt%,的复合了阿胶的营养品。具体地,在冬令进补的传统阿胶、传统鹿角胶或传统龟甲胶等的膏方中,添加1/3上下的食用明胶作稀释剂,则既可保持其凝固性,又可提高其可消化吸收性。在本发明中,阿胶的提高了的消化吸收性可补偿其制备过程中的稀释丢失等损失,从而使得珍贵资源能够得到更充分的吸收利用。对上述产品再补充表3和表4里的口服蛋白酶制剂,则可进一步达到改进其可消化吸收性,进而提高其效益研发中,对食用蛋白分别地做了酶水解实验。摄入酶的酶促水解在肠液条件(37℃,ph6.8)下进行。服用前即时的部分酶解实验在50-55℃,中性条件下进行。水解程度的检测采用本发明的a%水解指数法,和/或,用甲醛滴定法测相应的水解度dh。图16和图17展示了部分的体外实验结果。所述营养蛋白如:分离乳清蛋白,游离大豆蛋白,鲜牛奶,鲜豆浆,明胶,牛白蛋白,鸡白蛋白,干酪素(casein)等,不论补充蛋白酶制剂在肠液条件下的助消化,或在服用前对这些蛋白作即时的部分酶解,都能在补充蛋白酶的帮助下变得更容易消化吸收了。与鲜豆浆相比,所述酶对鲜牛奶的酶促消化效应更显著。由图中干酪素casein,奶蛋白,和大豆蛋白的酶促水解效应可以推断,所述补充蛋白酶和服用前即时的部分酶解技术亦可应用到干酪素casein,奶,和/或,大豆类制品中。实验指明,所述药食用动物胶与食用蛋白等营养物复配的复合营养品,也同样能被调节和补充蛋白酶而适应于体虚服用者。实施例12本发明的药食动物胶与蛋白酶技术组合“拳”的人体实用效果初步人体服用表明:对传统动物胶(阿胶,鹿角胶,龟甲胶)作了服用前即时的适度水解后服用,并佐以胃肠组合酶补充制剂,则能减少因难以消化引起的“腹腻”感,延长服用周期1周以上。更能起到壮身筋骨,改善睡眠,强健精神,缓解气虚咳嗽,于妇女改善经血等疗效。从而证明了本发明的药胶与蛋白酶技术“组合拳“的效用。具体服用办法是:传统动物胶溶解得100-200mg/ml的水溶液,和/或黄酒溶液,或传统阿胶50mg/ml溶解于奶和豆浆,搅拌加入表3组合酶-b(用于阿胶),或表4组合酶-d(用于鹿角胶,龟甲胶),不作ph的调节,一般加热并维持在50-60℃达2-5小时,阿胶溶液加热并维持在50-60℃0.5-2小时,然后升温半小时杀酶。阿胶水-黄酒中伴入大枣,核桃等切片。冷却后置冰箱保存。日服三次,阿胶每次约2.5-5克,鹿角胶和龟甲胶多于5克。服用时并佐以胃肠联合组酶:阿胶采用表3胃肠联合组酶-1;鹿角胶和龟甲胶采用表4胃肠联合组合酶-1。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1