一种养颜润肠保健茶及其制备方法与流程
本发明属于保健食品技术领域,具体涉及一种养颜润肠保健茶及其制备方法。
背景技术:
黄褐斑是一种面部色素代谢障碍的损容性皮肤病。在祖国医学古籍文献中记载为“肝斑”、“黧黑斑”。好发于面部,形状为不规则的淡褐色或黄褐色斑片,伴有月经量少、痛经、睡眠不佳等症状,病程缠绵,易诊难治等;给黄褐斑患者带来了生理、心理、精神等诸多方面的烦恼和痛苦。黄褐斑虽然是一种发生在面部的疾病,但多因脏腑功能失调,气血不营,脉络不畅,瘀而成斑为主,与肝、脾、肾三脏有关,尤其与脾、肝关系最为紧密,而血瘀贯穿始终,长期便秘也是引发黄褐斑的主要原因。
随着人们饮食结构和生活习惯的变化,便秘的发病率异常升高。便秘后机体会出现腹胀、精神倦怠、体重减轻、不思饮食、面色晦暗、色斑出现、反应迟缓、大便色黑,干燥。同患者也会伴有易怒、口臭,食欲减退等诸多病征,给患者带来了极大的不适和痛苦,严重影响生活质量。中医将便秘分为实证和虚证两大类,其中实证便秘包括肠胃积热型、气机郁滞型和阴寒积滞型,虚证便秘包括气虚型、血虚型、阴虚型和阳虚型。四者之中,又以虚实为纲,热秘、气秘、冷秘属实,阴阳气血不足的便秘属虚。而寒、热、虚、实之间,常又相互兼夹或相互转化。如热秘久延,津液渐耗,损及肾阴,病情由实转虚。气郁化火,则气滞与热结并存。气血不足者,易受饮食所伤或情志刺激,则虚实相兼。阳虚阴寒凝结者,如温燥太过,津液被耗,或病久阳损及阴,则可见阴阳俱虚之证。血虚兼寒凝型便秘,在现代女性中尤为多见,嗜食寒凉,脾运不足,寒凝于下,大肠传导失职;脾胃虚寒,寒自内生,运化失健,久而成寒积,使肠道传送无力则大便艰涩;阴寒内盛,气机阻滞,腹气不通则腹痛。
现有技术对便秘引发的黄褐斑目前尚无有效的专用治疗药,也无大众认可的保健食品。中药是中国的传统瑰宝,历史悠久,来源广泛,价格低廉,副作用小,中药越来越多地用于开发具有保健功能的特殊食品,对临床常见的慢性疾病辅助治疗和康复具有非常重要的意义。
技术实现要素:
本发明的目的是提供一种养颜润肠保健茶及其制备方法,以解决现有组方对便秘引发的黄褐斑作用不佳的问题。
为了达到上述目的,本发明采用的技术方案为:
一种养颜润肠保健茶,由下列重量份配比的原料制成:当归1-3份、白术1-3份、大枣1-4份和蜂蜜1-8份。
优选由下列重量份配比的原料制成:当归3份、白术3份、大枣4份和蜂蜜8份。
由上述原料制成溶液剂、口服液或流浸膏剂剂型。
所述养颜润肠保健茶的制备方法包括以下步骤:按配比称取当归、白术和大枣,加入三种原料重量12-25倍量的溶媒,浸泡1-2h,提取1-3次,每次0.5-1.5h,过滤,合并滤液,浓缩后加入配比量的蜂蜜,制备成制剂。
上述步骤中滤液浓缩后加入配比量的蜂蜜,定容,制备成溶液剂或口服液。
上述步骤中滤液浓缩后先干燥,再加入配比量的蜂蜜,制备成流浸膏剂。
上述步骤中溶媒为蒸馏水。
上述步骤中浓缩采用常压浓缩方式或减压浓缩方式。
上述步骤中干燥为喷雾干燥、冷冻干燥、减压干燥、微波干燥或常压干燥。
本发明相较于现有技术的有益效果为:
本发明根据中医学理论的君、臣、佐、使配伍及辨证论治的原则,选用具有补气养血、健脾和胃、温中散寒、润肠通便的中药组成复方,制备成临床可以接受的剂型。
当归:甘、辛,性温。归肝、心、脾经。具有补血活血,调经止痛,润肠通便的功效。当归是补血之圣品,具有质润泽肤、养血活血、补血生肌的作用,用于血虚萎黄、眩晕心悸、月经不调、经闭痛经、虚寒腹痛、肠燥便秘、风湿痹痛、跌扑损伤、痈疽疮疡。
白术:苦,甘,性温。归脾、胃经。具有健脾益气,燥湿利水,养颜益肌的功效。用于脾虚食少,腹胀泄泻,痰饮眩悸,水肿,皮肤暗黄。
大枣:甘,性温。归脾、胃经,具有益气补血,健脾和胃,养血安神,缓和药性的功效。用于脾虚食少,乏力便溏,妇人脏躁,贫血。
蜂蜜:甘,性平。归肺、脾、大肠经。具有补中,润燥,止痛,解毒的功效。用于脘腹虚痛,肺燥干咳,肠燥便秘;外治疮疡不敛,水火烫伤。
中医认为血虚,肠失濡养,则肠燥便秘,寒从内生,客于肠腑,气机升降失司,故胃肠气滞、脘腹冷痛。
本方中当归甘辛性温,归于肝、心、脾经,甘以养血,辛则行散,温可胜寒,既可养血益精,润肠通便,又可活血行气,导滞通腑,还可温阳散寒,融秘温下,集补、行、温于一身,正合血虚冷秘之虚、秘、寒之根本,一药三用而为君药。
白术气味甘温,质多脂液,乃调和脾土之药也。太阴主湿土而属脾,为阴中之至阴,喜燥恶湿,喜温恶寒,然土有湿气,始能灌溉四旁,如地得雨露,始能发生万物。若过于炎燥,则止而不行,为便难脾约之证,为臣药。
大枣,直入中焦,促进脾土运化,资化气血之源,既可建中以通腑,又可滋血以通便;大枣酸甘而温,养血敛阴,健脾、益气、生津,以助气血之化源,合当归以润肠通便,为佐药。
蜂蜜甘平,归于大肠,润肠通便,兼可调和诸药,为使药。
四药相伍,养血润肠,散寒通便,血虚得补,阴寒得散,瘀滞畅行,六腑通降,则秘自下。
本方集养血、温阳、导滞之合力,能健脾益气、补血活血,能防老抗衰,使肌肤艳丽。
本发明的保健食品有较强的健脾暖胃、补血益气、活血化瘀的功效,能防老抗衰,润肠通便,调节免疫使肌肤艳丽,未见明显急性毒性反应。
附图说明
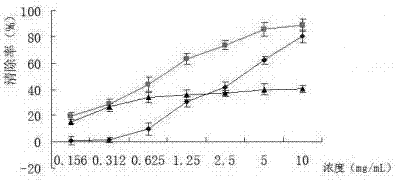
图1为当归养颜润肠茶体外总抗氧化活性;
图2为当归养颜润肠茶抗自由基活性;
附图标记含义如下:为DPPH自由基;为超氧阴离子自由基;为羟自由基。
具体实施方式
下面结合具体实施方式对本发明做进一步说明。
实施例1:
取当归300g、白术300g,混合,粉碎,过10目筛,大枣400g(破开或去核)、混匀,加10000ml蒸馏水,浸泡2h,煎煮提取1.5h,过滤,留滤液;药渣中加入8000ml蒸馏水,煎煮提取1h,过滤,合并两次滤液,浓缩,喷雾干燥,加蜂蜜800g,混匀,制成流浸膏。
实施例2:
取当归150g、白术200g,混合,粉碎,过10目筛,大枣400g(破开或去核)、混匀,加5000ml蒸馏水,浸泡1h,煎煮提取1.5h,过滤,留滤液;药渣中加入4000ml蒸馏水,煎煮提取1h,过滤,合并两次滤液,常压浓缩,加蜂蜜600g,并定容至2000ml,灌装,制成溶液剂。
实施例3:
取当归100g、白术150g,混合,粉碎,过10目筛,大枣300g(破开或去核)、混匀,加5000ml蒸馏水,浸泡2h,煎煮提取1.5h,过滤,留滤液;药渣中加入3000ml蒸馏水,煎煮提取1h,过滤,合并两次滤液,减压浓缩,加蜂蜜600g,并定容至1000ml,灌装,制成口服液。
实施例4:
取当归100g、白术200g,混合,粉碎,过10目筛,大枣200g(破开或去核)、混匀,加6000ml蒸馏水,浸泡2h,煎煮提取1.5h,过滤,减压浓缩,冷冻干燥,加蜂蜜600g,混匀,制成流浸膏。
实施例5:
取当归200g、白术200g,混合,粉碎,过10目筛,大枣200g(破开或去核)、混匀,加7000ml蒸馏水,浸泡1h,煎煮提取1h,过滤,留滤液;药渣中加入4000ml蒸馏水,煎煮提取1h,过滤,留滤液;药渣中加入4000ml蒸馏水,煎煮提取0.5h,过滤合并3次滤液,浓缩,微波干燥,加蜂蜜600g,混匀,制成流浸膏。
实施例6:
取当归100g、白术100g,混合,粉碎,过10目筛,大枣200g(破开或去核)、混匀,加5000ml蒸馏水,浸泡2h,煎煮提取1h,过滤,浓缩,加蜂蜜300g,混匀,制成口服液。
实验例1、本发明体外抗氧化活性实验:
1 材料与仪器
1.1 药品与试剂
本实验例采用实施例1的原料配比和工艺制备。推荐每日人用量40ml,分2-3次温水兑服);达正堂牌雪容口服液,国食健字G20060156,广州达正堂保健品有限公司生产,批号1601015;硫酸(98%),天津市致远化学试剂有限公司生产,批号201528;磷酸,天津市致远化学试剂有限公司生产,批号201118;钼酸铵(56.5%),上海麦克林化学试剂厂生产,批号201424;H2O2,天津市巴斯夫化工有限公司生产,批号201410,FeSO4·7H2O,天津市致远化学试剂有限公司生产,批号201328;水杨酸,天津市致远化学试剂有限公司生产,批号201420,无水乙醇,天津市富宇精细化工有限公司生产,批号201526;Tris(99.5%),西宝生物科技股份有限公司,批号2015644;邻苯三酚,天津市凯通化学制剂有限公司生产,批号201128;DPPH(1,1-二苯基-2-苦基苯肼),天津市致远化学试剂有限公司生产,批号201325;试剂均为分析纯。
1.2 主要仪器
Nestorius电子天平(CPA1003P型,德国Nestorius生产),紫外分光光度计(UV-2401型,依瓦塔精密光电有限公司),pH计(METER PHS-430型,西安禾普生物科技有限公司专业生产),液体快速混合器(YKH-Ⅱ型,江西医疗器械厂生产),超级恒温水浴锅(HH-601型,江苏金坛市恒丰仪器厂)。
2 方法与结果
2.1 体外抗氧化活性受试物的制备
取本发明10.0g溶于100ml双蒸水中,充分溶解,用双蒸水稀释制成不同浓度的溶液,过0.22μm滤膜过滤,浓度依次为0.156、0.312、0.625、1.25、2.5、5.0、10.0mg/ml,待用。
2.2 总抗氧化活性测定
取试管1只,依次加入1.0 mL(3.00 mol/ L)的H2SO4溶液,1.0 mL (0.14 mol/ L )的H3PO4溶液和1.0 mL (0.02 mol/ L)钼酸铵溶液,再用双蒸水定容至5.0 mL.摇匀。加塞于95℃水浴中加热90min。取出冷却后,作为空白管备用。
另取试管7只,分别依次加入1ml H2SO4、1ml H3PO4、1ml钼酸铵,再依次加入1ml不同浓度的受试物溶液,然后用蒸馏水定容到5ml,加塞于95℃水中90min,取出冷却后,用空白管溶液调零,在695nm波长下测吸光度As,试验重复3次,取平均值。
结果表明,本发明具有一定的体外抗氧化活性,随着受试物浓度的增加,总抗氧化活性逐渐增大,线性方程为y = 0.5487x - 0.6633(R2=0.9545),见图1。
2.3 抗DPPH 自由基活性测定
分别取2mL受试物溶液和2mL DPPH乙醇溶液加入试管,混匀,室温放置30min。用无水乙醇做参比,在517nm处测定吸光度Ai;取2mL DPPH乙醇溶液和2mL无水乙醇加入试管,混匀,在517nm处测定吸光度Ac;取2mL受试物溶液和2mL无水乙醇加入试管,混匀,室温放置30min,用无水乙醇做参比,在517nm处测定吸光度Aj;各试验重复3次,取平均值,计算DPPH 自由基清除率和半数抑制率。
DPPH 自由基清除率=[1-(Ai- Aj)÷Ac] ×100%
其中Ai为加入抗氧化剂的吸光度值,Aj为乙醇溶液的吸光度值,Ac为阴性对照吸光度值。
结果显示,本发明能明显清除DPPH自由基,随着受试物浓度的增加,清除率逐渐增大,线性方程为y = 13.981x - 23.48(R2=0.9566),计算IC50为3.2226mg/mL,a=0.05时的可信限为1.9992-5.1948mg/mL,见图2。
2.4 抗超氧阴离子自由基活性测定
配制pH为8的250mmol/L Tris-HCl缓冲液,取4.5mL Tris-HCl缓冲液和4.2mL蒸馏水加入试管,混匀,25℃水浴中恒温静置20min,取出后立即加入25℃预热的3mmo1/L邻苯三酚0.3mL(以10mmol/L的HCl配制),迅速摇匀,倒入比色杯,325nm处,每隔30s测定吸光度,计算每分钟吸光度的增加值,试验重复3次,取平均值。
分别取2.0mL受试物溶液、2.2mL蒸馏水和4.5mL Tris-HCl缓冲液加入试管,混匀,25℃水浴中恒温静置20min,取出后立即加入25℃预热的3mmo1/L邻苯三酚0.3mL(以10mmol/L的HCl配制),迅速摇匀,倒入比色杯,325nm处,每隔30s测定吸光度,计算每分钟吸光度的增加值,试验重复3次,取平均值。
空白管用10mmol/L的HCl代替3mmo1/L邻苯三酚溶液,空白管调零,计算清除率和半数抑制率。
·O2-自由基清除率(%)=(∆A0-∆A)/(∆A0 ) ×100%
其中∆A0为邻苯三酚的自氧化速率,∆A为加入受试物溶液后邻苯三酚的自氧化速率。
结果显示,本发明能明显清除·O2-自由基,随着受试物浓度的增加,清除率逐渐增大,线性方程为y = 12.605x + 7.2343(R2=0.9760),计算IC50为0.7986mg/mL,a=0.05时的可信限为0.5347-1.1869mg/mL,见图2。
2.5 抗羟自由基活性测定
取1 mL蒸馏水、1 mL 9mmo1/L的 FeSO4和1mL 9mmo1/L的水杨酸-乙醇加入试管,混匀,再加入1mL 8.8mmo1/L的H2O2,37℃恒温反应0.5h,以蒸馏水为参比,在510nrn处测量吸光度A0。
分别取1 mL不同浓度的受试物溶液、1 mL 9mmo1/L的 FeSO4和1mL 9mmo1/L的水杨酸-乙醇加入试管,混匀,再加入1mL 8.8mmo1/L的H2O2,37℃恒温反应0.5h,以蒸馏水为参比,在510nrn处测量吸光度AX。
分别另取1 mL不同浓度的受试物溶液、1 mL 9mmo1/L的 FeSO4和1mL 9mmo1/L的水杨酸-乙醇加入试管,混匀,37℃恒温反应0.5h,以蒸馏水为参比,在510nrn处测量吸光度AX0。计算清除率和半数抑制率。
·OH自由基清除率=(A0-Ax-Ax0)/A0×100%(2)
其中A0为空白液的吸光度,AX为加入受试物溶液后的吸光度,AX0为不加显色剂H2O2受试物溶液本底的吸光度。
结果显示,本发明具有一定的清除·OH自由基的作用,随着受试物浓度的增加,清除率呈现增大的趋势,线性方程为y = 3.78x + 17.55(R2=0.8207),计算IC50为20.8848mg/mL,a=0.05时的可信限为0.0017-263478.2mg/mL,见图2。
3.小结
本发明具有一定的体外抗氧化活性,随着受试物浓度的增加,总抗氧化活性逐渐增大,能明显清除DPPH自由基和·O2-自由基,IC50分别为3.2226mg/mL和0.7986mg/mL,对·OH自由基具有较弱的清除作用。
实验例2、本发明体免疫增强活性实验:
1 材料与仪器
1.1 动物
KM种小鼠,SPF级,体重20±2g,雌雄兼用,20±2℃控温和光暗周期各12h环境饲养,自由饮水,由甘肃中医药大学实验动物中心提供,合格证号SCXK(甘)2015-0001,动物实验设施使用证号SYXK(甘)2015-0001,SPF级小鼠生长繁殖饲料,由北京科奥协力饲料有限公司提供。
1.2 药品与试剂
本实验例采用实施例1的原料配比和工艺制备。推荐每日人用量40ml,分2-3次温水兑服);达正堂牌雪容口服液,国食健字G20060156,广州达正堂保健品有限公司生产,批号1601015;环磷酰胺(CTX),江苏恒瑞医药股份有限公司生产,批号150213;印度墨汁,CHROMA-GESELL-SCHAFTmbH&Co-D-48161 Munster;豚鼠血清(-20℃保存,临用时生理盐水1∶10稀释)。Alsever’s溶液、鸡红细胞(CRBC)悬液、姬姆萨染液按文献方法配制;试剂均为分析纯。
1.3 主要仪器
Nestorius电子天平(CPA1003P型,德国Nestorius生产),紫外分光光度计(UV-2401型,依瓦塔精密光电有限公司),PH计(METER PHS-430型,西安禾普生物科技有限公司专业生产),液体快速混合器(YKH-Ⅱ型,江西医疗器械厂生产),超级恒温水浴锅(HH-601型,江苏金坛市恒丰仪器厂)。
2 方法与结果
2.1小鼠巨噬细胞吞噬功能测定
取小鼠60只,♂♀兼用,按性别体重随机分为6组,设空白组,模型组 (CTX),阳性组(达正堂牌雪容口服液1.67g生药/kg,相当于成人日用量的10倍),AYT高、中、低剂量组(12、6、3g生药/kg,相当于成人日用量的20、10、5倍),每组10只,按20ml/kg体重容积灌胃给药,空白组灌服等量的生理盐水,每天1次,连续10d。给药第8天起除空白组外,其它各组均皮下注射 CTX(40mg/kg),每天1次,共3d。末次给药后第2d,各组小鼠腹腔注射5%鸡红细胞(CRBC)悬液(每只0.4mL)。8h后将小鼠颈椎脱臼处死,腹腔生理盐水2.5mL,抽取腹腔冲洗液滴片,37℃下孵育30min,生理盐水漂洗除去未贴片的细胞,晾干后以丙酮-甲醇液(1∶1)固定,姬姆萨染液染色,显微镜下每片计数100个巨噬细胞,常规计算吞噬指数与吞噬百分率,t检验判断各组差异的显著性。
吞噬百分率=吞噬CRBC的巨噬细胞数/200个巨噬细胞×100%
吞噬指数=被吞噬的CRBC总数/200个巨噬细胞
结果显示,与空白组比较,造模后小鼠腹腔巨噬细胞吞噬百分率和吞噬指数均明显下降(P<0.01),与模型组比较,阳性组、AYT高、中剂量组小鼠腹腔巨噬细胞吞噬百分率和吞噬指数均有明显升高(P<0.05);与阳性组比较,AYT各剂量组小鼠腹腔巨噬细胞吞噬百分率和吞噬指数差异无统计学意义,见表1。
注:与空白组比较**P<0.01,*P<0.05;与模型组比较#P <0.05,##P <0.01;与阳性组比较▲▲P<0.01,▲P<0.05。
2.2 小鼠溶血素抗体测定
分组及给药同“2.1”项,每天给药1次,连续10d。给药第4d,各组小鼠腹腔注射5%CRBC悬液(每只0.2mL)进行免疫。给药第8d起除空白组外,其它各组均皮下注射 CTX(40mg/kg),每天1次,共3d。末次给药后第2d,各小鼠股动脉取血于离心管中,室温下放置1h后以2000r/min离心40min。取血清,用生理盐水稀释100倍,取稀释血清1mL,与5%CRBC悬液0.5mL、10%补体0.5mL混合,37℃恒温箱中保温30min后0℃冰箱终止反应。离心,取上清液于分光光度计(λ=540nm)比色,以A值作为判定血清溶血素的指标,t检验判断各组差异的显著性。
结果显示,与空白组比较,造模后小鼠血清溶血素抗体水平明显下降(P<0.01),与模型组比较,阳性组、AYT高剂量组小鼠血清溶血素抗体水平明显升高(P<0.01);与阳性组比较,AYT高剂量组小鼠血清溶血素抗体水平明显增高 (P<0.05),见表2。
注:与空白组比较**P<0.01,*P<0.05;与模型组比较#P <0.05,##P <0.01;与阳性组比较▲▲P<0.01,▲P<0.05。
2.3 小鼠NK细胞活性测定
分组及给药同“2.1”项,每天1次,连续10d。给药第2天,起除空白组外,其它各组均灌胃羟基脲(320mg/kg),每天1次,共9d。第11d称体重和脾脏湿重、检测各组小鼠NK细胞活性。取脾脏后,用100目钢网研磨脾脏制备细胞悬液,吸入离心管后静置10 min,弃去沉淀的团块,Hanks液洗2遍,用完全RPMI-1640培养基调至所需浓度作为小鼠NK活性的效应细胞,每孔100μL标记靶细胞1×105(YAC-1)与标记同位素37 kBq混匀,37℃培养20-24h,弃上清,加入DNA酶和胰酶各100μL (分别含10μg DNA和0.6 mg胰酶),充分混匀,放置1 h后收获每管上清0.5 mL置另外的试管中。对照管以FCS-1640代替效应细胞。用γ计数仪分别测每管上清和细胞部分的cpm值,t检验判断各组差异的显著性。
NK细胞活性(%)=实验管3H-TdR释放率-对照管3H-TdR自然释放率
结果显示,与空白组比较,造模后小鼠NK细胞活性和脾脏指数均明显下降(P<0.01),与模型组比较,阳性组、AYT高、中剂量组小鼠NK细胞活性均有明显升高(P<0.05),阳性组、AYT高剂量组小鼠脾脏指数均有明显升高(P<0.05);与阳性组比较,AYT各剂量组小鼠NK细胞活性和脾脏指数差异无统计学意义,见表3。
注:与空白组比较**P<0.01,*P<0.05;与模型组比较#P <0.05,##P <0.01;与阳性组比较▲▲P<0.01,▲P<0.05。
2.4 小鼠网状内皮系统吞噬功能测定
分组及给药同“2.1”项,每天给药1次,连续10d。末次给药后 24 h,小鼠尾静脉注射印度墨汁(用 1% 明胶液稀释 4 倍)0.1 mL/10g体重。注射后用秒表计时,分别在 2min 和 10 min 时用毛细玻管从小鼠眼眶取血 25 μL,立即吹入 0. 1% Na2CO3溶液 2 mL 中,玻管于该液中吸入、吹出数次,以充分洗出玻管壁附着的血液,摇匀。以 0. 1% Na2CO3溶液调零,在675 nm 处测吸光度(A)。最后将小鼠颈椎脱臼处死,称体重和肝、脾质量,计算廓清吞噬指数(K)及校正吞噬系数(α)。
K = ( lgA1- lgA2) /(t2- t1) ;α=体重 /(肝质量 + 脾质量) × K1 / 3
结果显示,与空白组比较,造模后K和α均明显下降(P<0.01),与模型组比较,阳性组、AYT高、中剂量组K和α均明显升高(P<0.05,P<0.01);与阳性组比较,AYT各剂量组K和α差异无统计学意义,见表4。
注:与空白组比较**P<0.01,*P<0.05;与模型组比较#P <0.05,##P <0.01;与阳性组比较▲▲P<0.01,▲P<0.05。
3.小结
本发明具有一定的非特异性免疫增强作用,高、中剂量组小鼠腹腔巨噬细胞吞噬百分率和吞噬指数均有明显升高,高剂量组小鼠血清溶血素抗体水平明显升高),高、中剂量组小鼠NK细胞活性均有明显升高,高剂量组小鼠脾脏指数均有明显升高,高、中剂量组K值和α值均明显升高。
实验例3、本发明体润肠通便活性实验:
1 材料与仪器
1.1 动物
KM种小鼠,SPF级,体重20±2g,雌雄兼用,20±2℃控温和光暗周期各12h环境饲养,自由饮水,由甘肃中医药大学实验动物中心提供,合格证号SCXK(甘)2015-0001,动物实验设施使用证号SYXK(甘)2015-0001,SPF级小鼠生长繁殖饲料,由北京科奥协力饲料有限公司提供。
1.2 药品与试剂
本实验例采用实施例1的原料配比和工艺制备。推荐每日人用量40ml,分2-3次温水兑服);达正堂牌雪容口服液,国食健字G20060156,广州达正堂保健品有限公司生产,批号1601015。氢化可的松注射液(国药准字H20023069,国药集团容生制药有限公司,批号1507281),甲状腺素片(国药准字H31022151,上海长城药业有限公司,批号20150103),活性炭粉末(天津市大茂化学试剂厂,批号20140106)。
1.3 主要仪器
Nestorius电子天平(CPA1003P型,德国Nestorius生产),超级恒温水浴锅(HH-601型,江苏金坛市恒丰仪器厂)。
2 方法
2.1 造模、分组与给药
取60只小鼠,雌雄兼用,随机分为6组,设空白组,模型组 (CTX),阳性组(达正堂牌雪容口服液1.67g生药/kg,相当于成人日用量的10倍),AYT高、中、低剂量组(12、6、3g生药/kg,相当于成人日用量的20、10、5倍),每组10只,除空白组外,其余各组小鼠每天灌胃甲状腺素150mg/kg和皮下注射氢化可的松2.0mg/kg,连续7d。
2.2 指标检测
2.2.1排便时间
给药第7d,灌胃60min后,各组小鼠灌胃10%活性炭1.0ml/只,单笼饲养,记录各小鼠首次排黑便时间。
2.2.2粪便重量和粪便含水量
记录6小时内排便总粒数,称粪便湿重,80℃烘干4h,称粪便干重,计算粪便含水量,粪便含水量=(粪便湿重-粪便干重)/粪便湿重×100%。
2.2.3 小肠推进率
给药第8d,禁食不禁水12h,各组小鼠灌胃60min后,各组小鼠灌胃10%活性炭1.0ml/只,30min后,处死小鼠,摘自幽门部到回盲部的全部肠管,在光滑桌面铺直,观察肠道形态,测量肠管全长、活性炭在肠管内推进距离,计算小肠推进率。小肠推进率(%)=碳末推进距离(cm)/肠道总长(cm)×100%
2.3 统计学方法
数据以表示,采用SPSS 13.0软件对数据进行统计分析,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
3 结果
3.1 一般情况
实验期间小鼠均未出现死亡现象,与空白组小鼠比较,造模组小鼠精神亢奋,喜动,活动时间长。
3.2 本发明对便秘小鼠排便时间的影响
与空白组比较,模型组小鼠排便时间明显延长,差异有统计学意义(P<0.01);与模型组比较, AYT高、中、低剂量组小鼠排便时间明显缩短,差异均有统计学意义(P<0.01),见表1。
注:与空白组比较*P<0.05,**P<0.01; 与模型组比较#P<0.05,##P<0.01。
3.3 本发明对便秘小鼠排便量的影响
与空白组比较,模型组小鼠排便量明显减少(P<0.01);与模型组比较,AYT高剂量组排便量明显增加(P<0.01);AYT中、低剂量组间差异无统计学意义,见表2。
注:与空白组比较*P<0.05,**P<0.01; 与模型组比较#P<0.05,##P<0.01。
3.4本发明对便秘小鼠粪便含水量的影响
与空白组比较,模型组小鼠粪便含水量明显减少(P<0.01);与模型组比较,AYT高剂量组粪便含水量明显增加(P<0.05);AYT中、低剂量组间差异无统计学意义,见表3。
注:与空白组比较*P<0.05,**P<0.01; 与模型组比较#P<0.05,##P<0.01。
3.5 本发明对便秘小鼠小肠推进率的影响
与空白组比较,模型组小肠推进率明显减小(P<0.05);与模型组比较,AYT高剂量组小肠推进率明显增加(P<0.05),AYT中、低剂量组组间差异无统计学意义,见表4。
注:与空白组比较*P<0.05,**P<0.01;与模型组比较#P<0.05,##P<0.01。
4 小结
本实验例通过对便秘小鼠排便时间、排便量、粪便含水量和小肠推进率进行测定,与空白组小鼠比较,模型组排便时间明显延长,排便量和粪便含水量均明显减少,推进率也随之减小。与模型组小鼠比较,本发明高、中剂量组小鼠排便时间明显缩短,排便量明显增多,推进率不同程度增大,表明本发明对阴虚血於型便秘有一定的疗效。
实验例4、本发明对实验性黄褐斑的治疗作用实验:
1 材料与仪器
1.1 动物
KM种小鼠,SPF级,体重20±2g,雌雄兼用,20±2℃控温和光暗周期各12h环境饲养,自由饮水,由甘肃中医药大学实验动物中心提供,合格证号SCXK(甘)2015-0001,动物实验设施使用证号SYXK(甘)015-0001,SPF级小鼠生长繁殖饲料,由北京科奥协力饲料有限公司提供。
1.2 药品与试剂
本实验例采用实施例1的原料配比和工艺制备。推荐每日人用量40ml,分2-3次温水兑服);达正堂牌雪容口服液,国食健字G20060156,广州达正堂保健品有限公司生产,批号1601015;冰乙酸 (体积分数≥99.5%) 、无水乙醇 (体积分数≥99.7%) (天津远大化学试剂有限公司);甲醛 (体积分数37%-40%)(西陇化工股份有限公司);Anti-Melan A 抗体 (北京博奥森生物技术有限公司); Elivision TMsuper 免疫组化检测试剂盒 (福建迈新生物技术有限公司);PBS缓冲液 (自制),每1000ml中含8g NaCl,0.2g KCl,1.44g Na2HPO4,0.24g KH2PO4,pH 调至7.4;其他试剂均为国产分析纯。蛋白定量测试盒(考马斯亮蓝法,批号150505 )、丙二醛(MDA)试剂盒(批号150602)、超氧化物歧化酶(SOD)测定试剂盒(批号150622)、酪氨酸酶 (TYR)测定试剂盒(批号150622) ,(均购自南京建成生物工程有限公司;黄体酮注射液,每支20mg/mL (批号150708),购自上海通用药业股份有限公司。
1.3 主要仪器
FSH-Ⅱ型高速电动匀浆器 (江苏金坛金城国胜实验仪器厂) ,Nestorius电子天平(CPA1003P型,德国Nestorius生产),超级恒温水浴锅(HH-601型,江苏金坛市恒丰仪器厂),系统生物显微镜(OLYMPUS),BX50F4北航病理图像分析系统。
2 方法
2.1 造模与分组
取60只小鼠,雌雄兼用,随机分为6组,设空白组,模型组,阳性组,AYT高、中、低剂量组,每组10只,各组小鼠均用剃毛器除去背部短毛,用脱毛膏涂于小鼠背部 ( 面积约3. 0 cm×3. 0 cm),2 min后用抹布擦干净,实验期间小鼠背部短毛长出者,应立即除净。除空白组外,其余 5 组实验小鼠均放置在隔离箱内,以280-320 nm波长紫外线照射,每日照射小鼠背部皮肤1次,照射时间 60 min,动物与光源的距离为20 cm,连续照射30d;同时,空白组肌肉注射灭菌注射用水5ml/kg,模型组及各给药组肌肉注射黄体酮注射液20mg/kg ( 相当于人临床等效剂量的8倍) 。各组均注射于小鼠大腿根部,两腿交替,连续30d,并每天观察其脱毛部位皮肤变化情况。
2. 2 给药
造模的同时开始按分组灌胃给药,每天1次,连续30d。每天下午空白组和模型组,按10ml/kg灌胃生理盐水,AYT高、中、低剂量组分别灌胃12、6、3g生药/kg的AYT(相当于成人日用量的20、10、5倍),阳性组灌胃达正堂牌雪容口服液(1.67g生药/kg,相当于成人日用量的10倍),连续30d。
2. 3 观察指标及检测
给药30d后,颈椎脱臼处死小鼠,背部去毛,迅速取肝组织及涂药部位的皮肤组织各2块,其中一块用冰冷的生理盐水冲洗,除去血液,滤纸吸干,切取肝脏及皮肤各0.5g,分别放入2.0ml预冷生理盐水的烧杯中,剪碎组织,再倒入试管中,以高速分散器10r/min匀浆两次,每次10秒;再以3500r/min转速离心15分钟,取上清液。采用黄嘌呤氧化酶法,按试剂盒检测说明书方法测定SOD;采用硫代巴比妥酸法,按试剂盒检测说明书方法测定MDA值;采用生物素双抗体夹心酶联免疫吸附法 ( Elisa) 测定标本中小鼠酪氨酸酶水平。同时,分离小鼠背部皮肤,取去毛的皮肤组织一块(2cm×1cm左右),10%多聚甲醛固定,常规石蜡包埋,切片,HE染色,常规组织病理检测,光镜观察,计数上皮增生、真皮血管数及真皮炎细胞数;免疫组化染色,观察黑色素细胞染色和数目(阳性细胞:无,计0分; <15%,计0.5分,<30%,计1分;>30%,计2分)。
3 结果
3. 1本发明对黄褐斑模型小鼠肝脏及皮肤TYR的影响
结果表明,与空白组相比,模型组小鼠肝脏、皮肤中TYR水平明显增加,具有显著性差异(P<0.05);与模型组相比,阳性组、AYT高、中剂量组的肝脏、皮肤TYR水平明显降低,有显著性差异(P<0.05,P<0.01),见表 1。
注:与空白组比较*P<0.05,**P<0.01;与模型组比较#P<0.05,##P<0.01。
3. 2本发明对黄褐斑模型小鼠肝脏及皮肤氧化指标的影响
结果显示,与空白组相比,模型组小鼠肝脏、皮肤中 SOD 活力明显降低,MDA 水平明显增加,具有显著性差异(P<0.01)。与模型组相比,阳性组、AYT高剂量组小鼠肝脏中SOD 活力明显升高,MDA 水平明显降低,具有显著性差异(P<0.05);阳性组、AYT高、中剂量组小鼠皮肤中SOD 活力明显升高,MDA 水平明显降低,具有显著性差异(P<0.05,P<0.01);见表2、表3。
注:与空白组比较*P<0.05,**P<0.01; 与模型组比较#P<0.05,##P<0.01。
注:与空白组比较*P<0.05,**P<0.01; 与模型组比较#P<0.05,##P<0.01。
3. 2本发明对黄褐斑模型小鼠皮肤组织形态和组织化学的影响
病理形态学观察发现正常组小鼠表皮的上皮层细胞排列整齐,无增生,真皮层内未见小血管扩张,炎性细胞少见。模型组小鼠表皮的上皮层细胞增生明显,核大且排列紊乱,真皮层内可见小血管扩张,炎性细胞多见。AYT大、中剂量组及阳性组小鼠表皮的上皮层细胞增生有所减轻,排列紊乱减轻,真皮层内小血管扩张减轻,炎性细胞少见,见表4。
免疫组织化学研究发现正常组小鼠上皮层内可见少许黑色素细胞,胞浆着色棕褐色。模型组小鼠上皮层内可见大量黑色素细胞,胞浆着色深褐色,且阳性细胞数>30%。大、中剂量组及阳性对照组小鼠上皮层内可见黑色素细胞,胞浆着色深褐色,阳性细胞数减少,见表4。
注:轶和检验,与模型组比较#P<0.05,##P<0.01。
4 小结
本发明对黄褐斑模型小鼠有一定的防治作用,其机制可能与抑制酪氨酸酶活性和黑色素细胞的增殖,提高机体抗氧化能力有关。
实验例5、本发明体急性毒性作用实验:
1 材料
1.1 实验动物
昆明种小鼠,SPF级,18-22g,雌雄兼用,由甘肃中医药大学实验动物中心提供,合格证号SCXK(甘)2015-0002,动物实验设施使用证号SYXK(甘)2015-0005。SPF级饲料(由北京科奥协力饲料有限公司提供)喂养,自由进食,自由饮水,动物按性别分笼饲养,室温25±0.5℃,相对湿度55±5%,12h灯光,12h黑暗,适应3d后开始实验。
1.2 药品与试剂
本实验例采用实施例1的原料配比和工艺制备。推荐每日人用量40ml,分2-3次温水兑服,相当于36g药材,其中蜂蜜16g)。
1.3 主要仪器
Nestorius电子天平,德国Nestorius公司; SF-400型电子秤(500g/0.1g),浙江省永康市群泽工贸有限公司。
3.方法及结果
3.1本发明经口LD50测定
Dmin和Dmax的测定:取小鼠,分别以1:10:100剂量比例灌胃(20ml/kg体重)找出受试物的0%和100%估计致死量。另取小鼠,以受试物0%和100%估计致死量为依据,分别以1:4:16剂量比例灌胃(20ml/kg体重),测定受试物的Dmin和Dmax。
LD50的测定:根据Dmin和Dmax的值,以及计划分组数,计算组间剂量比值(K),以Dmin作为最低剂量组,Dmax作为最高剂量组,按K值计算出中间几组剂量。灌胃(20ml/kg体重)后观察并详细记录动物的反应情况,并记录动物死亡分布结果,采用LD50数据处理软件(Bliss法)计算受试物样品的LD50和LD50的95%可信区间。
结果显示,本发明无法测定Dmin和Dmax,无法直接测定其LD50和LD50的95%可信区间。
3.3本发明经口MTD测定
另取小鼠40只,雌雄各半,随机分为对照组和受试组,每组20只,禁食不禁水12h,受试组小鼠按40ml/kg体重的容量灌胃(0.9g生药/ml),共2次,间隔6h,对照组小鼠灌胃等容量蒸馏水。观察各小鼠的饮食、活动、精神状态、皮毛肤色、大小便、体重变化及死亡情况,连续观察14d,颈椎脱臼处死小鼠,大体解剖,观察肝、肾、肺、脾、心等脏器形态和色泽。
按下列公式计算小鼠1日MTD相当于临床成人日用量的倍数。
结果显示,按最高浓度最大给药容量灌胃后,各小鼠的饮食、自主活动均未出现异常,皮毛肤色未见异常,体重增加正常,大小便未见异常;持续观察14d,期间未见动物死亡;颈椎脱臼处死小鼠,大体解剖,肝、肾、肺、脾、心等脏器形态、色泽未见异常,结果见表1。
经计算,本发明小鼠1日最大给药量(MTD)为80.0ml/kg体重,折合为临床70kg成人日用量(36g)的140倍。
注:与对照组比较#P<0.05,##P<0.01。
4.小结
本发明以72.0g生药/kg体重灌胃(相当于70kg成人日用量的140倍),对小鼠未见明显急性毒性反应,提示本发明小鼠灌胃LD50大于72.0生药/kg体重,口服安全性较高。
- 还没有人留言评论。精彩留言会获得点赞!