增强造血干细胞移入的方法与流程
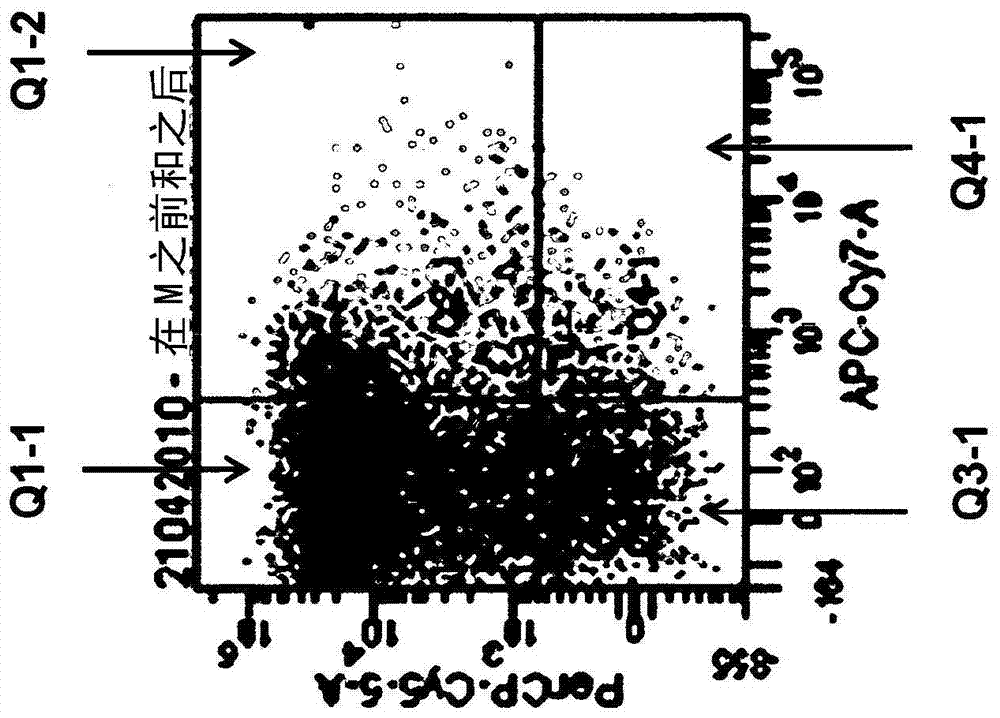
增强造血干细胞移入的方法本发明提供一种通过离体预处理增强造血干细胞的移入的新方法,所述方法包括下述步骤:获得包含造血干细胞的样品并且与前列环素类似物混合得到混合物,将所述混合物温育一段时间,所述时间足以在所述细胞中刺激Gαs-信号传导,和任选地分离所述被刺激过的细胞。此外,本发明提供一种包含曲前列尼(Treprostinil)的组合物,其用于进行造血干细胞移植的个体的治疗。造血干细胞(HSCs)是原始细胞,能够产生在个体的一生中所有血液产物、平衡其自我更新与后代分化。HSCs在发育过程中位置转移,并且在哺乳动物的整个生命中循环,进入并流出血流从而在归巢(homing)、移入(engraftment)和保持(retention)的连续步骤中结合骨髓生态位(bonemarrowniches)。归巢是供体干细胞找到进入骨髓的路径的过程,干细胞的移入意指其在骨髓中的生长。造血干细胞由于其在移植物接受体中恢复血细胞和免疫细胞的能力而具有治疗潜力。此外,HSCs具有产生其他组织如脑、肌肉和肝脏的细胞的潜力。人自体和异体骨髓移植方法目前用作疾病诸如白血病、淋巴瘤和其他威胁生命的疾病的疗法。对于这些方法,必须分离大量的供体骨髓,以确保存在足够的HSCs用于移入。造血干细胞在体内需要Gαs-转导的信号以定殖于骨髓生态位(1)。这些最近的发现证实了较早期的体外实验,其表明Gαs的激活促进造血干细胞的存活和分化(2,3)。Gαs是异三聚体G蛋白的结合鸟嘌呤核苷酸的α-亚基,其刺激膜结合的哺乳动物腺苷酸环化酶的所有9种同种型。通过用霍乱毒素处理细胞可以离体/体外组成型激活Gαs,原因在于霍乱毒素APD-核糖基化催化的鸟嘌呤残基(R186/187/201/202,精氨酸的精确数目取决于Gαs的剪接变体);GTP-水解和所导致的Gαs灭活需要完好的鸟嘌呤残基(4)。在用霍乱毒素预处理造血干细胞后的确可以观察到增强的移入:如果干细胞制剂已经用霍乱毒素预处理(1),在骨髓中存在大约两倍多的(Lin-)前体细胞。然而,对于用于进行骨髓移植的患者的干细胞制剂,霍乱毒素将是高度不利的。霍乱毒素(CT),尤其是其非毒性B亚基五聚体结构部分(CTB)是在体内和体外均具有强免疫调节特性的黏膜佐剂,并且是最有效的黏膜免疫原之一。霍乱毒素和CTB刺激强的肠IgA抗体应答和长期持续的免疫记忆。基于此,CTB已经成为最近开发的针对由肠毒性大肠杆菌(E.coli)引起的霍乱和腹泻的口服疫苗的重要成分。CT和CTB的强免疫原性在很大程度上可以由其结合在肠黏膜表面上的受体的能力所解释。另外,在感染的天然过程中,毒素分子的五聚体部分B结合肠上皮细胞的表面,并且与A亚基一起被迅速内吞。一旦被内吞,催化活性的A-亚基脱离五聚体部分B并且通过由B-亚基形成的孔进入细胞。一旦在细胞内,其永久性地使异三聚体G蛋白的Gsα亚基核糖基化,导致组成型cAMP的产生。这又导致H2O,Na+,K+,Cl-和HCO3-分泌到小肠的腔内,导致快速脱水以及与霍乱相关的其他因子。如果静脉内注射,则霍乱毒素被大部分细胞摄取(仅诸如血脑屏障的细胞被特定的屏障屏蔽)。因此,其在大部分体细胞中增加cAMP,引起大范围的副作用(从心动过速到血管舒张、肌肉震颤、高血糖等)。因此,这些作用使得霍乱毒素不能用于人用来刺激造血干细胞。然而,在进行异源骨髓移植(即,由免疫相容性供体收集的造血干细胞)时,刺激干细胞的治疗相关性是重要的,并且是用于治疗患有白血病的人、治疗患有血细胞区室遗传缺陷(例如,血红蛋白病(haemoglobinopathies)如地中海贫血症(thalassaemia);中性粒细胞功能缺陷等)的人的标准方法。由于自体骨髓移植是用于增加细胞毒性药物的治疗窗(therapeuticwindow)并且因此允许高剂量强度的化疗的标准方法(5,6),其也是重要的。造血干细胞表达所有四种前列腺素E受体(EP1-4)。用(二甲基化的)前列腺素E2预处理造血干细胞增强其移入(7,8)。这种作用由经典的Gαs-依赖性信号传导介导,原因在于cAMP-诱导的蛋白激酶A(PKA)活化协同Wnt-依赖性信号来稳定β-连环蛋白(9)。按照Otsuka等人,在兔模型中,通过贝前列素钠(Beraprostsodium)可以增强自体骨髓(BM)单核细胞(MNCs)的移入。研究的目的是支持外周和心肌缺血中的动脉发育。然而,造血干细胞是骨髓细胞中的特定类型的细胞(16)。Madonna等人描述了干细胞疗法和药理学治疗的组合,其中在冠状动脉内施用后在ADSC心肌移入中检测前列环素(17)。IshiiM.等人公开了前列环素的持续不变的释放增强间质干细胞的促血管生成功能和缺血组织中的肌肉细胞生长(18)。WO2006/017169描述了用于控制组织生长的具有生物相容性涂层的可植入传感器,其可以特别包含前列环素类似物。CrutchleyD.等人描述了西卡前列素(Cicaprost)或伊洛前列素(Iloprost)对人THP1细胞中的组织因子、肿瘤坏死因子和白介素-1β合成的抑制作用(19)。干细胞在移入后的定位是移植成功的关键决定因素。目前,由于干细胞不能成功地移入到骨髓中,并且存在长期的骨髓发育不全而导致成熟的血细胞的减少,因此对于移植需要大量的干细胞。因此,提供刺激HSCs以增加分离的HSCs向进行骨髓移植的受试者的骨髓生态位的归巢、移入和保持的方法和组合物仍然是未满足的需求。所述问题通过本发明的实施方案得以解决。发明简述:已经令人惊讶地表明合成的前列环素I2(PGI2)类似物如例如曲前列尼、伊洛前列素、贝前列素和西卡前列素能够增加造血干细胞中的cAMP水平,这导致在骨髓中增加的干细胞移入。与前列环素E2相比,前列环素类似物如曲前列尼提供数种优点:(i)其是前列环素/PGI2的稳定的类似物,其还刺激EP2-和EP4-受体(10)。因此,其具有刺激多种Gs-偶联的受体而不结合抑制性(即Gi-偶联的)EP3-受体的潜能,所述抑制性EP3-受体抑制cAMP累积。对于后者,二甲基-PGE2是完全的激动剂(1)。相比之下,曲前列尼仅是针对EP3-受体的低亲和性激动剂。(ii)由于其在代谢上比天然前列环素更稳定,如果在体内应用时,曲前列尼、伊洛前列素、贝前列素和西卡前列素可以激发持续更长久的作用,并且因此支持更有效的骨髓移入。(iii)延长的/重复的施用前列环素类似物,特别是曲前列尼、伊洛前列素、贝前列素和西卡前列素是充分耐受的。本发明提供一种通过离体预处理增强造血干细胞的移入的新方法,所述方法包括下述步骤:a.获得包含造血干细胞的样品,并且b.与至少一种前列环素类似物混合以得到混合物,c.将所述混合物温育一段时间,所述时间足以在所述细胞中刺激Gαs-信号传导,和任选地d.分离和任选地纯化所述被刺激过的细胞。按照本发明的一个实施方案,所述所述前列环素类似物选自下列各项的组:曲前列尼,伊洛前列素,西卡前列素和贝前列素或其药用盐。按照本发明的方法,还可以提供被刺激过的和未被刺激过的干细胞的混合物。特别地,所述样品是骨髓。所述干细胞通常是任意已知的来源的,特别地,其可以为由外周血、脐带血或骨髓分离的HSCs。按照本发明,曲前列尼可以是选自酸衍生物、前药、多晶型体或异构体的组的衍生物。类似地,伊洛前列素、西卡前列素或贝前列素可以是来自其酸衍生物、前药、多晶型体或异构体的组的衍生物。按照本发明的一个备选的实施方案,所述样品可以与至少一种前列环素类似物以及非特异性cAMP活化剂一起混合,所述非特异性cAMP活化剂优选地选自霍乱毒素和弗司扣林(forskolin)。按照本发明的一个具体的实施方案,提供包含前列环素类似物的组合物,其用于治疗可能进行造血干细胞移植的患有骨髓疾病的个体。按照本发明的一个具体的实施方案,所述组合物的前列环素类似物选自下列各项的组:曲前列尼,伊洛前列素,西卡前列素或贝前列素或其药用盐。按照一个优选的实施方案,所述组合物包含曲前列尼。特别地,所述个体患有白血病、血细胞区室缺陷(adefectofthebloodcellcompartment)、在化疗或照射后的骨髓移植。按照本发明的另一个实施方案,所述血细胞区室缺陷是血红蛋白病(haemoglobinopathy)或中性粒细胞功能缺陷。本发明的组合物还可以用于治疗进行造血干细胞移植的患有骨髓疾病的个体,其通过在骨髓移植后施用前列环素类似物至少七天进行治疗。特别地,使用选自曲前列尼、伊洛前列素、西卡前列素和贝前列素的组的前列环素类似物,更特别地使用曲前列尼。按照另一个实施方案,提供包含前列环素类似物和被刺激过的造血干细胞的组合物。按照另一个实施方案,提供包含曲前列尼或其药用盐和被刺激过的造血干细胞的组合物。特别地,用于在动物或动物研究中的应用,本发明的组合物可以进一步包含弗司扣林或霍乱毒素。本发明的组合物可以是药物组合物。本发明的组合物可以通过本领域已知的所有途径施用,特别地,其制备用于静脉内或皮下施用。前列环素类似物可以以口服可用的形式提供,所述口服可用的形式选自持续释放形式、片剂或胶囊的组。前列环素类似物的量取决于治疗应用或制备被刺激过的HSCs的方法。非常特别地,对于治疗应用,曲前列尼的有效量为至少1.0ng/kg体重。附图:图1:由磁珠保留的Lin+细胞群体的表征。x-轴(标记的APC-C7-A)表示通过针对下述谱系标记的抗体的混合物记录的荧光:关于T细胞的CD3ε,关于B细胞的CD45R(=B220),关于骨髓(单核细胞/粒细胞)谱系的CD11b和Ly-6G/Ly-6C(Gr-1),关于红细胞谱系的Ter-119。y-轴是关于针对鼠干细胞因子受体c-Kit的抗体记录的荧光。明显的是左上象限(表示c-Kit+和谱系标记-阴性细胞)没有细胞。图2:不与磁珠结合的Lin-细胞群体的表征。如在图1中,x-轴(标记的APC-C7-A)表示通过针对下述谱系标记的抗体的混合物记录的荧光:关于T细胞的CD3ε,关于B细胞的CD45R(=B220),关于骨髓(单核细胞/粒细胞)谱系的CD11b和Ly-6G/Ly-6C(Gr-1),关于红细胞谱系的Ter-119。y-轴是关于针对鼠干细胞因子受体c-Kit的抗体记录的荧光。明显的是,下象限(表示c-Kit-阴性和谱系标记-阳性细胞)没有细胞,并且细胞主要存在于左上象限中,在那里预期为c-Kit-阳性和谱系标记-阴性细胞。图3:显示关于Sca-1和c-Kit的存在对Lin+(图3A)和Lin-细胞群体(图3B)的表征。图3A和3B显示保持在磁珠上的细胞(在图1中表征)和出现在流过液中的细胞(在图2中表征)。这些如在方法部分所述那样染色,并且同时分析c-Kit(PerCP-Cy5-5-A,y-轴)和Sca-1(PE-Cy7-A,x-轴)的存在。明显的是,图A中分析的谱系阳性细胞存在于左下象限中,即,其缺乏c-Kit和sSca-1二者。相比之下,图B中的细胞主要在上部象限中,即,其具有高水平的c-Kit(左上象限)或c-Kit和sSca-1二者(右上象限),如关于造血干细胞细胞和未定型祖细胞所预测的那样。图4:在通过弗司扣林、曲前列尼、伊洛前列素、贝前列素或弗司扣林与类前列腺素组合刺激后,在(Lin-,c-Kit+,Sca-1+)造血干细胞中的环AMP累积。Lin-细胞(7*105/测定)在[3H]腺嘌呤的存在下温育,以代谢性预标记腺嘌呤核苷酸库,如在方法中所述。将细胞在不存在(左手侧标记为0的柱)和存在所示的化合物的条件下温育。累积的[3H]cAMP在DowexAG50-X8和矾土柱上通过连续的层析纯化,并且通过液闪计数定量。数据为平均值±S.D.(n=4)。图5:关于在(Lin-,c-Kit+,Sca-1+)造血干细胞中曲前列尼-诱导的cAMP累积的浓度-反应曲线。测定条件如在图4的图例中所述。数据为平均值±S.D.(n=2)。图6:用曲前列尼离体处理造血干细胞在致死性照射的小鼠中导致增强的骨髓移入。将如图3中制备的造血干细胞用所示的化合物(FSK,弗司扣林)预处理,如在方法中所述。通过FACS确定白血细胞计数。显示研究的动物的数量。图7:在骨髓移植后16周,Ly5.2与Ly5.1阳性血细胞的比例。Ly5.1细胞用CTX或曲前列尼与弗司扣林预处理。图8:在骨髓移植后16周,Ly5.2与Ly5.1阳性血细胞的比例。Ly5.2细胞用CTX或曲前列尼与弗司扣林预处理。发明详述:提供增加HSCs向骨髓环境的归巢和移入的方法和装置具有强烈的生物学和医学意义。由于在临床移植中需要大量的干细胞,因此导致对大量的供体细胞的需求,因此,干细胞在移植后的定位对于临床方法是高度重要的。由于显著量的自体供体移植物包含不足量的干细胞或HSCs,故而此类方法也是高度有用的。同样地,患者通常不能找到组织相容的供体,这强调了对减少成功移植所需要的HSCs数量的方法和组合物的需求。在体外或离体提高HSCs的归巢和移入的能力允许从供体收集较少的细胞,由此减少与骨髓/外周干细胞收集相关的时间和不适,并且增加自愿的HSC捐献者库。因此,本发明提供一种通过离体预处理HSCs而增强HSCs的移入的新方法,所述方法包括下述步骤:a)获得包含造血干细胞的样品,并且b)与至少一种前列环素类似物混合以得到混合物,c)将所述混合物温育一段时间,所述时间足以在所述细胞中刺激Gαs-信号传导,并且d)任选地分离所述被刺激过的细胞,或者使用所述包含所述被刺激过的细胞的混合物用于进一步的应用,例如,用于治疗或移植。特别地,所述前列环素类似物选自下列各项的组:曲前列尼,伊洛前列素,西卡前列素和贝前列素或其药用盐。曲前列尼是合成的前列环素类似物。曲前列尼以RemodulinTM市售。曲前列尼为(1R,2R,3aS,9aS)-[[2,3,3a,4,9,9a-六氢-2-羟基-1-[(3S)-3-羟基辛基]-1H-苯并[f]茚-5-基]氧基]乙酸一钠盐。伊洛前列素以“Ilomedine”市售并且为5-{(E)-(1S,5S,6R,7R)-7-羟基-6[(E)-(3S,4RS)-3-羟基-4-甲基-1-辛烯-6-炔基]-2-环[3.3.0]辛烷-3-亚基}戊酸。贝前列素为2,3,3a,8b-四氢-2-羟基-1-(3-羟基-4-甲基-1-辛烯-6-炔基)-1H-环戊(b)苯并呋喃-5-丁酸。西卡前列素为2-[(2E)-2-[(3aS,4S,5R,6aS)-5-羟基-4-[(3S,4S)-3-羟基-4-甲基-1,6-壬二炔基]-3,3a,4,5,6,6a-六氢-1H-并环戊二烯-2-亚基]乙氧基]乙酸。按照本发明的实施方案,至少两种、特别地至少三种不同的前列环素类似物可以用于所述方法。备选地,两种、三种、四种、五种或六种或甚至更多种不同的前列环素类似物可以用于所述方法。该方法有利地提供被刺激过的干细胞,其可以直接施用到个体中,并且其不表现出任何由于大量的非选择性cAMP活化剂导致的不希望的副作用。按照本发明的另一个实施方案,提供一种通过离体预处理增强造血干细胞的移入的方法,所述方法包括下述步骤:a.获得包含造血干细胞的样品,并且b.与前列环素类似物和弗司扣林混合以得到混合物,c.将所述混合物温育一段时间,所述时间足以在所述细胞中刺激Gαs-信号传导,和任选地d.分离所述被刺激过的细胞,和任选地e.纯化和/或浓缩所述被刺激过的细胞。按照本发明的一个具体的实施方案,前列环素类似物与弗司扣林的比例可以为约1∶3。用弗司扣林和前列环素类似物处理的HSCs可以在再植入之前纯化,然而,这些HSCs也可以无需进一步纯化而再植入,原因在于可以存在少量的弗司扣林而可以不引起任何不利的副作用。备选地,可以向干细胞中加入曲前列尼与伊洛前列素、贝前列素或西卡前列素之一的组合。备选地,曲前列尼可以与其他前列环素类似物(例如,但不限于,伊洛前列素、贝前列素或西卡前列素或其药用盐)中的多于一种,例如两种、三种、四种或五种组合混合。按照用于动物研究或动物治疗的具体的实施方案,在温育之前,可以另外将cAMP增强剂如弗司扣林和/或霍乱毒素与HSCs或HSC/曲前列尼、伊洛前列素、西卡前列素或贝前列素混合物混合。在所述细胞中刺激Gαs-信号传导所需要的时间可以按照已知的方法测量,例如,通过使用cAMP测量,其中存在多种变异:RIA,具有EPAC(epac1)的荧光共振能量转移(FRET)(PonsiouenB.等人,EMBOreports,5,12,1176-1180(2004)),放射化学方法等。其中发生Gαs-信号传导的被刺激过的细胞可以通过本领域已知的方法如基于FRET的cAMP报道子而被选择或从未被刺激过的细胞区别或分离。按照本发明的一个实施方案,温育时间为约1-60分钟,优选约2-30分钟。cAMP-依赖性途径是促进造血干细胞移入的基本途径。本发明人已经表明,前列环素类似物可以在造血干细胞中引起cAMP升高。其通过激活多种受体而实现,即,激活IP-和EP-受体,由此导致增加的Gαs-信号传导。因此,前列环素类似物如曲前列尼、伊洛前列素、西卡前列素或贝前列素更有效地升高cAMP水平。按照一个非常具体的实施方案,曲前列尼是优选的按照本发明的方法使用的前列环素类似物。备选地,在本发明的特定方法和组合物中,还可以加入至少一种选自环AMP(cAMP)增强剂或针对前列腺素EP受体的配体的试剂。cAMP增强剂的实例包括,但不限于,特别是本领域已知的二丁酰cAMP(DBcAMP),佛波醇酯,弗司扣林,sclareline,8-溴-cAMP,霍乱毒素(CT),氨茶碱,2,4二硝基苯酚(DNP),去甲肾上腺素,肾上腺素,异丙肾上腺素,异丁基甲基-黄嘌呤(IBMX),咖啡因,茶碱(二甲黄嘌呤),多巴胺,咯利普兰,前列腺素E1,前列腺素E2,激活垂体腺苷酸环化酶的多肽(PACAP)和血管活性肠肽(VIP),其可以在温育之前添加到干细胞/曲前列尼或干细胞/曲前列尼、伊洛前列素、西卡前列素和/或贝前列素混合物中。cAMP增强剂的实例还包括cAMP和cAMP的类似物,诸如sp-5,6-DCl-BIMPS(BIMPS)等等。按照本发明的具体的实施方案,在温育之前,另外将弗司扣林和/或霍乱毒素或霍乱毒素的A亚基与干细胞或干细胞/曲前列尼混合物混合。在具体的实施方案中,所述cAMP增强剂用于进行动物细胞的干细胞治疗或者用于进行干细胞移入的动物研究。关于前列环素类似物,按照本发明,术语“前列环素类似物”还包括所述物质的衍生物和类似物。术语“类似物”或“衍生物”是指在结构和功能上于另一种化学物质类似的化学分子,通常在结构上有单个元素或基团不同,其可以通过修饰多于一种基团(例如,2、3或4个基团)而不同,只要其保留与母体化学物质相同的功能。所述修饰对于技术人员来说是常规的,并且包括,例如,添加的或取代的化学结构部分,诸如酸的酯或酰胺,保护基诸如用于醇或硫醇的苯甲基,和用于胺的叔丁氧基羰基。还包括对烷基侧链的修饰,诸如烷基取代(例如,甲基、二甲基、乙基等),对侧链饱和度或不饱和度水平的修饰,和添加修饰基团,诸如取代的苯基和苯氧基。衍生物还可以包括缀合物,诸如生物素或抗生物素结构部分、酶如辣根过氧化物酶等,和放射性标记的、生物发光的、化学发光的或荧光结构部分。此外,可以向本文所述的试剂添加结构部分以改变其药物代谢动力学性质,诸如增加体内或离体半衰期,或增加其细胞穿透性质,特别是需要的性质。还包括前药,已知其增强药物的多种需要的性质(例如,溶解性、生物利用度、制造性等)。术语“衍生物”在其范围内还包括对母体序列的改变,包括添加、删除和/或置换,其提供功能等价或功能改善的分子。按照本发明的具体的实施方案,曲前列尼衍生物选自下列各项的组:曲前列尼的酸衍生物,曲前列尼的前药,曲前列尼的多晶型体或曲前列尼的异构体。类似地,伊洛前列素、西卡前列素或贝前列素可以是来自其酸衍生物、前药、多晶型体或异构体的组的衍生物。术语“造血干细胞”(HSCs)或更通用的术语“干细胞”在本发明的说明书中理解为等价的术语,并且通常涉及产生血细胞类型(包括骨髓(例如,单核细胞和巨噬细胞,嗜中性细胞,嗜碱性细胞,嗜酸性细胞,红细胞,巨核细胞/血小板、树突细胞),和淋巴谱系(例如,T细胞,B细胞,NK细胞)和本领域已知的其他细胞)的多能(pluripotent)或多能(multipotent)“干细胞”。“干细胞”通常特征在于其形成多种细胞类型(即,成为多能性的)的能力和其自我更新的能力。然而,也可以包括少能(oligopotent)和单能(unipotent)祖细胞。“血细胞生成”通常是指由HSC细胞分化或形成特化的血细胞的过程。在发育过程中,血细胞生成从胎儿肝脏转移到骨髓,然后其在整个成年过程中保持为血细胞生成的部位。一旦在骨髓中建立,HSCs不随机分布在整个骨腔中。相比之下,典型地在骨内膜表面紧邻处发现HSCs。更成熟的干细胞在数量上随着距离骨表面的距离增加而增加。造血组织包含具有长期和短期再生能力的细胞,以及定型的多能、少能和单能祖细胞。包含HSCs的样品具体地可以是骨髓。HSCs可以通过已知的技术从任何已知含有HSCs的来源获得,特别地从外周血、脐带或脐带血、胎盘和骨髓获得。备选地,如动物的胎儿肝脏、胎儿脾脏和大动脉-性腺-中期肾的来源也是可行的。对于本发明的方法和组合物,来自人来源的HSCs是优选的。例如,HSCs可以存在于成年人的骨髓中,包括股骨、髋骨、肋骨、胸骨和其他骨骼中。HSCs可以通过用针和注射器从髋骨取出而直接获得,或从血液直接获得,通常用细胞因子诸如G-CSF(粒细胞集落刺激因子)进行预处理,其诱导细胞从骨髓区室中释放。HSCs可以按照一些表型或基因型标记鉴定。例如,HSCs可以通过其小的尺寸、缺少谱系(lin)标记、活体染料如若丹明123(rho10)或Hoechst33342的低染色(旁群细胞(sidepopulation))、和在其表面上存在多种抗原标记(其中许多属于分化系列的簇(例如,CD5,CD11b,CD34,CD38,CD90,CD133,CD105,CD45,GR-1(=Ly-6G/C),7-4,Ter-119和c-kit))而鉴定。HSCs对于典型地用来检测谱系定型的标记主要是阴性的,并且因此,通常称为lin(-)细胞。大部分人HSCs可以表征为CD5+,CD45R(B220)+,CD11+,GR-1+,CD34+,CD59+,Thyl/CD90+,CD38lo/~,C-kit/CD117+和lin(-)。然而,并不是所有的干细胞都有这些组合所涵盖,原因在于某些HSCs为CD347+和CD38+。此外,一些研究表明最早的干细胞可能在细胞表面上缺少c-kit。为了通过流式细胞术或FACS纯化lin(-)HSCs,成熟血-谱系标记抗体的阵列可以用来耗尽lin(+)细胞或晚期多能祖细胞(MPP),包括,例如,针对特别是本领域已知的CD3ε,CD5,CD45R,CD11b,CD16,GR-1,7-4和Ter-119,CD13,CD32和CD33,CD71,CD19,CD61,Mac-1(CDllb/CD18),Gr-I,117Ra,CD3,CD4,CD5,和CD8的抗体。另外的纯化方法在本领域中是已知的,例如,使用细胞表面分子的‘信号传导淋巴细胞激活分子’(SLAM)家族的特定标志(signature)的方法。HSCs,不管是来自脐带血、骨髓、外周血或其他来源,可以在任何适当的、商购的或定制的有或无血清的培养基中生长或扩增。来自人来源的HSCs是本发明优选的实施方案。例如,在特定实施方案中,不含血清的培养基可以利用白蛋白和/或转铁蛋白。此外,可以包括细胞因子,特别是诸如Flt-3配体,干细胞因子(SCF)和血小板生成素(TPO)。HSCs也可以在诸如生物反应器的容器中生长。用于HSCs离体扩增的适当的培养基也可以包含HSC支持细胞,诸如基质细胞(例如,淋巴网状基质细胞),例如,其可以来源于淋巴组织的解离,并且其已经表现出支持HSCs及其后代的体外、离体和体内维持、生长和分化。“脐血”或“脐带血”通常涉及相对少量的来自于新生儿的返回到新生儿循环中的血液(至多约180ml)。脐血富含HSCs,并且可以按照本领域已知的技术收集并储存用于以后的应用。术语“离体”或“体外”是指在生物体外发生的活动,诸如在生物体外的人工环境中,优选地具有最少的天然条件改变,在活组织中或活组织上进行的实验或测量。在特定实施方案中,这样的组织或细胞可以收集并且冷冻,并且以后解冻用于离体处理。使用活细胞或组织的持续数天之久的组织培养实验或步骤典型地认为是“体外的”,尽管该术语可以与离体互换使用。“离体施用”、“离体处理”或“离体治疗用途”的引用通常涉及这样的医学步骤,其中一种或多种器官、细胞或组织从活的或最近患病的受试者获得,任选地经过纯化/富集,暴露于处理或处理干细胞的步骤(例如,离体施用步骤,其包括用本发明的组合物温育细胞,从而增强HSCs的移入能力),然后在任选的处理或步骤后施用给相同的或不同的活受试者。这样的离体治疗应用还可以包括任选的体内处理或程序步骤,诸如通过在施用器官、细胞或组织后给活受试者施用本发明的组合物一次或多次。按照本领域公知的技术,对于这些实施方案考虑局部和全身施用。施用给受试者的曲前列尼的量或包含曲前列尼和被刺激过的干细胞任选地以及其他试剂的混合物的量取决于受试者的特征,诸如整体健康、年龄、性别、体重和对药物的耐受性,以及针对曲前列尼和/或细胞移植物的反应的程度、严重性和类型。按照本发明的具体实施方案,提供包含前列环素类似物的组合物,用于治疗进行造血干细胞移植的个体。按照优选的实施方案,所述组合物包含选自下列各项的组的前列环素类似物:曲前列尼、伊洛前列素、西卡前列素和贝前列素或其药用盐,更特别地其包含曲前列尼。本发明的组合物还可以包含曲前列尼以及伊洛前列素、西卡前列素或贝前列素中的一种或多种。备选地,所述组合物可以包含伊洛前列素与曲前列尼、西卡前列素或贝前列素或其药用盐中的一种或多种的组合。备选地,所述组合物可以包含贝前列素与曲前列尼、西卡前列素或伊洛前列素或其药用盐中的一种或多种的组合。备选地,所述组合物可以包含西卡前列素与曲前列尼、贝前列素或伊洛前列素或其药用盐中的一种或多种的组合。所述受试者可以患有骨髓疾病,即,其中正常的骨髓结构被恶性病、再生障碍性贫血或感染取代的疾病,导致血细胞和血小板产生的减少。所述骨髓疾病可以例如是白血病、血细胞区室缺陷或在化疗或照射治疗后对骨髓移植的需求。更特别地,血细胞区室缺陷可以是血红蛋白病如地中海贫血或中性粒细胞功能的多种缺陷或中性粒细胞功能的一种缺陷。本发明还涵盖用于治疗患有骨髓疾病的个体的治疗的应用,例如,由于化疗或照射并且因此进行造血干细胞移植的个体,其通过在骨髓移植后施用至少一种前列环素类似物有限的时间段进行治疗。本发明还涵盖用至少一种前列环素类似物、至少一种前列环素类似物连同一种或多种(特别地两种、更特别地三种)cAMP增强剂或下述混合物来治疗进行骨髓移植的受试者,所述混合物为包含至少一种(特别地两种、更特别地三种)前列环素类似物和被刺激过的干细胞任选地连同其他试剂(如一种或多种cAMP增强剂)的混合物。更特别地,所述cAMP增强剂可以是弗司扣林。至少一种前列环素类似物可以在骨髓移植过程中或在通过使用HSCs重构骨髓时用于增强人HSCs的移入。加快的移入缩短受试者易感潜在的致命性感染、出血和其他严重并发症的时间段。因此,前列环素类似物应该是预处理供体骨髓从而增强骨髓移入(即,通过减少所需要的细胞数量和缩短骨髓发育不全的持续期)的有用的治疗选择。特别地,所述前列环素类似物选自曲前列尼、伊洛前列素、西卡前列素或贝前列素或其药用盐的组。更特别地,曲前列尼是优选使用的前列环素类似物。在骨髓移植后用前列环素类似物连续治疗受试者数天应该通过提高移入(即,通过减少需要的细胞的数量和缩短骨髓发育不全的持续期)而导致改善的临床结果。因此,按照具体的实施方案,在移植后治疗进行至少五天,更特别地至少10天,更特别地在移植后至少14天。按照本发明的备选实施方案,涵盖包含一种或多于一种前列环素类似物和被刺激过的造血干细胞的组合物。备选地,在特定的实施方案中,可以向所述组合物中添加选自环AMP(cAMP)增强剂或前列腺素EP受体的配体的试剂。按照具体的实施方案,本发明的组合物还包含弗司扣林。特别地,本发明的组合物是药物组合物。本领域已知的其他药用赋形剂可以包含在所述组合物中。前列环素类似物的量取决于用于制备被刺激过的HSCs的治疗剂或方法。非常特别地,对于治疗应用,曲前列尼的有效量为至少1.0ng/kg体重。本发明的组合物可以通过本领域适用的和已知的任何模式施用给受试者。更特别地,提供静脉内或皮下施用。所述组合物可以是选自持续释放形式、片剂或胶囊的组的口服可用的形式。将参考下述实施例更充分地理解前述说明。然而,所述实施例仅代表实施一个或多个本发明的实施方案的方法,并不应该被视为是限制本发明的范围。实施例:实施例1材料和方法分离骨髓干细胞通过颈脱位法处死十只小鼠(C57BL/6)。后肢的长骨(即,股骨和胫骨)去除肌肉和结缔组织,并且使用注射器和针头用RPMI培养基冲洗。细胞混悬液去除可见的结缔组织,收集并且转移到离心管中。通过离心(1,200rpm/~100g,5min)收集细胞并且重悬在3mL红细胞裂解缓冲液(0.15MNH4Cl,10mMKHCO3,0.1mMEDTA,调节pH至7.2-7.4)中。将细胞混悬液在20℃温育2min,然后在冰上4min。然后,加入RPMI(10mL),通过离心收集细胞并且计数。典型的细胞产率为3*107/只小鼠。将细胞以2.5*108个细胞/mL的细胞密度重悬在含有2%FCS(胎牛血清)的冰冷的PBS(磷酸缓冲盐水),其中加入含有针对CD5、CD45R(B220)、CD11b、GR-1(=Ly-6G/C)、7-4和Ter-119的谱系-特异性抗体的生物素化抗体的混合物(MiltenyiBiotec的“谱系细胞消耗试剂盒”),比例为0.1mL抗体溶液/108个细胞。将细胞用所述抗体在冰上温育20min,并且通过离心沉淀。在重悬后(3.3*108个细胞/mL),向细胞混悬液中加入第二抗-生物素-包被的微珠(0.2mL/108个细胞,由MiltenyiBiotec的“谱系细胞消耗试剂盒”提供),并将混合物在冰上温育15min。然后,将样品稀释在MACS-缓冲液(30mL)中,通过离心收集细胞,并且重悬在6mLMACS-缓冲液中。将该混悬液上样在预填充的LS柱上,该柱包含用细胞相容性塑料材料包被的磁性铁珠。典型地,使用三个柱(2mL细胞混悬液/柱)。流过液包含谱系标记-阴性细胞(Lin-细胞),而谱系定型细胞保留在柱上。通过离心沉淀细胞并且重悬在mLPBS中。典型的产率为7*105个Lin-细胞/只小鼠。荧光-活化的细胞分选(FACS)分析用于染色细胞表面标记的抗体来自下述来源:小鼠谱系组抗体来自BectonDickinsonBiosciences(BD559971,含有生物素化形式的抗-CD3ε,抗-CD11b,抗-CD45R,抗-Ly-6G/Ly-6c,抗-Ter-119),亲和纯化的大鼠抗-小鼠CD16/CD32(小鼠FcγII/III封闭,BD553142)和荧光染料链霉抗生物素-别藻蓝蛋白-Cy7(链霉抗生物素APC-Cy7,BD554063)也来自BectonDickinsonBiosciences。藻红蛋白(PE)-Cy7-标记的抗小鼠Ly6A/E(=干细胞抗原-1=Sca1)PE-Cy7(商品目录号25-5981-82)和PE-Cy5抗小鼠CD117(c-Kit)(商品目录号15-1171-81)来自eBiosciences。在MACS后直接将1*106个谱系阳性(Lin+)和阴性(Lin-)细胞转移到FACS管中,并且在冰上保存在50μLPBS中。同时,稀释(1∶50)下述FACS抗体并且在PBS中混合:纯化的抗CD16/CD32(以封闭Fc-受体),生物素化的抗-CD3ε,生物素化的抗-CD11b,生物素化的抗-CD45R,生物素化的抗-Ly-6G/Ly-6C和生物素化的抗-Ter-119,链霉抗生物素-标记的APC-Cy7,PE-Cy7-标记的抗-Sca-1,PE-Cy5-标记的抗-c-kit。将该主混合物(50μL)添加到每份样品中,然后通过轻轻涡旋而混合,并且在暗处在4℃温育15min。然后,通过离心收集细胞,在2mLPBS中洗涤,并且重悬在PBS中。在FACSCantoII(BectonDickinson)中分析样品。门控程序如下:关于活细胞的门控通过记录正向和侧向散射设定。活细胞进一步基于谱系标记(即CD11b,CD45R,Ly-6G/Ly-6C,Ter-119)的表达而区分。这允许定义关于Lin-细胞的门控,进一步分析Lin-细胞的Sca-1和c-Kit表达。[3H]cAMP累积测定将Lin-/sca1+-细胞在1mL含有苄基青霉素和链霉素各0.5mg/L和鼠干细胞因子(mSCF)、人Flt-3各50ng/mL,hIL-1150ng/mL,m-IL3(10ng/mL)(均来自PreProTech)10μg/mL腺苷脱氨酶(Roche)和[3H]腺嘌呤(PerkinElmer,1μCi/mL)的干细胞培养基(StemSpanSFEM,StemCellTech#09650)中温育。预先温育在37℃持续4h。然后将细胞用化合物(弗司扣林、曲前列尼和其他类前列腺素;霍乱毒素)刺激1h。然后,沉淀细胞(以100g5min),去除培养基并且在冰冷的含有0.1mMcAMP的2.5%高氯酸(0.9mL)中裂解沉淀物,置于冰上1h,并且用4.2MKOH(0.1mL))中和。谱系标记-阳性细胞以相似的方式预先温育,不过培养基包含RMPI而非无血清干细胞培养基。通过在含有DowexAG50-X8和中性矾土的柱上的连续层析而分离ATP和cAMP(12)。仅可以在存在弗司扣林时观察到差异的事实是技术问题-在不存在弗司扣林敏化时信号太低以致于观察不到不同化合物(即伊洛前列素、贝前列素和曲前列尼)之间的差异。敏化意指由于这些细胞包含极低的cAMP,故将细胞针对受体反应敏化。按照关于曲前列尼的浓度-反应曲线(图5),可以清楚地显示:不添加弗司扣林时,cAMP的增加是显著的。骨髓移植:对同基因接受体小鼠进行致死性照射。如果不通过静脉内施用造血干细胞拯救,这些小鼠在前两周内死亡。如上述制备Lin-(Sca1+和c-Kit+)造血干细胞,并且在不存在和存在10μM曲前列尼,曲前列尼+30μM弗司扣林(FSK)的组合,10μg/mL霍乱毒素时在37℃离体预处理1h。然后,通过尾静脉注射细胞(3x105/只小鼠)。通过FACS确定白血细胞计数。在第9天开始每5天确定白血细胞计数(其中血细胞计数为~1G/L)。结果纯化造血干细胞基于MACS的方法将谱系标记-阳性(Lin+)细胞保留在磁珠上,并且允许谱系标记-阴性细胞(Lin-)回收:细胞群体的性质通过FACS表征。MACS-保留的细胞群体的确富含关于谱系特异性标记染色的细胞,并且缺少干细胞受体c-Kit/CD117(图1)。相比之下,从柱流过液回收的细胞主要存在于左上象限中,即,其显示高c-Kit水平并且没有APC-Cy7-A荧光,这指示耗尽谱系标记(图2)。细胞群体进一步通过关于c-Kit和Sca-1(干细胞抗原-1)二者的染色进行评估:谱系阳性细胞缺少这两种标记(图3A),而谱系阴性部分表达高水平的c-Kit或c-Kit和Sca-1的组合(图3B)。在c-Kit+和Sca1+细胞中的环AMP累积造血干细胞(c-Kit+和Sca-1+群体,参见图3B)的腺嘌呤核苷酸库用[3H]腺嘌呤代谢标记,并且检查其针对曲前列尼和其他前列腺素受体激动剂的反应。因为这些细胞具有非常适度的cAMP反应,该酶通过使用弗司扣林敏化。该二萜结合在腺苷酸环化酶的催化C1和C2结构与之间的假底物缝中,并且使得酶的各种同种型对刺激性G蛋白Gαs更有反应性(13-15)。如可以从图4看出,曲前列尼、贝前列素和伊洛前列素本身引起适度的cAMP累积,其在幅度上与通过30μM弗司扣林引发的幅度相当。然而,当与弗司扣林组合时,曲前列尼引起cAMP水平的增加,其超过由IP-(I类前列腺素)受体-特异性化合物伊洛前列素和贝前列素引起的增加。如果考虑曲前列尼对EP(E类前列腺素)-受体的作用(10),这可以得到合理解释。曲前列尼在0.1-10μM范围内引起cAMP的浓度-依赖性累积(图5)。估测的EC50在0.3μM范围内。在Lin+造血细胞部分中,曲前列尼没有增加cAMP水平(数据未显示)。通过(Lin-,c-Kit+,Sca1+)造血干细胞重构骨髓致死性照射的小鼠通过静脉内注射3*105Lin-,c-Kit+,Sca1+细胞而拯救。在第9天白血细胞计数从最低点开始增加,并且在接下来的几周内缓慢增加。选择在注射造血干细胞后第60天的白血细胞的水平作为相关终点,原因在于60天后,循环的白血细胞可能仅是由移入的造血干细胞产生的。从图6可以看出,与接受赋形剂-处理的造血干细胞的小鼠相比,已经注射了曲前列尼-预处理的造血干细胞的小鼠具有显著更高水平的循环的白血细胞(p<0.05,对于未配对的数据进行t-检验)。作为另外的对照,动物注射:(i)用霍乱毒素处理的细胞,原因在于这是最有效和持久的Gαs激活剂,(ii)弗司扣林,原因在于-如前文提及的-其直接激活腺苷酸环化酶同种型,(iii)弗司扣林与曲前列尼的组合。明显的是,曲前列尼如阳性对照霍乱毒素一样有效,后者是已经确立的有效离体操作(1,2)。实施例2分离骨髓干细胞处死C57BL/6和B6SJL小鼠,并且如实施例1所述分离骨髓干细胞。体外预处理分离的干细胞来自C57BL/6或C6SJL小鼠的骨髓干细胞在体外用霍乱毒素(CTX)或曲前列尼+弗司扣林(FSK)预处理,并且将干细胞用Ly5.2或Ly5.1标记。在第一次实验中,使用未经预处理的来自C57BL/6小鼠的骨髓干细胞,并且将干细胞用Ly5.2标记。来自C6JL的骨髓干细胞在体外用霍乱毒素或曲前列尼+弗司扣林预处理,并且将干细胞用Ly5.1标记。对于比较研究,通过骨髓移植引入Ly5.1+与Ly5.2+细胞的1∶1混合物,并且在开始时测量Ly5.2与Ly5.1阳性血细胞的比例。然后在骨髓移植后16周,测量血细胞生长物。结果显示在图7中,其中清楚地显示,与未处理的细胞和用CT预处理的细胞相比,曲前列尼/FSK预处理的细胞(Ly5.1+)显示显著增加的生长物。在第二次实验中,来自C57BL/6的骨髓干细胞在体外用霍乱毒素或曲前列尼+弗司扣林预处理,并且将干细胞用Ly5.2标记。使用未经任何预处理的来自C6JL小鼠的用Ly5.1标记的骨髓干细胞。同样地,对于比较研究,通过骨髓移植引入Ly5.1+与Ly5.2+细胞的1∶1混合物,并且在开始时测量Ly5.2与Ly5.1阳性血细胞的比例。然后在骨髓移植后16周,测量血细胞生长物。结果显示在图8中,其中同样清楚地显示,与未处理的细胞和用CT预处理的细胞相比,曲前列尼/FSK预处理的细胞(Ly5.2+)显示显著增加的生长物。因此,可以表明曲前列尼和弗司扣林的作用不依赖于骨髓细胞的来源。因此,曲前列尼与弗司扣林的组合增加造血干细胞的移入,并且与用霍乱毒素预处理一样有效或者甚至更有效。参考文献1.AdamsGB,AlleyIR,ChungUI,ChabnerKT,JeansonNT,LoCelsoC,MarstersES,ChenM,WeinsteinLS,LinCP,KronenbergHM,ScaddenDT(2009)HaematopoieticstemcellsdependonGαs-mediatedsignallingtoengraftbonemarrow(造血干细胞依赖于Gαs-介导的信号传导来移入骨髓).Nature(自然)459:103-107.2.DexterTM,WhettonAD,HeyworthCM(1985)Inhibitorsofcholeratoxin-inducedadenosinediphosphateribosylationofmembrane-associatedproteinsblockstemcelldifferentiation(霍乱毒素抑制剂-诱导的膜缔合蛋白的腺苷二磷酸核糖化阻断干细胞分化).Blood(血液)65:1544-1548.3.LongMW,HeffnerCH,GragowskiLL(1988)Choleratoxinandphorboldiesterssynergisticallymodulatemurinehematopoieticprogenitorcellproliferation(霍乱毒素和佛波醇二酯协同性调节鼠造血祖细胞增殖)ExpHematol.(实验血液学)16:195-200.4.FreissmuthM,GilmanAG(1989)MutationsofGsαdesignedtoalterthereactivityoftheproteinwithbacterialtoxins(设计Gsα突变来改变该蛋白与细菌毒素的反应性).SubstitutionsatARG187resultinlossofGTPaseactivity(在ARG187的取代导致GTP酶活性丧失).JBiolChem(生物化学杂志)264:21907-219145.AksentijevichI,FlinnI(2002)Chemotherapyandbonemarrowreserve:lessonslearnedfromautologousstemcelltransplantation(化疗和骨髓储量:由自体干细胞移植学到的教训).CancerBiotherRadiopharm(癌症生物疗法和放射性药理学)17:399-403.6.AwedanAA(2002)Highintensityregimenswithautologoushematopoieticstemcelltransplantationastreatmentofmultiplemyeloma(作为多发性骨髓瘤的治疗的使用自体造血干细胞移植的高强度方案).AnnTransplant(年度移植)7:38-43.7.NorthTE,GoesslingW,WalkleyCR,LengerkeC,KopaniKR,LordAM,WeberGJ,BowmanTV,JangIH,GrosserT,FitzgeraldGA,DaleyGQ,OrkinSH,ZonLI(2007)ProstaglandinE2regulatesvertebratehaematopoieticstemcellhomeostasis(前列腺素E2调节脊椎动物造血干细胞稳态).Nature(自然)447:1007-1011.8.HoggattJ,SinghP,SampathJ,PelusLM(2009)ProstaglandinE2enhanceshematopoieticstemcellhoming,survival,andproliferation(前列腺素E2增强造血干细胞的归巢、存活和增殖).Blood(血液)113:5444-5455.9.GoesslingW,NorthTE,LoewerS,LordAM,LeeS,Stoick-CooperCL,WeidingerG,PuderM,DaleyGQ,MoonRT,ZonLI(2009)GeneticinteractionofPGE2andWntsignalingregulatesdevelopmentalspecificationofstemcellsandregeneration(PGE2与Wnt信号传导的遗传相互作用调节干细胞的发育特化和再生).Cell(细胞)136:1136-1147.10.AronoffDM,PeresCM,SerezaniCH,BallingerMN,CarstensJK,ColemanN,MooreBB,PeeblesRS,FaccioliLH,Peters-GoldenM(2007)Syntheticprostacyclinanalogsdifferentiallyregulatemacrophagefunctionviadistinctanalog-receptorbindingspecificities(合成的前列环素类似物通过不同的类似物-受体结合特异性差异性调节巨噬细胞功能).JImmunol(免疫学杂志)178:1628-1634.11.KiriyamaM,UshikubiF,KobayashiT,HirataM,SugimotoY,andNarumiyaS(1997)LigandbindingspecificitiesoftheeighttypesandsubtypesofthemouseprostanoidreceptorsexpressedinChinesehamsterovarycells(在中国仓鼠卵巢细胞中表达的八种类型和亚型的小鼠类前列腺素受体的配体结合特异性).BrJPharmacol(英国药理学杂志)122:217-22412.JohnsonRA,Alvarez,R,Salomon,Y.(1994)Determinationofadenylylcyclasecatalyticactivityusingsingleanddoublechromatographicprocedures(使用单和双重层析步骤确定腺苷酸环化酶活性).MethodsinEnzymology(酶学方法)238:31-5613.TesmerJJ,SunaharaRK,GilmanAG,SprangSR(1997)CrystalstructureofthecatalyticdomainsofadenylylcyclaseinacomplexwithGsα.GTPγS(与Gsα复合的腺苷酸环化酶GTPγS的催化结构域的晶体结构).Science(科学)278:1907-1916.14.SunaharaRK,DessauerCW,GilmanAG(1996)Complexityanddiversityofmammalianadenylylcyclases(哺乳动物腺苷酸环化酶的复杂性和多样性).AnnuRevPharmacolToxicol(药理学毒性学年度综述)36:461-480.15.KudlacekO,MitterauerT,NanoffC,HoheneggerM,TangWJ,FreissmuthM,KleussC(2001)Inhibitionofadenylylandguanylylcyclaseisoformsbytheantiviraldrugfoscarnet(通过抗病毒药物膦甲酸抑制腺苷酸环化酶和鸟苷酸环化酶同种型).JBiolChem(生物化学杂志)276:3010-301616.OtsukaH.etal.,Theprostacyclinanalogberaprostsodiumaugmentstheefficacyoftherapeuticangiogenesisinducedbyautologousbonemarrowcells(前列环素类似物贝前列素钠增强自体骨髓细胞诱导的治疗性血管生成的功效),A...Vasc.Surg,2006,20:646-65217.MadonnaR.,“Prostacyclinimprovestranscoronarymyocardialdeliveryofadiposetissue-derivedstromalcells(前列环素改善脂肪组织来源的基质细胞的透冠状心肌递送)”,Europ.HeartJourn.(欧洲心脏杂志),2006,Vol.27,No.17,2054-206118.IshiiM.etal.,“Mesenchymalstemcell-basedgenetherapywithprostacyclinsynthaseenhancedneovascularisationinhindlimbischemia(使用前列环素合酶的基于间质干细胞的基因治疗增强后肢缺血中的新血管生成)”,2009,Vol.206,No.1,109-11819.CrutchleyD.J.etal.,,,Effectsofprostacyclinanalogsonthesynthesisoftissuefactor,tumornecrosisfactor-alphaandinterleukin-1βinhumanmonocyticTHP-1cells(前列环素类似物对人单核细胞THP-1细胞中的组织因子、肿瘤坏死因子-α和白介素-1β合成的作用)”,J..Pharma.andExp.Therap(药理学和实验治疗学杂志),1994,Vol.271,No.1,446-451.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1