Wip1抑制剂在制备治疗肝再生不足疾病药物中的应用的制造方法与工艺
本发明属生物医学类技术领域,涉及Wip1抑制剂CCT007093在制备治疗肝再生不足疾病药物中的应用。
背景技术:
肝脏是人体中具有最强再生能力的组织器官,然而在许多急慢性肝病中,仍然会出现肝细胞再生抑制导致再生不足,严重影响健康甚至生命。如肥胖相关的非酒精性脂肪肝再生能力受到损害,更易受到酒精及病毒的作用而出现肝硬化,原位移植物为脂肪肝时,由于肝再生受到抑制,移植病人存活率降低;再生障碍性和爆发性肝衰竭病人由于缺乏有效的肝再生而导致死亡;肝细胞增殖能力下降导致酒精性肝炎病人死亡率上升;肝再生抑制是老龄化人群肝脏的典型表征,由此导致的>65岁人群肝病死亡率占人群死亡率比例是<45岁人群的4-5倍。此外,肝硬化肝癌更是对人类健康产生严重威胁的致死性疾病,在我国仅因慢性肝炎导致肝硬化致死的病人每年就有28万,肝脏移植为晚期肝硬化和肝癌唯一的治疗手段,对肝脏同种异体移植物需求的增长速度远远大于实际的供体数,致使等待肝移植的人数增加,肝脏先天具备再生能力使得将小体积移植物应用于肝脏移植。然而临床经验显示,移植时严重失代偿的受体往往在围手术期死亡率明显升高,这种病人的不良结果提示,其中一些过程是抑制再生造成的。因此,寻找有效的促进肝再生药物成为以上临床急慢性肝脏病人的需要。肝脏再生调控是一个复杂的多分子参与过程,为了阐明这种复杂过程的调节机制,科研人员最常用的模型为小鼠三分之二肝切除术及小鼠肝脏毒性损伤。作为唯一能够观察哺乳动物体内细胞进程的模型,小鼠三分之二肝脏切除术被研究人员认为是最为实用的再生模型,在肝再生研究中使用也最为广泛。综合肝再生机制研究发现肝脏的再生主要由三大部分调节网络构成,即细胞因子调控网络,生长因子调控网络和代谢调控网络。TNFα、IL-6等细胞因子第一时间参与肝脏再生的启动调控;肝素结合性表皮生长因子(heparin-bindingEGF-likegrowthfactor),双调蛋白(amphiregulin)等生长因子紧随其后促进肝脏再生的进行,mTOR-PS6K信号通路主导了代谢通路调控。Wip1(Wild-typep53-inducedphosphatase)是一种核蛋白,为丝氨酸/苏氨酸特异蛋白磷酸酶2C型家族中的一员,由PPM1D(proteinphosphatasemagnesium-dependent1delta)基因编码。作为一个磷酸酶,Wip1基因于1997年被发现,它的发现及命名都依赖于大名鼎鼎的原癌基因P53,这和它的功能--抑制P53蛋白的磷酸化相关。随后Wip1大量下游蛋白相继发现,如P38,ARF,ATR,CHK1,ATM,CHK2,MDM2,UNG2,NFκB,γH2X。在许多人类癌症,如乳腺癌、卵巢透明细胞腺癌、成神经细胞瘤、髓母细胞瘤、胃癌、胰腺癌中均检测到Wip1DNA和RNA的过表达,而敲除PPM1D基因的小鼠能够抵抗乳腺癌的发生,提示Wip1基因是一个致癌基因。Wip1在生理病理中的作用越来越受到科研人员的关注。近年来人们在小鼠中研究发现敲除Wip1基因可通过ATM-mTOR信号通路影响细胞自嗜功能有效抑制动脉粥样硬化的形成,在其癌症功能领域研究亦发现其可调控DNA甲基化参与癌症生成的调节。鉴于Wip1敲除小鼠可正常出生并发育,科研工作者将Wip1作为癌症和动脉粥样硬化的药物靶点。但在肝脏组织中,Wip1的作用尚不知晓。Wip1抑制剂CCT007093为小分子化合物,CASnumber176957-55-4,分子量272.38518,化学命名为2,5-bis-(2-Thienylidene)cyclopentanone,,分子式为C15H12OS2,化学结构如下:2008年在对高表达Wip1肿瘤细胞的小分子化合物筛选中被发现,其可特异性杀死高表达Wip1蛋白的肿瘤细胞如乳腺癌细胞,卵巢透明细胞癌细胞。但其在体内是否具有Wip1磷酸酶抑制效果尚未有文献报道。在本项专利中,我们首次发现CCT007093在肝再生相关疾病中的应用。具体的,本专利发现CCT007093在体内可发挥抑制Wip1去磷酸化的作用,加速肝脏再生,降低大部分切肝术后死亡率,同时并未引起再生肝脏组织及再生肝脏中炎症细胞的改变。本项专利亦揭示了其用于肝再生相关疾病的作用机制。CCT007093在肝脏再生过程中抑制Wip1蛋白的去磷酸化作用,Wip1以mTOR为靶蛋白抑制肝脏损伤后再生。本项专利亦首次揭示mTOR为Wip1的靶蛋白。
技术实现要素:
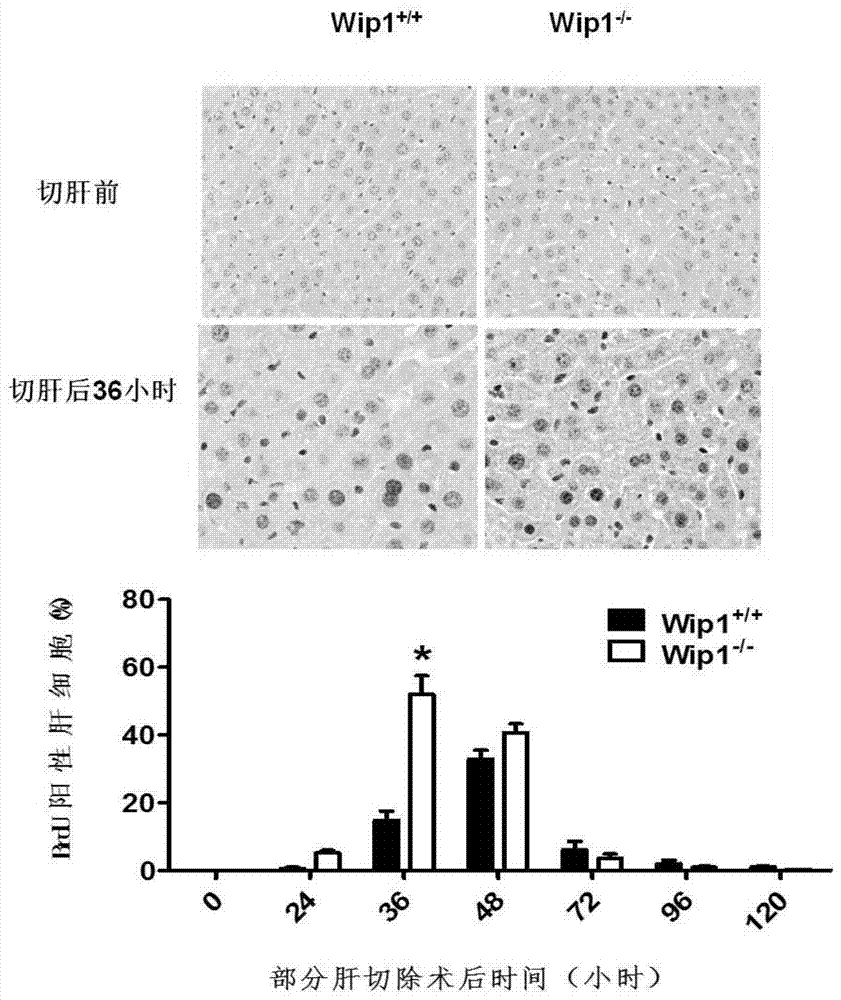
本发明的目的是针对上述问题,提出了Wip1抑制剂CCT007093在制备治疗肝再生不足疾病药物中的应用。本发明以70﹪切肝术建立小鼠肝再生模型,小鼠肝脏可在11天恢复切肝前比重,符合肝再生表现,造模成功。我们发现抑制Wip1基因表达可促进肝脏组织再生。抑制Wip1基因表达激活了mTOR-PS6K-PS6信号通路,促进细胞增殖。进一步实验表明Wip1蛋白可直接去磷酸化mTOR。本发明首次揭示mTOR为Wip1磷酸酶靶点。同时我们发现在体内给予Wip1抑制剂CCT007093可起相同的实验效果,并且CCT007093可提高大部分切肝术后小鼠的生存率。以上实验结果揭示了CCT007093在促进肝脏再生中的作用及机理。CCT007093的有效用量为3.2mg/kg,药物配成溶剂,以腹腔注射方式给药。该剂量可促进小鼠70﹪肝切除术后肝再生并显著提高80﹪肝切除术后小鼠存活率。本发明的有益效果是CCT007093能够促进肝脏组织再生,在肝脏组织大部分丢失时降低死亡率。CCT007093可促进肝脏细胞增殖,增加再生肝脏比重。CCT007093通过直接激活mTOR信号通路促进细胞增殖。本发明揭露了CCT007093可用于制备治疗肝脏再生不足相关疾病的药物,以及CCT007093用于促进肝脏再生的作用机制。附图说明图1为Wip1基因敲除可增加再生肝脏比重;图2为Wip1基因敲除可增加BRDU标记再生肝细胞数目;图3为Wip1基因敲除可增加再生肝脏细胞有丝分裂指数;图4为Wip1基因敲除可增加再生肝脏中增殖细胞核蛋白抗原(ProliferatingCellNuclearAntigen,PCNA)表达水平;图5为Wip1基因敲除可增加再生肝脏中细胞周期蛋白cyclinD蛋白表达水平;图6为Wip1基因敲除激活再生肝脏中蛋白合成通路和脂肪酸调控通路;图7为Wip1基因敲除激活再生肝脏中mTOR-P70S6K信号通路;图8为mTOR抑制剂雷帕霉素(rapamycin;Rapa)可逆转Wip1基因敲除小鼠中再生肝脏比重增加表型;图9为mTOR抑制剂雷帕霉素可逆转Wip1基因敲除小鼠再生肝脏中PCNA表达增高表型;图10为饥饿后给胰岛素刺激可激活HT293细胞内mTOR蛋白活性(磷酸化mTOR表达升高);图11为在激活mTOR蛋白的细胞内转染Wip1cDNA可降低细胞内mTOR信号通路活性(磷酸化mTOR及其下游磷酸化PS6蛋白的表达)图12为Wip1和mTOR蛋白可直接相互结合,Wip1和PS6K蛋白不存在相互结合;图13为体外磷酸酶实验证实Wip1去磷酸化mTORSer2448,Ser2481两个位点,且该去磷酸化作用可被Wip1抑制剂CCT007093抑制;图14为CCT007093在小鼠体内抑制Wip1去磷酸化作用剂量实验设计图;图15为以磷酸化p53蛋白的表达为检测指标,检测三种实验设计摸索CCT007093在小鼠体内腹腔注射抑制Wip1蛋白磷酸化实验;图16为CCT007093在小鼠体内可激活mTOR信号通路(Ser2448,Ser2481,Ser2159三个mTOR磷酸化位点及下游蛋白磷酸化P70S6K(T389),磷酸化S6(Ser235/236)蛋白的表达);图17为CCT007093在293T细胞系激活mTOR信号通路剂量效应关系;对照组(DMSO),25μMCCT组,50μMCCT组,随着CCT剂量的增加,mTOR信号通路(Ser2448,Ser2481,Ser2159三个mTOR磷酸化位点及下游蛋白磷酸化P70S6K(T389),磷酸化S6(Ser235/236)蛋白的表达)越来越高;图18为CCT007093可提高再生肝脏比重;图19为CCT007093可增加再生肝脏中PCNA表达水平;图20为CCT007093可提高大部分切肝术后小鼠的存活率;图21为大部分切肝术后小鼠的存活率与肝比重存在相关性;图22为腹腔注射CCT007093并未引发小鼠白细胞亚群(中性粒细胞,淋巴细胞,单核细胞)的绝对数目改变;图23为腹腔注射CCT007093并未引发小鼠白细胞亚群(中性粒细胞,淋巴细胞,单核细胞)的比例改变;图24为腹腔注射CCT007093并未引发小鼠大部分切肝术后肝组织结构的病理改变;图25为腹腔注射CCT007093并未引发小鼠大部分切肝术后肝组织细胞凋亡。具体实施方式下面结合实施例和附图对本发明作进一步的说明,而非限定本发明。本发明使用的Wip1敲除(Wip1-/-)小鼠为LawrenceA.Donehower教授赠送,p21和p53敲除小鼠来自KarlLenhardRudolph教授实验室。Wip1敲除小鼠分别与p21,p53敲除小鼠交配产生Wip1/p21,Wip1/p53双基因敲除小鼠。清洁级C57BL/6小鼠购自JacksonLab,饲养于杭州师范大学实验动物中心清洁级动物房,实验时小鼠为6-8周龄。在整个体内实验过程中,所有操作均遵守国家及杭州师范大学伦理委员会制定的《实验动物使用条例》。雷帕霉素购自美国LCLaboratories;二甲基亚砜(Dimethylsulfoxide,DMSO),5-溴脱氧尿嘧啶核苷(5-Bromo-2-deoxyUridine,BRDU),CCT007093,BRDU抗体,β-肌动蛋白(β-actin)抗体等从美国Sigma-Aldrich公司购买;HT293细胞细胞株由杭州师范大学衰老研究所干细胞实验室常规保存;质粒pCMV6-AC-GFP-PPM1D购自美国Origene公司。本发明中所使用的所有抗体,除特别说明,均购自美国CellSignalingTechnology公司。所有实验结果均是由独立的三次重复实验得到,采用不配对的t检验分析数据,均用士SEM表示。P值<0.05为显著性差异标准(*<0.05,**<0.01)。实施例一:Wip1基因敲除可促进小鼠肝脏再生对Wip1基因敲除和同窝对照野生型小鼠实施70﹪肝切除手术,检测并分析比较手术后不同时间点肝比重、增殖细胞数量、增殖细胞核抗原(PCNA)表达及细胞周期蛋白CyclinD的表达,分析Wip1对肝再生的作用。结果表明,Wip1-/-小鼠肝切除术后肝比重,肝脏增殖细胞,细胞增殖相关蛋白较Wip1+/+组显著增加。Wip1-/-组小鼠术后肝重占原肝重比值显著高于Wip1+/+组(每个时间点n≥12)(图1)。免疫组化显示术后Wip1-/-和Wip1+/+组BrdU阳性细胞,Wip-/-组小鼠术后BrdU阳性细胞数占细胞总数比值在36h显著高于Wip1+/+组(图2)。HE染色显示术后有丝分裂细胞,Wip1-/-组小鼠术后有丝分裂细胞数占细胞总数比值在36h,48h显著高于Wip1+/+组(图3)。Westernblot图显示肝切除术后各时间点PCNA,CyclinD蛋白表达,Wip1-/-组小鼠PCNA蛋白表达量在24h,48h显著高于Wip1+/+组(图4)。Wip-/-组小鼠CyclinD蛋白表达量在36h,48h,72h显著高于Wip1+/+组(图5)。以上结果表明Wip1缺失可通过增加进入增殖周期细胞数量加速肝组织再生。实施例二:mTOR信号通路是Wip1促进肝再生的靶点1.部分切肝术后肝再生过程中,mTOR信号通路在Wip1-/-组小鼠中高表达。为进一步探讨Wip1基因缺失促进肝脏再生的分子机制,我们对Wip-/-组和Wip1+/+组小鼠70﹪肝脏切除术后24和36小时的再生肝组织进行基因芯片分析,对差异蛋白高表达进行信号通路分析,结果表明Wip-/-组小鼠蛋白和脂肪酸代谢信号通路显著高于Wip1+/+组(图6)。根据文献(1.Espeillac,C.,etal.,S6kinase1isrequiredforrapamycin-sensitiveliverproliferationaftermousehepatectomy.JClinInvest,2011.121(7):p.2821-32.2.Goggin,M.M.,etal.,Rapamycin-sensitiveinductionofeukaryoticinitiationfactor4Finregeneratingmouseliver.Hepatology,2004.40(3):p.537-44.)报道,部分切肝术后mTOR信号通路为调控代谢的主要通路。我们对部分肝脏切除术后Wip1-/-和Wip1+/+组小鼠再生肝组织进行中的mTOR信号通路蛋白进行westernblot分析发现,磷酸化mTOR及其下游蛋白磷酸化p70S6K蛋白表达在Wip1-/-组显著高于Wip1+/+组,表明在肝再生过程中mTOR信号通路在Wip-/-组显著活跃于Wip1+/+组(图7)。2.mTOR抑制剂雷帕霉素(rapamycin)可逆转Wip1-/-组小鼠在部分肝脏切除术后肝再生加速表型在部分切肝术前2小时开始对Wip1-/-组小鼠腹腔注射雷帕霉素2.5mg/kg/d,部分肝切除术后36小时牺牲小鼠,取出再生肝组织,称重,结果发现,雷帕霉素注射后Wip1-/-组和Wip1+/+组小鼠再生肝重比体重较注射前均显著下降,且两组小鼠下降至同一水平(图8)。对再生肝组织进行Westernblot检测,发现雷帕霉素注射后PCNA蛋白在Wip1-/-组和Wip1+/+组表达均显著下调,且下调后的PCNA蛋白表达在Wip1-/-组和Wip1+/+组无显著差异(图9)。以上结果提示Wip1-/-组小鼠部分肝切除术后再生加速依赖于mTOR信号通路。3.Wip1蛋白可与mTOR蛋白特异性结合并直接去磷酸化mTOR蛋白。对HT293细胞进行无血清培养16小时,随后加入10﹪血清和100nM胰岛素37℃培养10分钟,可检测到磷酸化mTOR蛋白(ser2448,ser2481)高表达(图10)。在该细胞中过表达Wip1cDNA可显著降低磷酸化mTOR及其下游蛋白磷酸化S6(Ser235/236)表达水平(图11)。Wip1蛋白分别和mTOR蛋白、p70S6K蛋白进行免疫共沉淀,发现Wip1蛋白可直接结合mTOR蛋白并不与p70S6K蛋白进行直接结合(图12)。为进一步确认Wip1蛋白是否可以直接去磷酸化mTOR蛋白,我们进行了体外磷酸酶实验,具体如下,裂解过表达mTOR蛋白的细胞,使用mTOR蛋白抗体和免疫磁珠纯化磷酸化mTOR蛋白,加入过表达Wip1cDNA细胞的裂解液,进行Westernblot分析,发现磷酸化mTOR蛋白表达显著下降。加入Wip1抑制剂CCT007093后该抑制作用可被逆转(图13)。以上结果提示Wip1蛋白可直接去磷酸化mTOR蛋白。实施例三:Wip1抑制剂CCT007093可促进肝再生,并显著改善大部分切肝术后小鼠的生存率1.CCT007093可在体内发挥Wip1抑制剂效果CCT007093在DMSO中稀释为2.5mg/ml,分不同剂量和次数对进行70﹪切肝术的野生型C57小鼠进行腹腔注射(图14),收集术后36小时再生肝脏组织,Westernblot分析Wip1经典下游蛋白磷酸化p53的表达检测CCT007093抑制效果,结果发现CCT007093在使用3.2mg/kg的注射剂量,四次注射的情况下可达到对Wip1的最佳抑制效果(图15)。2.CCT007093可激活mTOR信号通路对野生型小鼠四次注射3.2mg/kg的CCT007093,并进行70﹪切肝术,收集术后36小时再生肝组织,Westernblot检测mTOR信号通路蛋白表达水平,发现CCT007093可显著升高磷酸化mTOR(ser2448,ser2481,ser2159)及其下游蛋白磷酸化p70S6K(T389),磷酸化S6(Ser235/236)的表达(图16)。在HT293细胞中通过血清饥饿实验激活mTOR信号通路,随后分别加入25μM和50μMCCT007093,结果发现磷酸化mTOR(ser2448,ser2481,ser2159)及其下游蛋白磷酸化p70S6K(T389),磷酸化S6(Ser235/236)的表达水平随着CCT007093剂量的升高而升高。该实验结果提示CCT007093的加入与mTOR信号通路的表达存在剂量效应关系(图17)。3.CCT007093可加速70﹪切肝术后小鼠肝组织再生对野生型小鼠四次注射3.2mg/kg的CCT007093,并进行70﹪切肝术,术后36小时牺牲小鼠,取出再生肝组织,称重,结果发现,CCT007093注射后小鼠再生肝重比体重较注射前均显著升高(图18)。对再生肝组织进行Westernblot检测,发现CCT007093注射后PCNA蛋白表达显著升高(图19)。以上结果提示CCT007093注射可加速小鼠部分肝切除术后再生。4.CCT007093可降低大部分切肝术后小鼠的死亡率对野生型小鼠进行80﹪切肝术,并在术前12小时注射3.2mg/kg的CCT00709312小时每次,记录CCT007093组及对照组小鼠死亡时间,统计发现,CCT007093可显著延长80﹪切肝术后小鼠存活时间(图20),并且小鼠存活时间延长与小鼠肝重之间存在相关性(图21)。以上结果提示CCT007093可通过加速大部分切肝术后小鼠肝组织再生改善小鼠术后生存率。实施例四:Wip1抑制剂CCT007093腹腔注射并未在体内引起免疫细胞改变,破坏肝组织结构或引起细胞凋亡等不良反应CCT007093组及对照组小鼠取血,抗凝,全自动血细胞计数仪进行血细胞计数分析小鼠体内白细胞,发现白细胞中中性粒细胞,单核细胞,嗜酸性粒细胞的绝对数目(图22)和比例(图23)均无改变。对大部分切肝术24,48小时后小鼠的肝组织进行固定,包埋,石蜡切片,HE染色发现,CCT007093组小鼠肝组织结构正常(图24)。对大部分切肝术24小时后小鼠的肝组织进行固定,包埋,石蜡切片,TUNEL染色分析细胞凋亡情况发现CCT007093组小鼠肝组织细胞并未出现细胞凋亡及坏死(图25)。上述实施例并非是对于本发明的限制,本发明并非仅限于上述实施例,只要符合本发明要求,均属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1