治疗三阴性乳腺癌的单克隆抗体的制作方法
本发明涉及抗体应用领域,具体地,涉及用于治疗三阴性乳腺癌的单克隆抗体及其在乳腺癌治疗方面的应用。
背景技术:
人类乳腺癌在临床上大致分为四种亚型。三种亚型(Luminal A,Luminal B,Her2阳性)的乳腺癌已知是由乳腺管腔细胞病变形成,并知道它们特异的细胞表面分子标志物分别为雌激素受体(Estrogen Receptor),孕酮受体(Progesterone Receptor)和EGF受体(EGF Receptor,Her2)。对于这三种乳腺癌,现在临床上已有一些针对性的治疗靶点药物。
上述三种受体都不表达的乳腺癌,在临床上被诊断为三阴性乳腺癌。对于三阴性乳腺癌,由于没有特异性的细胞表面分子标志,无法进行针对性地药物研发。目前在临床上用于三阴性乳腺癌的一线治疗药物为广普性的细胞毒化疗药物,仍缺乏有效的靶向治疗方法。现状是三阴性乳腺癌预后差,3-5年复发率及转移率为所有乳腺癌亚型中最高。
综上所述,寻找新的具有诊断或联合诊断价值的三阴性乳腺癌标志物,并针对性地进行靶向药物的研发是当务之急。因此,本领域迫切需要开发可用于治疗三阴性乳腺癌的药物。
技术实现要素:
本发明的目的就是提供了可治疗三阴性乳腺癌的单克隆抗体及其在治疗三阴性乳腺癌方面的应用。
本发明第一方面提供了一种单克隆抗体的用途,所述单克隆抗体用于制备治疗三阴性乳腺癌的药物组合物;
其中,所述的单克隆抗体具有选自下组的一个或多个特性:
(a)所述单克隆抗体特异性地抑制蛋白C与蛋白C受体(PROCR)的结合;
(b)所述单克隆抗体结合于蛋白C受体,且结合区域为蛋白C受体(PROCR)上与蛋白C发生结合的区域;
(c)所述单克隆抗体为(i)单克隆抗体RCR-252、或(ii)所述RCR-252竞争性抗体。
在另一优选例中,所述的“RCR-252的竞争性抗体”指具有选自下组的至少一个特征的单克隆抗体:
(1)所述竞争性抗体与RCR-252抗体结合于相同或相似的结合区域;
(2)所述竞争性抗体与RCR-252抗体结合于相同或相似的PROCR表位;
(3)所述竞争性抗体与RCR-252抗体存在与蛋白C受体结合的竞争关系(即竞争性抗体结合于蛋白C受体时,导致RCR-252抗体与蛋白C受体的结合受阻或下降;反之亦然);
(4)所述竞争性抗体与RCR-252抗体存在与蛋白C受体结合的位阻效应(即竞争性抗体结合于蛋白C受体时,导致RCR-252抗体与蛋白C受体的结合存在位阻效应;反之亦然)。
在另一优选例中,所述的RCR-252的竞争性抗体与蛋白C受体的亲和力F1与单克隆抗体RCR-252与蛋白C受体的亲和力F2相近或相当(即F1/F2的比值为0.1-10,较佳地为0.5-2)。
在另一优选例中,所述的RCR-252的竞争性抗体结合于蛋白C受体的区域R1,和单克隆抗体RCR-252结合于蛋白C受体的区域R2,两者在位置上是相同的,或相邻且存在位阻的。
在另一优选例中,所述药物组合物含有所述的单克隆抗体和药学上可接受的载体。
在另一优选例中,所述的药物组合物为液态制剂。
在另一优选例中,所述的药物组合物为注射剂、冻干制剂。
在另一优选例中,所述药物组合物中单克隆抗体的浓度为0.1-10mg/ml,较佳地0.5-5mg/ml。
在另一优选例中,所述单克隆抗体的施用剂量为0.1-20mg/kg,较佳地为0.5-10mg/kg体重,更佳地为1-8mg/kg体重。
在另一优选例中,所述的药物组合物还含有作为PROCR抑制剂的反义核酸。
在另一优选例中,所述的单克隆抗体为单克隆抗体RCR-252。
本发明第二方面提供了一种药物组合物,所述药物组合物含有(a)单克隆抗 体,所述单克隆抗体选自下组:(i)单克隆抗体RCR-252、或(ii)所述RCR-252竞争性抗体;(b)抑制PROCR表达的反义核酸;和(c)药学上可接受的载体。
本发明第三方面提供了一种单克隆抗体RCR-252或具有与单克隆抗体RCR-252相同功能的同类抗体的用途,用于制备治疗乳腺癌的药物组合物。
在另一优选例中,所述的乳腺癌为三阴性乳腺癌。
本发明第四方面提供了一种单克隆抗体,所述单克隆抗体是RCR-252的竞争性抗体并且所述单克隆抗体不是单克隆抗体RCR-252。
本发明第五方面提供了一种确定三阴性乳腺癌潜在治疗剂的方法,所述方法包括步骤:
(a)提供一测试物;
(b)测定所述测试物是否具有选自下组的一个或多个特性:
(i)能够结合于蛋白C受体;
(ii)能够干扰或抑制蛋白C受体与蛋白C之间的结合;
(iii)所述测试物是单克隆抗体RCR-252的竞争性抗体;
(iv)能够抑制或干扰单克隆抗体RCR-252与蛋白C受体之间的结合;
(v)能够促进单克隆抗体RCR-252与蛋白C受体之间的结合;和
(c)将对于经步骤(b)测试,具有所述一个或多个特性的测试物,作为三阴性乳腺癌潜在治疗剂。
在另一优选例中,所述方法还包括步骤(d),对所述的乳腺癌潜在治疗剂进一步测试其对三阴性乳腺癌细胞的抑制作用。
在另一优选例中,步骤(d)中的测试为体外细胞测试。
在另一优选例中,步骤(b)中的测定包括:抗体竞争性测定、竞争性抗体与PROCR结合后对PROCR与其配体蛋白C结合抑制程度的测定。
在另一优选例中,所述的测试物选自下组:抗体、化合物、多肽、核酸。
在另一优选例中,所述的蛋白C为活化的蛋白C(activated protein C,APC)。
在另一优选例中,所述的测试物抑制蛋白C受体(PROCR)蛋白与蛋白C的结合。
在另一优选例中,所述测试物为抗体,并且步骤(d)中包括测定所述抗体是否能够抑制三阴性乳腺癌细胞的生长(包括体外细胞实验、或动物实验)。
在另一优选例中,所述的方法是非诊断性和非治疗性的。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施 例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1显示了中和抗体(单克隆抗体RCR-252)对三阴性乳腺癌细胞形态方面的影响。
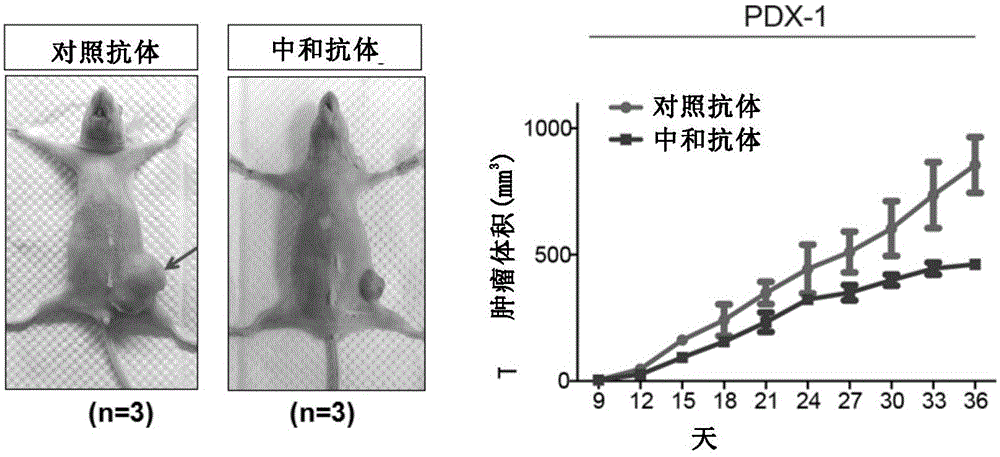
图2显示了注射中和抗体(单克隆抗体RCR-252)对病人来源的三阴性乳腺癌(PDX)细胞体内成瘤的抑制效果。
图3显示了对照抗体和中和抗体(单克隆抗体RCR-252)结合PROCR蛋白能力的比较结果(Western blot方法)。
图4显示了对照抗体和中和抗体(单克隆抗体RCR-252)对PROCR蛋白与其配体蛋白C(Protein C)之间抑制效果的比较。
图5显示了敲低PROCR对病人来源的三阴性乳腺癌(PDX)细胞成瘤能力的影响。
图6显示了对照抗体和中和抗体(单克隆抗体RCR-252)结合PROCR蛋白能力的比较结果(免疫组织化学方法)。
具体实施方式
本发明人经过广泛而深入的研究,首次意外地发现,PROCR在三阴性乳腺癌组织特异性高表达,因此可用作三阴性乳腺癌标志物,尤其是作为三阴性乳腺癌进一步分型的标志物。实验结果显示,PROCR的表达与(a)乳腺癌病人的存活率低、(b)增强肿瘤干细胞的特性以及(c)在肿瘤模型中的高转移能力存在密切的相关性。因此,PROCR可以作为检测三阴性乳腺癌或进一步分型的极其有用的标志物。本发明的实验还进一步证明:抑制PROCR其活性可以有效地遏制三阴性乳腺癌细胞生长及转移,因此该分型标志物是一种极有价值的三阴性乳腺癌的治疗靶点。
在此基础上,本发明人还开发了一种对三阴性乳腺癌具有显著治疗效果的单克隆抗体。本发明的这类治疗性单克隆抗体包括单克隆抗体RCR-252或其同类抗体(如竞争性抗体)。与一般的单克隆抗体不同,本发明的这类治疗性单克隆抗体(也称为“中和抗体”)可极其有效地抑制三阴性乳腺癌细胞的生长,因而在临床上可作为三阴性乳腺癌的治疗剂。在此基础上,本发明人完成了本发明。
术语
如本文所用,术语“三阴性乳腺癌(Triple Negative Breast Cancer,TNBC)”指雌激素受体阴性(ER-),孕酮受体阴性(PR-)和Her2阴性(Her2—)的乳腺癌。
“本发明的治疗性单克隆抗体”、“本发明的中和抗体”、或“本发明抗体”可互换使用,指出单克隆抗体RCR-252或其竞争性抗体。本发明的实验表明,本发明的中和抗体能够极其有效地抑制三阴性乳腺癌细胞的生长。此外,本发明的中和抗体能够有效结合于PROCR(蛋白C受体)中与蛋白C相互作用的区段,从而抑制PROCR与蛋白C(Protein C)结合。
样品
本文中使用的术语“样品”或“样本”是指与受试者特异地相关联的材料,从其中可以确定、计算或推断出与受试者有关的特定信息。样品可以全部或部分由来自受试者的生物材料构成。样品也可以是以某种方式与受试者接触过的材料,这种接触方式使得对样品进行的测试可以提供与受试者有关的信息。样品也可以是已经与其它材料接触过的材料,这种其它材料不是受试者的,但是能够使第一材料随后被测试以确定与受试者有关的信息,例如样品可以是探针或解剖刀的清洗液。样品可以为接触受试者之外的生物材料源,只要本技术领域的专业人员仍然能够从样品确定与受试者有关的信息就行。
表达
如本文所用,术语“表达”包括mRNA从基因或基因部分的产生,并且包括由RNA或基因或基因部分所编码的蛋白质的产生,还包括与表达相关的检测物质的出现。例如,cDNA,结合配体(如抗体)与基因或其它寡核苷酸、蛋白质或蛋白质片段的结合以及结合配体的显色部分都包括在术语“表达”的范围内。因此,在免疫印迹如western印迹上半点密度的增加也处于以生物学分子为基础的术语“表达”的范围内。
参比值
如本文所用,术语“参比值”是指当与分析结果相比时与特定结果统计学相关的值。在优选的实施方案中,参比值是根据对比较PROCR蛋白的表达与已知的临床结果的研究进行的统计学分析来确定的。在本文的实施例部分中显示了一些这样的研究。但是,来自文献的研究和本文公开的方法的用户经验也可用于生产或调整参比值。参比值也可以通过考虑与患者的医疗史、遗传学、年 龄和其它因素特别相关的情况和结果来确定。
非乳腺癌样品
如本文所用,术语“非乳腺癌样品”包括但不限于未患有乳腺癌的人群,乳腺癌患者的非乳腺癌组织。
PROCR蛋白和多核苷酸
在本发明中,术语“本发明蛋白”、“PROCR蛋白”、“PROCR多肽”或“蛋白C受体”可互换使用,都指具有蛋白C受体氨基酸序列的蛋白或多肽。它们包括含有或不含起始甲硫氨酸的PROCR蛋白。此外,该术语还包括全长的PROCR及其片段。本发明所指的PROCR蛋白包括其完整的氨基酸序列、其分泌蛋白、其突变体以及其功能上活性的片段。
PROCR蛋白是一种针对活化的蛋白C的受体,而蛋白C是一种在凝血途径中被激活的丝氨酸蛋白酶。
单克隆抗体RCR-252
如本文所用,术语“单克隆抗体RCR-252”、“抗体RCR-252”、“RCR-252单克隆抗体”可互换使用,指克隆号为RCR-252的单克隆抗体。该单克隆抗体是市售获得,例如可购自Abcam公司,货号为ab81712;或购自Sigma公司,产品号为E6280。
RCR-252的竞争性抗体
如本文所用,所述“RCR-252的竞争性抗体”指单克隆抗体RCR-252具有相同或相似的结合活性,并且可抑制PROCR与蛋白C(Protein C)结合的单克隆抗体。应理解,在本发明中,该术语包括具有选自下组的至少一个特征的单克隆抗体:
(1)所述竞争性抗体与RCR-252抗体结合于相同或相似的结合区域;
(2)所述竞争性抗体与RCR-252抗体结合于相同或相似的PROCR表位;
(3)所述竞争性抗体与RCR-252抗体存在与蛋白C受体结合的竞争关系(即竞争性抗体结合于蛋白C受体时,导致RCR-252抗体与蛋白C受体的结合受阻或下降;反之亦然);
(4)所述竞争性抗体与RCR-252抗体存在与蛋白C受体结合的位阻效应(即竞争性抗体结合于蛋白C受体时,导致RCR-252抗体与蛋白C受体的结合存在位阻效 应;反之亦然)。
在一优选实施方式中,所述的RCR-252的竞争性抗体与蛋白C受体的亲和力F1与单克隆抗体RCR-252与蛋白C受体的亲和力F2相近或相当(即F1/F2的比值为0.1-10,较佳地为0.5-2)。
在一优选实施方式中,所述的RCR-252的竞争性抗体结合于蛋白C受体的区域R1,和单克隆抗体RCR-252结合于蛋白C受体的区域R2,两者在位置上是相同的,或相邻且存在位阻的。
在本发明中,“特异性”是指抗体能结合于人PROCR基因产物或片段。较佳地,指那些能与人PROCR基因产物或片段结合但不识别和结合于其它非相关抗原分子的抗体。本发明中抗体包括那些能够结合并抑制人PROCR蛋白的分子,尤其是抑制人PROCR蛋白功能的抗体。本发明还包括那些能与修饰或未经修饰形式的人PROCR基因产物结合的抗体。
本发明不仅包括完整的单克隆或多克隆抗体,而且还包括具有免疫活性的抗体片段,如Fab'或(Fab)2片段;抗体重链;抗体轻链;遗传工程改造的单链Fv分子(Ladner等人,美国专利No.4,946,778);或嵌合抗体,如具有鼠抗体结合特异性但仍保留来自人的抗体部分的抗体。
本发明的抗体可以通过本领域内技术人员已知的各种技术进行制备。例如,纯化的人PROCR基因产物或者其具有抗原性的片段,可被施用于动物以诱导多克隆抗体的产生。与之相似的,表达人PROCR蛋白或其具有抗原性的片段的细胞可用来免疫动物来生产抗体。本发明的抗体也可以是单克隆抗体。此类单克隆抗体可以利用杂交瘤技术来制备(见Kohler等人,Nature 256;495,1975;Kohler等人,Eur.J.Immunol.6:511,1976;Kohler等人,Eur.J.Immunol.6:292,1976;Hammerling等人,In Monoclonal Antibodies and T Cell Hybridomas,Elsevier,N.Y.,1981)。本发明的抗体包括能阻断人PROCR蛋白功能的抗体以及不影响人PROCR蛋白功能的抗体。本发明的各类抗体可以利用人PROCR基因产物的片段或功能区,通过常规免疫技术获得。这些片段或功能区可以利用重组方法制备或利用多肽合成仪合成。与人PROCR基因产物的未修饰形式结合的抗体可以用原核细胞(例如E.Coli)中生产的基因产物来免疫动物而产生;与翻译后修饰形式结合的抗体(如糖基化或磷酸化的蛋白或多肽),可以用真核细胞(例如酵母或昆虫细胞)中产生的基因产物来免疫动物而获得。
药物组合物
如本文所用,所述“药物组合物”含有(a)本发明的单克隆抗体,所述单克隆 抗体选自下组:(i)单克隆抗体RCR-252或(ii)所述RCR-252竞争性抗体;(b)抑制PROCR表达的反义核酸;和(c)药学上可接受的载体。
本发明药物组合物可用于抑制乳腺癌细胞(尤其是三阴性乳腺癌细胞)的生长。
在本发明中,还可将单克隆抗体RCR-252或所述RCR-252竞争性抗体与其它治疗剂(如抑制PROCR表达的反义核酸等)联合用药,从而更有效地抑制乳腺癌细胞(尤其是三阴性乳腺癌细胞)的生长。
一种优选的本发明药物组合物含有安全有效量的本发明的单克隆抗体RCR-252或所述RCR-252竞争性抗体、抑制PROCR表达的反义核酸以及药学上可接受的载体或赋形剂。优选的剂型包括(但并不限于):液体剂型(如注射剂等)、或固态制剂(如冻干剂等)。
在本发明中,合适的载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。
药物制剂应与给药方式相匹配。本发明的药物组合物可以被制成针剂形式,例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。药物组合物如针剂、溶液宜在无菌条件下制造。活性成分的给药量是治疗有效量,例如每天约10微克/千克体重-约5毫克/千克体重。
使用药物组合物时,是将安全有效量的本发明的单克隆抗体RCR-252或所述RCR-252竞争性抗体和抑制PROCR表达的反义核酸施用于哺乳动物,其中该安全有效量通常至少约10微克/千克体重,而且在大多数情况下不超过约10毫克/千克体重,较佳地该剂量是约100微克/千克体重-约5毫克/千克体重。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
筛选三阴性乳腺癌潜在治疗剂的方法
本发明还提供了一种筛选或确定三阴性乳腺癌潜在治疗剂的方法,该方法包括步骤:
(a)提供一测试物;
(b)测定所述测试物是否具有选自下组的一个或多个特性:
(i)能够结合于蛋白C受体;
(ii)能够干扰或抑制蛋白C受体与蛋白C之间的结合;
(iii)所述测试物是单克隆抗体RCR-252的竞争性抗体;
(iv)能够抑制或干扰单克隆抗体RCR-252与蛋白C受体之间的结合;
(v)能够促进单克隆抗体RCR-252与蛋白C受体之间的结合;和
(c)将对于经步骤(b)测试,具有所述一个或多个特性的测试物,作为三阴性乳腺癌潜在治疗剂。
在一优选实施方式中,所述方法还包括步骤(d),对所述的乳腺癌潜在治疗剂进一步测试其对三阴性乳腺癌细胞的抑制作用。
在一优选实施方式中,步骤(d)中的测试为体外细胞测试。
在一优选实施方式中,步骤(b)中的测定包括:抗体竞争性测定、竞争性抗体与PROCR结合后对PROCR与其配体蛋白C结合抑制程度的测定。
在一优选实施方式中,所述的测试物选自下组:抗体、化合物、多肽、核酸。
在一优选实施方式中,所述的蛋白C为活化的蛋白C(activated protein C,APC)。
在一优选实施方式中,所述的测试物抑制蛋白C受体(PROCR)蛋白与蛋白C的结合。
在一优选实施方式中,所述测试物为抗体,并且步骤(d)中包括测定所述抗体是否能够抑制三阴性乳腺癌细胞的生长(包括体外细胞实验、或动物实验)。
在一优选实施方式中,所述的方法是非诊断性和非治疗性的。
本发明的主要优点包括:
(1)乳腺癌作为危害妇女的最常见的恶性肿瘤,早发现早治疗是提高病人存活率的最有效手段。PROCR是本发明人首次发现的一个三阴性乳腺癌的细胞表面标志物,可应用于乳腺癌分型的诊断。
(2)与一般仅具有检测作用的标志物不同,PROCR不仅可作为目前临床上无法进一步分型的三阴性乳腺癌的分型标志物,还是有效治疗乳腺癌(尤其是三阴性乳腺癌)的靶点。抑制PROCR的功能可以有效地遏制三阴性乳腺癌的发生及转移,这对于提高三阴性乳腺癌的治疗效果具有极其重要的意义。
(3)本发明首次发现一类可有效治疗三阴性乳腺癌的治疗性单克隆抗体。本发明的治疗性单克隆抗体可极其有效地抑制乳腺癌细胞(尤其是三阴性乳腺癌细胞)的生长,因此可以作为乳腺癌(尤其是三阴性乳腺癌)的临床治疗剂。
(4)体外细胞实验或动物实验方法都表明,本发明抗体(如抗体RCR-252)对三阴性乳腺癌细胞抑制率高达60%。动物实验表明,荷瘤小鼠的肿瘤生长被显著抑制。
(5)将本发明抗体(如单克隆抗体RCR-252或其竞争性抗体)与抑制PROCR表达的反义核酸联合用药,可进一步提高治疗乳腺癌(尤其是三阴性乳腺癌)的疗效。
(6)将本发明抗体(如单克隆抗体RCR-252或其竞争性抗体)与现有的乳腺癌临床治疗的小分子化疗药物联合用药,可进一步提高治疗乳腺癌(尤其是三阴性乳腺癌)的疗效。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如Sambrook等人,分子克隆:实验室手册(New York:Cold Spring Harbor Laboratory Press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
实施例1 中和抗体能够改变人三阴性乳腺癌细胞的细胞形态
将高表达PROCR的人三阴性乳腺癌细胞MDA-MB-231(获自购自ATCC。产品号 HTB-26TM。)以较稀疏的密度铺在盖玻片上生长,同时在细胞培养液中分别加入25ug/ml的抗PROCR的中和抗体(单克隆抗体RCR-252,购自Abcam公司,货号为ab81712)和抗PROCR的对照抗体(购自Abcam公司,货号为ab56689),12小时后用Vim抗体(购自Cell Signaling Technology货号为5741P)进行免疫荧光染色。
结果如图1所示。添加对照抗体的MDA-MB-231细胞的细胞形态没有明显改变,仍然是长梭形,而培养过程中添加中和抗体的细胞形态发生明显的变化。与用shRNA敲低PROCR的细胞相似(见实施例5),中和抗体使得细胞形态变成了圆球形。
上述结果表明,中和抗体RCR-252能够像shRNA一样,非常显著的抑制三阴性乳腺癌细胞的上皮-间充质转化。与之相反,对照抗体则无明显的抑制效果。
实施例2 中和抗体抑制病人来源的三阴性乳腺癌(PDX)细胞的成瘤性
取5周左右雌性裸鼠,将病人来源的三阴性乳腺癌(PDX)细胞按照相同的细胞量(106/只)注射到小鼠右侧第四对乳腺。9天后,肿瘤开始形成,分别对小鼠注射对照抗体和中和抗体(单克隆抗体RCR-252,购自Abcam公司,货号为ab81712)。具体注射方法为:腹腔注射,抗体用量为100ug/次。每隔2天注射一次,每只小鼠共注射3次。期间每隔1至2天统计所形成的肿瘤大小。
结果如图2所示。结果表明,通过腹腔注射中和抗体,能够显著抑制病人来源的三阴性乳腺癌细胞(PDX)的生长。与注射对照抗体相比,注射中和抗体组的肿瘤抑制率至少为50%。
实施例3 对照抗体和中和抗体(RCR-252)结合PROCR蛋白能力的比较
3.1 Western blot
实验方法:
在人293T细胞中通过PEI瞬时转染的办法转染人的PROCR过表达质粒(过表达片段为PROCR全长蛋白,过表达质粒购自addgene,plasmid No.18121)。48小时后收取对照组未经转染的293T细胞和过表达PROCR的293T细胞。经过蛋白裂解液裂解,12000rpm/分钟离心10分钟以去除细胞碎片,加入0.1M DTT和蛋白上样缓冲液,100℃煮沸10分钟。蛋白冻存在-80℃备用。
对照组293T细胞和实验组过表达PROCR蛋白的293T细胞得到的蛋白样品经过SDS-PAGE胶电泳(浓缩胶浓度:5%,浓缩胶电泳电压:恒定电压80V;分离胶浓度:11%,分离胶电泳电压:恒定电压120V)后,进行蛋白转膜(湿转法,恒定电流250mA,1.5小时;采用0.2um PVDF膜;转膜缓冲液:800ml去离子水,200ml甲醇,3.02gTris-base,14.4g glycine)。转膜后用5%脱脂牛奶封闭1小时,分别用对照抗体和中和抗体(单克隆抗体RCR-252)4℃孵育过夜。用TBST缓冲液(500ul Tween-20,1000ml去离子水,2.42g Tris-base,8.77g NaCl)洗膜5次,每次10分钟;之后用HRP标记的羊抗小鼠、羊抗大鼠即用型二抗(购自Millipore公司)室温孵育2小时;再用TBST缓冲液洗膜5次,每次10分钟;之后用Western专用显色剂(购自Thermo)进行显色。
实验结果如图3所示,Western Blot的结果表明,对照抗体不能在Western Blot中检测到PROCR蛋白,但中和抗体(单克隆抗体RCR-252)可以检测到PROCR蛋白。
3.2 免疫组织化学染色
实验方法:
取同一三阴性乳腺癌病人的病理切片,首先进行二甲苯脱蜡、梯度乙醇复水,然后加入0.3%过氧化氢37℃孵育15分钟,去内源性过氧化物酶;PBS浸洗,5分钟×3次;羊血清室温封闭1小时,分别加入对照抗体和中和抗体(对照抗体购自Abcam公司,货号为ab56689;中和抗体购自Abcam公司,货号为ab81712;抗体稀释比例均为1:200),4℃孵育过夜;磷酸盐缓冲液+0.2%TritonX-100(购 自sigma)-浸洗,20分钟×3次;加入HRP标记的羊抗小鼠、羊抗大鼠即用型二抗(购自Millipore公司),室温反应2小时;磷酸盐缓冲液+0.2%TritonX-100浸洗,20分钟×3次;DAB底物溶液(购自中杉金桥公司)显色,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。
如图6所示,结果表明,对照抗体能够在免疫组织化学染色中检测到PROCR蛋白,而中和抗体用免疫组化方法无法检测到PROCR蛋白。
实施例3的结果表明,对照抗体(通过免疫组化验证)和中和抗体(通过Western blot)都能够在一定程度上识别并结合PROCR蛋白,但由于其结合的表位不同,中和抗体能够结合PROCR上与蛋白C相互作用的区段(或中和抗体的结合区段对PROCR与蛋白C相互作用区段具有空间位阻效应),从而导致了只有中和抗体能够在功能性实验中有效抑制肿瘤细胞的生长。对照抗体虽然也能够识别并结合PROCR,但不能结合PROCR上与中和抗体相类似的区段,所以不具有相应的功能。
实施例4 中和抗体(单克隆抗体RCR-252)能够抑制蛋白C受体(PROCR)和其配体蛋白C(Protein C)的结合
4.1 构建PROCR胞外段、Protein C(与PROCR结合区肽段)质粒并纯化相应蛋白
构建人PROCR胞外段(不含信号肽区)克隆所用的PCR引物如下:
PROCR-F:TAGCGGCCGCCTGCACCT(SEQ ID NO.:1)
PROCR-R:CGGGATCCGGACCCAGGACCAG(SEQ ID NO.:2)
将扩增产物(带有BamHI和NotI酶切位点),克隆入pCMV-Fc质粒(购自Addgene公司)的相同酶切位点,获得构建的质粒。
构建人Protein C蛋白与PROCR结合区多肽克隆所用的PCR引物如下:
Protein C-F:CGGAATTCATGTGGCAGCTCACAAGCCTCC(SEQ ID NO.:3)
Protein C-R:CGACGCGTGGCCGCTGTCAGCACCCAGGAG(SEQ ID NO.:4)
将扩增产物(带有EcoRI和MluI酶切位点),克隆入pCMV-Fc质粒(购自Addgene公司)的相同酶切位点,获得构建的质粒。
分别将构建的质粒转染常规293T细胞,24小时后将培养液更换为CD293培养基同时添加1%GlutaMax和1%青链霉素。每隔24h收取上清,2000rpm离心去除细胞碎片,4天后在所有收集的上清中加入干净的蛋白A beads过夜。第二天将蛋白A beads用PBS清洗3次,用130ul pH 3.0的glycine-HCl洗脱,用500ul pH 9.5的Tris-base中和。将得到的可溶性片段透析过夜。经SDS-PAGE和考马斯亮蓝染色确定其蛋白浓度。
4.2 ELISA验证PROCR与Protein C的结合能够被中和抗体(单克隆抗体RCR-252)抑制而不能被对照抗体抑制
所使用的ELISA实验相关试剂和检测抗体均购自R&D公司(试剂盒货号为DY2245和DY008)
将0.2ug/ml的Protein C多肽100ul依次加入96孔ELISA微孔板中4℃孵育过夜。用洗涤缓冲液400ul洗板4次,每次5分钟。之后用抗体稀释缓冲液室温封闭1小时。用洗涤缓冲液400ul洗板4次,每次5分钟。分别将两种抗体从50ug/ml开始,以2倍为梯度稀释6次。将各个梯度抗体按照每孔100ul量加入96孔微孔板中,平行2个副孔,并设不加抗体的对照孔。然后将100ul 3ug/ml的PROCR蛋白依次加入各个孔中。室温孵育2小时后,用洗涤缓冲液400ul洗板4次,每次5分钟。加含有生物素标记的PROCR检测抗体100ul(1:200)依次加入各孔,室温孵育1小时。用洗涤缓冲液400ul洗板4次,每次5分钟。加入HRP偶联的亲和素二抗(1:200)室温孵育25分钟。用洗涤缓冲液400ul洗板4次,每次5分钟。加入试剂盒中的显色剂显色15分钟,后用终止剂终止。ELISA读板机读取各孔的信号值。
结果如图4所示。结果表明,ELISA中的检测信号随中和抗体浓度的增加而下降。这表明,对照抗体不能抑制PROCR与其配体Protein C的结合,而中和抗体能有效抑制二者结合。
实施例5 通过敲低PROCR可以抑制病人来源的三阴性乳腺癌(PDX)细胞的成瘤性
构建可用于慢病毒包装的的人PROCR shRNA,具体序列如下所示:
人PROCR-shRNA3:TGGCCTCCAAAGACTTCATAT(SEQ ID NO.:5)
将慢病毒包装载体质粒pCMVΔR8.2,pCMV-VSV-G质粒(购自Addgene公司)和PROCR shRNA的慢病毒载体质粒共同转入293T细胞(质粒质量比为6:4:10;每4×106细胞中转入20μg质粒),转染后16至24小时更换新鲜培养液;更换新鲜培养液后24小时和48小时分别收取含有慢病毒颗粒的上清,并以20000转/分钟,超速离心2小时进行制备浓缩PROCR shRNA的慢病毒颗粒。同时制备用于对照的不靶向任何基因的对照shRNA(scramble shRNA)慢病毒颗粒。
直接将三阴性乳腺癌病人的肿瘤细胞移植到免疫缺陷型小鼠乳腺中,待小鼠成瘤后,将得到的病人来源三阴性乳腺癌(PDX)细胞进行体外培养,并感染相应的对照shRNA和PROCR shRNA病毒。感染后5天收取部分细胞进行Western blot,验证PROCR的敲除效果。
同时取5周左右雌性裸鼠,将感染对照shRNA和PROCR shRNA的病人来源的 三阴性乳腺癌(PDX)细胞以相同细胞量(106/只)注射到小鼠右侧第四对乳腺。每隔1至2天,测量所形成的肿瘤大小并作统计。
如图5所示。结果表明,shRNA敲低能够非常显著降低病人来源的三阴性乳腺癌(PDX)细胞中PROCR的表达(图5,左)。
同时敲低PROCR病人来源的三阴性乳腺癌(PDX)细胞,其成瘤能力也受到明显抑制(图5中、右),其中shRNA治疗组中,在第40天健康(无肿瘤)的动物的百分比为在第40天高达66%,而对照组早在第10天,所有动物都已经发现肿瘤生长(图5,右)。
实施例6 确定三阴性乳腺癌潜在治疗剂的方案
通过测定测试物是否(i)能够结合于蛋白C受体;(ii)能够干扰或抑制蛋白C受体与蛋白C之间的结合;(iii)所述测试物是单克隆抗体RCR-252的竞争性抗体;(iv)能够抑制或干扰单克隆抗体RCR-252与蛋白C受体之间的结合;(v)能够促进单克隆抗体RCR-252与蛋白C受体之间的结合,从而确定测试物是否能够作为三阴性乳腺癌的潜在治疗剂。
当筛选出能够作为三阴性乳腺癌的潜在治疗剂后,用体外细胞实验或动物实验进一步测试其对三阴性乳腺癌细胞的抑制作用,并挑选出对三阴性乳腺癌细胞抑制效果最好的潜在治疗剂,用于治疗三阴性乳腺癌。
采用双盲法对15种测试物(包括多肽和小分子化合物)进行了上述测试,筛选出2种潜在的治疗剂。进一步的测试表明:这两种潜在治疗剂(一种为PROCR的胞外片段,一种属于RCR-252的竞争性抗体)都能够在动物实验有效抑制三阴性乳腺癌细胞的生长。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!