通过miR-183治疗高血脂、脂肪肝、二型糖尿病和降低体重的方法和药物及它们的应用与流程
本发明涉及生物医药领域,具体地,涉及通过抑制高血脂、脂肪肝、体重增加、二型糖尿病的标志物miR-183的功能在预防和/或治疗高血脂、脂肪肝、二型糖尿病和与这些疾病的症状相似的症状以及在降低体重中的应用,一种抑制miR-183的功能的方法,一种基于miR-183的抑制剂、药物组合物和试剂盒,以及他们在抑制miR-183的功能中的应用,特别是在预防和/或治疗高血脂、脂肪肝、二型糖尿病和与这些疾病的症状相似的症状以及在降低体重中的应用。
背景技术:
能量摄入过剩是高血脂、脂肪肝和肥胖的最根本原因,而肥胖是公认的二型糖尿病的诱因。已有的研究表明脑(下丘脑尤其重要)-肠胃中心轴对食欲、进食和消化吸收以及糖、脂代谢起着重要的调节作用[1],因而下丘脑-肠胃中基因表达的变化很可能是肥胖的最根本原因。而能量的摄入过剩会最先引起脂肪肝,继而改变肝脏中基因的表达,造成脂代谢的失常,引起心血管疾病。此外,有研究表明脑-肠胃-肝中心轴对血糖代谢起着重要的调节作用[2],表明脑-肠胃-肝中心轴可能是治疗高血脂、脂肪肝、肥胖和二型糖尿病的新靶器官系统[3]。
越来越多证据表明微RNA(microRNA,miRNA)在能量代谢调节中起着重要的作用[4]。微RNA是一类长度为16-25nt的非编码RNA分子(www.mirbase.org),能通过与靶基因部分互补配对来识别并沉默靶基因的RNA表达和/或蛋白表达。成熟的微RNA装载到RNA诱导的沉默复合体(RISC)上后,通过碱基配对来与靶基因mRNA 3'-UTR中的互补序列相结合,从而引发mRNA的降解和/或抑制其蛋白质的翻译。微RNA 5'端的第二位到第八位的核苷酸被称为“核心序列”,这七个核苷酸与靶基因的互补配对是识别靶基因的关键,配对程度越高,结合和调节靶基因的可能性和能力越大。同时微RNA“核心序列”之外的其它序列与靶基因的互补配对也能增强其结合和调控靶基因的能力。正是由于微RNA是通过非完全配对来识别和调节靶基因的表达,才使得一个微RNA能在一个细胞内同时不同程度地调节多个靶基因。
技术实现要素:
本发明的目的是开发基于微RNA的控制能量代谢的药物。
为了实现上述目的,一方面,本发明提供了抑制高血脂、脂肪肝、体重增加、二型糖尿病的标志物miR-183的功能在预防和/或治疗高血脂、脂肪肝、二型糖尿病和与这些疾病的症状相似的症状以及在降低体重中的应用。
第二方面,本发明提供了一种抑制高血脂、脂肪肝、体重增加、二型糖尿病的标志物miR-183的功能的方法,其中,该方法包括:将miR-183抑制剂与表达miR-183的靶细胞接触。
第三方面,本发明提供了一种miR-183抑制剂,其中,所述miR-183抑制剂为反义寡核苷酸,包括反义DNA和反义RNA,所述反义寡核苷酸与miR-183互补,且具有8-23个核苷酸的长度;或者所述miR-183抑制剂为miR-183前体的小干扰RNA。
第四方面,本发明还提供了一种药物组合物,其中,该药物组合物含有如上所述的miR-183抑制剂以及药学上可接受的载体。
第五方面,本发明还提供了一种试剂盒,其中,所述试剂盒包括如上所述的miR-183抑制剂,可选的,所述试剂盒还包括药学上可接受的载体。
第六方面,本发明还提供了如上所述的方法、如上所述的miR-183抑制剂、如上所述的药物组合物和/或如上所述的试剂盒在抑制miR-183的功能中的应用;特别是在预防和/或治疗高血脂、脂肪肝、二型糖尿病和与这些疾病的症状相似的症状以及在降低体重中的应用。
第七方面,本发明还提供了如上所述的miR-183抑制剂、如上所述的药物组合物在制备用于抑制miR-183的功能的药物中的应用;特别是在制备用于预防和/或治疗高血脂、脂肪肝、二型糖尿病和与这些疾病的症状相似的症状的药物以及在制备用于降低体重的药物中的应用。
本发明通过将miR-183抑制剂与表达miR-183的靶细胞进行接触,能够充分抑制miR-183的功能(包括抑制miR-183与其靶基因的结合或者降低miR-183的表达量,从而抑制miR-183的功能),当用于个体给药时,能够有效的预防和/或治疗miR-183表达量升高所引起的疾病,例如,高血脂、脂肪肝、体重增加、二型糖尿病或与这些疾病的症状相似的症状。相比于传统的单一降血脂或单一降血糖或单一减肥的药物,本发明提供的疗法能全面地调节食欲、消化吸收、糖、磷脂代谢,且为寡核苷酸;因而功效强大 且副作用小。
本发明的其它特征和优点将在随后的具体实施方式部分予以详细说明。
附图说明
附图是用来提供对本发明的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本发明,但并不构成对本发明的限制。在附图中:
图1是下丘脑、胃和肝中miR-183的表达水平图,其中,在12月龄小鼠中miR-183的表达水平显著高于2月龄的小鼠中的miR-183的表达水平。
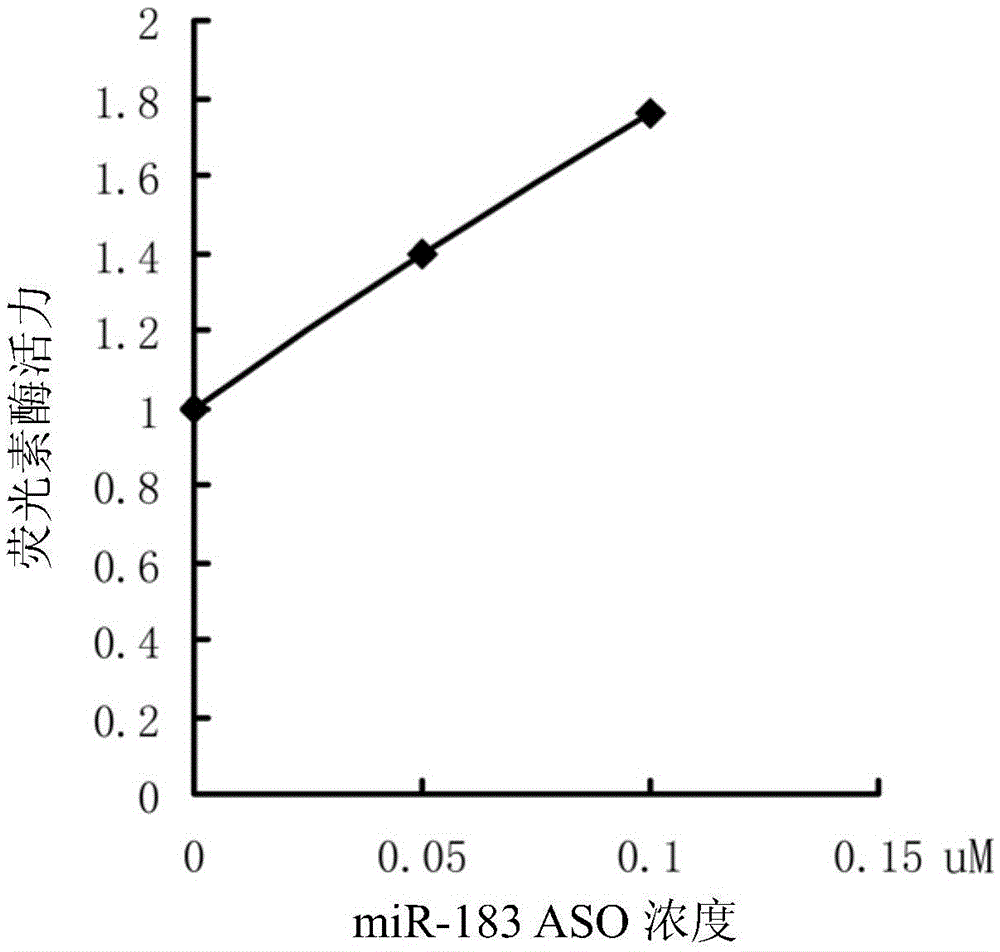
图2A是miR-183ASO剂量与其抑制miR-183的功能效应的线性关系图。
图2B是miR-183ASO、随机对照核苷酸、miR-183错配ASO在细胞水平上抑制miR-183的功能效应的对比图。
图3A是分别注射miR-183ASO和PBS的小鼠随时间体重变化的对比图。
图3B是分别注射miR-183ASO和PBS的小鼠随时间体重增长速率的对比图。
图3C是分别注射两个半月的miR-183ASO和PBS的小鼠的血糖浓度的对比图。
图4A是分别注射三个月的miR-183ASO和PBS的小鼠的肾、肝、附睾脂肪和胃的重量的对比图。
图4B是分别注射三个月的miR-183ASO和PBS的肾、肝、附睾脂肪和胃的重量相对体重的比例的对比图。
图5是分别注射三个月的miR-183ASO和PBS的小鼠血清中总胆固醇(CHOL)、甘油三脂(TG)、高密度脂蛋白(HDL)和低密度脂蛋白(LDL)的含量的对比图。
图6是miR-183的siRNA和随机对照RNA对miR-183表达影响的对比图。
具体实施方式
以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
除非另有说明,本文中使用的科技术语具有与本领域技术人员常规理解的术语具有相同的含义。
本发明的发明人在研究的过程发现,相比于2月龄的小鼠,主控食欲、消化吸收和能量代谢的下丘脑-胃轴心中的miR-183在12月龄小鼠中是明显上调的,且在肝脏中的 表达也是显著上调的。基于以上发现,发明人又利用TargetScanHuman(www.targetscan.org)算法预测了在脊椎动物中保守的miR-183的靶基因,然后与KEGG通路对比发现,很多miR-183的靶基因富集在胃酸分泌、唾液分泌、磷脂酰肌醇信号通路、胰岛素信号通路和二型糖尿病信号通路(表1)。另有68个miR-183的靶基因位于MAPK信号通路中该通路参与了脂肪细胞分化、胆固醇运输、二型糖尿病[5,6];有84个miR-183的靶基属于调节葡萄糖代谢、脂肪细胞分化的PI3K-Akt信号通路[5,7];和26个miR-183的靶基位于与肥胖、糖尿病、肝病相关的TGF-beta信号通路[5,8,9];以及34个miR-183的靶基位于调节血糖和代谢的GnRH signaling pathway[10](表1)。
表1
基于以上研究,本发明的发明人发现miR-183可以作为高血脂、脂肪肝、体重增加和二型糖尿病的标志物,并随后证明了通过抑制miR-183的功能可以预防和/或治疗高血脂、脂肪肝、二型糖尿病和与这些疾病的症状相似的症状以及降低体重。
因此,本发明提供了抑制高血脂、脂肪肝、体重增加和二型糖尿病的标志物miR-183的功能在预防和/或治疗以下疾病和/症状中的应用:高血脂、脂肪肝、体重增加和二型糖尿病以及与这些疾病的症状相似的症状,一种miR-183抑制剂,通过该miR-183抑制剂以抑制miR-183的功能的方法,以及包括有miR-183抑制剂的药物组合物和试剂盒,以 及他们在预防和/或治疗高血脂、脂肪肝、二型糖尿病和与这些疾病的症状相似的症状以及在降低体重中的应用。
方法
本发明提供了一种抑制高血脂、脂肪肝、体重增加和二型糖尿病的标志物miR-183的功能的方法,其中,该方法包括:将miR-183抑制剂与表达miR-183的靶细胞接触。
在一种优选的情况下,miR-183具有SEQ ID No:1(人和鼠的miR-183序列完全一致)(UAUGGCACUGGUAGAAUUCACU)所示的核苷酸序列。
根据本发明,所述“抑制miR-183的功能”是指相比于不使用本发明方法处理的同种的表达miR-183的靶细胞中miR-183对其靶基因表达下调的程度,使用本发明处理的所述表达miR-183的靶细胞中miR-183对其靶基因表达下调的程度降低了至少0.5倍,通常可以降低至少1倍,例如图2A和图2B。
本发明提供在体内或体外表达miR-183的靶细胞中抑制miR-183功能的方法。术语“抑制miR-183的功能”是指用试剂通过直接或间接作用于miR-183而使得被miR-183调节的靶基因的表达量升高。其方法包括但不限于下列几种:
1)小分子化合物
miR-183抑制剂包括但不局限于自然存在或人工合成的小分子化合物,这类小分子化合物直接作用于miR-183而使得被miR-183调节的靶基因的表达量升高,通常是分子量大于50且小于2500道尔顿的有机化合物。这类候选化合物拥有与蛋白质,特别是氢键相互作用的功能基团,且通常包含至少一种胺,羰基,羟基或羧基基团。这些小分子miR-183抑制剂可以通过合适的筛选方法或其它方法被发现。
2)反义寡核苷酸
所述反义寡核苷酸能通过与靶miR-183的直接结合来抑制靶miR-183的功能,包括反义RNA和反义DNA。优选的,所述反义寡核苷酸与miR-183互补,具有8-23个核苷酸的长度,并且具有与miR-183的2-8位核苷酸互补的序列。
如背景技术部分所述的,公知的,微RNA能通过与靶基因部分互补配对来识别并沉默靶基因的表达和/或翻译,同理的,miR-183也能够通过结合与其部分互补的核苷酸序列而竞争性抑制其自身的功能,从而上调miR-183的靶基因的表达。因此,本发明中,术语“互补”不仅包括完全互补,还包括部分互补,只要能够和miR-183结合并抑制其 功能即可。
因此,所述反义寡核苷酸具有如下的核苷酸序列:
a)SEQ ID No:4所示的核苷酸序列(AGTGAATTCTACCAGTGCCATA);
b)在SEQ ID No:4所示的核苷酸序列中经缺失、取代或添加一个或几个核苷酸且与miR-183互补的核苷酸序列。
当在非完全互补的情况下,也即,当所述反义寡核苷酸为通过在SEQ ID No:4所示的核苷酸序列中经缺失、取代或添加一个或几个核苷酸得到的核苷酸序列的情况下,在互补核苷酸区域内,所述反义寡核苷酸优选该与miR-183至少具有60%、65%、70%、75%、80%、85%、90%或95%的互补。更为优选的,在miR-183的2-8为的核苷酸区域内,所述反义寡核苷酸至多具有3个与miR-183错配的核苷酸。
如上所述的,在所述反义寡核苷酸与miR-183非完全互补的情况下,进一步优选的,与SEQ ID No:4相比,在长度上将至多有10个、9个、8个、7个、6个、5个、3个、2个或1个核苷酸的差别。
在一种优选的情况下,与miR-183非完全互补的反义寡核苷酸具有SEQ ID No:5所述的核苷酸序列(AGTGAGCTCTACCAGTGGCATA)。
另外,本发明还包括对所述反义寡核苷酸进行一些常规的修饰以改善所述反义寡核苷酸的稳定性和活性,这些均属于本发明的范围。
本发明需要指出的是,具有如上特性的完全或非完全互补的RNA也在本发明的保护范围内。综合考虑在细胞内的稳定性,本发明优选所述反义寡核苷酸为DNA。
由于所述反义寡核苷酸能够与miR-183互补(完全互补或部分互补),因此,当所述反义寡核苷酸在体内或体外与表达miR-183的靶细胞接触时,所述反义寡核苷酸能够与miR-183进行互补配对,并抑制miR-183与其靶基因的结合(也即,抑制miR-183的活性),从而打破了miR-183对其靶基因的沉默。
根据本发明,所述方法包括将有效量的和miR-183互补的反义寡核苷酸引入到表达miR-183的靶细胞中。其中,所述“有效量”根据表达miR-183的靶细胞的不同而有所不同,并且呈现出一定的剂量效应,如本发明下图2A所示的,本领域技术人员根据常规的实验手段以及所达到的预期目的能够容易的确定针对表达miR-183的靶细胞的有效剂量。
当所述接触为体内接触时,可以通过常规的核酸给药的方法将本发明的反义寡核苷 酸给药至个体中。例如,可以使用如下的方法进行所述反义寡核苷酸的给药:所述反义寡核苷酸可以通过病毒感染、微注射、或者囊泡融合的方法进行给药,或者也可以通过射流注射的方法用于所述反义寡核苷酸的肌肉给药。另外,也可以将所述反义寡核苷酸涂覆到金微粒上,然后通过粒子轰击设备或“基因枪”等公知方法进行经皮给药。这些均为本领域常规的技术手段,本发明在此不再一一赘述。
再者,还可以以表达载体的方法将所述反义寡核苷酸引入到表达miR-183的靶细胞中。这类表达载体具有位于邻近启动子序列的便捷性限制位点以便于所述反义寡核苷酸的插入。其中,位于所述表达载体中的转录盒可以包括转录起始区、靶基因或其片段和转录终止区。所述载体例如可以为但并不限于,质粒,病毒等等,本领域技术人员可以根据实际情况自行进行选择。
此外,所述反义寡核苷酸还可以通过呼吸道喷雾给药的方式从而被引入到表达miR-183的靶细胞中,例如通过制备成喷雾制剂的方式给药。
另外,所述反义寡核苷酸还可以通过口服给药的方式从而被引入到表达miR-183的靶细胞中,例如通过制备成口服制剂的方式给药,或是通过将所述反义寡核苷酸与食品混合的方式进行口服给药。
如上所述的个体可以为任何哺乳动物细胞,包括但不限于:有蹄动物,例如,牛,山羊,猪,绵羊等;啮齿动物,例如,仓鼠,小鼠,大鼠,兔;灵长类,例如,猴子,狒狒,人类等。
当所述接触为体外接触时,可以通过将所述反义寡核苷酸或含有所述反义寡核苷酸的载体(例如,含有所述反义寡核苷酸的药物)直接加入到培养有表达miR-183的靶细胞的基质中进行接触,并在常规的细胞培养条件下对导入有所述反义寡核苷酸的表达miR-183的靶细胞进行培养。
3)RNAi试剂
在代表性的实施例中,RNAi试剂靶向miR-183的前体分子(precursor of microRNA,pre-microRNA(人的序列),如SEQ ID No:2所示,CCGCAGAGUGUGACUCCUGUUCUGUGUAUGGCACUGGUAGAAUUCACUGUGAACAGUCUCAGUCAGUGAAUUACCGAAGGGCCAUAAACAGAGCAGAGACAGAUCCACGA),通过RNA干扰的机制来调节miR-183的表达,也即,间接抑制miR-183的功能。
本领域公知的是,RNA干扰(RNA interference,RNAi)是由双链RNA(double-stranded RNA,dsRNA)诱发的、同源mRNA高效特异性降解的现象。由于使用RNAi技术可以特异性剔除或关闭特定基因的表达,所以该技术已被广泛用于探索基因功能和传染性疾病及恶性肿瘤的治疗领域。而具体到本申请,本申请通过使用miR-183的前体分子的干扰RNA,对miR-183的前体分子造成基因沉默,从而降低了miR-183的前体分子的水平,由此,降低了由miR-183的前体分子转变为的成熟miR-183的水平,也即,抑制了miR-183的功能,从而升高miR-183靶基因的表达水平。
RNAi试剂可以是小的RNA分子,通常是一条理论上可以形成小发夹(small hairpin)结构的单链脱氧寡核苷酸(shRNA),其长度一般不会超过100个核苷酸,典型的不会超过75个核苷酸;或者是一条15-30bp的双链脱氧寡核苷酸(siRNA),最典型的是20-23bp,如本发明中的实施例5所描述的siRNA(如SEQ ID No:7所示的反义链和如SEQ ID No:8所示的正义链)。
在一些应用中,RNAi试剂也可以是编码shRNA或者siRNA的模板DNA。这些模板DNA可能存在于载体,比如质粒载体或病毒载体等载体中;也可以不存在与载体中,只是一段编码shRNA或者siRNA的模板DNA加一个控制其转录的常见启动子序列片段。
其中,所述RNAi试剂与表达miR-183的靶细胞的接触也可以为体内接触或是体外接触。所述RNAi试剂的给药方法可以参照如上对反义寡核苷酸的描述进行,为了避免不必要的重复,本发明在此不再详细赘述。
miR-183抑制剂
本发明还提供了miR-183抑制剂,所述miR-183抑制剂的具体类型可以为如上所述的小分子化合物、反义寡核苷酸和RNAi试剂中的至少一种,为了避免不必要的重复,本发明在此不再详细赘述。
药物组合物
本发明还提供了一种药物组合物,其中,该药物组合物含有如上所述的miR-183抑制剂以及药学上可接受的载体。
在本发明的组合物中,作为活性成分的如上所述的miR-183抑制剂的含量可以在较大的范围内变化,例如,可以为0.01-99重量%,优选的,可以为1-70重量%,更优选的, 可以为5-30重量%。
根据本发明,所述药物组合物可以制备为本领域常规的各种剂型,本发明对此并没有特别的限制,例如,可以配制成固体,半固体,液体或气体形式的,例如,片剂、胶囊、酏剂、悬浮液、糖浆、粉末、颗粒、软膏、栓剂、注射剂、吸入剂、气溶胶等等,本发明在此不再一一列举。
因此,根据药物剂型的不同也可以进行多种形式的给药,例如但不限于,口服给药,经颊给药,直肠给药,胃肠外给药,腹膜内给药,呼吸道吸入给药,皮内给药,经皮给药。
其中,所述药学上可接受的载体可以根据剂型的不同而进行不同的选择,这些均是本领域技术人员所公知的。例如但不限于,所述药学上可接受的载体可以为淀粉、胶质、乳糖、葡萄糖、蔗糖、微晶纤维素、高岭土、甘露醇、磷酸氢钙、氯化钠、海藻酸等等。
另外,还可以加入常规的添加剂如增溶剂、等渗剂、悬浮剂、乳化剂、稳定剂和防腐剂。
另外,所述药学上可接受的载体还可以包括能够提高所述反义寡核苷酸靶向特定器官或组织或细胞的靶向试剂,所述靶向试剂例如可以为靶向肽,还可以包括能够携带所述反义寡核苷酸更容易进入表达miR-183的靶细胞的穿膜试剂,例如穿膜肽,脂质体,微囊泡和膜脂蛋白等。
根据本发明,所述药物组合物中还可以添加有调味剂,例如,薄荷、冬青油等等。另外,还可以在所述药物组合物中添加着色剂以使所制备的剂型在外观上具有一定的吸引力,或者与其他产品进行区别。
根据本发明,所述反义寡核苷酸还可以与其他能够起到类似作用的常规药物进行联合以制备成联合药物组合物。
试剂盒
本发明提供了一种试剂盒,其中,所述试剂盒包括如上所述的反义寡核苷酸,可选的,所述试剂盒还包括额外的试剂,例如,如上所述的药学上可接受的载体、调味剂和/或着色剂、增溶剂、等渗剂、悬浮剂、乳化剂、稳定剂、防腐剂、靶向试剂或穿膜试剂。
根据本发明,所述额外的试剂可以与所述反义寡核苷酸结合在一起存在于所述试剂盒中,或者也可以独立的存放于所述试剂盒中,待使用时再进行混合。
本发明的试剂盒中还可以包括有使用说明书,所述说明书的存在形式不受特别的限制,例如,可以为打印的纸质形式,可以为CD的形式,或是为网址的形式,使用时通过互联网获取使用方法。
应用
本发明提供了抑制高血脂、脂肪肝、体重增加和二型糖尿病的标志物miR-183的功能在预防和/或治疗以下至少一种疾病和/或症状中的应用。
所述疾病和/或症状包括:高血脂、脂肪肝、体重增加和二型糖尿病以及与这些疾病的症状相似的症状。
特别的,所述应用包括制备用于预防和/或治疗以上任意一种疾病和/或症状的药物和/或食品。其中,所述食品包括保健品。
本发明还提供了如上所述的miR-183抑制剂、如上所述的药物组合物、如上的试剂盒和/或如上所述的方法在抑制miR-183的功能中的应用。
进一步优选的,所述应用包括预防和/或治疗以上任意一种疾病和/或症状。
另外,本发明还提供了如上所述的miR-183抑制剂、如上所述的药物组合物在制备用于降低miR-183量的药物中的应用。
优选的,所述药物包括用于预防和/或治疗以上任意一种疾病和/或症状的药物和/或食品。其中,所述食品包括保健品。
根据本发明,所述治疗是指受试者与由miR-183引起的疾病或状态相关的症状的改善或完全消失,其中,广泛的意义上的改善是指降低至少一个参数。具体到本申请,例如,可以为体重的减轻、血脂和/或血糖的降低和脂肪肝的改善等等。
治疗的个体可以为任意被如上所述的症状所困扰的个体,优选为哺乳动物。
根据本发明,所述“抑制miR-183的功能”是指相比于不使用本发明方法处理的同种的表达miR-183的靶细胞中miR-183对其靶基因表达下调的程度,使用本发明处理的所述表达miR-183的靶细胞中miR-183对其靶基因表达下调的程度降低了至少0.5倍,通常可以降低至少1倍,例如图2A和图2B。
所述药物的给药剂型以及成分可以参照如上的描述,本发明在此不再详细赘述。
以下将通过实施例对本发明进行详细描述。以下实施例中,
miR-183过表达载体
将SEQ ID No:3所示的(人的)miR-183基因(CCGCAGAGTGTGACTCCTGTTCTGTGTATGGCACTGGTAGAATTCACTGTGAACAGTCTCAGTCAGTGAATTACCGAAGGGCCATAAACAGAGCAGAGACAGATCCACGA)克隆至pCAG-GFP载体中,得到miR-183基因的过表达质粒pCAG-miR-183-GFP。其中,SEQ ID No:3所示的miR-183基因的合成以及克隆由金斯瑞公司进行。
miR-183感受载体(miR-183sensor vector)
miR-183感受载体是通过把两个miR-183结合并调节的如SEQ ID No:11所示的靶点序列(TGGAAATGAGATCTTGTGCCATAGCTACGGTAAGGATTTTCAGTGCCATT)克隆到pGL3-SV40载体的火荧光素酶(Fire luciferase)基因3'下游的xbaI位点上而得到的,从而miR-183感受载体中火荧光素酶的表达就受miR-183的调节。
实施例1
本实施例用于说明2月龄的和12月龄小鼠中miR-183表达量的差异
(1)总RNA的提取及反转录
野生型C57/Bl6雄性小鼠2月龄的和12月龄的各三只,颈椎脱臼处死后,各取500μl的血液,解剖取整个下丘脑和半个胃,以及200mg的肝、肌肉和附睾脂肪组织。加1ml的Trizol试剂(invitrogen)至血液中,并混匀。再分别加入200μl的Trizol试剂至下丘脑、胃、肝、肌肉和脂肪组织,然后用剪刀剪碎下丘脑、胃、肝、肌肉和脂肪组织,再用电动匀浆器把这些组织研磨成碎末,之后按Trizol的说明书把整个组织中的总RNA提取出来。用无核酸酶的水溶解RNA,然后用Nanodrop 2000仪器测定RNA的260与280的比值,取比值大于1.8的样本继续后续实验。之后用Qubit测定RNA的浓度后,用生物分析仪(bioanalyzer)检测RNA的完整性,RNA完整性指数RIN要大于0.9。其中,为了确保每种组织或器官都能够进行后续实验,可以设置多个重复进行总RNA提取。
从各个样本中取1μg的总RNA,利用flashPAGE筛分仪(Ambion)分离总RNA中的10-40nt的短RNA,然后用Illumina的试剂盒反转录制备微RNA的cDNA文库,再在第二代测序仪上测定样品中微RNA的表达水平。
结果显示12月龄小鼠的下丘脑、胃和肝中miR-183的表达量比2个月龄小鼠中的表 达要高,即表明miR-183的表达量随着年龄的增长而在下丘脑、胃和肝中升高,与体重的增长及肥胖呈正相关。
(2)定量PCR检测miR-183的表达量
为了确认miR-183在下丘脑、胃和肝中的表达量是随着年龄的增长而升高的,用定量PCR检测miR-183的表达量。从各个样本中取1μg的总RNA,用Catch AllTM miRNA&mRNA RT-PCR试剂盒(Pengekiphen,Kunshan)反转录微RNA和mRNA的cDNA。用于检测的引物有:如SEQ ID No:12所示的miR-183正向引物(5'-TATGGCACTGGTAGAATTCACT-3');如SEQ ID No:13所示的U6正向引物(5'-CGCAAGGATGACACGCAAATTCG-3');反向引物为试剂盒提供的通用引物。检测的仪器为Bio-Rad公司的iQ5系统,试剂为TaKaRa公司的SYBR Green Mix。每个样品同时检测三个复孔,以U6作为内参,用2-ΔΔct方法计算miR-183在每个样本中的表达水平。然后把2月龄小鼠各个脏器的miR-183的表达水平定为1,并计算12月龄小鼠中的miR-183相对表达水平,结果见图1。
如图1所示,主控食欲的下丘脑-胃中心轴的miR-183的表达量在12月龄小鼠中是明显上调的,且miR-183在肝脏中的表达也是显著上调的。定量PCR确认12月龄小鼠的下丘脑、肝和胃中miR-183的表达量比2月龄小鼠中的表达分别高1.8、1.6和2.4倍。由此可以证明,miR-183的上调和体重增加以及脂肪肝的形成是相关的。其中,图1中,**P<0.01,*p<0.05。
实施例2
本实施例用于说明反义寡核苷酸对miR-183的体外调节作用
将人胚肾细胞HEK-293T培养在含有10%胎牛血清的DMEM培养基中。细胞培养箱恒定保持37℃和5%的CO2。以每孔10万个细胞的接种量将HEK-293T细胞接种至24孔细胞培养板中,培养体积为500μl。第二天用脂质体2000(Invitrogen)按照说明书将如下表2的设置共转染KEK-293细胞中,36小时后用双荧光素酶分析仪(Promega)测量从miR-183感受载体中表达的荧光素酶的活力。每次设置三个重复孔,实验重复三次。
其中,各组别中,miR-183感受载体的转入量以每孔计:miR-183感受载体500ng,pCAG-GFP空白载体20ng,miR-183过表达载体500ng,寡核苷酸配置成50μM的溶液。另外,当转入的寡核苷酸为miR-183ASO时,分别取0.5μl和1μl的50μM的寡核苷酸溶 液,加入到细胞培养液后其终浓度分别为0.05μM和0.1μM。以测定荧光素酶的活力,并以其为纵坐标,miR-183ASO浓度为横坐标,绘制曲线。结果见图2。
由图2可以看出,miR-183ASO能抑制miR-183的功能。
由图2A可以看出,共转染miR-183感受载体、miR-183过表达载体和不同浓度的miR-183ASO,荧光素酶活力检测结果表明miR-183ASO能抑制miR-183的功能,且有剂量效应。
由图2B可以看出,过表达miR-183能抑制miR-183感受载体的表达(左1柱与左2柱);miR-183ASO和miR-183错配ASO能抑制miR-183的功能(左4柱和左5柱),miR-183ASO的抑制效果要优于miR-183错配ASO的,而随机对照核苷酸不能抑制miR-183的功能(左3柱),Data=平均值±SEM;N=3;***P<0.001,**P<0.01。并且,在HEK293细胞中过表达miR-183能抑制miR-9感受载体中报告基因荧光素酶的表达水平至对照组的水平的46%,而当共转终浓度0.1μM的miR-183ASO时,能使miR-183感受载体中报告基因荧光素酶表达恢复至对照组水平的76%,即miR-183ASO能够抑制miR-183功能的56%。
表2
实施例3
本实施例用于说明miR-183的反义寡核苷酸在体内调节miR-183靶基因及其后续影响能量代谢的作用
将12周龄的体重差异少于10%的10只野生型C57/Bl6雄性小鼠(北京维通利华实验动物技术有限公司)随机分成两组,饲养两周后(饲喂20%的高脂饲料),实验组小鼠尾静脉注射3.5OD/100μl的miR-183ASO(溶于PBS种),对照组小鼠注射100μl的溶剂PBS。第一周每隔三天注射一次,之后每两周注射一次。每周称量小鼠的体重,体重变化以及体重增长速率分别见图3A和图3B。
从注射开始的两个半月后,测量小鼠的空腹血糖。早上9点,把小鼠的饲料拿开,饥饿6个小时后,剪尾取一滴血,然后用罗氏卓越型血糖仪(型号是ACCU-CHEK Performa)和卓越金锐血糖试纸测量血糖浓度,见图3C。
从注射开始的三个月后,小鼠麻醉处死,从右心房取血,并解剖出和称量胃、肝、附睾脂肪和肾的重量,结果见图4A,相对体重的比例见图4B。血液5000rpm离心15分钟后取血清,用全自动生化分析仪(日立7180)测量血清中总胆固醇(CHOL)、甘油三脂(TG)、高密度脂蛋白(HDL)和低密度脂蛋白(LDL)的含量,见图5。
由图3可以看出,与对照组相比,静脉注射miR-183的反义寡核苷酸(miR-183ASO)能抑制小鼠的体重增长(图3A)和体重的增长速率(图3B)。Data=平均值±SD;N=5;*P<0.05。静脉注射miR-183的反义寡核苷酸(miR-183ASO)能降低高脂食物诱导的高血糖(图3C),Data=平均值±SEM;N=3;*P<0.05。
由图4可以看出,与对照组相比,静脉注射miR-183ASO能减少肝和胃的重量(图4A)以及肝和胃的重量相对体重的比例(图4B);miR-183ASO对肾重量没有影响(图4B)。miR-183ASO还能减少血液中总胆固醇和甘油三脂的含量,但对高密度脂蛋白和低密度脂蛋白没有影响(图5)。Data=平均值±SD;N=5;*P<0.05;**P<0.01。
按照实施例1中的方法提取对比实验组和miR-183ASO注射组小鼠的下丘脑和胃的总RNA,经二代测序并分析得知:与对比实验组相比,miR-183ASO注射组上调了参与糖脂代谢或二型糖尿病或肝病相关的PI3K-Akt信号通路、MAPK信号通路、TGF-beta信号通路、GnRH信号通路中的很多基因(表3)。此外还上调了胃酸分泌、唾液分泌、磷脂酰肌醇信号通路、胰岛素信号通路和二型糖尿病信号通路中的很多基因(表3)。
表3
综上所述,抑制miR-183的功能能够减少体重的增长,这为肥胖的治疗提供了新的思路。目前治疗重度肥胖最好的方法是做胃绕道手术,这说明胃肠是治疗肥胖的一个重要靶器官。而本申请证明了抑制miR-183的功能能够减少胃的重量及其与体重的比例,并且影响胃酸和唾液的分泌来影响食物的消化吸收,因此,可以推断出miR-183是一个治疗肥胖的重要靶点。
已知甘油三脂和总胆固醇高会导致心血管疾病。这些数据表明抑制miR-183的功能能降低血液中甘油三脂和总胆固醇的浓度,从而减少高血脂引起的心血管疾病的风险,另外,如前述的,抑制miR-183的功能可减少高脂食物诱导的肝重的增加,可知miR-183是一个治疗高血脂和脂肪肝的重要靶点。
而且本发明的分子实验证明了miR-183在体内调节了控制食欲、消化吸收、能量代谢、脂肪细胞分化信号通路中的很多基因,这阐明了miR-183反义核苷酸能降血脂、降血糖和抑制体重的分子机制。
实施例4
本实施例用于说明小干扰RNA(siRNA)对miR-183的体外调节作用
将人胚肾细胞HEK-293T培养在含有10%胎牛血清的DMEM培养基中。细胞培养箱恒定保持37℃和5%的CO2,培养体积为500μl。第二天用脂质体2000(Invitrogen)按照说明书将miR-183siRNA(反义链SEQ ID No:7:5’AGACUGUUCACAGUGAAUUCU’3,正义链SEQ ID No:8:5’AGAAUUCACUGUGAACAGUCU’3,上海吉玛合成,其中,在SEQ ID No:7和SEQ ID No:8的3’端均具有dTdT的结构)和随机对照RNA(反义链SEQ ID No:9:5’CGUGACACGUUCGGAGAA’3;正义链SEQ ID No:10:5’UUCUCCGAACGUGUCACGU’3,上海吉玛合成,其中,在SEQ ID No:9和SEQ ID No:10的3’端均具有dTdT的结构)分别转染KEK-293至细胞中,36小时后用Trizol裂解细胞并抽提总RNA,然后用于实施例1相同的定量PCR试剂盒和引物检测miR-183的表达量。每次设置三个重复孔,实验重复三次,结果如图6所示,***P<0.01。
结果显示用miR-183siRNA能下调miR-183表达量的72%,由此可知,与miR-183的靶基因结合的miR-183的量也下调了72%,从而提升了靶基因的表达水平。可见,通过RNA干扰miR-183前体的方式也能够成功抑制miR-183的功能。
总结
本发明通过将miR-183抑制剂(包括反义寡核苷酸以及干扰RNA)与在体内或体外表达miR-183的靶细胞进行接触,能够充分抑制表达miR-183的靶细胞中miR-183的功能(反义寡核苷酸抑制miR-183与其靶基因的结合,干扰RNA能够降低miR-183的表达量,从而抑制miR-183的功能),当用于个体给药时,能够有效的预防和/或治疗miR-183量升高所引起的疾病,例如,高血脂、脂肪肝、体重增加和二型糖尿病。相比于传统的单一降糖或单一降血脂或单一减肥的药物,本发明提供的疗法能全面地调节食欲、消化吸收、糖、脂代谢,且为寡核苷酸;因而功效强大且副作用小。为肥胖、脂肪肝、高血脂和二型糖尿病等疾病的治疗提供了新方向,从而具有极高的社会效益和经济效益。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型, 这些简单变型均属于本发明的保护范围。
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合。为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。
参考文献
1.Buhmann,H.,C.W.le Roux,and M.Bueter,The gut-brain axis in obesity.Best Pract Res Clin Gastroenterol,2014.28(4):p.559-71.
2.Wang,P.Y.,et al.,Upper intestinal lipids trigger a gut-brain-liver axis to regulate glucose production.Nature,2008.452(7190):p.1012-6.
3.Beraza,N.and C.Trautwein,The gut-brain-liver axis:a new option to treat obesity and diabetes?Hepatology,2008.48(3):p.1011-3.
4.Schneeberger,M.,et al.,Hypothalamic miRNAs:emerging roles in energy balance control.Front Neurosci,2015.9:p.41.
5.鞠大鹏,詹丽杏.,脂肪细胞分化及其调控的研究进展.Chinese Journal of Cell Biology 2010,32(5):690-695.
6.Gehart,H.,et al.,MAPK signalling in cellular metabolism:stress or wellness?EMBO Rep,2010.11(11):p.834-40.
7.Maiuri,T.,J.Ho,and V.Stambolic,Regulation of adipocyte differentiation by distinct subcellular pools of protein kinase B(PKB/Akt).J Biol Chem,2010.285(20):p.15038-47.
8.Dooley,S.and P.ten Dijke,TGF-beta in progression of liver disease.Cell Tissue Res,2012.347(1):p.245-56.
9.Goldfarb,S.and F.N.Ziyadeh,TGF-beta:a crucial component of the pathogenesis of diabetic nephropathy.Trans Am Clin Climatol Assoc,2001.112:p.27-32;discussion 33.
10.Zhang,Q.,et al.,Berberine moderates glucose metabolism through the GnRH-GLP-1 and MAPK pathways in the intestine.BMC Complement Altern Med,2014.14:p.188。
- 还没有人留言评论。精彩留言会获得点赞!