并用IL‑18与分子靶向抗体的癌治疗药的制作方法
本发明涉及一种并用白细胞介素18(以下,称为“IL-18”)与分子靶向抗体的癌治疗药。更详细而言,本发明涉及一种通过含有IL-18与分子靶向抗体,可取得协同的优异的抗肿瘤效果、且副作用少的癌治疗药。
背景技术:
已知肿瘤的腹膜播散伴随胃癌、大肠癌、卵巢癌等而发生,即便在通过手术来切除肿瘤的情况下,有时也会发病,治疗非常困难。在现有技术中,在腹膜播散的治疗中尝试了利用化疗剂的治疗、将血管内皮细胞增殖因子(VEGF)作为靶向的治疗、使用双膦酸的增敏疗法等。
另外,近年来,将抑制免疫反应及/或炎症反应的淋巴球(regulatory cells(调节细胞))以及作为在巨噬细胞中表达的抗原的CTLA-4抗原或PD-1/PD-L1抗原作为靶向,使所述淋巴球(抑制性淋巴球)减少的抗体在临床上开始实用化(专利文献1、2)。
所述抗体使所述抑制性淋巴球减少,另一方面,增强表达CD28或NKG2D等的效应淋巴球,并利用效应淋巴球进行肿瘤细胞的排除或病原体感染细胞的排除。
如此,使用所述抗体的治疗是以通过使先天性免疫及获得性免疫活化,持续地增加破坏肿瘤细胞的淋巴球(也称为效应淋巴球或效应细胞),并提高对于肿瘤的游走性而使肿瘤退缩或消灭为目标的。而且,已证明所述抗体对于在现有的治疗法中难以治疗的黑色素瘤等恶性肿瘤有效,期待能够增大其有效性并且扩大其对于多种肿瘤的适用范围。
另外,也进行了使用GM-CSF、IL-15及抗CTLA-4抗体来确认抗肿瘤效果的尝试(非专利文献1)。而且,公开了IL-18与利妥昔单抗或赫赛汀(HERCEPTIN)(注册商标)的组合显示出比使用单剂的情况更优异的治疗效果(专利文献3)。进而,也公开了使用将由所限定的分子式所表示的化合物、1个以上的分子靶向抗体、及免疫刺激化合物组合而成的组合物进行癌免疫治疗(专利文献4)。
现有技术文献
专利文献
专利文献1:国际公开公报“WO2004/004771号(2004年1月15日公开)”
专利文献2:日本公表专利公报“特表2004-512005号(2004年4月22日公表)”
专利文献3:日本公表专利公报“特表2010-52239号(2010年7月1日公表)”
专利文献4:日本公表专利公报“特表2008-539249号(2008年11月13日公表)”
非专利文献
非专利文献1:Fong L.等人,《癌症研究(Cancer Res)》,2009,69:609-615。
技术实现要素:
[发明所要解决的问题]
但是,我们认为使用所述专利文献1、2中公开的抗体时的治疗效果仍然存在改善的余地。进而,使所述抑制性淋巴球减少并增强效应淋巴球的结果,也存在可能产生自身免疫疾病发病等副作用这一问题。即,从提高治疗效果且减轻副作用这一角度而言,可以说专利文献1、2中公开的技术留有改善的余地。
另外,所述非专利文献1中公开的方法存在药剂的施用量过多以及方法不现实这一问题。
专利文献3公开了对患者同时或依次地个别施用IL-18与利妥昔单抗或赫赛汀(注册商标),且组合的治疗效果比单剂更优异。另外,专利文献4公开了通过将免疫增强剂添加至由所限定的分子式所表示的特定的化合物及1种以上的分子靶向抗体(利妥昔单抗、赫赛汀(注册商标)等)中,能够增大免疫反应。再者,所谓“分子靶向抗体”,是指能够识别与淋巴球的功能相关的表面抗原或癌细胞的表面抗原的抗体。
但是,关于使用专利文献3、4中所使用的抗体以外的其他抗体时可获得何种效果、及副作用的程度并不明确。因此,关于提供可提高治疗效果且减轻副作用的癌治疗药,可以说专利文献3及4仍未提供足够的见解。
本发明是鉴于所述现有技术中的问题点而做出的,其目的在于提供一种新型的癌治疗药,所述癌治疗药通过含有IL-18与所限定的抗体,可取得优异的抗肿瘤效果,并可减轻副作用。
[解决问题的技术手段]
本发明者对能够提高治疗效果且减轻副作用的癌治疗药进行了努力研究。其结果,发现通过将IL-18与选自由抗PD-L1抗体、抗PD-1抗体、抗PD-L2抗体、抗CTLA-4抗体、抗CD25抗体、抗CD33抗体及抗CD52抗体所组成的群组中的一种以上的抗体并用,可解决所述课题,从而完成了本发明。
即,为了解决所述课题,本发明的癌治疗药的特征在于:含有IL-18与选自由抗PD-L1抗体、抗PD-1抗体、抗PD-L2抗体、抗CTLA-4抗体、抗CD25抗体、抗CD33抗体及抗CD52抗体所组成的群组中的一种以上的抗体作为有效成分。
[发明的效果]
本发明的癌治疗药由于含有IL-18与选自由抗PD-L1抗体、抗PD-1抗体、抗PD-L2抗体、抗CTLA-4抗体、抗CD25抗体、抗CD33抗体及抗CD52抗体所组成的群组中的一种以上的抗体作为有效成分,可显著地提升由所述抗体所产生的抗肿瘤效果。其结果,取得了可提供治疗效果高且副作用少的癌治疗药这一效果。
附图说明
图1是表示以小鼠的生存率来观察从移植CT-26细胞的日期的3日后施用含有抗CTLA-4抗体及IL-18的癌治疗药时的效果的结果的图。
图2是与实施例1同样地,以腹腔内施用CT-26细胞的小鼠的生存率来表示抗CTLA-4抗体及IL-18的用量效果的图。
图3是与实施例1同样地,以小鼠的生存率来表示含有抗PD-L1抗体及IL-18的癌治疗药的效果的图。
图4是以小鼠的生存率来表示从移植CT-26细胞的日期起7日后施用含有抗CTLA-4抗体、抗PD-L1抗体及IL-18的癌治疗药等,其后每4日施用共计4次的情况的效果的图。
图5是以小鼠的生存率来表示从移植CT-26细胞的日期起14日后施用含有抗CTLA-4抗体、抗PD-L1抗体及IL-18的癌治疗药等的情况的效果的图。
图6是表示在移植CT-26细胞的日期的3日后分别施用抗CTLA-4抗体及IL-18;抗PD-L1抗体及IL-18;抗CTLA-4抗体、抗PD-L1抗体及IL-18的小鼠的4日间的腹腔渗出细胞(PEC)数的变化的图。
图7是表示分别施用抗CTLA-4抗体及抗PD-L1抗体;抗CTLA-4抗体及IL-18;抗PD-L1抗体及IL-18;抗CTLA-4抗体、抗PD-L1抗体及IL-18作为癌治疗药的4日后,再次分别施用这些癌治疗药的小鼠的PEC数的变化的图。
图8是表示向具有肿瘤的小鼠中将由抗CTLA-4抗体、抗PD-L1抗体、及IL-18所诱导的PEC进行过继细胞移植的情况下寿命延长效果的图。
图9是表示对由将仅抗PD-L1抗体;仅IL-18;抗PD-L1抗体及IL-18;抗CTLA-4抗体及抗PD-L1抗体;抗CTLA-4抗体、抗PD-L1抗体及IL-18施用至小鼠的腹腔内所诱导的PEC的B220(CD45R)、NKG2D、及DX5(CD49b)的表达强度进行研究的结果的图。
图10是对由将抗CTLA-4抗体及抗PD-L1抗体,或抗CTLA-4抗体、抗PD-L1抗体及IL-18施用至小鼠的腹腔内所诱导的PEC的B220(CD45R)、NKG2D及DX5(CD49b)的表达强度进行研究的结果的图。
图11是表示确认本发明的治疗药使CD4阳性CD25阳性T细胞的数量减少的结果的图。
图12是表示破坏并去除自然杀伤(NK)细胞的抗asialo-GM1抗体对施用了本发明的治疗药的小鼠的生存率所造成的影响的图。
图13是表示由有无施用抗asialo-GM1抗体所引起的小鼠来源的PEC的分析结果的不同的图。
图14是表示由有无施用抗asialo-GM1抗体所引起的小鼠来源的PEC中的表面标记物的分析结果的不同的图。
图15是表示确认有无施用抗asialo-GM1抗体所引起的小鼠来源的PEC中的CD4阳性T细胞及CD8阳性T细胞的表达强度、以及CD25阳性T细胞的细胞数的结果的图。
图16是表示从移植CT-26细胞的日期起21日后的对照或施用治疗药的各群组的小鼠有无腹水的外观照片。
图17是表示对照或施用治疗药的各群组的小鼠的腹围的变化的图。
图18是表示对照或施用治疗药的各群组的小鼠的体重的变化的图。
图19是表示对照与施用抗CTLA-4抗体的小鼠从移植CT-26细胞的日期起21日后的腹腔的样子的图。
图20是表示对照与施用抗CTLA-4抗体、抗PD-L1抗体及IL-18的小鼠从移植CT-26细胞的日期起21日后的腹腔的样子的图。
图21是表示对照的小鼠的从移植CT-26细胞的日期起21日后的小肠的外观的图。
图22是表示施用抗CTLA-4抗体、抗PD-L1抗体及IL-18的小鼠从移植CT-26细胞的日期起21日后的小肠的外观的图。
图23是表示对照与施用抗CTLA-4抗体、抗PD-L1抗体及IL-18的小鼠从移植CT-26细胞的日期起21日后的十二指肠、小肠、大肠的一部分的外观的图。
图24是表示实施例16中的CT-26细胞的移植与治疗药的施用日程表的图。
图25是表示在实施例16中测定血液中的白蛋白浓度(图25的(a))、总胆红素浓度(图25的(b))、AST(GOT)浓度(图25的(c))及ALT(GPT)浓度(图25的(d))的结果的图。
图26是表示在实施例16中测定血液中的LD(LDH)浓度(图26的(a))、肌酐浓度(图26的(b))、ALP浓度(图26的(c))、及尿酸浓度(图26的(d))的结果的图。
图27是表示在实施例16中测定血液中的尿素氮浓度的结果的图。
图28是表示实施例16中的群组1~群组4的小鼠的肝脏用苏木精伊红(HE)进行的组织染色结果的图。
图29是表示实施例16中的群组1~群组4的小鼠的胃用苏木精伊红(HE)进行的组织染色结果的图。
图30是表示实施例16中的群组1~群组4的小鼠的胃用苏木精伊红(HE)进行的组织染色结果的图。
图31是表示实施例16中的群组1~群组4的小鼠的十二指肠用苏木精伊红(HE)进行的组织染色结果的图。
图32是表示实施例16中的群组1~群组4的小鼠的小肠用苏木精伊红(HE)进行的组织染色结果的图。
图33是表示实施例16中的群组1~群组4的小鼠的大肠用苏木精伊红(HE)进行的组织染色结果的图。
图34是表示实施例16中的群组1~群组4的小鼠的肾脏用苏木精伊红(HE)进行的组织染色结果的图。
图35是表示实施例17中的B16黑色素瘤细胞的移植与治疗药的施用日程表的图。
图36是表示对实施例17中的群组1的小鼠的肺中所生成的小结节进行观察的结果的图。
图37是表示对实施例17中的群组2的小鼠的肺中所生成的小结节进行观察的结果的图。
图38是表示对实施例17中的群组3的小鼠的肺中所生成的小结节进行观察的结果的图。
具体实施方式
以下,对本发明的实施形态进行详细说明。表示范围的例如“A~B”般的记载表示A以上、B以下。再者,本说明书中所记载的专利文献及非专利文献的全部内容作为参考而引用于本说明书中。
[实施形态1:本发明的癌治疗药]
(1)有效成分
本发明的癌治疗药含有IL-18与选自由抗PD-L1抗体、抗PD-1抗体、抗PD-L2抗体、抗CTLA-4抗体、抗CD25抗体、抗CD33抗体及抗CD52抗体所组成的群组中的一种以上的抗体作为有效成分。
IL-18作为IFN-γ的诱导因子由冈村等人在1995年发现(冈村等人,《自然(Nature)》,378:88-91,1995),其是近年来已明确具有各种生物学作用的细胞活素。
IL-18通过如下方式来生成:由缺乏营养、氧不足、紫外线等应激所引起的内质网应激反应的结果,炎性体(蛋白质的复合体,含有NLRP3、ASC、半胱天冬酶-1等)得到活化,半胱天冬酶-1因该炎性体而活化,pro-IL-18通过该半胱天冬酶-1而得到加工,并变化成活性型的IL-18。
而且,已知IL-18可作用于通过抗原或细胞活素而得到活化的CD8阳性T细胞、自然杀伤细胞(以下,称为NK细胞)、γδT细胞等效应细胞,并显著地增加这些细胞的数量,并且抑制这些细胞的死亡,促进生存、分化(例如,Li Wen等人,《白细胞生物学期刊(J.Leukoc.Biol.)》,82,142-151,2007.)。
作为IL-18,并无特别限定,可使用专利文献3中所记载的人类IL-18多肽(序列号1)、小鼠IL-18多肽(序列号2)等。人类IL-18与小鼠IL-18之间的氨基酸序列的相同性为65%。关于人类IL-18多肽,如专利文献3中所记载的那样,公开在EP0692536A2、EP0712931A2、EP0767178A1及WO97/2441等中。再者,以下在本说明书中,将IL-18多肽简称为“IL-18”。
如专利文献3中所记载的那样,所述人类IL-18是在大肠杆菌无毒株中表达的人类IL-18的重组成熟形态。小鼠及人类的IL-18cDNA对由192氨基酸及193氨基酸组成的前体蛋白质(分别为序列号2及1)进行编码。
IL-18可通过硫酸铵或乙醇沉淀法、酸萃取法、阴离子或阳离子交换色谱法、磷酸纤维素色谱法、疏水性相互作用色谱法、亲和色谱法、羟基磷灰石色谱法、凝集素色谱法、及高效液相色谱法等公知的方法,从重组细胞培养物进行回收及精制。
当在细胞内的合成、单离、及/或精制时IL-18被改性的情况下,可使用关于蛋白质的再折叠的广为人知的技术,使活性构象再生。对活性型的人类IL-18进行精制及制作的方法公开在WO01/098455中。IL-18也可以使用市售品。
本申请案发明的癌治疗药含有选自由抗PD-L1抗体、抗PD-L1抗体、抗PD-1抗体、抗PD-L2抗体、抗CTLA-4抗体、抗CD25抗体、抗CD33抗体及抗CD52抗体所组成的群组中的一种以上的抗体作为抗体。
关于抗PD-L1抗体、抗PD-1抗体、抗PD-L2抗体,在专利文献1中有详述。如专利文献1中所记载的那样,人类PD-1cDNA以EMBL/GenBank(基因银行)Acc.No.NM_005018中所示的碱基序列构成,小鼠PD-1cDNA以Acc.No.X67914中所示的碱基序列构成,在胸腺细胞中,当从CD4-CD8-分化成CD4+CD8+细胞时可确认它们的表达(《国际免疫学(Int.Immunol.)》,1996年,第18卷,第5号,p.773~780,《实验医学杂志(J.Exp.Med.)》2000年,第191卷,第5号,p.891~898)。
另外,有报道在因来自抗原受体的刺激而活化的T细胞、B细胞(《国际免疫学(Int.Immunol.)》,1996年,第18卷,第5号,p.765~772)或含有活化巨噬细胞的骨髓细胞中能够确认末梢中的PD-1的表达。另外,还已知PD-1传递抑制抗原受体(TCR)信号的信号。
PD-L1是PD-1的配位体,除肿瘤细胞以外,在经活化的单核细胞或树突状细胞等所谓的抗原提示细胞中表达(《实验医学杂志(J.Exp.Med.)》2000年,第191卷,第7号,p.1027~1034)。如专利文献1中所记载的那样,人类PD-L1cDNA以由EMBL/GenBank Acc.No.AF233516表示的碱基序列构成,小鼠PD-L1cDNA以由NM_021893所表示的碱基序列构成。
这些细胞对T淋巴球细胞提示诱导各种免疫诱导信号的相互作用分子,PD-L1是诱导由PD-1所产生的抑制信号的分子之一。
如专利文献1中所记载般,有报导PD-L2被鉴定为PD-1的第2个配位体,但其表达及功能与PD-L1大致相同。再者,人类PD-L2cDNA以由EMBL/GenBank Acc.No.NM_025239所示的碱基序列构成,小鼠PD-L2cDNA以由NM_021896所表示的碱基序列构成(《自然免疫学(Nature Immunology)》,2001年,第2卷,第3号,p.261~267)。
一般认为,来自以PD-1为代表的共轭抑制分子的抑制信号通过适当地控制由抗原受体(TCR)及共轭刺激分子所产生的正信号的机制,控制淋巴球产生或成熟过程中的免疫耐受或对于自身抗原的异常的免疫反应。
关于抗CTLA-4抗体,例如记载在日本专利特开2007-277242号公报中。所谓CTLA-4,是指细胞损伤性T淋巴球相关抗原4(CD152)。如日本专利特开2007-277242号公报中所记载般,若CTLA-4与作为其天然的配位体的B7.1(CD80)及B7.2(CD86)结合,则负的控制信号被传送至T细胞中,若阻断该负的控制信号,则在动物模型中T细胞的免疫功能及抗肿瘤活性增强(Thompson及Allison,《免疫(Immunity)》,7,445~450页(1997);McCoy及LeGros,《免疫学和细胞生物学(Immunol.&Cell Biol.)》77:1~10页(1999))。
若使用抗体阻断CTLA-4的负的控制信号,则显示T细胞做媒介的肿瘤的死灭增加,能够诱导抗肿瘤性免疫(例如,Leach等人,《科学(Science)》271:1734~1736页(1996)等)。人类CTLA-4的完整的序列记载在GenBank登录号L15006中。
CD25是分子量为55kDa的单链糖蛋白,作为成人T细胞性白血病细胞的表面抗原而为人所知。CD33作为急性骨髓性白血病细胞的表面抗原而为人所知,CD52作为B细胞性慢性淋巴性白血病细胞的表面抗原而为人所知。
抗PD-L1抗体、抗PD-1抗体、抗PD-L2抗体、抗CTLA-4抗体、抗CD25抗体、抗CD33抗体、抗CD52抗体只要分别能够阻碍由PD-L1、PD-1、PD-L2、CTLA-4、CD25、CD33、CD52所产生的免疫抑制信号,则可以是人类来源的抗体、小鼠来源的抗体、大鼠来源的抗体、兔子来源的抗体或山羊来源的抗体等任一种抗体,进而也可以是这些的多克隆抗体或单克隆抗体、完整型或缩短型(例如F(ab')2、Fab'、Fab或Fv片段。以下,将这些也称为“抗体片段”)抗体、嵌合化抗体、人源化抗体或完全人源化抗体的任一种抗体。
可将PD-L1、PD-1、PD-L2、CTLA-4、CD25、CD33或CD52的细胞外区域的部分蛋白质作为抗原,根据公知的抗体或抗血清的制造法来制造这些抗体。细胞外区域的部分蛋白质可通过公知的蛋白质表达及精制法来制备。
多克隆抗体可通过公知的方法来制造。例如可通过如下方式来制造:利用抗原蛋白质、或抗原蛋白质与载体蛋白质的混合物,对适当的动物进行免疫,从该免疫动物中提取针对抗原蛋白质的抗体含有物,并进行抗体的分离精制。
作为所使用的动物,通常可列举:小鼠、大鼠、绵羊、山羊、兔子、及豚鼠。为了提高抗体产生能力,可将完全弗氏佐剂或不完全弗氏佐剂与抗原蛋白质一同施用。施用通常约每2周各进行1次,一般共计进行约3~10次左右。
多克隆抗体可从通过上述方法而得到免疫的动物的血液、腹水等中提取。抗血清中的多克隆抗体效价可通过ELISA法来测定。
多克隆抗体的分离精制例如可根据利用抗原结合固相、蛋白A或蛋白G等活性吸附剂的精制法,盐析法,醇沉淀法,等电点沉淀法,电泳法,利用离子交换体的吸脱附法,超速离心法,凝胶过滤法等免疫球蛋白的分离精制法来进行。
作为所述抗体,更优选使用单克隆抗体或其修饰体。如专利文献1中所记载般,从用抗原免疫的动物中选择已确认抗体效价的个体,在最终免疫的2~5日后提取脾脏或淋巴结,使脾脏或淋巴结中所含有的抗体产生细胞与同种动物或异种动物的骨髓瘤细胞融合,制作可传代培养的单克隆抗体产生杂交瘤,由此可制作单克隆抗体产生细胞。
将抗原蛋白质本身单独施用至可产生抗体的部位,或与载体、稀释剂一同施用。此时,为了提高抗体产生能力,通常施用完全弗氏佐剂或不完全弗氏佐剂。
另外,也可以通过被称为“DNA免疫”的方法来对动物进行免疫。该方法是利用如下的现象的方法:在免疫动物的后腿胫骨前肌中处置心脏毒素(Cardiotoxin),进而导入表达抗原蛋白质的载体后,在组织修复的过程中载体进入至肌细胞中,并表达蛋白质(《自然免疫学(Nature Immunology)》、2001年,第2卷,第3号,p.261~267)。
作为得到免疫的动物,可使用小鼠、大鼠、绵羊、山羊、兔子或豚鼠,优选使用小鼠或大鼠。融合操作可通过科勒与米尔斯坦(Kohler and Milstein)的方法(《自然(Nature)》,1975年,第256卷,第5517号,p.495~497)来实施,作为融合促进剂,可使用聚乙二醇(PEG)或仙台病毒等。作为骨髓瘤细胞,可列举P3U1、NS1、SP2/0、及AP1等骨髓瘤细胞,通常经常利用P3U1。
如专利文献1中所记载般,单克隆抗体产生细胞的挑选例如可通过利用向直接吸附或与载体一同吸附抗原蛋白质的固相中添加杂交瘤培养上清的ELISA法等检测来进行。进而,杂交瘤培养上清的抗体效价可通过ELISA法来测定。单克隆抗体的分离精制可根据与所述多克隆抗体的分离精制相同的免疫球蛋白的分离精制法来进行。
作为所述杂交瘤,只要使用为了制造所述抗体而通常使用的公知的杂交瘤即可。例如,在制造抗PD-L1抗体或抗PD-1抗体的情况下,则可使用专利文献1中公开的杂交瘤。
可利用蛋白酶对抗体进行处理,根据情况进行还原而获得所述抗体片段。F(ab')2抗体片段可通过用胃蛋白酶完全地消化经精制的单克隆抗体,并利用离子交换色谱法、凝胶过滤、亲和色谱法的任一种公知的方法进行精制。Fab'抗体片段可通过利用2-巯基乙胺对所制备的F(ab')2进行部分还原来制作。另外,Fab抗体片段可在半胱氨酸存在下通过木瓜蛋白酶消化酶来直接消化,并进行精制而制作。
scFv抗体例如可通过约斯特(Jost)等人的方法(《生物化学杂志(J.Biol.Chem.)》,1994年,第269卷,第42号,p.26267~26273)来制备。
将对人类以外的哺乳动物进行免疫所制作的非人类抗体的一部分置换成人类抗体的一部分,由此可制作所述人源化抗体。具体而言,已知通过构筑对人类抗体的恒定区域进行编码的基因与对非人类抗体的可变区域进行编码的基因的嵌合体,可制作人源化抗体(《美国科学院院报(Proc.Natl.Acad.Sci.)》(USA),1987年,第84卷,p.3439~3443,《免疫学杂志(J.Immunol.)》,1987年,第139卷,第1号,p.3521)。
人类抗体的恒定区域的DNA序列在文献中有记载,该恒定区域的基因可从已知的克隆中容易地获得。继而,使对抗体的可变区域进行编码的DNA序列融合到人类抗体的恒定区域的序列中。人类抗体的恒定区域的同种型可根据所期望的效应功能、或抗体依赖性细胞介导的细胞毒性(即抗体依赖性细胞损伤)中的活性来选择。优选的同种型为IgG1、IgG3及IgG4。另外,可使用人轻链恒定区、κ链或λ链的任一种。该人源化嵌合抗体可通过通常的方法来表达。
完全人源化抗体可利用导入了人类免疫球蛋白的恒定区基因的小鼠(转基因小鼠(《化学生物学(Chemical Biology)》,2000年,第7卷,第8号,p.R185-6))等来制作,进而能够将从所述小鼠中单离的抗体产生淋巴球变成杂交瘤,来量产作为目标的抗体。另外,完全人源化抗体也可以通过噬菌体展示法(《欧洲生物化学学会联盟通讯(FEBS Letter)》,1998年第441卷,p.20-24)来制作。
本发明的癌治疗药含有(i)IL-18与(ii)选自由抗PD-L1抗体、抗PD-1抗体、抗PD-L2抗体、抗CTLA-4抗体、抗CD25抗体、抗CD33抗体及抗CD52抗体所组成的群组中的一种以上的抗体作为有效成分。所述“一种以上的抗体”只要是选自所述群组中的抗体,则可使用几种。
其中,在本发明的癌治疗药中,优选含有作为癌治疗药具有实际成绩的抗PD-L1抗体及/或抗CTLA-4抗体,最优选含有IL-18与抗PD-L1抗体、抗CTLA-4抗体。
另一方面,如上所述,PD-L1是PD-1的配位体,PD-L2是PD-1的配位体。因此,在使用抗PD-1抗体或抗PD-L2抗体来代替抗PD-L1抗体的情况下,也可期待获得与使用抗PD-L1抗体的情况相同的效果。
另外,如上所述,CD33、CD52、及CD25分别作为急性骨髓性白血病细胞的表面抗原、B细胞性慢性淋巴性白血病细胞的表面抗原及成人T细胞性白血病细胞的表面抗原为人所知。在这些癌的患者中的已肿瘤化的白血球中,可看见许多被称为MICA及MICB的表面抗原。
当本发明的癌的治疗药含有IL-18与选自由抗CD25抗体、抗CD33抗体及抗CD52抗体所组成的群组中的一种以上的抗体时,所述抗体分别将CD25、CD33、CD52作为靶向。另外,如后述的实施例中所示般,IL-18能够强化NKG2D的表达强度高的NK细胞的诱导。而且,该NK细胞可通过NKG2D来识别MICA及MICB,并使表达这些表面抗原的细胞融解。
因此,可认为当本发明的癌的治疗药含有IL-18与选自由抗CD25抗体、抗CD33抗体及抗CD52抗体所组成的群组中的一种以上的抗体时,该治疗药有可能对于治疗急性骨髓性白血病、B细胞性慢性淋巴性白血病及成人T细胞性白血病有效地发挥作用。
在本发明的癌治疗药中,关于IL-18与所述抗体的使用量的比,当使用一种所述抗体时,IL-18与所述抗体的质量比优选1:10~1:200、1:25~1:200、1:25~1:50或1:30~1:50,当将所施用的生物体(实验对象、患者)的体重每1kg的IL-18的施用量设为0.1mg/kg时,优选以上述质量比施用抗体。
另外,当使用两种以上的所述抗体时,使IL-18的质量与将两种以上的抗体的质量合计所得的值的比作为所述质量比,抗体彼此的质量比可以为任意的比。
即,IL-18的质量与选自由抗PD-L1抗体、抗PD-1抗体、抗PD-L2抗体、抗CTLA-4抗体、抗CD25抗体、抗CD33抗体及抗CD52抗体所组成的群组中的一种以上的抗体的质量(所使用的抗体的质量的合计)的比优选1:10~1:200、1:25~1:200、1:25~1:50或1:30~1:50,抗体彼此的质量比可为任意的比。
例如,在使用两种抗体的情况下,当将IL-18的所述施用量设为0.1mg/kg时,能够以质量比1:50:50使用IL-18与第一种抗体及第二种抗体。
本发明的癌治疗药将IL-18与所述抗体(选自由抗PD-L1抗体、抗PD-1抗体、抗PD-L2抗体、抗CTLA-4抗体、抗CD25抗体、抗CD33抗体及抗CD52抗体所组成的群组中的一种以上的抗体)作为有效成分。所述癌治疗药可以是将IL-18与所述抗体混合而成的组合物。另外,IL-18与所述抗体也可以不混合而分别存在。
即,作为有效成分,只要使用IL-18与所述抗体,则即便不将IL-18与所述抗体混合,也包含在本发明的癌治疗药的范围内。
例如,即便在如对患者先施用IL-18后再施用所述抗体般,分别施用IL-18与所述抗体的情况下,由于并用了IL-18与所述抗体作为有效成分,因此不将IL-18与所述抗体混合的形态也相当于含有IL-18与所述抗体作为有效成分的本发明的癌治疗药。但是,施用的顺序并不限定于此,也可以对患者施用所述抗体后再施用IL-18、或者也可以对患者同时施用所述抗体与IL-18。
当所述抗体为多种抗体时,该抗体的施用形态可为同时施用多种抗体的形态,但并不限定于此。例如当使用两种抗体时,能够以任意的顺序对患者分别经时地施用IL-18与第一种抗体及第二种抗体。例如,可为以IL-18、抗PD-L1抗体及抗CTLA-4抗体这一顺序,或IL-18、抗CTLA-4抗体及抗PD-L1抗体这一顺序对患者进行施用的形态等。当经时地施用IL-18与一种或多种抗体时,IL-18与抗体的施用间隔、或抗体与抗体的施用间隔优选2~5日。
另外,IL-18与各个抗体的施用部位可以相同,也可以不同。例如,可以是将IL-18与多种抗体全部进行静脉注射的施用形态,也可以是如将IL-18进行静脉注射,将第一种抗体进行皮下注射,将第二种抗体进行皮内注射般的施用形态。通常若鉴于施用的简便性,则优选对相同的部位施用IL-18与抗体。
本发明的癌治疗药的有效成分(IL-18及所述抗体)的用量根据患者的年龄、症状等而不同,因此无法一概而论,但在1次的施用中,通常相对于患者的体重,作为有效成分,IL-18优选0.1mg/kg,抗体优选1mg/kg~20mg/kg,抗体更优选2.5mg/kg~5.0mg/kg或3.0mg/kg~5.0mg/kg。再者,在有效成分中所占的IL-18与所述抗体的质量比如上所述。
另外,在后述的实施例中使用小鼠作为实验对象,但相对于小鼠的体重的施用量与相对于人类的体重的施用量无大的差异。在对人类进行施用的情况下,作为一例,可考虑当将IL-18设为0.1mg/kg时,将抗体设为1mg/kg~20mg/kg,且每3周施用4次的施用形态。
(2)其他成分
除所述有效成分以外,本发明的癌治疗药根据需要可进一步含有例如专利文献3中所记载的医药上所允许的载体、稀释剂或赋形剂。
所述载体可为水及包括花生油、大豆油、矿物油或芝麻油等,或石油、源自动物、植物、或合成的油的油等无菌的液体。
当静脉内施用本发明的癌治疗药时,可将水用作载体。例如,作为注射溶液用的液体载体,也可以使用生理盐水以及葡萄糖及甘油的水溶液。
作为适当的医药赋形剂,可列举:淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、稻米、小麦粉、碳酸钙粉(胡粉)、硅胶、硬脂酸镁、单硬脂酸甘油、滑石、氯化钠、脱脂奶粉、甘油、丙二醇、水及乙醇等。
本发明的癌治疗药根据需要也可以含有少量的保湿剂或者乳化剂,或pH缓冲剂。本发明的癌治疗药可采用溶液、悬浮液、乳剂、片剂、丸药、胶囊、粉末或缓释制剂等形态。
本发明的癌治疗药可作为具有三甘油脂等现有的结合剂及载体的栓剂来配制。口服制剂可含有医药级的甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素或碳酸镁等标准的载体。本发明的癌治疗药在含有所述有效成分的同时也可含有适量的载体。制剂的形式只要结合施用方式而适宜调整即可。
本发明的癌治疗药对患者的施用形态并无特别限定,但在本发明的一实施形态中,所述癌治疗药是根据现有技术中已知的程序,作为适合于向人的静脉内施用的医药组合物来开处方。
如专利文献3中所记载般,静脉内施用的组合物典型地是无菌且等张性的水性缓冲液中的溶液。在适当的情况下,所述组合物也可以含有可溶化剂及缓和注射部位的疼痛的利诺卡因等局部麻醉剂。
通常,成分例如作为显示活性剂的量的安瓿或小袋等密封容器内的干燥冷冻粉末或不含水的浓缩物,以单位用量形态个别地供给或一次性混合来供给。再者,如上所述,所述癌治疗药可不必将IL-18与所述抗体混合。因此,IL-18与所述抗体可个别地供给。
当注入施用所述癌治疗药时,可通过存储无菌的医药级的水或生理盐水的注入瓶来进行分注。当注射施用所述癌治疗药时,可供给无菌的注射用水或生理盐水的安瓿,并在施用前将成分混合。
本发明的癌治疗药可作为非口服施用的溶液或冷冻干燥粉末来配制。在使用前,粉末可通过添加适当的稀释剂或其他医药上所允许的载体来进行还原。液体制剂可为完成缓冲且等张性的水溶液。适当的稀释剂的例子在通常的等张性生理盐水、水或者乙酸钠缓冲液或乙酸铵缓冲液中为5%的标准的葡萄糖。
所述制剂适合于非口服施用,但也可以用于口服施用,也可以存储在吸入用的用量计量型吸入器或喷雾器中。在所述癌治疗药中,有时希望添加聚乙烯吡咯烷酮、明胶、羟基纤维素、阿拉伯胶、聚乙二醇、甘露醇、氯化钠或柠檬酸钠等赋形剂。
为了口服施用,所述癌治疗药也可以进行胶囊化、进行片剂化、制备成乳剂或糖浆。也可以添加医药上所允许的固体或液体的载体,而使所述癌治疗药增强或稳定化,也可以使所述癌治疗药的制备容易化。
固体的载体包括淀粉、乳糖、硫酸钙二水合物、白土、硬脂酸镁或硬脂酸、滑石、果胶、阿拉伯胶、琼脂或明胶。
液体的载体包括糖浆、花生油、橄榄油、生理盐水及水。另外,载体可包括单独的、或者伴有蜡的单硬脂酸甘油酯或二硬脂酸甘油酯等缓释用材料。
固体载体的量各式各样,但平均用量单位为约20mg~约1g。当医药制剂为片剂形态时,只要适当,则可按照包括粉碎、混合、造粒及压缩的现有的制药法来制作,当医药制剂为硬质明胶胶囊形态时,可按照包括粉碎、混合及填充的现有的制药法来制作。
当使用液体的载体时,制剂为糖浆、酏剂、乳剂、或者水性或非水性的悬浮液的形态。此种液体制剂可通过口服(p.o.)而直接施用,或填充至软质明胶胶囊中来施用。
本发明的癌治疗药可用作为了注射而准备的形态中的以生理pH含有完成缓冲的所述癌治疗药的水性悬浮液或水溶液。作为水性载体,例如可使用0.4%生理盐水或0.3%甘氨酸等各种水性载体。这些溶液为无菌,通常不含粒状物质。
所述水性悬浮液或水溶液可通过现有技术中已知的杀菌法(例如过滤法)来进行杀菌。本发明的癌治疗药可含有pH调整剂或缓冲剂等为了接近生理条件所需的医药上所允许的辅助物质。
含有此种载体、辅助物质等的医药制剂中的本发明的癌治疗药的浓度只要根据所选择的具体的施用方式,基于流体容量、粘稠度等来选择即可。
[实施形态2:本发明的癌治疗药的施用]
本发明的癌治疗药可通过任一种适当的体内路径而对患者进行施用。
作为施用的方法,例如可使用专利文献3中所记载的现有技术中已知的各种方法。即,已知在脂质体中封入、微粒子、微胶囊、具有表达化合物的能力的重组细胞、经由受体的内吞作用(例如参照Wu等人、《生物化学杂志(J.Biol.Chem.)》,第262卷4429~4432页(1987))、作为反转录病毒载体或其他载体的一部分的核酸的构筑等各种输送系统,可用于本发明的癌治疗药的施用。
导入法包括皮内路径、肌肉内路径、腹腔内路径、静脉内路径、皮下路径、鼻腔内路径、硬膜外路径及口服路径,但并不限定于这些路径。所述癌治疗药可通过任意的适宜的路径,例如注入或弹丸注射、经由上皮或由粘膜皮肤所形成的内膜(例如口腔粘膜、直肠及肠粘膜等)的吸收来进行施用,且可与其他生物活性剂一同施用。
施用可为全身施用或局部施用。此外,本发明的癌治疗药有时希望通过包括脑室内注射、及蛛网膜下注射的任意的适当的路径来导入至中枢神经系统中,脑室内注射例如可通过安装在奥马耶贮器等容器中的脑室内导管而容易化。例如,通过使用具有吸入器或喷雾器及喷雾剂的制剂,也可以采用肺内施用。
施用如上所述,有效成分(IL-18及所述抗体)的用量理想的是每1次施用,相对于患者的体重,以IL-18为0.1mg/kg,抗体为1mg/kg~20mg/kg,更优选为2.5mg/kg~5.0mg/kg或3.0~5.0mg/kg的方式进行。
[实施形态3:本发明的癌治疗药的抗肿瘤效果]
如上所述,本发明的癌治疗药是并用IL-18与规定的抗体作为有效成分的。如后述的实施例中所示般,通过进行该并用来施用本发明的癌治疗药,与单独使用IL-18的情况及单独使用抗体的情况相比,能够取得协同且显著地提升移植了引起腹膜播散的大肠癌细胞的小鼠的生存率的效果。
在实施例中,当使IL-18与抗CTLA-4抗体的质量比为1:25~1:50,并以IL-18为2μg/25g、抗CTLA-4抗体为50~100μg/25g的方式施用至小鼠的腹腔内时(后述的图2),以及将IL-18、抗PD-L1抗体及抗CTLA-4抗体施用至小鼠的腹腔内时(后述的图4),非常强烈地实现该效果。
即,即便大肠癌细胞的移植后经过60日,供试的小鼠也全部生存,且也未见腹水的存积,也未见自身免疫样的病变,从而保持健康的状态。即,可认为未产生副作用。
另外,如后述的实施例中所示般,通过所述并用,可长时间持续地增加腹腔内渗出细胞的数量,也观察到由所述腹腔内渗出细胞所带来的小鼠的寿命延长效果。而且,观察到在所述腹腔内渗出细胞中,在活性型的NK细胞增殖且长时间持续地存在的同时,如CD4阳性CD25阳性T细胞般的炎症抑制性的细胞减少。
即,可认为本发明的癌治疗药通过IL-18促进NK细胞等效应细胞的增强,使经活化的效应细胞长时间持续地存在并使炎症抑制性的细胞减少,从而进一步增强并用的抗体的抗肿瘤效果。
另外,当单独使用所述抗体时,如上所述,存在会产生自身免疫疾病的发病等副作用这一问题,但本发明的癌治疗药具有此种副作用少的优点。
鉴于本发明的癌治疗药的优异的抗肿瘤效果,本发明的癌治疗药可应用于各种癌的治疗。作为可适用的癌种,例如可列举:鳞状细胞癌(子宫颈管、眼睑、结膜、阴道、肺、口腔、皮肤、膀胱、舌、喉头、食道)以及腺癌(例如前列腺、小肠、子宮内膜、子宫颈管、大肠、肺、胰、食道、直肠、子宮、胃、乳房、卵巢)。进而,肉瘤(例如肌源性肉瘤)、白血病、神经瘤、黑色素瘤、淋巴瘤也包含在可适用的癌种中。
本申请案发明包括以下的发明。
本发明的癌治疗药的特征在于:含有IL-18与选自由抗PD-L1抗体、抗PD-1抗体、抗PD-L2抗体、抗CTLA-4抗体、抗CD25抗体、抗CD33抗体及抗CD52抗体所组成的群组中的一种以上的抗体作为有效成分。
根据所述构成,从后述的实施例中所示的结果推测,通过IL-18促进效应细胞的增殖、生存、分化,且对抑制性T细胞的增殖进行抑制,可显著地提高所述抗体的抗肿瘤效果。其结果,与仅使用所述抗体的情况或仅使用IL-18的情况相比,本发明的癌治疗药可显示出协同的非常优异的抗肿瘤效果。而且,对于难以治疗的腹膜播散的抑制非常有效果,另一方面,存在减轻副作用的可能性。
因此,可提供治疗效果非常高的癌治疗药,同时可大幅度降低副作用对患者所造成的痛苦。
另外,本发明的癌治疗药优选所述抗体为抗PD-L1抗体及/或抗CTLA-4抗体。
根据所述构成,由于并用IL-18,因此与单独使用抗PD-L1抗体或抗CTLA-4抗体的情况相比,可获得显著优异的抗肿瘤效果。因此,可进一步提高对于癌治疗具有实际成绩的这些抗体的抗肿瘤效果,并提供更优异的癌治疗药。
进而,所述构成之中,当所述抗体为抗PD-L1抗体及抗CTLA-4抗体时,如后述的实施例中所示般,与含有IL-18与抗PD-L1抗体或抗CTLA-4抗体的癌治疗药相比,也可以获得协同的非常优异的抗肿瘤效果,而不仅仅是相加的效果。
因此,可提供抗肿瘤效果更优异、且副作用少的癌治疗药。
本发明的癌治疗药优选IL-18的质量与所述一种以上的抗体的质量的合计的比为1:25~1:200。
根据所述构成,如后述的实施例中所示般,可将IL-18与抗体向生物体中的施用量设为准确的量,因此在获得所述协同的非常优异的抗肿瘤效果方面优选。
而且,本发明的癌治疗药优选为选自由胃癌、大肠癌、卵巢癌、骨肉瘤、及白血病所组成的群组中的一种以上的癌的治疗药。
所述癌多伴有肿瘤的腹膜播散,即便在切除肿瘤的情况下,有时腹膜播散也会发病。根据所述构成,如后述的实施例中所示般,可显示出对于腹膜播散的高治疗效果。
因此,可提供特别适合于伴有腹膜播散的所述癌、且副作用少的癌治疗药。
本发明并不限定于上述各实施形态,可在权利要求所示的范围内进行各种变更,将在不同的实施形态中分别公开的技术手段适宜组合而获得的实施形态也包含在本发明的技术范围内。进而,通过将在各实施形态中分别公开的技术手段加以组合,可形成新的技术特征。
实施例
以下,通过实施例来更详细地说明本发明。再者,本发明并不限定于以下的实施例。
首先,对实施例中所使用的材料及实验方法进行说明。
[材料]
(1)小鼠及细胞系
作为小鼠,使用从日本SLC(浜松市)购入的BALB/C野生型小鼠(6~8周龄,雄性)。在25℃下,且在12小时明、12小时暗的循环控制照明的条件下,以无病原体的状态饲养所述小鼠。小鼠呈可自由地摄取水及颗粒状的饲料的状态。
CT-26小鼠结肠癌细胞的细胞系从美国菌种保藏中心(American Type Culture Collection)购入,在37℃、含有5%CO2的大气环境下,在含有10%胎牛血清(FBS,Bio West)及青霉素/链霉素(Gibco BRL,USA)的RPMI1640培养基(纳卡莱泰思科(Nacalai Tesque)(股份)制造)中进行维持。
所述细胞使用含有0.05%胰蛋白酶及0.01%EDTA、且无Ca2+及Mg2+的杜氏(Dulbecco's)PBS(pH7.4,纳卡莱泰思科(股份)制造。以下,称为“胰蛋白酶-EDTA”)进行处理并回收。
(2)试剂
使用由葛兰素史克有限公司好意赠与的重组小鼠IL-18(葛兰素史克制造,商品号SB-528775,以下简称为“IL-18”)。
使用从BioXcell购入的抗小鼠CD152/CTLA-4单克隆抗体(mAb,克隆UC10-4F10-11。以下简称为“抗CTLA-4抗体”)及抗小鼠PD-L1抗体(克隆10F.9G2。以下简称为“抗PD-L1抗体”)。兔子抗asialo-GM1抗体(Cat.No.014-09801,和光纯药(股份)制造)、抗CD8抗体(Cat.No.SC-18913,圣克鲁斯(Santa Cruz)制造)及兔子IgG(Cat.No.PMO35,MBL制造)全部为市售的抗体。
[实验方法]
(1)在活体内(In vivo)的处置
通过使用胰蛋白酶-EDTA剥离来从培养容器中回收处于近汇合(sub-confluent)状态的CT-26细胞,并使用PBS清洗两次。活细胞的数量通过台盼蓝染料排除试验来计数,以各种细胞浓度使活细胞悬浮在PBS中来制备悬浮液。所述细胞浓度为5.0×104个/0.25ml。
将所述悬浮液0.25ml注射至所述BALB/C野生型小鼠的腹腔内。在移植CT-26细胞后的适当的日期,将各种量(25~100μg)的抗CTLA-4抗体或抗PD-L1抗体与L-18(1~2μg)一同注射至所述小鼠的腹腔内,或不使用IL-18而注射至所述小鼠的腹腔内。为了研究NK细胞或T细胞在活体内的参与情况,也施用抗NK细胞抗体或抗T细胞抗体。各实施例中所使用的抗体及IL-18的具体的量、施用间隔记载在各实施例中。
(2)细胞的制备及培养
小鼠的腹腔渗出细胞(PEC)用5ml的PBS清洗3次,由此从腹腔中回收,用ACK溶解缓冲液(自家制)去除红血球3次,并用PBS清洗3次。
淋巴球是在含有10%胎牛血清、L-谷氨酰胺(Gibco BRL制造)、青霉素/链霉素及2-巯基乙醇(西格玛(Sigma)公司制造的M7154)的RPMI1640培养基(纳卡莱泰思科(股份)制造)中,在37℃、含有5%CO2的大气环境下进行培养。
(3)过继细胞移入
过继细胞移入实验用的PEC从移植了CT-26细胞的小鼠的腹腔中进行制备。在移植CT-26细胞的日期的3日后,对小鼠的腹腔内注射抗CTLA-4抗体、抗PD-L1抗体及IL-18的各种组合的治疗药。在腹腔内注射上述治疗药的日期的4日后回收PEC。所回收的细胞的大部分为淋巴球。对该淋巴球进行清洗,并以2.5×107细胞/ml的细胞密度悬浮在PBS中来制备细胞悬浮液。为了过继细胞移入,对移植了CT-26细胞的小鼠的腹腔内,在移植日的3日后、7日后、11日后注射所述细胞悬浮液0.2ml(约5×106cells/小鼠)。
(4)流式细胞术
PEC的细胞表面标记物及脾细胞的细胞表面标记物的分析是利用流式细胞术来进行。细胞表面标记物是使用FITC标记抗CD4抗体(eBioscience制造,克隆GK1.5)、APC标记抗CD8抗体(Biolegend制造,克隆54-6.7)、生物素标记抗CD8抗体(eBioscience制造,克隆53-6.7)、生物素标记抗CD11c抗体(Beckton Dickinson制造,克隆HL3)、APC标记抗CD45R/B220抗体(Biolegend制造,克隆RA3-6B2)、PE标记抗CD49b抗体(Beckton Dickinson制造,克隆DX5)进行染色。利用流式细胞术的分析是使用FACS Calibur流式细胞仪(Beckton Dickinson Biosciences制造)来进行。
即,利用以特异的FITC、PE、APC或生物素对CD4、CD8、CD11c、CD45R/B220、CD49b进行标记的单克隆抗体对细胞进行染色,继而,使用FACS Calibur流式细胞仪进行分析。另外,将抗小鼠CD16/32抗体(eBioscience制造,克隆93)用作Fc受体阻断剂。数据使用Cell Quest软件(注册商标,Beckton Dickinson Biosciences制造)进行分析。
在本说明书中,流式细胞术的条件是固定的,根据Becton-Dickinson immunocytometry system,1995.中所记载的条件来进行。再者,在本说明书中,细胞表面标记物的表达强度全部是指通过流式细胞术所测定的表达强度。
[实施例1:相对于腹腔内施用CT-26细胞的小鼠的生存率的、含有抗CTLA-4抗体及IL-18的癌治疗药的效果]
关于上述实验方法的(1)中所记载的CT-26细胞,将细胞浓度为5.0×104个/0.25ml的悬浮液0.25ml注射至所述BALB/C野生型小鼠的腹腔内来进行移植。
作为所述小鼠的治疗药,分成施用100μg的作为对照的兔子IgG的群组;仅施用2μg IL-18的群组;仅施用100μg抗CTLA-4抗体的群组;施用100μg的抗CTLA-4抗体及2μg的IL-18的群组,各群组由5只小鼠组成。在注射所述CT-26细胞的日期的3日后、7日后、10日后、14日后,腹腔内注射所述治疗药共计4次。以下,在所有实施例中,实验重复进行3次。
再者,所述兔子IgG抗体、抗CTLA-4抗体及IL-18的施用量(μg)是每25g的小鼠体重的施用量。
图1是表示以小鼠的生存率来观察从移植CT-26细胞的日期的3日后施用含有抗CTLA-4抗体及IL-18的癌治疗药时的效果的结果的图。在图1中,横轴表示从移植(腹腔内注射)CT-26细胞的日期起的天数,纵轴表示小鼠的生存率。
如图1中所示般,对照组在移植CT-26细胞的日期起24日后生存率开始下降,在27日后所有小鼠死亡。另外,仅施用IL-18的群组与仅施用抗CTLA-4抗体的群组显示出类似的生存率的下降倾向,分别在42日后、49日后所有小鼠死亡。
另一方面,在施用抗CTLA-4抗体及IL-18的群组中,连腹水的存积也不存在,完全未看见小鼠的死亡,即便从移植CT-26细胞的日期起60日后,所有小鼠也都生存。而且,未看见小鼠的衰弱,保持健康的状态。
根据以上的结果而明确,在施用抗CTLA-4抗体及IL-18的群组中,显示出非常优异的协同的抗肿瘤效果,而不仅仅是由IL-18与抗CTLA-4抗体所产生的相加的抗肿瘤效果。即,已明确通过将IL-18与抗CTLA-4抗体并用,可飞跃性地提高抗CTLA-4抗体的抗肿瘤效果。
[实施例2:抗CTLA-4抗体及IL-18的用量效果]
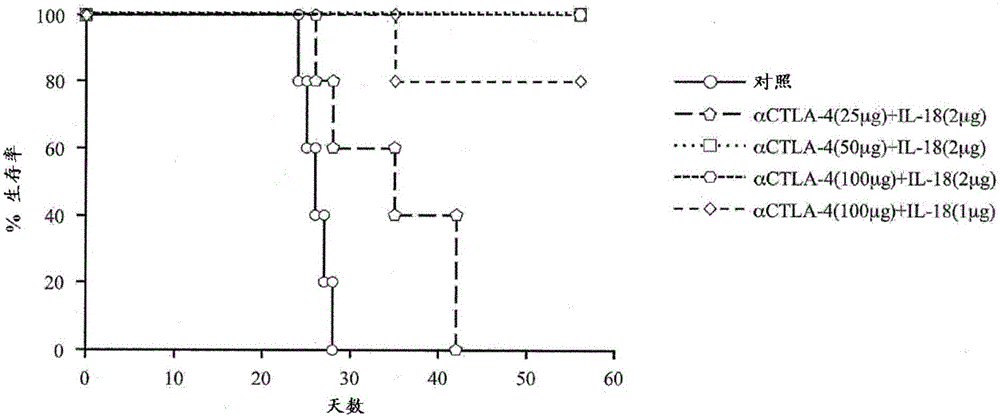
关于所述[实验方法]的(1)中所记载的CT-26细胞,将细胞浓度为5.0×104个/0.25ml的悬浮液0.25ml注射至所述BALB/C野生型小鼠的腹腔内来进行移植。
作为所述小鼠的治疗药,分成施用100μg的作为对照的兔子IgG的群组;施用25μg的抗CTLA-4抗体及2μg的IL-18的群组;施用50μg的抗CTLA-4抗体及2μg的IL-18的群组;施用100μg的抗CTLA-4抗体及2μg的IL-18的群组;施用100μg的抗CTLA-4抗体及1μg的IL-18的群组,各群组包含5只小鼠。在注射所述CT-26细胞的日期的3日后、7日后、10日后、14日后,腹腔内注射所述治疗药共计4次。
再者,所述兔子IgG抗体、抗CTLA-4抗体及IL-18的施用量(μg)是每25g的小鼠体重的施用量。
图2与实施例1同样地,以腹腔内施用CT-26细胞的小鼠的生存率来表示抗CTLA-4抗体及IL-18的用量效果的图。横轴及纵轴与图1相同。
如图2中所示般,对照组在移植CT-26细胞的日期起24日后生存率开始下降,在28日后所有小鼠死亡。
另一方面,施用抗CTLA-4抗体及IL-18的群组之中,在施用25μg的抗CTLA-4抗体及2μg的IL-18的群组中,从CT-26细胞的移植日起28日后生存率开始下降,在42日后所有小鼠死亡。但是,若与对照进行比较,则可见寿命延长的效果。
在施用100μg的抗CTLA-4抗体及1μg的IL-18的群组中,从CT-26细胞的移植日起35日后生存率下降至80%,但其后即便是60日后,生存率也得到维持。生存的小鼠的健康状态良好。
在施用50μg的抗CTLA-4抗体及2μg的IL-18的群组、以及施用100μg的抗CTLA-4抗体及2μg的IL-18的群组中,即便是从所述施用日起60日后,所有小鼠也都生存。小鼠的健康状态良好。
如以上般,当将抗CTLA-4抗体与IL-18并用时,在4个施用群组中的3个施用群组中可获得非常优异的抗肿瘤效果,并可获得高治疗效果。另外,可确认即便是施用25μg的抗CTLA-4抗体及2μg的IL-18的群组,也显示出寿命延长效果。
[实施例3:相对于向腹腔内移植了CT-26细胞的小鼠的生存率的、含有抗PD-L1抗体及IL-18的治疗药的效果]
将具有与实施例1中所用的相同的细胞浓度(5.0×104个/0.25ml)的CT-26细胞的悬浮液0.25ml注射至所述BALB/C野生型小鼠的腹腔内来进行移植。
作为所述小鼠的治疗药,分成施用100μg的作为对照的兔子IgG的群组;仅施用2μg的IL-18的群组;仅施用100μg的抗PD-L1抗体的群组;施用100μg的抗PD-L1抗体及2μg的IL-18的群组,各群组由5只小鼠组成。在注射所述CT-26细胞的日期的3日后、7日后、10日后、14日后,腹腔内注射所述治疗药共计4次。再者,所述施用量是每25g的小鼠体重的量。
图3是与实施例1同样地,以小鼠的生存率来表示含有抗PD-L1抗体及IL-18的癌治疗药的效果的图。横轴及纵轴与图1相同。
如图3中所示般,对照组及仅施用IL-18的群组的生存率的推移与实施例1相同。在施用抗PD-L1抗体与IL-18的群组中,至移植CT-26细胞的日期的35日后为止显示出与仅施用IL-18的群组相同的倾向,但35日后以后,在仅施用IL-18的群组中42日后所有小鼠死亡,相对于此,在施用抗PD-L1抗体与IL-18的群组中,即便是60日后,生存率也维持在60%。另外,生存的小鼠的健康状态良好。
仅施用抗PD-L1抗体的群组的生存率比仅施用IL-18的群组差。根据该结果可见,通过施用抗PD-L1抗体与IL-18、即使用含有抗PD-L1抗体及IL-18的治疗药,显示出非常优异的协同的抗肿瘤效果,而不仅仅是由IL-18与抗PD-L1抗体所产生的相加的抗肿瘤效果。
即,已明确通过将IL-18与抗PD-L1抗体并用,可飞跃性地提高抗PD-L1抗体的抗肿瘤效果。另外,已知抗PD-L1抗体的副作用比抗CTLA-4抗体少,因此通过所述协同的抗肿瘤效果,可提供抗肿瘤效果高且副作用少的癌的治疗药。
[实施例4:相对于向腹腔内移植了CT-26细胞的小鼠的生存率的、含有抗PD-L1抗体、抗CTLA-4抗体及IL-18的癌治疗药的效果(其1)]
将具有与实施例1中所用的相同的细胞浓度(5.0×104个/0.25ml)的CT-26细胞的悬浮液0.25ml注射至所述BALB/C野生型小鼠的腹腔内来进行移植。
作为所述小鼠的治疗药,分成施用100μg的作为对照的兔子IgG的群组;仅施用2μg的IL-18的群组;施用100μg的抗CTLA-4抗体及2μg的IL-18的群组;施用100μg的抗PD-L1抗体及2μg的IL-18的群组;施用100μg的抗CTLA-4抗体及100μg的抗PD-L1抗体的群组;施用100μg的抗CTLA-4抗体、100μg的抗PD-L1抗体及2μg的IL-18的群组,各群组由5只小鼠组成。从注射CT-26细胞的日期起7日后,在腹腔内注射所述治疗药,其后,每4日在腹腔内注射所述治疗药共计4次。
图4是以小鼠的生存率来表示从移植CT-26细胞的日期起7日后施用含有抗CTLA-4抗体、抗PD-L1抗体及IL-18的癌治疗药等,其后每4日施用共计4次的情况的效果的图。横轴及纵轴与图1相同。再者,所述施用量是每25g的小鼠体重的量。
在实施例4中,与实施例1~3不同,在将CT-26细胞移植至腹腔内的日期的7日后开始治疗药的施用。即,在肿瘤比实施例1~3更加成长后开始治疗药的施用,如图4所示,与施用抗CTLA-4抗体及抗PD-L1抗体的群组相比,施用抗CTLA-4抗体及IL-18的群组及施用抗PD-L1抗体及IL-18的群组显示出非常高的生存率。另外,生存的小鼠的健康状态良好。
进而,在施用抗CTLA-4抗体、抗PD-L1抗体及IL-18的群组中,虽然在从向腹腔内的移植(肿瘤移植)CT-26细胞起7日后开始施用,但可获得即便是从施用起60日后,所有小鼠也都生存这一应大书特书的结果。而且,该小鼠的健康状态非常良好。
[实施例5:相对于向腹腔内移植CT-26细胞的小鼠的生存率的、含有抗PD-L1抗体、抗CTLA-4抗体及IL-18的癌治疗药的效果(其2)]
图5是以小鼠的生存率来表示从移植CT-26细胞的日期起14日后施用含有抗CTLA-4抗体、抗PD-L1抗体及IL-18的癌治疗药等的情况的效果的图。横轴及纵轴与图1相同。
作为治疗药,使用100μg的实施例4中所使用的所述对照;100μg的抗CTLA-4抗体及100μg的抗PD-L1抗体;100μg的抗CTLA-4抗体、100μg的抗PD-L1抗体、及2μg的IL-18,在向腹腔内移植CT-26细胞的日期的14日后在腹腔内注射所述治疗药,除此以外,以与实施例4相同的方式进行实验。再者,所述施用量是每25g的小鼠体重的量。
如图5中所示,可见与施用抗CTLA-4抗体及抗PD-L1抗体的情况相比,作为癌治疗药,施用抗CTLA-4抗体、抗PD-L1抗体及IL-18的情况显示出较高的生存率。
实施例5中,在肿瘤移植的14日后开始癌治疗药的施用,因此当施用癌治疗药时已形成肿瘤块,并且还观察到腹水的存积。尽管如此,当使用抗CTLA-4抗体、抗PD-L1抗体及IL-18时,观察到明确的寿命延长效果。这一点暗示含有抗CTLA-4抗体、抗PD-L1抗体、及IL-18的治疗药即便在形成肿瘤块后施用的情况下,也有可能获得治疗效果。
[实施例6:腹腔渗出细胞数的变化]
在实施例6中显示,抗CTLA-4抗体及IL-18;抗PD-L1抗体及IL-18;以及抗CTLA-4抗体、抗PD-L1抗体及IL-18能够增加移植了CT-26细胞的小鼠的腹腔渗出细胞(PEC)的数量。
将具有与实施例1中所用的相同的细胞浓度(5.0×104个/0.25ml)的CT-26细胞的悬浮液0.25ml注射至所述BALB/C野生型小鼠的腹腔内。在进行所述注射的日期的3日后,将下述的治疗药注射至各小鼠的腹腔内。每种治疗药准备16只小鼠,在施用治疗药的日期的1日后~4日后,每日从4只中回收PEC,使用计数盘对PEC数进行计数,并求出4只的PEC数的平均值。
图6是表示在移植CT-26细胞的日期的3日后分别施用抗CTLA-4抗体及IL-18;抗PD-L1抗体及IL-18;抗CTLA-4抗体、抗PD-L1抗体及IL-18的小鼠的4日间的腹腔渗出细胞(PEC)数的变化的图。横轴表示从施用所述治疗药的日期起的天数,纵轴表示每1只小鼠的PEC数(4只的平均值)。
图6的(a)是表示作为治疗药,施用100μg的作为对照的兔子IgG的群组;仅施用100μg的抗CTLA-4抗体的群组;仅施用2μg的IL-18的群组;施用100μg的抗CTLA-4抗体及2μg的IL-18的群组中的PEC数的变化的图。
图6的(b)是表示作为治疗药,施用100μg的所述兔子IgG的群组;仅施用100μg的抗PD-L1抗体的群组;仅施用2μg的IL-18的群组;施用100μg的抗PD-L1抗体及2μg的IL-18的群组中的PEC数的变化的图。
图6的(c)是表示作为治疗药,施用100μg的所述兔子IgG的群组;施用100μg的抗CTLA-4抗体及100μg的抗PD-L1抗体的群组;施用100μg的抗CTLA-4抗体、100μg的抗PD-L1抗体及2μg的IL-18的群组中的PEC数的变化的图。图中,所谓“NE-PEC”,是指施用了作为对照的兔子IgG的小鼠的腹腔渗出细胞。再者,所述施用量是每25g的小鼠体重的量。
可知在图6的(a)~(c)的任一者中,与仅施用抗体的情况相比,在并用抗体与IL-18的情况下均可大幅度地增加PEC的数量。
另外,对在分别施用抗CTLA-4抗体及抗PD-L1抗体;抗CTLA-4抗体及IL-18;抗PD-L1抗体及IL-18;抗CTLA-4抗体、抗PD-L1抗体及IL-18的4日后,再次分别施用这些癌治疗药的小鼠的PEC数的变化也进行观察。所述癌治疗药的第1次的施用、第2次的施用的施用量均与图6中所示者相同。
图7是表示其结果的图。图7的(a)是将所述癌治疗药的第1次的施用日设为第0日(图中,表示为“注射1”),表示向腹腔内移植CT-26细胞的日期(图中,表示为“CT-26细胞接种”)、进行PEC的回收及分析的日期(图中,表示为1~8及分析1~7)、以及所述癌治疗药的第2次的施用日(图中,表示为“注射2”)。
图7的(b)表示图7的(a)中所示的第0日~第8日的每1只小鼠的PEC数(4只的平均值)。至第4日为止与图6中所示的结果相同。
根据图7的(b)可知,在施用所述癌治疗药的日期的4日后开始下降的PEC的数量因在同日再次施用所述癌治疗药而再次显示出上升倾向。另外,与使用抗CTLA-4抗体及抗PD-L1抗体的情况相比,将IL-18与抗体并用的情况的PEC的数量更多,在使用抗CTLA-4抗体、抗PD-L1抗体及IL-18的情况下变得最多。
[实施例7:由腹腔渗出细胞带来的寿命延长效果]
将具有与实施例1中所用的相同的细胞浓度(5.0×104个/0.25ml)的CT-26细胞的悬浮液0.25ml注射至所述BALB/C野生型小鼠的腹腔内来进行移植。而且,如所述[实验方法]的(3)中所记载般,在移植CT-26细胞的日期的3日后将癌治疗药注射至腹腔内。作为癌治疗药,使用在以上针对实施例6的图6的(c)的说明中所提及的部位中记载的量的兔子IgG;抗CTLA-4抗体及抗PD-L1抗体;抗CTLA-4抗体、抗PD-L1抗体及IL-18。
如所述[实验方法]的(3)中所记载般,在腹腔内注射所述治疗药的日期的4日后回收PEC,并制备PEC的细胞悬浮液,对移植了CT-26细胞的小鼠的腹腔内,在移植日的3日后、7日后、11日后注射该细胞悬浮液0.2ml(约5×106细胞/小鼠)。
图8是表示向具有肿瘤的小鼠中将由抗CTLA-4抗体、抗PD-L1抗体及IL-18所诱导的PEC进行过继细胞移入的情况的寿命延长效果的图。横轴表示从在腹腔内施用PEC的日期起的日数,纵轴表示小鼠的生存率。
另外,凡例的“对照PEC”表示施用了将兔子IgG作为治疗药施用所获得的PEC的情况的结果,“αCTLA-4+αPD-L1诱导的PECs”表示施用了将抗CTLA-4抗体及抗PD-L1抗体作为治疗药施用所诱导的PEC(以下,在本项中称为“PEC-1”)的情况的结果,“αCTLA-4+αPD-L1+IL-18诱导的PECs”表示施用了将抗CTLA-4抗体、抗PD-L1抗体及IL-18作为治疗药施用所诱导的PEC(以下,在本项中称为“PEC-2”)的情况的结果。
如根据图8而可知,在对照组中从在腹腔内施用PEC的日期起28日后所有小鼠死亡。在施用PEC-1的小鼠中,与对照组相比可见寿命延长效果,但从在腹腔内施用PEC-1的日期起35日后所有小鼠死亡。另一方面,在施用PEC-2的小鼠中,即便是从施用日起58日后,也显示出20%的生存率,与施用PEC-1的情况相比,显示出若干的寿命延长效果。
即,可认为通过将抗CTLA-4抗体及抗PD-L1抗体与IL-18并用,能够诱导抗肿瘤效果更优异的PEC,其结果,可取得比使用抗CTLA-4及抗PD-L1抗体的情况更优异的寿命延长效果。
[实施例8:腹腔内渗出细胞中的NK细胞的增强]
在本实施例中,利用流式细胞术来研究通过以与实施例6相同的方法,将实施例6中所使用的治疗药之中,仅抗PD-L1抗体;仅IL-18;抗PD-L1抗体及IL-18;抗CTLA-4抗体及抗PD-L1抗体;抗CTLA-4抗体、抗PD-L1抗体及IL-18施用至小鼠的腹腔内所诱导的腹腔内渗出细胞为何种性状的细胞。作为供于流式细胞术的腹腔内渗出细胞,使用如下的细胞:各治疗药使用5只的小鼠,从施用所述治疗药的日期起4日后所回收的细胞。
流式细胞术是使用所述[实验方法]的(4)中所示的APC标记的抗CD45R/B220抗体(Biolegend制造,克隆RA3-6B2)、抗NKG2D抗体(BD-pharmingem562347)及PE标记的抗CD49b抗体(Beckton Dickinson制造,克隆DX5),并通过所述[实验方法]的(4)中所示的方法来进行。
图9是表示对分别作为表面标记物的B220(CD45R)、NKG2D及DX5(CD49b)的表达强度进行研究的结果的图。(a)~(j)的横轴表示DX5的表达强度,(a)~(e)的纵轴表示B220(CD45R)的表达强度,(f)~(j)的纵轴表示NKG2D的表达强度。(a)~(j)的“第3.036天”等的表述表示对在施用所述治疗药的日期的3日后所回收的PEC进行分析。
图9的(a)~(e)分别如图中所示般分割成4个区域,右上方的区域中所存在的细胞可以说B220(CD45R)的表达强度高且DX5的表达强度高。而且,图9的(f)~(j)也分别分割成4个区域,右上方的区域中所存在的细胞可以说NKG2D的表达强度高且DX5的表达强度高。
若对图9的(a)及(b)与(c)进行比较,则在(c)中所示的使用抗PD-L1抗体及IL-18的情况下,右上方的区域中所存在的细胞变多。另外,若对(d)与(e)进行比较,则在(e)中所示的使用抗CTLA-4抗体、抗PD-L1抗体及IL-18的情况下,右上方的区域中所存在的细胞变多。
而且,如图9的(h)中所示般,与(g)中所示的仅使用IL-18的情况相比,在使用抗PD-L1抗体及IL-18的情况下,右上方的区域中所存在的细胞的比例变少。但是,如对图9的(i)与(j)进行比较而可知,与使用抗CTLA-4抗体及抗PD-L1抗体的情况相比,在使用抗CTLA-4抗体、抗PD-L1抗体及IL-18的情况下,右上方的区域的细胞的比例变多。因此,可见通过并用抗体与IL-18,由抗体所产生的NK细胞向腹腔内的诱导得到进一步强化。
如此,根据图9的(a)~(j)中所示的结果可见,NK细胞之中,B220(CD45R)、NKG2D及DX5的表达强度高的NK细胞,即活性型的NK细胞向腹腔内的诱导通过并用抗体与IL-18而得到强化。可认为这是本发明的治疗药显示出高抗肿瘤效果的一个原因。
[实施例9:在小鼠腹腔内诱导的NK细胞的维持]
在本实施例中,对将抗CTLA-4抗体、抗PD-L1抗体及IL-18作为癌治疗药施用时,从施用起经过长时间后是否还可以维持在小鼠腹腔内诱导的NK细胞进行研究。
将具有与实施例1中所使用者相同的细胞浓度(5.0×104个/0.25ml)的CT-26细胞的悬浮液0.25ml注射至所述BALB/C野生型小鼠的腹腔内。在进行所述注射的日期的3日后,腹腔内注射下述的治疗药。
以与实施例6相同的方法,将抗CTLA-4抗体及抗PD-L1抗体,或抗CTLA-4抗体、抗PD-L1抗体及IL-18作为治疗药施用至小鼠的腹腔内,并对从施用日起11日后回收的PEC进行分析。
流式细胞术是使用所述APC标记的抗CD45R/B220抗体(Biotegend制造,克隆RA3-6B2)、PE标记的抗CD49b抗体(Beckton Dickinson制造,克隆DX5)、抗NKG2D抗体(BD Pharmingen562349),并通过所述[实验方法]的(4)中所示的方法来进行。
图10是表示对分别作为表面标记物的B220(CD45R)、NKG2D及DX5(CD49b)的、在所述PEC中的表达强度进行研究的结果的图。图10的(a)~(c)的横轴表示DX5的表达强度,纵轴表示B220(CD45R)的表达强度。
图10的(a)、(d)为对照,表示移植CT-26细胞后,不施用治疗药而回收的PEC的数据。图10的(b)、(e)分别表示使用抗CTLA-4抗体及抗PD-L1抗体作为治疗药时的PEC的数据,图的(c)、(f)分别表示使用抗CTLA-4抗体、抗PD-L1抗体及IL-18作为治疗药时的PEC的数据。
在图10的(a)~(c)中,用框包围的记载为“R5”的区域表示可以说DX5的表达强度与B220(CD45R)的表达强度均高的PEC,在未施用治疗药的对照(图10的(a))中,该PEC在细胞整体中所占的比例为43.93%,从施用所述抗CTLA-4抗体及抗PD-L1抗体的日期起11日后所回收的PEC的所述比例为45.57%,基本没什么变化(图10的(b))。相对于此,从施用所述抗CTLA-4抗体、抗PD-L1抗体及IL-18的日期起11日后所回收的PEC的所述比例高达59.79%(图10的(c))。
另外,图10的(d)~(f)的横轴表示NKG2D的表达强度,纵轴表示细胞数。NKG2D的表达强度与细胞数的关系在图10的(d)~(f)中基本没什么变化。
根据以上的结果而明确,当施用抗CTLA-4抗体、抗PD-L1抗体及IL-18作为治疗药时,从施用起经过11日这一长时间后,也可以维持在腹腔内诱导的活性型的NK细胞(DX5的表达强度与B220(CD45R)的表达强度均高的细胞)。
即,已明确本发明的治疗药可增强对肿瘤细胞进行攻击、破坏的效应细胞,并使其长时间持续地存在。
[实施例10:CD4阳性CD25阳性T细胞的减少]
在本实施例中,对施用本发明的癌治疗药的小鼠中的CD4阳性CD25阳性T细胞的数量的变化进行研究。
将具有与实施例1中所用的相同的细胞浓度(5.0×104个/0.25ml)的CT-26细胞的悬浮液0.25ml注射至所述BALB/C野生型小鼠的腹腔内来进行移植。在进行所述注射的日期的3日后,腹腔内注射下述的治疗药。
作为治疗药,使用仅抗PD-L1抗体;仅IL-18;抗PD-L1抗体及IL-18;抗CTLA-4抗体及抗PD-L1抗体;抗CTLA-4抗体、抗PD-L1抗体及IL-18,并对从施用日起7日后所回收的PEC进行分析。施用量与实施例6相同。
图11是表示确认本发明的治疗药使CD4阳性CD25阳性T细胞的数量减少的结果的图。
图11的(a)~(e)、(f)~(j)表示分别使用抗PD-L1抗体;IL-18;抗PD-L1抗体及IL-18;抗CTLA-4抗体及抗PD-L1抗体;抗CTLA-4抗体、抗PD-L1抗体及IL-18作为治疗药时的结果,(a)~(e)表示求出CD4阳性T细胞在所述PEC整体中所占的比例的结果。
(a)~(e)的横轴表示TCR-β(T细胞受体β)的表达强度,纵轴表示CD4的表达强度。图11的(a)~(e)中,用圆圈包围的区域为存在CD4阳性T细胞的区域,例如图11的(a)的记载为“20.35%”的数字是图11的(a)的用圆圈包围的区域中所存在的CD4阳性T细胞在所述PEC整体中所占的比例。
另外,图11的(f)~(j)表示CD4阳性CD25阳性T细胞的检测结果,横轴表示CD4阳性CD25阳性T细胞的表达强度,纵轴表示CD4阳性CD25阳性T细胞的细胞数。(f)~(j)的图中的数值表示CD4阳性CD25阳性T细胞在图11的(a)~(e)中用圆圈包围的区域中所存在的CD4阳性T细胞中所占的比例。
CD4阳性T细胞、CD25阳性T细胞是具有在癌细胞增殖时,抑制免疫反应、炎症反应的作用的抑制性淋巴球(Treg)。即,所述细胞的增加有助于癌细胞的增殖。
根据图11的(a)~(c)可知,与仅使用抗PD-L1抗体、仅使用IL-18的情况相比,在使用抗PD-L1抗体及IL-18的情况下,CD4阳性细胞减少。另外,根据图11的(d)、(e)可知,与使用抗CTLA-4抗体及抗PD-L1抗体的情况相比,在使用抗CTLA-4抗体、抗PD-L1抗体及IL-18的情况下,CD4阳性细胞减少。
另外,根据图11的(f)~(j)可知,与仅使用抗PD-L1抗体、仅使用IL-18的情况相比,在使用抗PD-L1抗体及IL-18的情况下,CD4阳性CD25阳性T细胞的比例也少,与使用抗CTLA-4抗体及抗PD-L1抗体的情况相比,在使用抗CTLA-4抗体、抗PD-L1抗体及IL-18的情况下,CD4阳性CD25阳性T细胞的比例也少。
根据以上的结果可知,与仅使用抗体的情况相比,本发明的癌治疗药进一步抑制抑制性淋巴球的增殖。可认为其原因在于:通过并用IL-18,由抗体所产生的抑制性淋巴球的增殖抑制效果进一步提高。
另外,如上所述,本发明的癌治疗药可促进效应细胞的增强、增殖。如此,可认为本发明的癌治疗药由于能够抑制抑制性淋巴球的增殖且促进效应细胞的增强、增殖,因此可发挥非常高的抗肿瘤效果。
[实施例11:关于NK细胞对于抗肿瘤效果的重要性]
在本实施例中,使用作为针对NK细胞的抗体的抗asialo-GM1抗体,对NK细胞在本发明的癌治疗药的抗肿瘤效果中所发挥的作用进行研究。
用PBS来将50μl的兔子抗asialo-GM1抗体或50μg的兔子IgG稀释成250μl,并在CT-26细胞移植的1日前注射至小鼠的腹腔内。在进行所述兔子抗asialo-GM1抗体或兔子IgG的所述腹腔内注射的日期的3日后,再次将所述250μl的稀释液进行腹腔内注射,其后,每4日在腹腔内注射2次所述250μl的稀释液。即,在CT-26细胞移植的1日前、2日后、6日后、10日后进行所述腹腔内注射。
作为小鼠的治疗药,分成施用50μg的作为对照的兔子IgG的群组;施用100μg的抗CTLA-4抗体、100μg的抗PD-L1抗体及2μg的IL-18的群组,各群组由5只小鼠组成。
在腹腔内注射所述抗asialo-GM1抗体或兔子IgG的日期的1日后,将具有与实施例1中所用的相同的细胞浓度(5.0×104个/0.25ml)的CT-26细胞的悬浮液0.25ml注射至所述BALB/C野生型小鼠的腹腔内。而且,在进行所述注射的日期的3日后,将所述治疗药进行腹腔内注射,其后,每4日腹腔内注射所述治疗药共计4次(即,移植CT-26细胞的日期的3日后、7日后、11日后、15日后)。
图12是表示破坏并去除自然杀伤(NK)细胞的抗asialo-GM1抗体对施用本发明的癌治疗药的小鼠的生存率所造成的影响的图。图12的(a)是表示所述兔子抗asialo-GM1抗体或兔子IgG、以及所述治疗药的施用日程表的图。图12的(b)是表示实验结果的图。
图12的(a)的上段表示将移植CT-26细胞的日期设为零日,并如所述般在其3日后、7日后、11日后、15日后施用所述治疗药这一日程表。图12的(a)的下段表示如所述般在CT-26细胞移植的1日前、2日后、6日后、10日后施用兔子抗asialo-GM1抗体或兔子IgG这一日程表。
图12的(b)中,白圆圈表示对照(在CT-26细胞移植的1日前及移植的2日后、6日后、10日后施用兔子IgG,作为治疗药以上述方式也施用兔子IgG)的结果,三角形表示在CT-26细胞移植的1日前及移植的2日后、6日后、10日后施用兔子IgG,并如所述般施用抗CTLA-4抗体、抗PD-L1抗体及IL-18作为治疗药的群组(以下,称为“群组1”)的结果,四角形表示在与由三角形所表示的相同的实验中施用抗asialo-GM1抗体来代替兔子IgG的群组(以下,称为“群组2”)的结果。图12的(b)的横轴表示从施用CT-26细胞的日期起的日数,纵轴表示小鼠的生存率。
在所述群组1中,例如与实施例4中所示者同样地,所有小鼠在从移植CT-26细胞的日期起经过60日后也都生存,健康状态也良好。另一方面,在群组2中,与对照组相比可见寿命延长效果,虽然使用抗CTLA-4抗体、抗PD-L1抗体及IL-18,但效果远差于群组1,从移植CT-26细胞的日期起35日后所有小鼠死亡。
如实施例8中所示般,本发明的癌治疗药促进活性型的NK细胞向腹腔内的诱导。可认为其原因在于:IL-18促进由抗体带来的所述诱导。但是,可认为在施用抗asialo-GM1抗体的群组2中,NK细胞因该抗体而减少,因此获得如图12般的结果。如此,暗示在由本发明的癌治疗药所产生的抗肿瘤效果中,由抗体与IL-18所诱导的活性型NK细胞发挥重要的作用。
[实施例12:施用抗asialo-GM1抗体的小鼠中的NK细胞数的变化]
在本实施例中,利用流式细胞术对施用抗asialo-GM1抗体的小鼠的PEC进行分析,并对NK细胞数的变化进行研究。
分别准备5只实施例11的群组1及群组2的小鼠,以与实施例11相同的日程表进行抗asialo-GM1抗体或兔子IgG的施用、CT-26细胞的移植及治疗药的施用,在施用治疗药的日期的4日后回收PEC,并供于流式细胞术。
流式细胞术是使用所述APC标记的抗CD45R/B220抗体(Biolegend制造,克隆RA3-6B2)、PE标记的抗CD49b抗体(Beckton Dickinson制造,克隆DX5),并通过所述[实验方法]的(4)中所示的方法来进行。
图13是表示由有无施用抗asialo-GM1抗体所引起的小鼠来源的PEC的分析结果的不同的图。图13的(a)~(d)表示未施用抗asialo-GM1抗体的小鼠(所述群组1)来源的PEC的分析结果,(e)~(h)表示施用抗asialo-GM1抗体的小鼠(所述群组2)来源的PEC的分析结果。
在图13的(a)及(e)中,横轴表示DX5的表达强度,纵轴表示B220(CD45)的表达强度。R4表示表达NKG2D的细胞,R5表示T细胞,R6表示NK细胞(包含Pre-mMK)。
在图13的(a)中,R4为47.91%,R5为21.99%,R6为16.96%。另外,在图13的(e)中,R4为36.82%,R5为48.97%,R6为4.45%。
图13的(b)及(f)分别表示(a)、(e)的R4中所存在的表达NKG2D的细胞的数量,图13的(c)及(g)分别表示(a)、(e)的R5中所存在的T细胞的数量,图13的(d)及(h)分别表示(a)、(e)的R6中所存在的NK细胞(包含Pre-mMK)的数量。
根据图13可知,在所述群组2来源的PEC中,NK细胞的比例大幅度地减少,T细胞的比例增加。可认为此种NK细胞的减少带来图12中所示的结果。即,可认为在由本发明的癌治疗药所产生的抗肿瘤效果中,由抗体及IL-18所诱导的活性型的NK细胞发挥重要的作用。
[实施例13:由抗asialo-GM1抗体的施用所引起的在NK细胞中特异的细胞表面标记物的表达的变化]
在本实施例中,利用流式细胞术对施用抗asialo-GM1抗体的小鼠的PEC进行分析,并对在NK细胞中特异的细胞表面标记物的表达的变化进行研究。
与实施例12同样地,针对所述群组1及群组2的小鼠回收PEC,并供于流式细胞术。流式细胞术是使用所述生物素标记的抗CD11c抗体(Beckton Dickinson制造,克隆HL3)、PE标记的抗NK1.1抗体(BD Bioscience制造,克隆PK136)、APC标记的抗CD62L抗体(BD Bioscience制造,克隆MEL-14)、PE标记的抗CD69抗体(eBiocience制造,克隆H1.2F3)、PE标记的抗CD49b抗体(Beckton Dickinson制造,克隆DX5),并通过所述[实验方法]的(4)中所示的方法来进行。
图14是表示由有无施用抗asialo-GM1抗体所引起的小鼠来源的PEC中的表面标记物的分析结果的不同的图。图14的(a)~(d)表示未施用抗asialo-GM1抗体的小鼠(所述群组1)来源的PEC的表面标记物的分析结果,(e)~(h)表示施用抗asialo-GM1抗体的小鼠(所述群组2)来源的PEC的表面标记物的分析结果。横轴表示DX5的表达强度,纵轴表示各表面标记物的表达强度。
图14中所示的NK1.1、CD11c、CD62L、CD69均为在NK细胞(包含Pre-mMK)中特有的表面标记物。若分别对图14的(a)~(d)与(e)~(h)进行对比,则可知在所述群组2来源的PEC中,表达任一种表面标记物的细胞均减少。可认为此种NK细胞的减少带来图12中所示的结果。即,可认为在由本发明的癌治疗药所产生的抗肿瘤效果中,由抗体与IL-18所诱导的活性型的NK细胞发挥重要的作用。
[实施例14:由抗asialo-GM1抗体的施用所引起的CD4阳性CD25阳性T细胞的增加]
在本实施例中,利用流式细胞术对施用抗asialo-GM1抗体的小鼠的PEC进行分析,并对CD4阳性CD25阳性T细胞的细胞数的变化进行研究。
与实施例12同样地,针对所述群组1及群组2的小鼠回收PEC,并供于流式细胞术。
流式细胞术是使用所述FITC标记的抗CD4抗体(eBioscience制造,克隆GK1.5)、APC标记的抗CD8抗体(Biolegend制造,克隆54-6.7)、PE标记的抗CD25抗体(BD Bioscience制造,克隆PC-61),并通过所述[实验方法]的(4)中所示的方法来进行。
图15是表示确认有无施用抗asialo-GM1抗体所带来的、小鼠来源的PEC中的CD4阳性T细胞及CD8阳性T细胞的表达强度、以及CD25阳性T细胞的细胞数的结果的图。
在图15的(a)、(c)中,横轴表示TCR-β的表达强度,纵轴表示CD4的表达强度。在图15的(b)、(d)中,横轴表示CD25的表达强度,纵轴表示CD4阳性CD25阳性T细胞的数量。在图15的(e)、(f)中,横轴表示TCR-β的表达强度,纵轴表示CD8的表达强度。
如上所述,CD4阳性T细胞、CD25阳性T细胞是抑制性的T淋巴球,所述细胞的增加有助于癌细胞的增殖。另一方面,CD8阳性T细胞是具有抗肿瘤效果的细胞。
当施用抗asialo-GM1抗体时,根据图15的(a)与(c)的对比可知,图中的右上方的区域中所存在的CD4阳性T细胞在整个PEC中所占的比例从7.59%大幅度增加至17.02%。
另外,根据图15的(b)与(d)的对比可知,CD4阳性CD25阳性细胞在整个PEC中所占的比例也从2.34%大幅度增加至7.87%。另一方面,根据图15的(e)与(f)的对比可知,CD8阳性T细胞在整个PEC中所占的比例从2.26%至1.22%大致减少了一半。
该结果表示在预先施用抗asialo-GM1抗体的小鼠中,即便施用抗CTLA-4抗体、抗PD-L1抗体及IL-18,也会增加抑制性淋巴球,且CD8阳性T细胞减少。已知NK细胞使CD8阳性T细胞活化,若NK细胞减少,则CD8阳性T细胞也减少。
因此,根据本实施例的结果,暗示本发明的癌治疗药使NK细胞活化,并使NK细胞作为活性型而长时间持续,其结果,使CD8阳性T细胞活化,由此显示出优异的抗肿瘤效果。
[实施例15:对于腹水的存积的治疗效果]
在本实施例中,对本发明的癌治疗药对于移植了肿瘤细胞的小鼠中的腹水存积的效果进行研究。
将CT-26细胞的悬浮液(5.0×104个/0.25ml)0.25ml注射至所述BALB/C野生型小鼠的腹腔内。作为小鼠的治疗药,分成施用100μg的作为对照的兔子IgG的群组;施用100μg的抗CTLA-4抗体的群组;施用100μg的抗CTLA-4抗体及2μg的IL-18的群组,各群组由5只小鼠组成。在从移植CT-26细胞的日期起3日后,将所述治疗药进行腹腔内注射,其后,每4日腹腔内注射所述治疗药共计4次。而且,在从移植CT-26细胞的日期起21日后,研究对于腹水的存积的治疗效果。
图16是对于从移植CT-26细胞的日期起21日后的所述各群组的小鼠,表示有无腹水的外观照片。
图17是表示所述各群组的小鼠的腹围的变化的图。横轴表示从移植CT-26细胞的日期起的天数,纵轴表示腹围(mm)。对组成各群组的小鼠测定腹围,并求出其平均值。
如图17中所示,对照组是在CT-26细胞的移植后第26日,腹围伴随腹水的存积而显著增加并达到115mm,以后维持在这一数值。另一方面,施用抗CTLA-4抗体及IL-18的小鼠的腹围停留在80mm前后这一低水准,即便在CT-26细胞的移植后第56日,也与移植后第1日基本没什么变化。另外,与仅施用抗CTLA-4抗体的小鼠相比,施用抗CTLA-4抗体及IL-18的小鼠的腹围也得到大幅度抑制,未见腹水的存积。
图18是表示所述各群组的小鼠的体重的变化的图。横轴与图17相同,纵轴表示体重(g)。对组成各群组的小鼠测定体重,并求出其平均值。
关于体重,对照组可见因腹水的存积而显著上升,即便是仅施用抗CTLA-4抗体的小鼠,在CT-26细胞的移植后第42日以后,也增加至与对照组无大的差别的体重。
另一方面,施用抗CTLA-4抗体及IL-18的小鼠未见腹水的存积,如图18中所示,明显抑制在低体重,并维持在低的状态。
图19是对于所述对照组(图19的(a))与施用抗CTLA-4抗体的小鼠(图19的(b)),表示从移植CT-26细胞的日期起21日后的腹腔的样子的图。如图19中所示,两者均可看见许多肿瘤块,也看见脏器的粘连。
图20是对于所述对照组(图20的(a)及作为其放大图的(b))与施用抗CTLA-4抗体、抗PD-L1抗体及IL-18的小鼠(图20的(c)及作为其放大图的(d)),表示从移植CT-26细胞的日期起21日后的腹腔的样子的图。在施用抗CTLA-4抗体、抗PD-L1抗体及IL-18的小鼠中,未见肿瘤块及脏器的粘连,脏器的状态非常良好地保持。
图21是表示所述对照组的从移植CT-26细胞的日期起21日后的小肠的外观的图。图22是表示施用抗CTLA-4抗体、抗PD-L1抗体及IL-18的小鼠的从移植CT-26细胞的日期起21日后的小肠的外观的图。如根据两者的对比可见,在对照组中形成有多个肿瘤块,相对于此,在施用抗CTLA-4抗体、抗PD-L1抗体及IL-18的小鼠中,几乎未观察到肿瘤块。
图23是对于所述对照组(图23的(a)~(c))与施用抗CTLA-4抗体、抗PD-L1抗体及IL-18的小鼠(图23的(d)~(f)),表示从移植CT-26细胞的日期起21日后的十二指肠((a)、(d))、小肠((b)、(e))、大肠((c)、(f))的一部分的外观的图。
根据图23,在大肠中,在对照组与施用抗CTLA-4抗体、抗PD-L1抗体及IL-18的小鼠中基本未见差异,但在十二指肠及小肠中,在对照组中形成有肿瘤块,相对于此,在施用抗CTLA-4抗体、抗PD-L1抗体及IL-18的小鼠中保持干净的状态。
如图20的(c)、(d),图22,图23的(d)~(f)中所示,在肠等器官中未见发生了强烈的自身免疫样的病变。另外,施用抗CTLA-4抗体及/或抗PD-L1抗体、以及IL-18的小鼠观察到的均是健康的,也未见体重的减少等。
根据以上的结果可知,当使用抗CTLA-4抗体、抗PD-L1抗体及IL-18时,由移植作为小鼠大肠癌细胞的CT-26细胞所引起的腹膜播散得到充分抑制。已知胃癌、大肠癌、卵巢癌、骨肉瘤及白血病等会进行腹膜播散从而导致治疗困难,而本发明的癌治疗药可有效地抑制腹膜播散,因此可以说是对这些癌的治疗非常有效的治疗药。
[实施例16:关于本发明的癌治疗药的副作用的研究]
在实施例15中,在施用本发明的癌治疗药的小鼠中,未见强烈的自身免疫样的病变,也未确认到体重的减少等,因此暗示本发明的癌治疗药是副作用得到减轻的癌治疗药。因此,在本实施例中,对本发明的癌治疗药的副作用进行更详细的研究。具体而言,对IL-18抵抗(憎悪)作为所述癌治疗药的有效成分的抗体的副作用的可能性进行研究。
与实施例1同样地,将CT-26细胞(细胞浓度为5.0×104个/0.25ml)的悬浮液0.25ml注射至BALB/C野生型小鼠的腹腔内来进行移植。
作为所述小鼠的治疗药,分成施用0.25ml的作为对照的PBS的群组(群组1);施用100μg的抗CTLA-4抗体及200μg的抗PD-L1抗体的群组(群组2);施用100μg的抗CTLA-4抗体、200μg的抗PD-L1抗体及IL-18(2μg)的群组(群组3);施用100μg的抗CTLA-4抗体、200μg的抗PD-L1抗体及IL-18(10μg)的群组(群组4),各群组由5只小鼠组成。再者,PBS、抗CTLA-4抗体、抗PD-L1抗体及IL-18的施用量(μg)是每25g的小鼠体重的施用量。
从注射所述CT-26细胞的日期的3日后,每4日将所述治疗药注射至所述小鼠的腹腔内共计4次。在注射所述CT-26细胞的日期的18日后提取血液及组织,除肝功能、肾功能以外,对肠、肝脏、肾脏等的组织病变进行调查。再者,实验重复进行3次。
图24是表示所述CT-26细胞的移植与治疗药的施用日程表的图,表示将移植CT-26细胞的日期设为“第0日”,在该日期的3日后、7日后、11日后、15日后进行所述治疗药的腹腔内施用,在18日后屠宰小鼠。
图25是表示测定所述血液中的白蛋白浓度(图25的(a))、总胆红素浓度(图25的(b))、AST(GOT)浓度(图25的(c))及ALT(GPT)浓度(图25的(d))的结果的图。图26是表示测定所述血液中的LD(LDH)浓度(图26的(a))、肌酐浓度(图26的(b))、ALP浓度(图26的(c))及尿酸浓度(图26的(d))的结果的图。图27是表示测定所述血液中的尿素氮浓度的结果的图。再者,图中的“阴性对照(Negative Control)”是使用未进行CT-26细胞的移植及治疗药的施用的健康小鼠(以下称为“健康对照群组”)的血液的情况的结果。
如图25的(a)的“αCTLA-4+αPD-L1”所示,在施用100μg的抗CTLA-4抗体及200μg的抗PD-L1抗体的所述群组2中,与健康对照群组相比,血中白蛋白浓度显著地下降。图28的(a)~(d)是表示所述群组1~群组4的小鼠的肝脏的利用苏木精伊红(HE)的组织染色结果的图,倍率为200倍。
将所述群组2的肝脏的组织的观察结果示于图28的(b)中。在该群组的所有小鼠中,与图28的(b)同样地,可看见多个细胞分裂像。图25的(a)及图28的(b)中所示的结果表示抗CTLA-4抗体及抗PD-L1抗体具有肝组织损伤等副作用的可能性。
另外,如图26的(b)的“αCTLA-4+αPD-L1”所示,在所述群组2中存在血中肌酐高的倾向,可想到对于肾脏也会有引起轻度的损伤的可能性。
另一方面,在将抗CTLA-4抗体及抗PD-L1抗体与IL-18组合施用的群组(群组3、群组4)中,如图25的(a)中所示,血中白蛋白浓度与健康小鼠几乎相同。另外,如图28的(c)、(d)中所示,也未见肝脏组织中的细胞分裂像。进而,如图26的(b)中所示,关于血中肌酐,在群组3、群组4中也与健康对照群组大致相同。血中的尿素氮如图27中所示,在群组3中可看见抑制倾向。
如图26的(c)、图25的(d)中所示,血中ALP及血中ALT(GPT)的值在仅移植癌细胞而未实施治疗的群组(图中由“PBS”所表示的所述群组1)中显著下降,但在群组3及群组4中显示出与健康对照群组的值接近的值。另一方面,关于群组2,血中ALP与群组1几乎无变化,血中ALT(GPT)比群组1显著下降。根据图26的(c)、图25的(d)的结果,暗示在群组3及群组4中,用IL-18改善了血中ALP及血中ALT(GPT)的值。
本实施例的结果表示抗CTLA-4抗体与抗PD-L1抗体的组合带来作为副作用的对肝脏、肾脏等造成损伤的可能性,且暗示IL-18抑制了所述副作用或促进了从损伤中的修复。关于抗CTLA-4抗体与抗PD-L1抗体中的哪种抗体与组织损伤相关等问题,今后需要进行进一步的研究。
如上所述,在所述群组2中,白蛋白、ALT(GPT)及ALP的血中浓度比健康对照群组大幅度下降,肌酐的血中浓度比健康对照群组大幅度增加。另一方面,关于所述群组3及群组4,在群组4中显示出AST(GOT)比健康对照群组增加的倾向(图25的(c)),在群组3中显示出尿素氮比健康对照群组得到抑制的倾向(图27)。另外,关于尿酸,在群组3及群组4中比健康对照群组有所增加(图26的(d))。
但是,鉴于在图25~27中所示的9个项目之中,在群组2中4个项目的结果大幅度背离健康对照群组,以及群组3与群组4与健康对照群组相比结果较差的均仅为尿酸的情况,综合来看,可认为所述群组3及群组4中所使用的治疗药的副作用比群组2中所使用的治疗药少。
图29及30、图31、图32、图33、图34分别表示胃、十二指肠、小肠、大肠、肾脏用苏木精伊红(HE)的组织染色结果,在图29~34中,(a)~(d)分别表示对所述群组1~群组4的小鼠的组织进行观察的结果。根据图29~34可知,胃、十二指肠、小肠、大肠及肾脏的组织在群组1~群组4之间几乎未见差异。
[实施例17:癌治疗药对于B16黑色素瘤细胞的转移的效果]
B16黑色素瘤细胞(黑色素瘤)经常用作癌的转移模型。在本实施例中,从小鼠(C57BL/6,日本SLC)的尾静脉移入B16黑色素瘤细胞(2×105个),在几周后清点肺中所形成的黑的小结节(小瘤)的数量并测定转移的多少。
B16黑色素瘤细胞的细胞系使用从ATCC购入者,通过与实施例1中记载的方法相同的方法,制备细胞浓度为2×105个/0.25ml的悬浮液,并将该悬浮液0.25ml注射至所述C57BL/6小鼠的尾静脉中。
作为所述小鼠的治疗药,分成施用0.25ml的作为对照的PBS的群组(群组1);施用100μg的抗CTLA-4抗体及200μg的抗PD-L1抗体的群组(群组2);施用100μg的抗CTLA-4抗体、200μg的抗PD-L1抗体及IL-18(2μg)的群组(群组3),各群组由4只小鼠组成。再者,PBS、抗CTLA-4抗体、抗PD-L1抗体及IL-18的施用量(μg)是每25g的小鼠体重的施用量。
图35是表示B16黑色素瘤细胞的移植与治疗药的施用日程表的图,表示将移植B16黑色素瘤细胞的日期设为“第0日”,在该日期的3日后、7日后、11日后、15日后进行所述治疗药的腹腔内施用,在28日后屠宰小鼠。
从所屠宰的小鼠中摘出肺,清点肺中所生成的黑的小结节(小瘤)的数量并测定转移的多少。图36~38分别是表示对所述群组1~群组3的小鼠的肺中所生成的小结节进行观察的结果的图,各图的(a)~(d)表示供试的4只小鼠的结果。
对照群组(所述群组1)中的肺表面的小结节的数量平均为233+/-22.6,但在从B16黑色素瘤细胞的移植3日后起每4日施用抗CTLA4抗体及抗PD-L1抗体共计4次的群组(所述群组2)中为179+/-14.0,在施用抗CTLA4抗体、抗PD-L1抗体及IL-18的群组(所述群组3)中为121+/-42.7。
相对于所述群组2的结果,所述群组3的结果未显示出统计学上的显著差异,但根据图37与图38的对比可知,群组3比群组2更抑制了向脏器的转移。根据该结果,虽然在本实施例中供试了4只小鼠,但可认为通过进一步增加供试的小鼠的数量,或如实施例1般经时地求得从移植B16黑色素瘤细胞的日期起的小鼠的生存率,十分有可能会显示出所述显著差异。
再者,在向腹腔内施用抗CTLA4抗体及抗PD-L1抗体,在皮下施用IL-18的情况下,所述群组3的治疗效果与将所述抗体及IL-18一并进行腹腔内施用的情况也无不同。可认为其原因在于:由于所述抗体及IL-18均向血中转移,因此不论施用路径如何均显示出相同的效果。
[总结]
如实施例中所示,已明确本发明的癌治疗药通过将抗CTLA-4抗体、抗PD-L1抗体等分子靶向抗体与IL-18并用,在癌腹膜播散模型中显示出非常优异的抗肿瘤效果。除此以外,在肺转移模型或实体癌模型中也同样地显示出强的抗肿瘤效果。可认为其原因在于:IL-18显著地提高了分子靶向抗体的治疗效果。
即,可认为IL-18在移入有肿瘤细胞的小鼠的腹腔中促进了CD8阳性T细胞、NK细胞等效应细胞的活化或增殖,由此提高了分子靶向抗体的治疗效果。
尤其,暗示了B220阳性、DX5阳性、CD11c阳性的NK样细胞(被称为IKDC。IKDC是Interferon introducing killer dendritic cells(干扰素诱导的杀伤树突状细胞)的略称)由IL-18引起的增加与由所述并用所带来的抗肿瘤效果的增大相关。
另一方面,可认为由于所述并用抑制了CD4阳性T细胞的增殖,因此不会因所述并用而促进Treg等具有免疫/炎症抑制作用的淋巴球的增殖。
另外,施用抗CTLA-4抗体及/或抗PD-L1抗体、以及IL-18的小鼠健康,未见体重减少等,在肠等器官中未见强烈的自身免疫样的病变。另外,对肝功能、肾功能及组织病变进行研究的结果,已确认可认为本发明的癌治疗药的副作用少。
根据以上所述,本发明的癌治疗药可以说是显示出优异的抗肿瘤效果的有用的治疗药,尤其,可以说对于伴有腹膜播散的癌的治疗有效。
[产业上的可利用性]
本发明可有效地用于癌的治疗,特别是伴有腹膜播散的癌的治疗。可在医药及与其相关的领域中广泛利用。
序列表
<110> 学校法人兵库医科大学
<120> 并用IL-18与分子靶向抗体的癌治疗药
<130> FP1V170038ZX/JPHA/HF
<150> JP2014-161799
<151> 2014-08-07
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 157
<212> PRT
<213> 智人
<400> 1
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Met Tyr Lys Asp Ser Gln Pro Arg Gly Met Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Ser Val Pro Gly His Asp Asn Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 2
<211> 157
<212> PRT
<213> 鼠
<400> 2
Asn Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Thr Asp Ile Asp Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Gln Lys Arg Val Pro Gly His Asn Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
- 还没有人留言评论。精彩留言会获得点赞!