假体植入物输送装置的制作方法
本发明涉及医疗方法和装置,更具体地涉及用于经皮植入瓣膜的方法和装置。
背景技术:
循环系统是动脉血管和静脉血管的闭环床,通过毛细血管床将氧和营养输送到人体末梢。循环系统的驱动器是心脏,心脏根据人体需要向循环系统提供正常压力并调节流量。脱氧血首先通过右心房进入心脏,并且被允许经过三尖瓣而进入右心室。一旦进入右心室内,心脏输送该血液通过肺动脉瓣膜到达肺,以进行氧气交换。循环压力将血液经肺静脉而运载回心脏,进入左心房。随着二尖瓣膜打开,填充左心房,允许将血液抽入左心室,以通过主动脉瓣排出并输送到人体末梢。当心脏不能持续地形成正常流动和压力时,出现通常称为心力衰竭的疾病。
心脏的四个瓣膜(即三尖瓣膜、肺动脉瓣膜、二尖瓣膜和主动脉瓣膜)的功能是以确保血液仅在一个方向上流动心脏。瓣膜由随着心脏收缩打开和关闭的组织薄片形成。心脏瓣膜病是包括心脏瓣膜中一个或多个瓣膜的疾病过程。例如,疾病和年龄可能引起心脏瓣膜组织增厚和硬化,这可能引起瓣膜不能完全打开并且干扰血液流动。该增厚过程通常称为狭窄。心脏瓣膜也可能弱化或伸长,从而不能完全关闭,这可能使得血液通过瓣膜渗漏回流。这种通过瓣膜的渗漏通常称为心脏瓣膜回流。心脏瓣膜的问题可能增加心脏的工作量。工作的增加导致心肌增大或增厚,以补偿额外的工作负荷。
更换不正确工作瓣膜的标准治疗是置换瓣膜。传统地,瓣膜置换经由开放式外科手术而完成。近来,经由导管的瓣膜置换已经尝试了经由诸如导管插入术或者使用脉管系统路径的输送机构的经皮方法。开放式外科手术通常包括将新瓣膜缝合至现有组织结构,以进行固定。进入这些位置通常包括用于患者的胸廓切开术或者胸骨切开术,并且包括大量恢复时间。这种开放式心脏外科手术可以包括在外科手术期间对患者进行心脏塔桥以使得血流持续流向关键器官,诸如大脑。虽然开放式心脏手术瓣膜修复和置换可以成功地治疗患有瓣膜功能不全的许多患者,但是当前使用的技术伴有由于开放式心脏外科手术固有的侵入性而引起的重大发病率和致死率。
根据最近的估计,在美国的医院,每年有79000多患者被诊断患有主动脉瓣膜和二尖瓣膜疾病。在美国,每年进行49000多例二尖瓣膜或主动脉瓣膜置换手术,以及相当大量的心脏瓣膜修复手术。由于外科手术技术具有高侵入性,长久以来已经意识到需要一种微创的心脏瓣膜置换方法。如上所述,目前,经导管的心脏瓣膜系统已经得以发展,在此系统中,心脏瓣膜通过血管内导管被输送通过心脏。这种经导管心脏瓣膜有潜力降低尤其是年长和/或具有并发症的患者经历传统瓣膜外科手术而相关的预期致死率和发病率。然而,仍然需要对经导管心脏瓣膜置换的基本概念进行改进。例如,目前的经导管瓣膜置换有时可能导致血管并发症,诸如主动脉夹层、通路位置或者通路相关血管和/或血管源末梢栓塞。用于减少这种并发症的一个方法是减少心脏瓣膜的输送装置的直径比例。
技术实现要素:
一个实施例包括一种输送系统,用于输送心血管假体植入物。输送系统可以包括输送导管,其具有带有近端部分的外套管以及至少局部延伸通过外套管的内套管。内套管可以具有近端部分。手柄可以位于输送导管的近端部分处。螺杆部件可以至少局部地位于手柄内。螺杆部件可以配置以围绕手柄内的轴旋转。螺杆部件可以包括内螺纹。托架可以位于螺杆部件内,并且可以与内螺纹啮合。托架耦联至外套管的近端部分。对准部件位于螺杆部件内。对准部件连接托架用于当螺杆部件旋转时限制托架围绕轴进行旋转。螺杆部件在第一方向上围绕轴旋转,使得托架在螺杆部件内在第一纵向上移动,使得外套管在第一方向上相对于手柄移动。
另一实施例包括将假体植入物定位在心脏内的方法。该方法可以包括将具有定位在外护套内的人工瓣膜的输送导管推进进入患者血管系统;经管腔地推进人工瓣膜至靠近心脏原生瓣膜附近的位置;并且随着旋转螺杆部件,通过旋转定位在输送导管的手柄内的螺杆部件以缩回外套管而使得耦联至外套管并且定位在螺杆部件内的托架缩回至螺杆圆筒内,以展开人工瓣膜。
另一实施例包括用于导管系统的手柄,其包括第一部件和第二部件。手柄可以包括螺杆部件,定位在手柄内并且配置以围绕轴旋转。螺杆部件包括内螺纹。托架定位在螺杆部件内。托架啮合内螺纹,并且耦联至第一部件。对准部件在螺杆部件内延伸,以在螺杆部件旋转时限制托架围绕轴旋转。螺杆部件在第一方向上围绕轴旋转,使得托架在螺杆部件内在第一纵向上移动,从而使得第一部件在第一纵向上相对于手柄移动。
另一实施例包括相对于导管内套管缩回外套管的方法,其可以包括旋转位于输送导管的手柄内的螺杆部件,以使得托架耦联至外套管并且位于螺杆部件内,随着螺杆部件旋转时,线性地缩回至螺杆圆筒内。
结合随附附图和权利要求而阅读下文对实施例的详细描述,本发明的其他特征设置、实施例和优点将显而易见。
附图说明
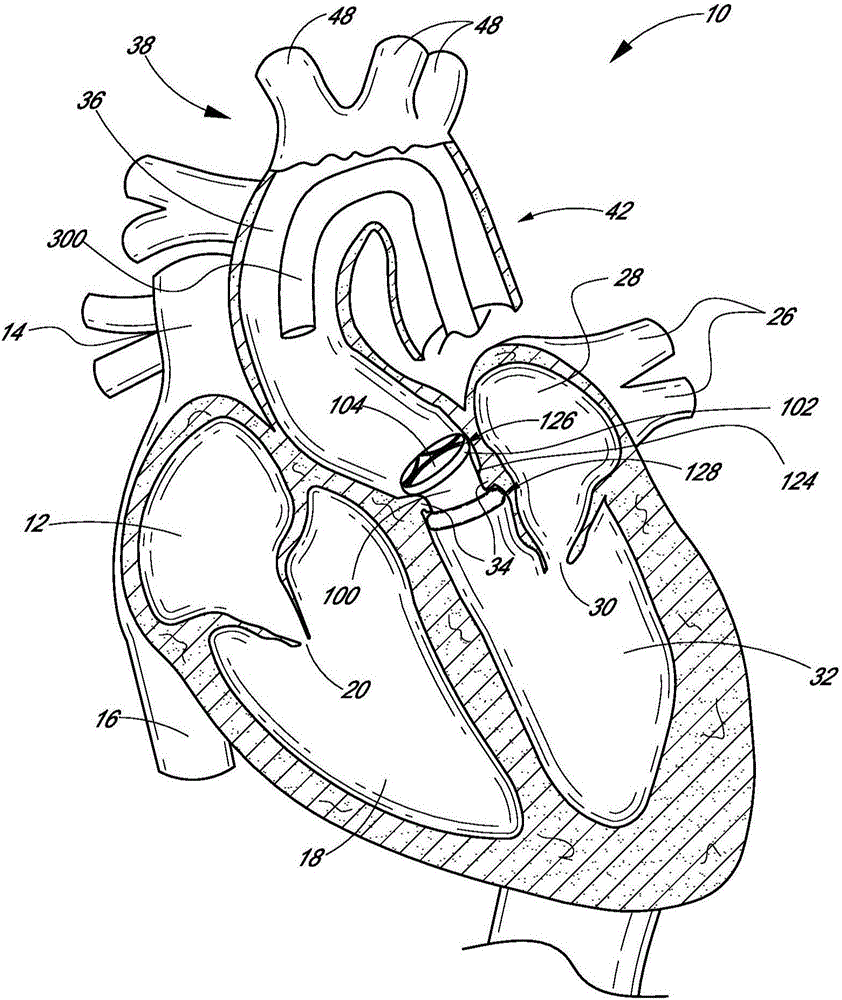
图1是心脏及其主要血管的横截面视图。
图2A是根据一个实施例的左心室和具有假体主动脉瓣膜植入物的主动脉的局部剖视图。
图2B是跨越原生主动脉瓣膜放置的图2A的植入物的侧视图。
图3A是图2B的植入物的前侧透视图。
图3B是图3A的植入物的可填充支撑结构的前侧透视图。
图3C是图3A的植入物的横截面视图。
图3D是图3C的上部的放大横截面视图。
图4是图3B的植入物内的连接端口和填充阀的横截面视图。
图5A是具有伸缩的植入物的展开导管的侧面透视图。
图5B是具有位于外套管护套外侧的植入物的图5A的展开导管的侧面透视图。
图5C是定位和填充内腔(PFL)的侧面透视图,其是图5A和5B的展开导管的部件。
图6是沿着图5B的线A-A截取的横截面视图。
图7是装载工具基底的侧面透视图。
图8A是具有收缩植入物的引入导管和展开导管的侧面透视图。
图8B是具有位于外套管护套外侧的植入物的图8A的引入导管和展开导管的侧面透视图。
图8C是定位和填充内腔(PFL)的侧视图,其是图8A和8B的展开导管的部件。
图9是图8A-8C的引入导管的侧视图。
图10A是图8A-8C的展开导管的侧视图。
图10B是密封组件的分解视图。
图11A示出了局部展开和定位人工瓣膜植入物的一个步骤。
图11B示出了局部展开和定位人工瓣膜植入物的第二步骤。
图11C示出了局部展开和定位人工瓣膜植入物的第三步骤。
图12A示出了展开、测试和再定位人工瓣膜植入物的步骤。
图12B示出了展开、测试和再定位人工瓣膜植入物的步骤。
图12C示出了展开、测试和再定位人工瓣膜植入物的步骤。
图12D示出了展开、测试和再定位人工瓣膜植入物的步骤。
图12E示出了展开、测试和再定位人工瓣膜植入物的步骤。
图13示出了展开系统的另一实施例的侧视图。
图14示出了展开系统的另一实施例的侧视图。
图15A示出了展开系统的另一实施例的侧视示意图。
图15B是图15A的系统的横截面示意图。
图16A是包括外套管、旋钮和手柄的展开系统的另一实施例的顶视图。
图16B是省略外套管的图15的展开系统的俯视图。
图17是图16B的展开系统的仰视图。
图18是移除了手柄顶盖的图17的展开系统的仰视图。
图19是移除了手柄底盖的图17的展开系统的前部部分的侧视图。
图20A是移除了手柄顶盖的图16B的展开系统的俯视图。
图20B是图20A的一部分的近视图。
图21是图16B的展开系统的旋钮、螺杆部件、托架、追踪部件和锁定机构的分解侧视图。
图22是图16B的展开系统的一些部件的分解侧视图。
图23是图16B的展开系统的一些部件的分解侧视图。
图24A和24B示出了托架在图15的展开系统的手柄内的移动,省略了螺杆部件和旋钮。
图25A是螺杆部件和移除顶盖的手柄一部分的侧视图。
图25B是位于螺杆部件内的托架的侧视图。
图25C是位于螺杆部件内的托架的前视图。
图26A是位于旋钮内的螺杆部件的侧视图。
图26B是位于旋钮内的螺杆部件处于不同横截面的侧视图。
图26C是位于旋钮内的托架螺杆部件的后视图。
图27是托架的后侧透视图。
图28是托架的前侧透视图。
图29是处于锁定位置的锁定机构的前侧透视图。
图30是处于未锁定位置的锁定机构的前侧透视图。
图31是图29的锁定机构的分解前视图。
具体实施方式
图1是心脏10的解剖结构和主要血管的示意性横截面视图。由上腔静脉14和下腔静脉16将脱氧血液输送至心脏10的右心房12。右心房12中的血液通过三尖瓣膜20进入右心室18。一旦进入右心室18内,心脏10输送该血液通过肺动脉瓣膜22而到达肺动脉24并输送到肺中,以进行氧气的气体交换。循环压力将该血液经由肺静脉26而运载回心脏,进入左心房28。随着二尖瓣膜30打开,填充左心房28,允许将血液抽入左心室32,以通过主动脉瓣膜34排出并且通过主动脉36排至人体末梢。当心脏10不能持续地形成正常流动和压力时,出现了通常称为心力衰竭的疾病。
心力衰竭的一个原因是心脏10的一个或多个瓣膜发生故障或机能障碍。例如,主动脉瓣膜34可能因多种原因而发生机能障碍。例如,主动脉瓣膜34可能是天生异常(例如二瓣化、钙化、先天性主动脉瓣膜疾病),或者其可随着年龄增加而患病(例如获得性主动脉瓣膜疾病)。在这种情况下,可能需要更换异常或患病瓣膜34。
图2是左心室32的示意图,其通过主动脉瓣膜34将血液输送至主动脉36。主动脉36包括(i)升主动脉38,其升起自心脏10的左心室32,(ii)主动脉弓40,其从升主动脉38弯成弓形,以及(iii)降主动脉42,其从主动脉弓40朝向腹主动脉(未示出)下降。同样示出了主动脉14的主分支,其包括立刻分成右颈动脉(未示出)和右锁骨下动脉(未示出)的无名动脉44、左颈动脉46和左锁骨下动脉48。
可填充主动脉瓣膜植入物
继续参考图2A,示出了根据一个实施例的心血管假体植入物800,横跨原生异常或患病主动脉瓣膜34。下文将详细描述植入物800及其经修改的实施例。如下文更详细说明,可以使用血管内输送导管900或者用反式套管针经心尖途径而微创地输送植入物800。更多的细节,植入物或输送系统的附加实施例和/或修改可以在美国专利号No.7641686/8012201和美国公开号No.2007/0005133、2009/0088836和2012/0016468中公开,所述这些专利和公开文献的全部内容以引用方式并入本文。
下文的描述将首先介绍置换或修复异常或患病主动脉瓣膜34。然而,正如本领域技术人员在本文公开内容的教导下将意识到,本文公开的方法和结构的各个特征和方面可应用于置换或修复心脏10的二尖瓣膜30、肺动脉瓣膜22和/或三尖瓣膜20。此外,本领域技术人员也将意识到,本文公开的方法和结构的特征和方面可以用于包括瓣膜,或者可以因增加瓣膜而获益的人体其他部分,诸如例如食道、胃、输尿管和/或囊泡、胆管、淋巴系统和肠道。
此外,将参考包括“远端”和“近端”方向的坐标系,描述植入物及其输送系统的各个部件。本申请中,远端和近端方向参考展开系统900,其用于输送植入物800,并且沿着与血液通过主动脉36的常规方向相反的方向使植入物经过主动脉36前进。因而,通常,远端指的是更靠近心脏,而近端指的是相对于循环系统更远离心脏。
在一些实施例中,植入物800可以是假体主动脉瓣膜植入物。参考图2B,在所示实施例中,植入物800的形状可见为管状部件或者双曲面形,其中腰部805排挤原生瓣膜34或者血管,而在近端,近端端部803形成环圈或环以密封血流防止其再进入左心室32。在远端,远端端部804也形成环圈或环以密封血液防止其向前流过流出通道。在两个端部803和804之间,可以将瓣膜104安装至套囊或主体802上,从而当填充时,植入物800排挤原生瓣膜34,或者延伸超过原生瓣膜34的先前位置,并且代替其功能。远端端部804可以具有适当的尺寸和形状,从而使其不干扰二尖瓣膜的正常功能,但是仍然充分地固定瓣膜。例如,在装置的远端端部804可以具有缺口、凹槽或切口,以防止二尖瓣膜干扰。可以设计近端端部803位于主动脉根部。在一种布置中,近端端部803可以如此成形,即其维持与主动脉根的壁具有良好的并置。这可以防止装置向后移动至心室32内。在一些实施例中,可以配置植入物800使其不延伸至如此高而干扰冠状动脉。
可以在近端端部803和远端端部804之间设置任意数量的附加可填充环或支柱。植入物800的远端端部804可以设置在左心室34内,并且可以利用主动脉根以提供轴向稳定性,因为植入物直径可能大于主动脉腔。该设置可能减少对吊钩、倒钩或者与血管壁的干涉匹配的需求。由于可以在没有用于径向扩张的可填充球囊的协助下设置植入物800,主动脉瓣膜34和血管可能不需要任何阻塞期间,并且能够向患者提供更大的舒适度,并且向医生提供更多的时间以精确地恰当地设置装置。由于在所示设置中,植入物800未利用具有单一配置选择的支撑部件,如塑性可形变或形状记忆金属支架,如果需要,可以移动或移除植入物800。这可以进行多次,直至植入物800永久地和输送导管900脱离,正如下文将更详细所述。此外,如下文将所述的,植入物800可以包括特征,以允许在导管900脱离之前,测试植入物800是否正确行使功能、密封以及尺寸。
参考图3A,所示实施例的植入物800基本上包括可填充套囊或主体802,其配置为与套囊802连接以支持瓣膜104(参考图2A)。在一些实施例中,瓣膜104是组织瓣膜。在一些实施例中,组织瓣膜的厚度等于或大于约0.011英寸。在另一实施例中,组织瓣膜的厚度等于或大于约0.018英寸。如下文更详细所述,瓣膜104可以配置以响应于心脏10泵送血液的血液动力学移动,而在“打开”结构和“关闭”结构之间移动,其中在“打开”结构,血液可以在第一方向上冲击植入物800,而在“关闭”结构中防止血液在第二方向上经瓣膜104回流。
在所示实施例中,套囊802可以包括薄弹性管状材料,诸如弹性织物或几乎没有尺寸完整性的薄膜。如下文将更详细所述,套囊802优选地可以在原处改变成支撑结构,植入物800的其他部件(例如瓣膜104)可以固定至其上,并且可能产生组织向内生长。如果未填充时,套囊802不能提供支撑。在一个实施例中,套囊802包括涤纶、PTFE、ePTFE、TFE或者聚酯织物,如在常规设备中可见,例如手术支架或支架瓣膜以及瓣膜成形术环。根据材料选择和编织,织物厚度的范围从约0.002英寸至约0.020英寸。编织厚度也可以从防止血液穿过织物的非常紧密的编织,调整至允许组织生长和完全围绕织物的松散的编织。在一些实施例中,织物的线性质量密度约为20丹尼尔(denier)或更低。
参考图3B-3D,在所示实施例中,植入物800可以包括可填充结构813,其由一个或多个可填充通道808形成。可填充通道808可以由一对不同的球囊环或螺环(807a和807b)以及支柱806而形成。在所示的实施例中,植入物800可以在套囊802的近端端部803处包括近端螺环807a,而在套囊802的远端端部804处包括远端螺环807b。螺环807可以以任何各种方式固定至套囊802。参考图3C和3D,在所示实施例中,螺环807可以固定在形成于套囊802的近端端部803和远端端部804处的折叠部801内。进而,折叠部801可以通过缝合或缝线812而固定。当已填充时,植入物800可以由围绕套囊802的系列支柱806而部分支撑。在一些实施例中,支柱806配置使得套囊上的部分基本上与螺环垂直。支柱可以缝合至套囊802上,或者可以封闭在由套囊材料制成的内腔中并且缝合在套囊802上。螺环807和支柱806一同可以形成一个或多个可填充通道808,该可填充通道由气体、液体或者填充介质来填充。
参考图3B,可填充通道可以配置使得当植入物800压缩或处于缩回状态时减小其横截面轮廓。例如,可填充通道808可以设置成阶梯功能模式。可填充通道808可以具有三个连接端口809,用于经由定位和填充内腔管道(PFL)916(参见图5A-5C)而耦联至输送导管900。在一些实施例中,至少两个连接端口809还作为填充端口,而填充介质、空气或液体可以通过这些端口而引入可填充通道808。PFL管道916可以经由合适的连接机构而连接至连接端口809。在一个实施例中,PFL管道916和连接端口809之间的连接是螺纹连接。在一些实施例中,填充阀810处于连接端口809内,并且在PFL管道脱离之后可以阻止填充介质、空气或液体漏出可填充通道808之外。在一些实施例中,远端螺环807b和近端螺环807a可以独立填充。在一些实施例中,可以分别从支柱806以及近端螺环807a填充远端螺环807b。在将植入物放置在植入位置期间,单独填充可能是有用。参考图3C和3D,支柱806的部分可以平行于螺环807,并且可以封装在植入物800的折叠部801内。该设置还有助于在压缩或折叠植入物时减小横截面轮廓。
如上所述,可填充环或螺环807和支柱806可以形成可填充结构813,其进而限定可填充通道808。可填充通道808可以接收填充介质,以通常地为可填充结构813填充。当已填充时,可填充环807和支柱806可以为可填充植入物800提供结构支撑和/或协助将植入物800固定在心脏10内。未填充时,植入物800基本上是薄、柔软无定形组件,其优选不能支撑并且有利地能够呈小的、减小的轮廓形状,在此形式下,可以经皮地插入体内。如下文更详细所述,在已修改的实施例中,可填充结构813可以包括可填充通道808的任意不同结构,其可以由其他可可填充部件形成,作为图3A和3B中所示的可填充环807和支柱806的附加或者备选方案。在一个实施例中,瓣膜具有扩张的直径,其大于或等于22毫米,并且最大压缩直径小于或等于6毫米(18F)。
特别参考图3B,在所示实施例中,远端环807b和支柱806可以连接,从而远端环807b的可填充通道808与一些支柱806的可填充通道808流体连通。近端环807a的可填充通道808也可以与近端环807a的可填充通道808以及一些支柱806连通。这样,(i)近端环807a和一些支柱806的可填充通道可以独立于(ii)远端环807b和一些支柱来填充。在一些实施例中,近端环807a的可填充通道可以与支柱806的可填充通道连通,而远端环807b的可填充通道与支柱的可填充通道不连通。如下文更详细所述,两组可填充通道808可以连接至独立的PFL管道916,以有利于独立填充。应当意识到,在修改的实施例中,可填充结构可以包括更少(例如,一个共同的可填充通道)或者多个独立的可填充通道。例如,在一个实施例中,近端环807a、支柱806和远端环807b的可填充通道可以彼此流体连通,从而它们可以由单一填充装置填充。在另一实施例中,近端环807a、支柱806和远端环807b的可填充通道可以均隔离,并且因而使用三个填充装置。
参考图3B,在所示实施例中,近端环807a和远端环807b的每一个的横截面直径均约为0.090英寸。支柱的横截面直径可以约为0.060英寸。在一些实施例中,可填充通道808内还容纳了阀系统,其在单一方向液体无泄漏或者通过的情况下允许加压。在图3B所示的实施例中,两个端部阀和填充阀810可以位于可填充通道808靠近连接端口809的每个端部分处。这些端部阀810用于填充和交换流体,诸如盐水、造影剂和填充介质。该可填充通道808的长度可以根据植入物800的尺寸以及几何形状的复杂性而改变。填充通道材料可以使用热或压力由材料吹制而成,所述材料诸如尼龙、聚乙烯、Pebax、聚丙烯或者将维持耐压的其他常规材料。引入的流体用于形成支撑结构,如果没有流体,植入物800可以是未确定的织物和组织组件。在一个实施例中,首先用盐水和造影剂填充可填充通道808,用于在荧光检查下进行不透射线的显像。这可以使得植入物800在置入位置定位更容易。该流体借助于诸如内扩张器的填充装置或其他装置而从导管900的近端引入,以受控的方式对流体加压。该流体可以通过PFL管道916而从导管900的近端传输,所述PFL管道916在连接端口809的每个可填充通道808的端部连接至植入物800。
参考图3B,在所示实施例中,可填充通道808可以在每个端部具有端部阀810(即填充阀),由此它们可以与PFL管道916分离,因而使导管和植入物脱离。该连接可以是螺杆或螺纹连接、夹头系统、干涉配合或在两个部件(即端部阀810和PFL管道916)之间形成可靠固定的其他装置和方法。在可填充通道808的端部之间可以设置附加方向阀811,以允许流体在单一方向上通过。这允许填充可填充通道808的每个端部并且流体在单一方向上移动。一旦植入物808置于所需的位置,并且采用盐水和造影剂填充时,该流体可以由能够凝固或硬化的填充介质所替换。因为从导管900的近端端部可以引入填充介质,所以包含盐水和造影剂的流体可以从可填充通道808的一端被推出。一旦填充介质完全取代第一流体,那么PFL管道就可以与植入物800脱离,而植入物800维持填充和受压。可以由位于可填充通道808的每个端部处的整体阀(即端部阀810)而维持植入物800内的压力。在所示实施例中,该端部阀810可以具有球体303,并且就位以在连接时允许流体通过且当脱离时进行密封。在一些情况下,植入物800具有三个或多个连接端口809,但是仅其中两个连接有填充阀810。没有端部阀810的连接端口可以使用相同的连接装置,诸如螺杆或螺纹元件。在所示实施例中,由于该连接端口未用于与支撑结构813连通以及对其进行填充,故不需要填充阀810。在其他实施例中,所有三个连接端口809可以具有填充阀810,用于引入流体或填充介质。
参考图4,端部阀系统810可以包括管状部分312,其具有柔软密封件304和球体303以形成密封机构313。在一个实施例中,管状部分312长度约为0.5cm至约2cm,外径约0.010英寸至约0.090英寸,壁厚约0.005英寸至约0.040英寸。材料可以包括许多聚合物,诸如尼龙、聚乙烯、聚醚酰胺、聚丙烯或者其他常规材料,诸如不锈钢、镍钛合金或用于医疗装置的其他金属材料。软密封材料可以引入为液体硅树脂或可发生固化的其他材料,因而允许穿过密封材料进行去心或打孔以形成的中心内腔而构建通孔。软密封件304可以粘附至具有便于流体流动的通孔的管状部件312的壁内径。球体303可以在管状部件312的内径内移动,其在一个端部密封压力下位于可填充通道内,并且随着引入PFL管道916被移动至另一个方向上,但是不允许移动过远,因为止动环或球形止动件305防止球体303移动进入可填充通道808内。由于PFL管道916通过螺纹连接至连接端口809内,球体303移动至开放位置,以允许可填充通道808和PFL管道916之间形成流体连通。当脱离时,球体303可以抵靠柔软密封件304移动,并且停止可填充通道808外部的任何流体连通,使得植入物800受压。其他实施例可以使用弹簧机构以使得球体返回密封位置,并且可以使用其他形状的密封装置,而不是球体。还可以使用鸭嘴型密封机构或片状阀,以阻止流体泄漏,并且向植入物提供封闭系统。在Bishop等人的美国专利公开号No.2009/0088836中已经描述了其他端部阀系统,所述文献在此全文引入作为参考。
所示实施例的植入物800与目前可获得方案相比,能够以较小轮廓和更安全的方式经由导管插入术而输送人工瓣膜。当经由输送导管900将植入物800输送至位置时,植入物800是需要重构和定形的薄的、基本上未定型组件。在植入位置处,可以经由输送导管900的PFL管道将填充介质(例如流体或气体)添加至可填充通道808,对植入物800进行重构和定型。因而,填充介质可以包括在填充时用于植入物800的部分支撑结构。插入可填充通道808内的填充介质可以在原处加压和/或凝固,以对植入物800提供重构。在授予Block的美国专利号No.5554185和Bishop等人的美国专利公开号No.2006/0088836中可以发现植入物800的其他细节和实施例,所述文献在此全文引入作为参考。
套囊802可以由许多不同的材料制成,诸如涤纶、TFE、PTFE、ePTFE、金属编织物、编织结构或者其他通常可接受的可植入材料。可以使用热、(直接或间接)烧结技术、激光能源、超声技术、模制或热压成形技术,而将这些材料浇铸、挤压或焊合在一起。由于可填充通道808通常围绕套囊802,而可填充通道808可以由分离部件(例如球囊和支柱)形成,这些可填充通道808的连接或封装可以与套囊材料紧密接触。在一些实施例中,可填充通道808被封装进折叠部801或者由套囊材料制成的并被缝合至套囊802的内腔。这些可填充通道808还可以通过密封套囊材料以由套囊802自身形成整体内腔。例如,通过将诸如硅树脂层的材料添加至诸如涤纶的多孔材料上,织物可以抵抗流体穿透或者在密封时维持压力。还可以添加材料至薄片或圆筒形材料,以形成流体密封屏障。
可以制备各种形状的套囊802以最佳匹配人与人之间的解剖结构的差异。如上所述,这些可以包括简单的圆筒、双曲面、中部直径大且一端或两端直径小的装置、漏斗形结构或者符合原生解剖结构的其他形状。植入物800的形状优选具有波状外形,以啮合原生解剖结构的特征,而防止装置在近端或远端方向上移动。在一个实施例中,装置啮合的特征是主动脉根或主动脉球34(例如参见图2A),或者冠状动脉窦。在另一实施例中,装置啮合的特征是原生瓣膜环面、原生瓣膜或者原生瓣膜的一部分。在一些实施例中,植入物800啮合以防止移动的特征的直径差在1%和10%之间。在另一实施例中,植入物800啮合以防止移动的特征的直径差在5%和40%之间。在一些实施例中,直径差由植入物800的自由形状所限定。在另一实施例中,直径差仅防止在一个方向上的移动。在另一实施例中,直径差防止在两个方向上的移动,例如近端的和远端的,或者倒退的和前进的。类似于外科手术瓣膜,植入物800的直径范围从约14mm至约30mm在其中瓣膜104的瓣片安装于其上的植入物800的部分中,高度范围从约10mm至约30mm。植入物800置于主动脉根中替换的部分的直径优选更大,范围从约20mm至约45mm。在一些实施例中,当完全填充时,植入物800的外径可以大于约22mm。
在一些实施例中,当植入物800填充时,套囊、填充结构可以(至少局部地)符合患者的解剖结构。这种设置可以在患者解剖结构和植入物800之间提供了更好的密封。
可能需要不同直径的人工瓣膜以替换各种尺寸的原生瓣膜。对于解剖结构中的不同位置,还将需要不同长度的人工瓣膜和锚定装置。例如,由于冠状动脉口(左右主动脉)的位置,设计用于置换原生主动脉瓣膜的瓣膜需要具有相对短的长度。由于肺动脉允许额外长度,设计以置换或者补充肺动脉瓣膜的瓣膜可能需要更大的长度。在Bishop等人的美国专利公开号No.2009/0088836中已经描述了可能有助于锚定植入物800的不同锚定机构。
在本文所述的实施例中,可填充通道808可以配置使得它们横截面为圆形、椭圆形、方形、矩形或者抛物线形。圆形横截面的直径范围可以从0.020英寸至约0.100英寸,而壁厚范围可以从约0.0005英寸至约0.010英寸。根据所需的套囊厚度和所需的强度,椭圆形横截面可以具有二比一或三比一的长宽比。在可填充通道808由球囊形成的实施例中,这些通道808可以由常规球囊材料制成,诸如尼龙、聚乙烯、PEEK、硅树脂或其他通常可接受的医疗装置材料。
在一些实施例中,套囊或主体802的部分可以是不透射线的,以有助于显像植入物800的位置和方向。可以使用由铂金或钽或其他合适材料制成的标记物。这些可以用于识别瓣膜必须正确定位的关键区域,例如对于主动脉瓣膜,瓣膜结合处可能需要相对于冠状动脉正确定位。此外,在手术期间,可能有利地是使用不透射线的尖头引导导管对冠状动脉插管,从而可以显像冠状动脉口。可以开发特殊的导管,具有增强的辐射不可透过性,或者大于标准灌注孔。导管在近端部分的直径也可以减小,允许随着瓣膜展开导管引入。
如上所述,在输送期间,主体802可以弯曲且具有柔性的,提供较小的形状以安装在输送套管中。因而,主体802优选由生物兼容的薄软材料制成,并且在与原生组织接触处可以有助于组织生长。材料的一些实例可以是涤纶、ePTFE、PTFE、TFE、诸如不锈钢、铂、MP35N、聚酯或其他可植入金属或聚合物的编制材料。如上参考图2A所述,主体802可以是管状或双曲面形,以允许在套囊802的壁下方排挤原生瓣膜。在该套囊802中,可填充通道808可以连接至导管内腔,用于输送填充介质,以对植入物800限定或添加结构。瓣膜104定位在套囊802内,其配置以允许诸如血液的流体在单一方向上流动或者限制一个或两个方向上的流动。瓣膜104与套囊802的连接方法可以是通过常规缝合、粘合、焊接、介入或者行业普遍公认的其他装置和方法。
在一个实施例中,套囊802的直径在约15mm和约30mm之间,而长度在约6mm和约70mm之间。壁厚的理想范围在约0.01mm至2mm之间。如上所述,套囊802可以在原处从由可填充通道形成的或者聚合物或固体结构元件形成的部件而获得纵向支撑,以提供轴向分离。套囊802的内径可以具有固定尺寸,向瓣膜连接提供恒定尺寸,并且具有可预测的瓣膜打开和关闭功能。套囊802的外表面的部分任选地可以是适应性的,并且允许植入物800实现与原生解剖结构的干涉配合。
植入物800可以具有各种整体形状(例如,沙漏型以将装置固定在瓣膜环面周围的合适位置处,或者装置可以具有不同的形状以将装置固定在原生解剖结构的另一部分、诸如主动脉根的合适位置处)。不考虑植入物800的整体形状,可填充通道808可以位于植入物800的近端端部803和远端端部804处,优选形成近似环或螺环807的结构。这些通道可以由中间通道而连接,该中间通道设计为下列三项功能的任意组合:(i)向植入物800排开的组织提供支撑,(ii)向植入物800提供轴向和径向强度和硬度,和/或(iii)向瓣膜104提供支撑。可以优化可填充结构813的特定设计特征或方向以更好地行使每个功能。例如,设计可填充通道808以向装置的相关部分增加轴向强度,通道808在大体轴向上理想地定向。
套囊802和植入物800的可填充通道808可以以各种方法制备。在一个实施例中,套囊802由织物制成,类似于通常用于血管内移植物中使用的或者用于外科手术植入的假体心脏瓣膜的套囊的织物。对于套囊802的一些部分,织物优选编织成管形。织物还可以织成薄片。在一个实施例中,用于制备织物的纱线优选是捻线,但是也可以使用单丝或者编织纱线。纱线直径的有用范围从直径约0.0005英寸到直径约0.005英寸。取决于编织形成的紧密度。优选地,织物由每英寸约50至约500根纱线织成。在一个实施例中,织物管织成直径18mm,每英寸200根纱线或纬纱。每根纱线由PET材料制成的20根单丝制成。对于管的单一壁,该机织织物的最终厚度为0.005英寸。根据植入物800的所需轮廓和织物对血液或其他流体的所需可透性,可以使用不同的织法。可以使用任何生物兼容性材料以制备纱线,一些实施例包括尼龙和PET。其他材料或材料的组合是可行的,包括特氟龙、含氟聚合物、金属,诸如不锈钢、钛、镍钛诺、其他形状记忆合金、主要包括钴、铬、镍和钼的组合的合金。可以向纱线添加纤维以增加强度和辐射不可透性,或者输送药剂。织物管也可以通过编织处理而制备。
织物可以缝缝纫、缝合、密封、溶解、胶合或结合在一起以形成所需形状的植入物800。将织物的部分连接在一起的优选方法是缝纫。优选实施例使用聚丙烯单丝风险材料,直径约为0.005英寸。缝线材料的直径范围从约0.001英寸至约0.010英寸。在更高应力位置处可以使用更大的缝线材料,诸如瓣膜结合处连接至套囊之处。缝线材料可以是任何可接受植入物等级的材料。优选地,使用生物兼容性缝线材料,诸如聚丙烯。尼龙和聚乙烯也是常规使用的缝线材料。其他材料或材料的组合是可行的,包括特氟龙、含氟聚合物、金属,诸如不锈钢、钛、Kevlar/镍钛诺、其他形状记忆合金、主要包括钴、铬、镍和钼的组合的合金、诸如MP35N。优选地,缝合是单丝设计。还可以使用多股编织或交织缝线材料。许多缝合和缝纫模式是可行的,并且已经在各种文本中描述。优选的缝合方法是使用一些类型的锁式缝纫,其设计使得如果缝线在其长度的一部分断裂,则缝线的整个长度仍然保持解开。并且,缝线将仍然基本上执行其将织物层固定在一起的功能。
在一些实施例中,植入物800未配置有分离的球囊,作为代替,套囊802自身的织物可以形成可填充通道808。例如,在一个实施例中,直径类似于植入物800的所需最终直径的两个织物管设置彼此共轴。两个织物管缝合、熔合、胶合或者以其他方式耦联在一起形成通道808的模式,其适于形成可填充结构813的几何形状。在一些实施例中,织物管缝合成一定模式,从而织物管的近端端部和远端端部形成环形环或螺环807。在一些实施例中,植入物800的中间部分包含一个或多个以阶梯功能模式成形的可填充通道。在一些实施例中,织物管在植入物的中间部分缝合在一起,以形成可填充通道808,其在植入物800的端部部分垂直于螺环807。在Bishop等人的美国专利公开号No.2006/0088836中已经描述了制备植入物800的方法。
在图3A和3B的所示实施例中,支柱806设置使得远端环807a和近端环807b没有径向重叠。即,在所示实施例中,支柱808未增加填充结构的径向厚度,因为在远端环和近端环以及通道之间没有径向重叠,从而通道位于远端环807a和近端环807b限定的径向厚度包围内。在另一实施例中,支柱808在径向上比远端环807a和近端环807b更宽,从而远端环807a和近端环807b位于支柱806限定的径向厚度包围内。
在一个实施例中,瓣膜800可以通过具有18F或更小外径的展开导管而输送,并且当完全填充时,其有效孔口面积至少约1.0平方厘米;而在另一实施例中,至少约1.3平方厘米,并且在另一实施例中约1.5平方厘米。在一个实施例中,瓣膜800的最小横截面流动面积至少约1.75平方厘米。
瓣叶配件
返回参考图2A的实施例,瓣膜104优选是组织形心脏瓣膜,其包括尺寸稳定、预先对准的组织瓣叶配件。按照该结构,典型的组织瓣膜104可以包括多个组织瓣叶,其在尖端模板化并连接在一起,以形成尺寸稳定和尺寸一致的接合瓣叶配件。随后,在可能的单一过程中,配件的每个瓣叶可以与套囊802对准并且独立缝合至其上,在瓣叶尖端外周周围从一个缝合处的尖端均匀地缝合至相邻接合处的尖端。因此,被缝合的缝线作用类似于对齐的订书钉,所有这些缝合线均相等地承受沿着预先对准的接合瓣叶每一个的整个尖端作用的负荷力。一旦填充,套囊802可以用将会固化的填充介质及其相应压力支撑缝合处,形成类似于支架结构的系统。由此形成的最终植入物800可以通过将应力均匀地分布在从接合处到接合处的整个瓣叶尖端上,而减少瓣叶缝合处的应力和潜在疲劳。在一些实施例中,通过仅连接至套囊的织物,组织瓣膜耦联至可填充套囊802。
在一个实施例中,组织瓣叶未彼此耦联,而是独立连接至套囊802。
通过使用植入物800和本文使用的套囊802结构而形成,可以产生许多其他的的优势。例如,对于套囊802的每个关键区域,柔软性可以优化或定制。如果需要,可以使得接合组织瓣叶接合处或多或少地柔软,以允许在结束时或多或少地偏转以减轻组织上的应力或者较好地调节瓣膜的操作。类似地,整个植入物结构的基本径向硬度可以由压力或填充介质增加或减少,以保留植入物800的圆度和形状。
将瓣膜104连接至套囊802,可以以任何常规方法完成,包括缝合、环或护套连接、胶合、焊接、过盈匹配、通过机械装置和诸如部件间的捏合的方法而连接。在Huynh等人的公开申请(06/102944)或Lafrance等人的公开申请(2003/0027332)或者授予Peredo的美国专利号6409759中描述了这些方法的实例,所述文献在此引入作为参考。这些方法是瓣膜装置产业中基本已知和公认的。无论是组织、工程组织/机械或聚合物支撑的瓣膜,可以在包装之前或者在植入之前于医院中连接。一些组织瓣膜是天然瓣膜,诸如猪、马、牛或天然人瓣膜。大部分在诸如戊二醛的固定溶液中悬浮。
在一些实施例中,心脏瓣膜假体可以用柔软组织瓣叶或聚合物瓣叶构成。例如,假体组织心脏瓣膜可以从猪心瓣膜得到或者由其他生物材料制成,诸如牛或马心包膜。假体心脏瓣膜中的生物材料基本上具有能够提供层流式和非湍流血流的轮廓和表面特征。因而,与具有机械心脏瓣膜假体相比,不太可能发生血管内凝块。
天然组织瓣膜可以从动物种类得到,通常为哺乳动物,诸如人、牛、猪、犬、海豹或袋鼠。例如,这些组织可以从心脏瓣膜、主动脉根、主动脉壁、主动脉瓣叶、心包组织,诸如心包片、旁路分支、血管、人脐带组织等得到。这些天然组织通常是软组织,并且通常包括含胶原质的材料。这些组织可以是活组织、脱细胞化组织或再细胞化组织。组织可以通过交联而固定。固定提供了机械稳定,例如通过防止组织的酶降解。通常用戊二醛或甲醛来固定,但是可以使用其他固定剂,诸如其他双官能乙醛、环氧化物、京尼平及其衍生物。根据组织的类型、用途和其他因素,组织可以以交联或不交联的形式使用。通常,如果使用异种移植组织,组织交联和/或脱细胞化。在Bishop等人的美国专利公开号No.2009/008836中可以找到组织瓣膜的其他描述。
填充介质
根据所需的性能,可以使用任何不同的填充介质以使可填充结构813填充。通常,填充介质可以包括诸如水的溶液或水基液体,诸如CO2的气体,或者可以以第一相对低粘性引入到可填充通道808并且转换成第二相对高粘性的可硬化介质。通过任何已知的UV引起或催化剂启引起的聚合反应或者现有技术中已知的其他化学系统而实现粘性增大。根据所需的性能和耐久性,粘性增加处理的终点可以从凝胶至刚性结构之间的任意硬度。
有用的填充介质通常通过混合多种成分而形成,并且固化时间范围在数十分钟至约一小时,优选从约二十分钟至约一小时。这种材料可以是生物兼容性的,呈现长期稳定性(优选在活体内存活约十年),尽可能小的引起血栓风险,并且呈现了固化前和固化后的适当机械性能,适于套囊在活体内运作。例如,在凝固或固化之前,这种材料应当具有相对低粘性,以有助于套囊和通道填充过程。这种填充介质的所需固化后弹性模量从约50至400psi~平衡填充主体在活体内形成足够密封的需要,同时维持套囊的临床相关抗纵向弯曲性。填充介质理想地应当是不透射线的,即敏锐又持久,但是这并不是绝对必须的。
一组优选的可硬化填充介质是两部分环氧树脂。第一部分是环氧树脂混合物,包括第一芳香族二环氧化合物和第二脂肪族二环氧化合物。第一芳香族二环氧化合物在水环境中提供了良好的机械和化学稳定性,并且当与适当的脂肪族环氧树脂组合时可溶于水溶液中。在一些实施例中,第一芳香族二环氧化合物包括至少一个N-N双环氧苯胺基团或片段(N,N-diglycidylaniline)。在一些实施例中,第一芳香族二环氧化合物是任选地取代N,N-双环氧苯胺。取代基可以是缩水甘油氧基或N,N-二缩水甘油基苯胺-甲基(N,N-diglycidylaniline-methyl)。第一芳香族二环氧化合物的非限制性实例是N,N-二缩水甘油基苯胺、N,N-二缩水甘油基-4-缩水甘油氧基苯胺(N,n-diclycidyl-4-glycidyloxyaniline(DGO))和4,4'-亚甲基-双(N,N-二缩水甘油基苯胺)(MBD)等。
第二脂肪族二环氧化合物提供了低粘性和在水溶液中的良好溶解性。在一些实施例中,第二脂肪族二环氧化合物可以是1,3-丁二烯二环氧化物,缩水甘油醚或C1-5烷烃二醇缩水甘油醚。第二脂肪族二环氧化合物的非限制性实例为1,3-丁二烯二环氧化物,丁二醇二缩水甘油醚(BDGE),1,2-乙二醇二缩水甘油醚,缩水甘油醚等。
在一些实施例中,可以将附加第三化合物添加至第一部分环氧树脂混合物,以改进机械性能和耐化学性。在一些实施例中,附加第三化合物可以是芳香族环氧树脂,而不包含N,N二缩水甘油基苯胺。然而,随着附加芳香环氧树脂的浓度增加,环氧树脂混合物的可溶性也可以下降,并且粘性可以增加。优选的第三化合物可以是三甲烷(4-羟基苯基)三缩水甘油醚(THTGE)、双酚A二缩水甘油醚(BADGE)、双酚F二缩水甘油醚(BFDGE)或间苯二酚二缩水甘油醚(RDGE)。
在一些实施例中,附加的第三化合物可以是脂环族环氧化合物,优选地比第一芳香族二环氧化合物更可溶。与上述芳香族环氧树脂相比,其可以较少程度地增加机械性能和耐化学性,但是将不降低可溶性。这种脂环族环氧化物的非限制性实例是1,4-环己烷二甲醇二缩水甘油醚(1,4-cyclohexanedimethanol diclycidyl ether)和环氧环己烯二缩水甘油基1,2-环己烷二甲酸酯(cyclohexene oxide diglycidyl1,2-cyc1ohexanedicarboxylate)。类似地,在一些实施例中,出于相同的原因,可以添加具有三个或多个缩水甘油醚基团,诸如聚缩水甘油醚,作为附加第三化合物。聚缩水甘油醚可以增加交联,并且因而增强机械属性。
通常,随着第一芳香族二环氧化合物的浓度增加,环氧树脂混合物的可溶性减小以及粘性增加。此外,随着脂肪族二环氧化合物在环氧树脂混合物中的浓度增加,机械属性和抗化学性可以降低。通过调节第一芳香族二环氧化合物和第二脂肪族二环氧化合物的比例,本领域技术人员可以控制环氧树脂混合物和已硬化介质的所需属性。在一些实施例中,添加第三化合物还进一步允许调整环氧树脂属性。
可硬化填充介质的第二部分包括硬化剂,其包括至少一种脂环族胺。其提供了活化性、机械属性和耐化学性的良好组合。脂环族胺可以包括但不限于异佛尔酮二胺(IPDA)、1,3-二氨基环己烷(1,3-BAC)、二氨基环己烷(DACH)、正氨基乙基哌嗪(AEP)或正氨基丙基哌嗪(APP)。
在一些实施例中,可以将脂族胺添加至第二部分中,以增加反应率,但是可能减少机械属性和耐化学性。优选的脂族胺具有如下的化学结构式I):
其中每个R独立地选自C2-5烷基的支链或直链、优选C2烷基。本文所用的术语“烷基”是指完全饱和烃的基团,包括但不限于甲基、乙基、正丙基、异丙基(或异丙基)、正丁基、异丁基、叔丁基(或叔丁基)、正己基以及类似物的原子团。例如,本文使用的术语“烷基”包括由下列通式CnH2n+2限定的完全氢饱和的基团。在一些实施方案中,脂族胺可包括但不限于四亚乙基五胺(TEPA)、二亚乙基三胺和三亚乙基四胺。在一些实施例中,硬化剂还可以包括至少一种辐射不可透化合物,诸如碘苯甲酸。
在2011年5月18日提交的发明名称为“Inflation Media Formulation”的共同未决申请号No.13/110780中描述了可硬化填充介质的其他细节。在2000年2月1日Hubbell等人提交的、发明名称为“Biomaterials Formed by Nucleophilic Addition Reaction to Conjugated Unsaturated Groups”的美国专利申请序列号No.09/496231以及Hubbell等人的美国专利号6958212中也描述了其他合适的填充介质。所述每个专利在此全文引入作为参考。
下文列出了一种特殊的双组分介质。该介质包括:
第一部分-环氧树脂混合物
(1)N,N-二缩水甘油基-4-缩水甘油基氧基苯胺(DGO),其重量百分比为约10至约70%;特别是重量百分比为约50%,
(2)丁二醇二缩水甘油醚(BADGE),其重量百分比为约30至约75%;特别是重量百分比为约50%,以及任选地
(3)1,4-环己烷二甲醇二缩水甘油醚,重量百分比在约0至约50%。
第二部分-胺硬化剂
(1)重量百分比为约75至约100%的异佛尔酮二胺(IPDA),和任选地
(2)重量百分比为约0至约25%的二亚乙基三胺(DETA)。
混合的未固化填充介质优选粘性小于2000cps。在一个实施例中,基于环氧树脂的填充介质的粘性为100-200cps。在另一实施例中,填充介质的粘性小于1000cps。在一些实施例中,环氧树脂混合物的初始粘性小于约50cps,或者在混合之后小于30cps。在一些实施例中,在填充介质的两种成分混合后的前十分钟器平均粘性约50cps至约60cps。低粘性确保填充介质可以通过小直径展开导管的填充内腔而输送,诸如18Fr(French)导管。
在一些实施例中,球囊或可填充通道可以连接至导管的两端。这允许使用非凝固材料,诸如气体或液体,来预先填充球囊。如果选择气体,CO2或氦是可能的选择;这些气体用于填充主动脉内球囊泵。优选地,预先填充介质是不透射线的,从而可以由血管造影术确定球囊位置。通常在介入性心脏病中使用的造影剂也可以用于对大部分为液体的预填充介质增加足够的辐射不可透过性。当需要使得植入物永久并且交换预填充介质以成为永久填充介质,通过第一导管连接将永久填充介质注入可填充通道内。在一些实施例中,永久填充介质能够凝固成半固体、凝胶或固体状态。随着将永久填充介质引入可填充结构中,从第二导管连接排出预填充介质。导管连接设置使得随着引入永久填充介质,基本上排出所有的预填充介质。在一个实施例中,使用中间填充介质以防止预填充介质被截留在永久填充介质中。在一个实施例中,中间填充介质是气体,而预填充介质是液体。在另一实施例中,中间填充介质和预填充介质作为引物,以协助永久填充介质接合至可填充通道的内表面。在另一实施例中,预填充介质和中间填充介质作为隔离剂,以防止永久填充介质接合至可填充通道的内表面。
与预填充介质相比,永久填充介质具有不同的不透射线性。过于不够射线的装置趋向于在血管造影术下遮挡其他附近特征。在预填充步骤期间,可能需要清楚地显像可填充通道,因此可以选择非常不透射线的填充介质。在使用永久填充介质填充装置之后,优选采用较少不透射线的填充介质。随着将造影剂诸如心室或主动脉,较少不透射线的特征有利于显像正确的瓣膜功能。
图5A-5B示出了可用于输送植入物800的低截面轮廓输送导管900。通常,输送系统包括输送导管900,并且输送导管900可以包括具有近端端部和远端端部的细长柔软导管主体。在一些实施例中,导管主体的最大外径约为18Fr或更少,尤其在导管主体的远端部分(即展开部分)处更小。在一些实施例中,输送导管还在导管主体的远端端部包括心血管假体植入物800(例如如上配置)。在修改的实施例中,使用如上所述的心血管假体植入物800具有一些优点,本文所述的输送导管和输送系统的一些特征还可以用于使用支架或其他支撑结构和/或不适用填充介质的假体植入物中。
如本文所述,植入物800和输送系统900的一些特征尤为有利于促进在外径约18Fr(French)或更小的导管主体内输送心血管假体植入物,同时仍然维持组织瓣膜厚度等于或大于约0.011英寸和/或有效孔口面积等于或大于约1平方厘米,或者在另一实施例中1.3平方厘米,或者在另一实施例中1.5平方厘米。在这种实施例中,植入物800的扩张最大直径还可以大于或等于约22cm。在一些实施例中,在导管主体和植入物800之间存在至少一个连接。在一些实施例中,至少一个连接是PFL管道。在一个实施例中,输送系统可与0.0035英寸或0.0038英寸的导丝兼容。
通常,可以使用产业熟知的技术以挤压管制备输送导管900。在一些实施例中,导管900可以将编织或绕圈的金属丝和/或带集成在管道中,用于提供硬度和旋转扭转能力。硬度加强金属丝的数量可以是1至64根。在一些实施例中,使用的变质结构包括8至32根金属丝或带。如果在其他实施例中使用金属丝,直径范围可以从约0.0005英寸至约0.0070英寸。如果使用带,厚度优选小于宽度,带的厚度范围可以从约0.0005英寸至约0.0070英寸,而宽度范围可以从约0.0010英寸至约0.0100英寸。在另一实施例中,使用线圈作为硬度加强部件。线圈可以包括1至8根金属丝或带,其缠绕围绕管的外周,并且嵌入管内。金属丝可以缠绕,从而彼此平行并且处于管表面的弯曲平面内,或者多根金属丝可以在相反的方向上缠绕在不同的层中。用于线圈的金属丝或带的尺寸可以类似于用于编织物的尺寸。
参考图5A和5B,导管900可以包括具有近端端部902和远端端部903的外管状部件901,以及也具有近端端部905和远端端部906的内管状部件904。内管状部件904可以基本上延伸穿过外管状部件901,从而内管状部件904的近端端部902和远端端部903基本上延伸超过外管状部件901的近端端部902和远端端部903。外管状部件901的远端端部903可以包括套管护套912和从套管护套912向近端延伸的杆部区域917。在一些实施例中,套管护套912可以包括KYNAR管道。套管护套912可以容纳处于收缩状态的植入物800,用于将其输送至植入位置。在一些实施例中,套管护套912能够透射可见光光谱内的至少部分光。这允许显现位于导管900内的植入物800的方向。在一些实施例中,外套管标记带913可以位于外管状部件901的远端端部903处。
在一个实施例中,套管护套912的外径大于管状部件901的杆部区域917的相邻或邻近区域。在这种实施例中,套管护套917和杆部区域917可以包括彼此连接或耦联的分离管状部件。在其他实施例中,管状部件901可以扩张以形成较大直径的套管护套912,从而杆部区域917和套管护套912由同一管状部件形成。在另一实施例中或者与前述实施例组合,杆部区域917的直径可以减小。
内管状部件904的近端端部905可以连接至手柄907,用于抓握内管状部件904并且相对于外管状部件901而移动内管状部件。外管状部件901的近端端部902可以连接至外套管手柄908,用于抓握外管状部件901并且相对于内管状部件904而维持其固定。止血密封件909优选可以设置在内管状部件901和外管状部件904之间,并且止血密封件909可以设置在外套管手柄908内。在一些实施例中,外套管手柄908包括侧端口阀921,而流体可以通过其而进入外管状部件内。
基本上,内管状部件904包括多内腔轴管(参见图6)。在一些实施例中,颈部部分910位于内管状部件904的近端端部905处。颈部部分910可以由不锈钢、镍钛合金或者另外合适的材料制成,这些材料可以用于提供附加强度以在外光装部件901内移动内管状部件904。在一些实施例中,标记带911位于内管状部件904的远端端部906处。多内腔轴管的壁厚在约0.004英寸至约0.006英寸之间。在一个实施例中,壁厚为约0.0055英寸,其提供了足够的裂断强度,并且增加了扭绞轴管所需的弯曲负荷。参考图6,内管状部件904(即,在所示实施例中的多内腔轴管)可以包括至少四个内腔。一个内腔可以容纳导丝管道914,并且每个其余内腔可以收纳定位和填充内腔(PFL)管道916。导丝管道914可以配置以接收导丝。PFL管道916可以配置以作为用于将植入物800定位在植入位置处的控制金属丝,以及用于将液体、气体或填充介质输送至植入物800的填充管。尤其,管道916可以允许对植入物800进行角度调节。即,可以使用管道916调节瓣膜的平面(限定基本上垂直于植入物800的纵轴)。
参考图5A和5B,通常,导丝管道914可以大于输送导管900,并且可以在其整个长度上延伸。导丝导管914的近端端部可以穿过内套管手柄907,以便于操作者控制;导丝管道914的远端端部可以延伸超过外管状部件901的远端端部903,并且可以耦联至导丝尖端915。导丝尖端915可以封闭外管状部件901(或容器)的远端端部903,并且例如在输送导管推进期间保护缩回的植入物800。导丝尖端915通过向近侧地缩回外管状部件901,而与外管状部件901具有一定距离,同时维持导丝管道914固定。作为选择地,导丝管道914可以推进,同时维持外管状部件901固定。导丝管道914的内径约为0.035英寸至约0.042英寸,从而导管系统与常规0.0035英寸或0.0038英寸导丝兼容。在一些实施例中,导丝管道914的内径可以约为0.014英寸至约0.017英寸,从而导管系统与常规直径为0.0014英寸的导丝兼容。导丝管道914可以由润滑材料制成,诸如聚四氟乙烯、聚丙烯或者灌注聚四氟乙烯的聚合物。其还可以覆有润滑或亲水涂层。
导丝尖端915的前端部可以是锥形、弹头形或者半球形。导丝尖端915的最大直径优选近似等于外管状部件901的远端部分903。导丝尖端915优选逐步减小至直径略小于外套管护套912的内径,从而尖端可以啮合外套管护套912并且提供光滑的过渡。在所示实施例中,导丝尖端915连接至导丝管914,而导丝内腔穿过一部分导丝尖端915。导丝尖端915的近侧还具有锥形、弹头形或半球形,从而导丝尖端915可以容易地越过已展开的植入物800缩回,并且进入展开导管900。导丝尖端915可以由诸如聚碳酸酯的刚性聚合物或者由允许呈弹性的较低硬度材料诸如硅树脂的而制成。作为选择,导丝尖端915可以由具有不同硬度的多种材料制成。例如,与外管状部件901的远端部分903啮合的导丝尖端915的部分可以由刚性材料制成,而导丝尖端915的远端和/或近端端部由低硬度材料制成。
如下文将更详细所述,在一个实施例中,导丝尖端915配置(例如呈锥形)以沿着导丝直接插入血管。这样,导丝尖端915和护套912可以直接扩张进入的血管,以容纳位于沿着输送导管上的引入导管。
每个PFL管道916可以在输送导管900的整个长度上延伸。PFL管道916的近端端部穿过手柄907,并且具有鲁尔锁917,用于连接至液体、气体或填充介质源。PFL管道916的远端端部通过轴管内腔延伸超过内管状部件904的远端端部906。参考图5C,在一些实施例中,PFL管道916包括处于近端端部处的应力释放部分918,其中管道916连接至鲁尔锁(luer lock)917,而应力释放部分918用于释放PFL管道916上的应力,同时由操作者操纵。PFL管道916的远端端部包括尖端或针919,用于连接至植入物800。在一些实施例中,尖端919可以具有螺纹部分,朝向针919的端部(参见图5C)。在一些实施例中,PFL管道916可以在管道916的远端端部和/或近端端部处具有PFL标记920,用于识别。
PFL管道916可以设计为以便于在曲折的解剖结构中旋转。管道916可以使用聚酰亚胺编织管、镍钛合金轴管或者不锈钢轴管而构建。在优选实施例中,PFL管道916由编织聚酰亚胺制成,其由编织有平坦金属丝的聚酰亚胺衬垫制成,由另一聚酰亚胺层封装,并且覆套有prebax和尼龙外层。在一些实施例中,可以向PFL管道916的近端端部添加镍钛合金套管,以提高扭住传动、扭结阻力以及推动力。在一些实施例中,PFL管道916的外表面和/或多内腔轴管中的内腔内表面也可以覆有润滑硅树脂涂层,以减少摩擦。在一些实施例中,诸如聚四氟乙烯的内衬套材料可以用于多内腔轴管中内腔的内表面上,以减少摩擦并且改善在弯曲部分处的性能。此外,可以添加诸如DOW 360、MDX硅树脂或BSI公司的亲水涂层的光滑涂层,以提供另一种形式的摩擦减少元件。在定位植入物800期间,这可以提供对PFL管道916的准确控制。在一些实施例中,PFL管道916的外表面可以套设或软熔有附加尼龙12或Relsan AESNO层,以确保光滑的抛光表面。在一些实施例中,还可以在PFL管道916的外表面上设置防血栓涂层,以减少在管道上形成血栓的风险。在一些实施例中,PFL管道916可以具有斑纹涂层,其实的PFL管道916更易于固定或操纵。也可以选择斑纹涂层,以增加金属丝的可推动性。
在一些实施例中,测得导管900的外径处于约0.030英寸至约0.200英寸之间,而外管状部件901的壁厚为约0.005英寸至约0.060英寸。在一些实施例中,外管状部件901的外径可以在约0.215英寸和约0.219英寸之间。在该实施例中,外管状部件901的壁厚在约0.005英寸和约0.030英寸之间。导管900的总长度范围为约80厘米至约320厘米。在一些实施例中,外管状部件901的工作长度(从套管护套912的远端端部至管状部件901连接至外部套管手柄908之处)可以为约100cm至约120cm。在一些实施例中,套管护套912的内径可以大于或等于0.218英寸,而套管护套912的外径小于或等于约0.241英寸。在优选实施例中,套管护套部分912的外径可以小于或等于约0.236英寸或18Fr。在一些实施例中,PFL管道916的外径可以小于或等于约0.0435英寸,而长度约为140cm至约160cm。在一些实施例中,至少一部分PFL管道916可以具有减小的直径,例如PFL管道916的横向直径可以是0.050英寸。
在采用低截面轮廓的外管状部件的实施例中,优选采用处于缩回状态的低截面轮廓可填充植入物,以安装在套管护套912中。套管护套912的外径可以是18Fr或更少。在一些实施例中,植入物800包括组织瓣膜104,其扩张的外径大于或等于约22mm,而组织厚度大于或等于约0.011英寸。植入物800的压缩直径小于或等于约6mm或18Fr。缩回的植入物800基本上设置在外管状部件901的远端部分903和内管状部件904的远端部分906之间。因而,外管状部件901的远端部分903可以形成用于植入物800的容器。随着外管状部件901缩回,通过保持植入物800固定,而露出植入物800或者将其推出容器之外。作为选择,外管状部件901可以保持固定,同时推进内管状部件904,并且由此将植入物800推出容器之外。
输送系统可以包括装载工具基底925,其可以连接至PFL管道916。在一些实施例中,PFL管道916可以经由鲁尔连接而连接至装载工具基底921。参考图7,装载工具基底921的一端可以配置以具有阶梯边缘923。在一些实施例中,装载工具基底的远端端部具有三个阶梯边缘923,每个阶梯边缘923具有鲁尔连接器924,用于连接PFL管道916。在一些实施例中,装载工具基底921还可以包括至少两个附加连接器922(例如,附加鲁尔连接器),均与阶梯边缘923上的一个鲁尔连接器924流体联通,这将允许处于测试目的而将流体、气体或空气引入植入物800内。例如,在所示的实施例中,一旦PFL管道916连接至装载工具基底921,可以经由附加连接器922而将液体或空气源连接至装载工具基底921。随后,可以通过装载工具基底921和PFL管道916而将液体或空气引入植入物800内。
装载工具基底921上的阶梯边缘可以允许植入物800塌陷或紧密折叠,从而在外管道部件901的远端处将其装载于套管护套912内。当PFL管道916的近端端部连接至装载工具基底921并且远端端部连接至植入物800的连接端口809时,阶梯边缘连接可以拖动PFL管道916,以当植入物800折叠或塌陷时,在填充阀810和/或可填充通道808的连接端口809之间形成偏移。通过摆动连接端口/填充阀,塌陷的植入物800可以具有减小的横截面轮廓。在一些实施例中,可填充通道的止回阀814也随着连接端口/塌陷状态下的填充阀而摆动。因此,在一个实施例中,当瓣膜以塌陷状态设置在展开导管中时,填充阀810和/或连接端口809轴向对齐。即,填充阀810和/或连接端口809和/或止回阀814设置使得彼此不重叠,但是作为代替地,相对于展开导管的纵轴而基本上对齐。这样,植入物800可以塌陷成较小直径,而不是其中填充阀810和/或连接端口809和/或止回阀814在径向上彼此重叠的结构,否则将增加压缩植入物800的直径。类似地,通道806可以设置使得彼此不重叠。装载工具基底925可以用于在近端方向上拉动远端和近端环的一端,以如上所述轴向地对齐填充阀810和/或连接端口809和/或止回阀814,和/或对准通道,以减少多个通道806之间的重叠。
具有输送导管和引入导管的组合输送系统
图8A示出了组合输送系统1000的典型实施例,其可以用于输送植入物800,诸如如上所述的植入物实施例。组合的输送系统1000可以包括引入导管1030,并且至少局部地定位在上述的输送导管900上。如下文将更详细所述的,有利的是使用组合输送系统1000,因为引入导管1030的能够具有比在将引入导管1030和输送导管900分别引入患者体内时更小的直径。例如,在所示实施例中,输送导管900的套管护套912的外径可能过大而不能插入通过引入导管1030(即,套管护套912的外径可以大于引入导管1030的内径,并且在一些实施例中,套管护套912的外径可以等于或基本上等于引入导管的外径)。因此,通过预组装或构建引入导管1030位于输送导管900的近端部分上,可以形成直径减小的输送系统1000。在一个实施例中,引入导管1030是能够接收16Fr导管的16Fr引入导管。输送导管900的套管护套912的外径和引入导管1030的远端可以约为18Fr或更小。应当认为,这种组合的输送系统1000的外径小于任何已知认可的用于输导管心脏瓣膜的输送系统和引入系统。较小的输送系统尺寸可以减少血管并发症,诸如来自血管源头的主动脉剖开、通路位置或者通路相关血管和/或血管源末梢栓塞,尤其在患者股动脉直径较小处。
图9更详细地示出了所示实施例的引入导管1030。通常,引入导管1030可以包括具有近端端部1032和远端端部1034的细长导管。在一些实施例中,引入导管1030的远端端部1034可以是锥形。引入导管1030可以包括位于引入导管1030的近端端部1032处的密封组件1042。
引入导管1030的内径可以小于输送导管900的远端部分的外径。在一些实施例中,引入导管1030的内径约为16Fr或更小。在一些实施例中,引入导管1030可以包括从市场上可获得的具有合适直径的引入导管。例如,在一些实施例,引入导管1030是可从Cook买到的16F引入导管。
密封组件1042(参见图10B)可以以螺纹方式啮合引入导管1030的近端端部1032。密封组件1042可以包括密封部件1046,配置以形成围绕输送导管900的密封。密封组件1042可以调节以在手术期间维持引入导管1030相对于输送导管900的位置。在一些实施例中,密封组件1042包括止血密封/瓣膜,配置以最小化经皮手术期间的失血。在一些实施例中,密封组件1042包括冲洗端口1044。
如上所述,通常,组合的输送系统1000包括输送导管900,其延伸穿过引入导管1030。在所示实施例中,输送导管900的部件因而可以与上文讨论的低截面轮廓输送导管900的相应部件相同、类似或等同。因此,为简便起见,下文将仅讨论输送导管900的一些部件。
如上所述,输送导管900可以包括具有近端端部902和远端端部903的外管状部件901,以及也具有近端端部905和远端端部906的内管状部件904。内管状部件904基本上延伸穿过外管状部件901,从而内管状部件904的近端端部902和远端端部903基本上延伸超过外管状部件901的近端端部902和远端端部903。在一些实施例中,输送导管900基本上延伸穿过引入导管1030,从而输送导管900的近端端部902和远端端部903基本上延伸超过引入导管1030的近端端部1032和远端端部1034。
在多个实施例中,输送导管900的远端部分,尤其套管护套912的外径,大于引入导管1030的远端端部的内径。在一些实施例中,输送导管900的外径约为18Fr或更少,尤其在输送导管900的远端部分处。在一些实施例中,输送导管900的近端部分处的外径为约16Fr或更少。在图8A和8B中,套管护套912、导丝尖端915和引入导管103的近端部分的外径,示为具有不同的外径。然而,在一些设置中,这些部件912、915和1030的外径可以相等或基本上相等,而外管状部件901可以具有比这些部件更小的外径。在一些设置中,套管护套912和导丝尖端915的近端部分可以与引入导管1030的近端部分具有相同的外径或基本相同的外径。
图10示出了外管状部件901的近视图。外管状部件901的远端端部903可以形成套管护套912。如上所述,套管护套912可以容纳处于收缩状态的植入物800,用于将其输送至植入位置。在一些实施例中,套管护套912的外径大于外管状部件901的杆部部分917的外径。在所示实施例中,套管护套912的外径大于引入导管1030远端端部的内径,而杆部部分912的外径小于引入导管1030的内径。在一些实施例中,套管护套912的外径约为18Fr或更小。在一些实施例中,外管状部件901的杆部部分917的外径为16F或更小。如上所述,在一些实施例中,套管护套912是连接至外管状部件901的杆部部分917的分开的部件,而在其他实施例中,套管护套912由外管状部件901的近端集成。
如上所述,在一些设置中,使用组合输送系统1000,以减小用于将输送导管900输送至治疗位置的引入导管1030的直径是有益的。如果引入导管1030和输送导管900分别被引入,则引入导管1030的内径必须大于将引入患者的输送导管900的最大部分的外径。相反地,在组合输送系统1000的多个实施例中,输送导管900的远端部分的外径大于引入导管1030的内径。例如,在一些实施例中,输送导管900的远端部分的外径约为18Fr,而输送导管900的近端部分的外径约为16Fr。在一些实施例中,引入导管1030的内径约为16Fr或更小。在一些实施例中,引入导管1030可以预先安装在输送导管900的近端部分上。
使用组合输送系统的展开方法
在多个实施例中,使用上述的组合输送系统1000和微创手术,可以在主动脉位置处展开植入物800。在一些实施例中,该方法基本上包括进入主动脉,大部分情况穿过骨动脉。可以根据标准惯例,拟定血管进入位置,并且可以将导丝通过血管通路插入左心室。
如图8A所示和如上所述,可以在进行微创手术之前将引入导管1030预先安装在输送导管900上。例如,厂商可以将引入导管1030预先安装在输送导管900上。在一些实施例中,在完成组合输送系统1000的组装之前,厂商将输送导管900延伸通过引入导管1030。例如,在一些设置中,在将手柄连接至外管状部件901的近端端部902之前,可能需要将输送导管900延伸通过引入导管1030。在其他设置中,在将套管护套912或植入物800连接至输送导管900的远端端部940之前,可能需要将输送导管900延伸通过引入导管。
在其他实施例中,在将引入导管1030或输送导管900插入患者体内之前,操作者(例如护士、医生或其他人员)将输送导管900延伸通过引入导管1030。在一些实施例中,外管状部件901的手柄可移除,因而在将引入导管1030或输送导管900插入患者体内之前,允许用户移除手柄并且将输送导管900延伸通过引入导管1030。
在一些实施例中,在厂商或操作者已经将输送导管900延伸通过引入导管1030之后,输送导管900的远端部分从引入导管1030的远端端部1034向远侧延伸。在一些实施例中,远端的套管护套912或者植入物800从引入导管1030的远端端部1034向远侧延伸。
如图10中所示,在组合输送系统1000组装之后,可以将携带心血管假体植入物800的组合输送系统1000经内腔推进。在一些实施例中,组合输送系统1000沿着导丝插入。在这种实施例中,导丝尖端915可以沿着导丝直接插入血管内,从而使得导丝尖端为引入导管1030扩张所进入血管。在一些实施例中,组合输送系统1000推进直至密封组件1042到达患者。在其他实施例中,如图8B所示,当进一步推进输送导管900,使引入导管1030维持在合适的位置处。输送导管900可以推进至接近原生瓣膜的位置处。在其他实施例中,整个组合输送系统1000,包括引入导管1030和输送导管900,可以推进至接近原生瓣膜的位置处。
在输送导管900推进至主动脉弓上并且通过主动脉瓣之后,通过调节密封组件1042可以维持外管状部件901相对于引入导管1030的定位以围绕外管状部件901形成密封。
如图8C中所示,在一些实施例中,通过部分或完全缩回外管状部件901,同时维持内管状部件904固定,可以显露或暴露植入物800,并且允许正确地定位在原生瓣膜处或下方。在一些实施例中,通过向远端推动内管状部件904,同时维持外管状部件901固定来显露植入物。一旦植入物800被拔出,其可以向近端或远端移动,并且可以将流体或填充介质引入套囊802中,提供形状和结构完整性。在一些实施例中,首先使用第一流体使得可填充套囊或可填充结构的远端螺环填充,并且使用植入物800和组合输送系统1000之间的连接件,将植入物800定位在植入位置处。在一些实施例中,存在不多于三个连接件。在一些实施例中,连接件是PFL管916,其可以用于控制植入物800并且填充可填充套囊。使用上述的任意其他方法,可以填充或控制植入物800。
在一些实施例中,连接件是PFL管916,其可以用于控制植入物800并且填充可填充套囊。
植入物800的展开可以通过可拆卸地耦联至植入物800的PFL管916来控制。将PFL管916连接至植入物800的套囊802,从而在套管或输送导管900移除之后,可以控制和定位植入物800。优选地,使用三个PFL管916,可以通过PFL管916在展开和定位期间向植入物800提供精确控制。PFL管916可以用于向近端或远端移动植入物800,或者倾斜植入物800并且改变其相对于原生解剖结构的角度。
在一些实施例中,植入物800包含多个填充阀810,以允许操作者使用不同量的第一流体或第一气体使植入物800的特定区域填充。参考图11A-C,在一些实施例中,植入物800最初在心室32内局部展开(图11A)。局部地填充可填充通道808,允许植入物800的远端部分打开以实现近似其整个直径。随后,将植入物拉回至原生瓣膜34环面处或附近的位置(图11B)。在一些实施例中,首先,将远端螺环807b至少局部填充,随后心血管假体植入物800向近端缩回,以跨越原生瓣膜34定位套囊。远端环807b就位于主动脉环面的心室侧上,而植入物800自身设置在主动脉根中的原生瓣膜34环的正上方。这时,采用切割球囊可以破解纤维或钙化病变的相同机制,PFL管916可以帮助分离熔合的合缝处。可以添加附加填充流体或气体,以完全填充植入物800,从而植入物800延伸跨过原生瓣膜环面,略延伸至两侧(参见图11C)。PFL管916提供了在展开导管900的手柄和植入物800之间的力传递机构。通过一同移动所有PFL管916或者内管状部件904,可以在近端或远端方向上推进或缩回植入物800。通过相对于其他PFL管916推进PFL管916的一部分,可以相对于原生解剖结构调节植入物800的角度或方向。植入物800或PFL管916上的不透射线标记,或者PFL管916的不透射线性,有助于在操作者定位和定向植入物800时指示植入物800的定向。
在一些实施例中,植入物800具有位于可填充通道808的各端部处的两个填充阀810以及位于可填充通道808内的止回阀811。止回阀811定位使得流体或气体可以在从近端螺环807a至远端螺环807b的方向上流动。在一些实施例中,通过对连接至第一PFL管916的内扩张器加压,可以使得植入物800完全填充,所述第一PFL管916与通向近端螺环的第一填充阀810连通,而连接至与远端螺环807b连通的第二填充阀810的内扩张器关闭。流体或气体可以通过单向止回阀流入远端螺环807b内。随后,通过对连接至第二填充阀的内扩张器减压,使得近端螺环807泄气。因为流体或气体不能通过止回阀811漏出,因此远端螺环807b将维持填充状态。随后,可以将植入物800跨越原生环面放置。一旦处于满意的设置,可以使近端螺环807a再次填充。
在一些实施例中,植入物800仅具有一个填充阀。当使用第一流体或气体使得可填充通道808填充时,植入物800的近端部分可能略受PFL管916之间的间距限制,而远端部分填充更完全。通常,PFL管916限制植入物800近端端部直径的量取决于PFL管916延伸超过外管状部件901的长度,这可以由操作者调节。在其他实施例中,使用爆破隔膜或限流器以控制植入物800的近端部分的填充。
在初始展开之后,为进一步调整,植入物800还可以缩小或局部缩小。如图12A中所示,植入物800可以局部展开,并且使用PFL管916使得植入物800就位抵靠原生主动脉瓣34。植入物800可以如图12B中完全展开,而后如图13C中进行测试。如果测试证明正确,植入物800可以缩小并且如图12D中移动至更优的位置。随后,植入物800可以完全展开,并且如图12E所示从控制金属丝中释放。
如上所讨论的,在一些实施例中,第一填充流体或气体可以替换为能够硬化以在体内形成更永久支撑结构的填充介质。一旦操作者对植入物800的位置满意,则随后将PFL管916断开,并且抽出导管,留下植入物800(参见图12)以及可硬化填充介质。允许填充介质在可填充套囊中凝固。断开方法可以包括切断连接、旋转螺杆、抽离或剪断针、机械地去互锁部件、电分离熔合点、从管上移除受限制的圆筒、断裂设计区域、移除夹头机构以露出机械连接或者产业中已知的许多其他技术。在经修改的实施例中,如果需要,这些步骤可以反转或者修改其顺序。
在一些设置中,可能需要使用组合输送系统1000输送心血管假体植入物800,以减少定位心血管假体植入物800所需的部件和步骤。例如,如果通过输送导管分别插入引入导管,操作者使用扩张器以促进引入导管的输送。在一些情况下,扩张器包括柔软、细长导管主体,以及基本上呈锥形的尖端。扩张器通常是独立部件,其延伸穿过引入导管,并且在将引入导管输送至合适位置之后必须移除。在移除扩张器之后,操作者插入输送导管穿过引入导管。通过使用组合输送系统1000输送心血管假体植入物800,可以有利地消除使用扩张器或者消除导管交换步骤。而不依赖于独立的扩张器部件,组合输送系统1000可以使用导丝尖端915起扩张器的作用。如上所述,在一些实施例中,导丝尖端915可以是锥形、弹头形或者半球形,以有助于扩张。此外,导丝尖端915的直径可以配置以形成从套管护套912的远端端部至导丝尖端915的平滑过渡。平滑过渡可以有助于防止引入导管1030的远端端部损伤血管壁。
在一些设置中,有利的是使用组合输送系统1000输送心血管假体植入物800,以减少在将植入物800输送至合适位置之后移除组合输送系统1000所需的步骤数量。例如,如果通过输送导管单独地插入引入导管,在从患者移除引入导管之前,可以从患者体内完全移除输送导管。在一些情况下,可能需要使用组合输送系统1000同时移除引入导管和输送导管。在将植入物800输送至合适位置之后,PFL管道916可以向近端缩回进入内管状部件904内。在一些实施例中,输送导管900向近端缩回,直至套管护套912的近端端部邻接引入导管1030的远端端部1034。导丝管道914可以向近端缩回,直至导丝尖端915封闭外管状部件901的远端端部,并且形成从引入导管1030的远端端部1034至导丝尖端915形成平滑过渡。平滑过渡可以有助于在从患者体内移除引入导管时,防止引入导管1030的远端端部1034损伤血管壁。随后,可以从患者体内同时移除引入导管1030和输送导管900。
使用集成引入器,需要具有相对较长的锥形尖端,以有助于引入穿过曲折动脉,并且在装置移除之后拉紧用于动脉闭合的缝合线,但是为了在相对小的心室内安全展开,需要使得尖端不占据过多空间。描述了解决该问题的多个实施例。这些实施例与上述的各个实施例可以组合使用。
在图13中所示的第一实施例中,类似于用于相似尺寸引入器的扩张器引入器,导管尖端927的远端部分可以约为2至8cm,但是非常柔软,从而其可以沿着心室内侧的导丝914的弯曲(参见例如图14)。在一个实施例中,尖端由诸如硬度小于约25A的硅树脂或氨基甲酸乙酯的材料制成。在另一实施例中,尖端927的外表面基本上连续,但是省略了尖端内部体积的材料,允许尖端弯曲。优选地,使用小于1磅(lb)的力,能够将尖端927弯曲呈半径小于3cm。更优选地,使用小于0.5磅(lb)的力,能够将尖端927弯曲呈半径小于3cm。在另一实施例中,尖端927的弯曲半径约2至8cm,优选约3至5cm。优选地,当设置在非常坚硬0.035导丝914的坚硬部分上时,弯曲尖端927基本上伸直,并且在导丝914的柔软或弯曲远端部分上恢复弯曲形状。优选地,尖端927是不透射线的。这可以通过使用诸如硫酸钡、钨或钽的不透射线材料填充尖端927而实现。
在另一实施例中,装置在一个结构中具有长尖端,而在第二结构中具有短尖端,其中长尖端大于约3cm,而短尖端小于约3cm。在类似的实施例中,长尖端大于约2cm,而短尖端小于约2cm。装置通过长尖端配置中的髂动脉推进,并推进靠近治疗位置以短尖端配置进入心室。在一个实施例中,长尖端套在短尖端上,并且由延伸至装置近端部分的至少一个张紧部件而将其维持在合适的位置处。在装置已经穿过复杂的进入位置之后,放松张紧部件,允许从短尖端上移除长尖端,并且包含短尖端以备于稍后移除。
在另一实施例中,尖端具有直的结构和弯曲结构,并且可以用诸如牵引线的机械装置而从一个结构调整为另一结构。
在另一实施例中,尖端可填充,当受压时实现长结构,而当收缩时或当施加真空时实现短结构。
当使用集成导引鞘治疗患者时,通常使用已横跨主动脉瓣的导丝来引入装置。在一些情况下,在装置插入期间维持导丝处于正确的位置,这可能存在挑战或风险。本文所述的实施例包括多种方法,以在装置插入之后使用导丝促进跨越原生瓣膜。
在一个实施例中,导丝以与输送系统的轴呈至少5度的角度而离开导丝的远端尖部,并且优选在10至40度之间。这允许输送导管旋转将导丝直接指向主动脉瓣处,以允许导丝容易地跨越瓣膜。在一个实施例中,尖端形状与跨越主动脉瓣所常规使用的管状引导导管的形状相似。
在另一实施例中,尖端可弯曲并且可以由操作者选择尖端的弯曲。在一个实施例中,这可以通过牵引线实现。
一个实施例包括可操纵导丝作为附件。可操纵导丝是本领域中是公知的。
在另一实施例中,内腔在远端端部附近配置有弯曲,并且外径约0.035英寸,或者配置使得其穿过导丝内腔。内腔的内径配置使得0.032、0.018或者0.014或0.009导丝可以穿过其中。可以使用额外的内腔来控制导丝,并且使用导丝有助于跨越主动脉瓣。
当使用集成导引鞘治疗患者时,通常必须使用已经处于横跨主动脉瓣的导丝而引入装置。在一些情况下,在装置插入期间维持导丝处于正确的位置,这可能存在挑战或风险。本文所述的实施例包括多种方法以最小化套管交换的难度和风险。
在一个实施例中,导丝内腔在导管近端端部远端至少5、10、20或50cm处离开导管。这允许单一操作者在移除较小套筒和插入装置期间控制导丝位置。
在一个实施例中,导丝穿过尖端中的内腔,其中内腔的一端大致位于尖端的远端端部,而内腔的第二端靠近尖端的侧面,该侧面远离尖端与输送导管的套管部分接触之处。这有利于单一操作者进行导丝控制,同时允许与尖端的连接具有较小的横截面积,允许进一步减小轮廓。
当使用集成的导引鞘治疗患者时,对于并非用于所有手术的一些操作、诸如取回植入物,可能需要更大直径的套管。在一些实施例中,引入器可以在这些情况下扩张,但在常规使用期间维持装置的低轮廓。可扩张的引入器的设计可以类似于Edwards Lifesciences销售的e-sheath,或者类似于onset medical销售的产品。在另一实施例中,导引鞘可以由横截面呈管状的聚合物制成,其在取回期间通过弹性或塑性形变扩张。已可扩张的结构比未可扩张结构优选至少大10%。已扩张结构的内径(ID)优选类似于未扩张结构的外径(OD)。已扩张结构的内径优选大于未扩张结构的外径。
对于具有整体套管装置的回收,尤其当利用诸如Abbot实验室销售的prostar或proglide的装置采用经皮封闭技术时,优选能够随着从患者体内移除装置而绷紧装置锥形尖端上的缝线。为了利于简单移除,优选实施例具有将尖端锁定至导管主体和/或者将导管主体锁定到导引鞘的机构,从而使得在拉紧缝合线的同时在单一部件上拉回,是需要多个操作者之间最小协作的简单手术。
在一个实施例中,尖端和外套管的最大直径部分可塌陷,以有利于通过基本上不可填充的集成引入器而将其移除。在一个实施例中,部件可机械塌陷,从而通过提供轴向力而将部件牵拉进入所塌陷的导引鞘。在一个实施例中,尖端由具有中空横截面以及壁厚在0.005和0.050英寸之间的尼龙12制成。
在一个实施例中,锁定机构是位于近端手柄上的凸轮,其将导丝内腔锁定至导管主体,基本上防止导管主体和尖端之间的相对移动。在另一实施例中,锁定机构是位于集成导引鞘的近端端部的toughy-borst型阀,其可张紧,以防止集成导引鞘和导管主体之间的相对移动。
对于具有集成套管装置的撤回,尤其当利用诸如Abbot实验室销售的prostar或proglide的装置采用经皮封闭技术时,重要的是知晓尖端、输送装置的较大直径部分的远端和近端以及集成导引鞘的远端的相对位置。
装置的一个实施例包括位于如上所述位置的不透射线标记。在另一实施例中,输送装置的大直径部分的外部部分上的可见标记当与集成引入器的的可见标记或边缘对齐时指示输送装置的大直径部分的近端端部与输送导管的远端对齐。
一个实施例包括用于难以进入的髂骨解剖结构的附件装置。将反向尖端球囊插入通过对侧的侧部,并且推进通过主动脉分支,返回进入血管。该反向尖端允许导丝推进通过装置,随后通过反向尖端球囊的导丝内腔。球囊可以推进靠近装置,从而装置的尖端位于球囊的反向尖端内侧,通过使球囊填充并且使用球囊推进系统,可以推进该装置通过钙化位置和曲折处。反向尖端球囊的外径类似于输送系统的外径,优选在3mm至8mm之间。球囊的额定破裂压力在2至20大气压之间,并且优选导丝内腔直径约0.036英寸。球囊优选具有低顺应性,以在压力下维持反向尖端形状,在不引起不必要损伤的情况下,允许血管扩张至输送装置所需的尺寸。
展开系统
图15A和15B是展开系统1400的侧视示意图和横截面视图,其可以用于相对于第二部件1404来移动(例如缩回)第一部件1402。在一种设置中,第一部件1402可以是外部部件(例如导管的外套管或管),而第二部件1404可以是内部部件(例如,导管的内导管或管)。
在一个设置中,系统1400可以包括旋转部件1406和手柄1408。旋转部件1406可以包括驱动器1407,其可以延伸至手柄1408外侧,从而用户可以相对于手柄1408旋转旋转部件1406。例如,在一个实施例中,可以单手抓握手柄1408,而用另一手旋转驱动器1407。在一个实施例中,手柄1408和驱动器1407可以配置以由单手持有和驱动,例如,通过在用户抓握手柄的拇指附近提供转盘或轮。在所示实施例中,驱动器1407定位在手柄的远端端部上,但是在其他设置中,驱动器可以局部或完全定位在手柄的长度内和/或手柄的近端端部处。
如图15B中所示,第一部件1402可以延伸进入旋转部件1406,并且可以耦联至位于旋转部件1406内的托架1410。旋转部件1406的内表面可以包括内螺纹或外螺纹或者螺纹状部件,其与托架1410上的相应内部和/或外部凸出或凹槽相互作用。耦联至手柄1408的对准部件1412可以延伸进入旋转部件1406,以限制托架1410在旋转部件1406内的旋转。
使用中,用户可以旋转旋转部件1406(例如,通过抓握旋转部件的一部分或者与其耦合的驱动器1407),将其延伸超过、穿过手柄的一部分和/或通过而露出。随着旋转部件1406在手柄1408内(其可以相对于旋转部件1406维持固定)旋转,并且由于托架的旋转运动受对准部件1412限制,托架1410可以沿着内和/或外螺纹或螺纹状部件而移动,并且可以在旋转部件1406的纵向长度或其一部分上移动。进而,托架1410可以耦联至第一部件1402,使得随着托架1410在旋转部件1406内向近端移动时第一部件1402缩回。所示设置的优点是托架1410可以至少局部地在用户驱动的旋转部件1406的一部分内移动。该设置形成系统1400的小型结构。
第二部件104可以耦联至手柄1408(如下所述),并且可以延伸穿过托架1410和第一部件1402,从而托架1410在手柄1408内的移动可以导致第一部件1402相对于第二部件1404的相对移动。
所示的展开系统1400还可以包括可释放耦联机构1420。如图15B中所示,第二部件1404可以延伸穿过(或者局部穿过)可释放耦联部件1420,进而可以耦联至手柄1408。当处于“锁定”位置时(例如,如图15A和15B中的实线所示),第二部件1404、耦联部件1420和手柄1408之间的移动受限。因此,在上述移动期间,第一部件1402可以移动,而第二部件1404相对于手柄1408维持固定(或基本上固定)。耦联机构1420可以包括驱动器1422(例如控制杆、旋钮等),其可以将耦联机构1420从锁定位置移动至开启位置(例如,如图15A和15B中的实线和虚线所示)。在开启位置(例如虚线位置),第二部件1404可以从耦联部件1420上释放,从而可以从手柄1408上移除第二部件1404(或反之亦然)。在一个设置中,可以允许将第一部件和手柄撤回至第二部件1404上,从而可以从患者体内移除第一部件1402。随后,可以将第三部件(例如取回导管)插入第二部件1404上,将其保留在患者体内。
如图15A和15B所示,冲洗端口1424可以耦联至托架1410,从而托架1410的移动可以引起冲洗端口1424的移动。冲洗端口1424可以用于将冲洗材料(例如液体)输送至系统1400内的部件,诸如手柄1409、托架1410和/或第一部件1402和第二部件1404。
图16A是展开系统1500的侧面透视视图,其与图15A和15B中示意性示出的系统1400具有一些共有的特征。所示的展开系统1500可以与上述的展开导管900实施例和/或该实施例的修改设置和/或其子组合而组合使用。如下文所述,在所示实施例中,展开系统1500可以替换内套管手柄907和外套管手柄908(如上所述)。如下文将述,在一个实施例中,展开系统1500可以用于相对于内套管904(例如内管状部件)而缩回外套管901,其与内套管手柄907和外套管手柄908相比,具有一定优点。图16B-31提供了对展开系统1500以及展开系统1500的各个部件的附加视图。
虽然将结合本文所述的展开导管900和植入物800的一些特征描述和示出展开系统1500,展开系统1500的特征也可以独立于本文所述的实施例而使用,并且可以在其他类型的展开导管和/或其他类型的植入物中具有优势,其中第一部件(例如第一导管或管状部件)相对于第二部件(例如第二导管或管状部件)缩回或移动。例如,展开系统可以用于相对于内部部件或内管状部件缩回外套管。展开系统1500还可以独立或者结合引入器导管1030和上述的组合输送系统1000组合使用。在这种组合设置中,引入器导管1030可以预组装或构建在如上所述的输送导管900的近端部分上。
首先参考图16A,在所示实施例中的展开系统1500包括手柄或主体1502。手柄1502的远端端部1504可以包括旋钮1506,如下文详细所述,其可以相对于手柄1502旋转或扭转,以缩回外管状部件901(有时称为“外套管”),同时维持内管状部件904(图16A中未示出)相对于外套管901固定或基本固定。外套管901的近端端部902可以耦联至展开系统1500的一部分,如下文所述。套管的远端端部903可以如上所述形成套管护套912,其中内管状部件904延伸穿过外套管902并且进入展开系统1500,如下文所述。外套管901的部分和从手柄501向远端延伸的内管状部件904可以根据上述实施例配置。
例如,如上所述,内管状部件904可以包括多内腔管(例如参见图6),其可以包括至少四个内腔。一个内腔可以容纳导丝管道914,并且其余内腔可以容纳定位和填充内腔(PFL)管道916。导丝管道914可以配置以接收导丝。修改的实施例可以不包括、包括更少或更多的内腔和/或其他目的的内腔或部件。
如图15和16所示,手柄1502在其与旋钮1506相邻的远端端部处具有基本上圆筒形部分1508,并且在手柄1506的近端端部具有凹槽部分1510。在一个实施例中,手柄可以具有不同的外形,例如基本上圆筒形、圆锥形、花生形等。定位和填充内腔(PFL)管道916可以从凹槽部分1510的近端端部的开口延伸。如下文所述,管道916可以独立缩回、旋转和/或推动,以对如上所述的植入物提供控制。可以在手柄1502上邻近开口处提供标记、可视或物理标志等1505,以向管道916提供标签。例如,所示实施例包括标签“1”、“2”、“3”和具有不同长度的相应凸起脊部。作为附加和/或作为选择地,管道916从其上延伸的近端端部的各个开口可以不共平面。例如,标为“2”的开口与标为“1”和“3”的开口相比略高或略低。不共平面的开口可以允许用户在管道916之间限定间隔。可以选择开口的定位有助于尽可能减少管道916和手柄1506的接触。可以选择开口的位置以优化管道916的出口通道,并且减少管道916和手柄1506之间的摩擦。将开口定位在不同高度的优点是用户在不看管道916时可以确定抓握的管道916。即,在一个实施例中,中间管道916定位高于或低于另两个管道916。在这种设置中,用户可以感觉到一个管道(例如中心管道916)与其他管道位于不同高度,因而在不看就能感觉到抓握和/或操作的是中心管道916。类似地,通过用手感知高度差,用户感觉到抓握管道并抓握中间管道916的侧部。
如图17所示,手柄1502的凹槽部分1510可以包括槽1512,导丝管道914可以延伸并穿过其中。该槽1512可以具有多个优点。例如,用于主动脉瓣膜置换术的标准导丝可以制成具有不同长度,但是通常使用260cm丝用于主动脉瓣置换术。这些导丝可以具有相对硬的部分,长度约260cm,以及在远端部分具有更柔软或松弛的部分,其长度通常1至10cm。使用大体上较长的丝可能很麻烦,因为其可能延伸超过普通消毒范围。然而,使用大体上较短的丝可能是不切实际的,因为为了在导丝上推进装置,优选在患者人体外侧延伸的导丝长度比输送装置更长。该设置允许医生在插入设备时始终稳定导丝的一个区域。为了使用特定长度导丝治疗的血管路径的长度最大化,优选地,外套管的长度用导丝内腔的长度得以平衡,并且需要最小化手柄的远端部分和导丝穿过其中的手柄的最近端部分之间的长度。申请人所述的用于实现该设计目标的方案,是在手柄1502中提供槽1512,其允许导丝管道914离开手柄远端,朝向手柄1502的近端。
在一个实施例中,导丝槽1512的长度至少0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8或2.0英寸,或者包括在0.2和2.0英寸之间的任意值。在一个实施例中,导丝槽1512设计以允许导丝管道914和导丝穿出医生手之外,其将手柄固定在凹槽部分中。在这种设置中将手柄1502固定在凹槽部分1510内的手指或手的部分可以位于导丝管道914和手柄1502之间。在这种实施例中,导丝槽1512的长度可以是2.0、3.0、4.0或5.0英寸,或者包括在2.0和5.0英寸之间的任意长度。
通常,可以治疗的血管长度由下式限定。其中:
A是装置从在导丝上追踪的最近端部分至在导丝上追踪的最远端部分的长度。
A’是可以通过引入器追踪进入患者解剖结构的装置长度,从装置的远端尖端至大于所示导引鞘的进入端口的装置轮轴部分测得。
B是安全以在其上受装置追踪的导丝的刚硬部分的长度,不包括防止导丝损伤原生组织的松弛尖端长度。
C是导丝尖端处的松弛尖端长度。
D是从导引鞘的轮轴至装置的远端尖端旨在追踪的患者解剖结构中的目标位置的通路长度。
L是手柄的有效长度,限定为A-A’。
L’是限定为手柄直径大于装置与之兼容的导引鞘的近端部分的内径的手柄部分的手柄的物理长度。
在一个实施例中,为了允许适当的导丝长度以插入装置并且维持导丝的控制,同时在导丝上推进导丝至引入器轮轴:
B>/=D+A
为了允许使用输送系统而到达目标位置,输送系统优选足够长。
A’>/=D
在一个实施例中,为了最大化对于给定标准长度导丝可以治疗的最长解剖路径的长度,应当使得L尽可能短。在一些情况下,出于人体工程学原因或者为了手柄功能所需的包装机构,需要L具有一定长度。在导丝可以进出和弯曲的手柄1502内设置凹槽,允许手柄的物理长度大于A-A’。
因此,在一个实施例中,手柄1502的物理长度大于其有效长度(如上所定义)。在一个实施例中,展开系统1500具有导丝内腔的近端端部,其位于手柄的近端端部远侧,其中医生可进出导丝内腔,并且导丝通过手柄的远端部分而与输送系统共轴。
继续参考图16-17,展开系统1500还可以包括冲洗端口1514,耦联至冲洗管道1515。在追踪展开导管900至目标位置之前,可能需要从展开系统1500冲洗尽可能多的空气。导管内的空气能够在手术期间释放,并且如果发生,则空气可能引起空气栓塞,其中血管中的空气防止含氧血液到达相邻组织。在一个设置中,使用盐溶液冲洗展开系统1500,并且在一个设置中约0.9%盐水。在一些设置中,溶液还可以包含抗凝血剂,诸如肝素。
在一个实施例中,在将导管尖端插入引入器之后和推进导管进入患者血管之前或者至少在推进导管尖端通过主要血管之前,手术包括最终的冲洗步骤。该手术过程可以冲出所有参与空气,并且优选地将其阻截在导引鞘内或者至少在较不关键的外周组织中。
在一个实施例中,柔软冲洗端口管1515与外导管901流体连接,外导管901和内导管904之间的密封表面防止至少一部分或优选大部分冲洗流体从近侧流出。优选地,适量的冲洗流体通过将植入物装载在导管内的区域远端的内外导管之间,从而流体将截获在植入物内的所有气泡推出。如下文更详细所述,在所示实施例中,当由于外导管缩回而抽出植入物时,连接至导管的冲洗端口1514的端部相对于手柄1502的主体轴向移动。为了允许冲洗端口1514的相对移动,在一个实施例中,整个冲洗端口管道1515能够在用于抽出植入物的轴向运动的大致方向上,相对于手柄1502移动。在一些实施例中,冲洗端口1514向近侧延伸,在其他实施例中,冲洗端口1514向手柄1502的远侧延伸。在另一实施例中,与外套管流体连接的冲洗端口管的端部,随着外套管移动,但是冲洗端口管的部分固定至手柄主体。在这种设置中,可以提供充分的长度,从而外套管可以相对于手柄主体而推进至其最远端位置,从而过分地伸展冲洗端口管道,或者充分延伸冲洗端口管道,以引起相当永久的变形。还可以在手柄主体内提供足够的间距,从而冲洗端口管可以弯曲以将外套管收纳在其最近侧位置,而管道不扭结。在另一实施例中,冲洗端口可以在其最近侧位置扭结。在一个实施例中,在将装置引入患者体内的结构中,冲洗端口尽可使用外套管操作,而在其他结构中冲洗端口扭结,这允许在一些实施例中具有更小的包装。
如上所述,在一个实施例中,冲洗端口1514可以流体连接至手柄的外主体,而外套管流体连接至随着外导管移动的部件并且相对于手柄主体在外套管的至少一个位置处流体地密封至手柄主体。在一个实施例中,冲洗端口管道流体并机械地连接至手柄主体。当流体被迫进入冲洗端口时,手柄主体内的流体腔基本上填充有冲洗流体。在该实施例中,外导管和内导管之间的移动界面在手柄端部处不包含密封件。在手柄中的腔内的加压流体能够在内导管和外导管之间流动,由此冲刷输送系统内的空气,包括植入物所在的区域。对于该设计,手柄外壳有利地相对流体密封,并且内部容积可以最小化并且成形以使随后在冲洗处理中可能引入气泡的残余气囊最小化。
在另一实施例中,冲洗步骤通过向冲洗端口施加真空并且将输送系统的远端浸没在流体中,可以执行冲洗步骤。该方法的优点在于在真空下冲洗装置,从而诸如截获在织物内的所有小气泡扩张并且更可能被冲走。
参考图15-21,如上所述,主体的远端端部包括驱动器1506,在所示实施例中呈旋钮状,其可以旋转或扭转,以便于缩回外管状部件或外套管901,同时维持内管状部件904(图16A中未示出)固定。尤其参考图21,用于缩回外管状部件或外套管901的机构可以包括驱动器1506或向前的“旋钮”、螺杆部件1520、轨道1522和托架1524。如下所述,旋钮1506可以用于旋转螺杆部件1520,并且可以包括脊部或者压制花纹以协助用户抓握。在其他实施例中,驱动器可以呈杆、转盘或配置以传输旋转力的其他机构。
继续参考图21,展开机构1500还可以包括锁定机构1526,其将在下文更详细所述。旋钮1506、螺杆部件1520、轨道1522、托架1524和锁定机构1526的部分可以定位在手柄1502内。为了有助于组装,手柄1502可以由多个部件形成,诸如例如,在所示实施例中,可以形成手柄1502的“蚌壳”半部的“顶”半部1529和底半部1530。顶半部1529和底半部1530可以连接在一起以限定内腔,其中前述部件(或其部分)可以定位在其中,而两个半部的外表面形成手柄1502的外表面。图18示出了手柄1502,其中移除了顶半部1529,而图19示出了移除底半部。在修改的设置中,手柄1502可以由更多或更少部件形成。
在所示的设置中,可以使用螺杆机构以展开装置/使其脱鞘。在这种实施例中,展开机构1500可以相对于手柄1502移动外套管901,以在植入物上缩回套管901,同时最低限度(假设全部)推进植入物更远。所示的设置可以有利地改进手术期间的医生感受和舒适度,使得手术更容易、培训更容易,并且向临床医生和工作人员全面地提供更积极的体验。有利地,展开机构1500将维持生物修复术的功能性并且在脱鞘期间从系统进行反馈,同时产生可靠的感受、提供控制,同时最小化或减小力。
有利的是,螺杆机构的间距将在脱鞘期间提供一些机械辅助,同时还维持向操作者体提供一些感受。在一个实施例中,脱鞘是快速过程,其中需要旋转旋钮小于3.5转以利用完全脱鞘投距。如下文将详细所述,在螺杆机构的所示设置中,“螺母”(托架)设置在“螺杆”(即螺杆部件)内侧。这允许设计小型化。在一个设置中,“螺母”或托架可以至少局部地在旋钮内行进。
在一个设置中,用户优选在顺时针方向上旋转旋钮1506,其进而旋转螺杆部件1520,其具有内螺纹1534(参见图25B)并且可以具有圆柱形外形。托架(或螺母)1524沿着内螺纹1534行进,并且可以在螺纹部件1520的长度或其一部分行进。进而,托架1524可以耦联至外套管901,从而随着托架1524在螺杆部件1520内向近端移动,外套管901缩回。内管状部件904可以耦联至手柄1502(如下所述),并且可以延伸穿过托架1524和外套管901,从而托架1524在手柄1502内的移动可以导致外套管901相对于内管状部件904相对移动。管914、916可以延伸通过内管状部件904内的内腔,并且离开上述的槽和开口。如下文将所述的,托架1524还可以耦联至冲洗管道1515。对准部件1522可以在螺杆部件1520内延伸,并且可以跨越螺杆部件1520的长度(或其一部分),并且可以维持托架1524处于正确的方向。
在一个实施例中,旋钮1506是注模塑料,诸如尼龙,而外径约为1.45英寸,而在一个实施例中,在0.15英寸和14.5英寸之间,而用户可访问的长度约为1.7英寸,而在一个实施例中在17英寸之间。提供该尺寸以及本文和下文中所述的其他部件的尺寸作为一个实施例的实例,用于理解各个部件的设置。修改的设置和实施例可以具有不同的尺寸或范围。旋钮可以约跨越附加0.55英寸,或者在一个实施例为0.055英寸和5.5英寸,进入手柄1502,以维持刚性感觉,并且将所有负荷散布在手柄1502上。如图16A所示,旋钮1506的实际外径可以包括多个凹槽或槽口,以增加人体工学结构和纹理,以便于用户接触。在一个设置中,围绕约0.2英寸宽的外径的薄环可以示出标记,其示出了旋转旋钮以脱鞘的方向。在所示实施例中,标记包括一系列印刷箭头。
参考图26A-C,沿着定位在手柄壳/半部内侧的旋钮长度,可以设置一系列环形肋条1507。环形肋条1507可以与手柄中的相应的环形凹槽和肋条(例如参见图19)相互作用,以维持旋钮1506定向正确,并且限制旋钮1506相对于手柄1502的轴向移动。肋条1507可以从长度的中心均匀间隔,并且在一个实施例中约0.059英寸宽,约0.116英寸远,并且在一个实施例中肋条的外径约1.25英寸,而在一个设置中,0.55英寸长度的外径约1.18英寸。所示的实施例包括3根肋条1507,在手柄1502中具有3个相应的凹槽1509。在其他设置中,可以使用更多或更少的肋条/凹槽。同样,凹槽和肋条可以互换和/或可以使用其他结构,以允许旋钮旋转,同时限制轴向移动(例如凹槽、翼片、脊部和肋条等)。
继续参考图26A-C,在一个实施例中,旋钮的远端内径约0.452英寸,而近端内径约为1.08英寸。在所示实施例中,该近端内径包含一个或多个翅片或肋条1511,以提供结构支撑。在所示设置中,一些肋条1511跨越内径的长度。旋钮1502的内径和肋条1511可以接收螺杆部件1520的远端外径,其具有相应的凹槽1513,配置以匹配旋钮1506的肋条1511,从而旋钮1506的旋转引起螺杆部件1520的旋转。在其他设置中,可以使用更多或更少的肋条/凹槽。同样,凹槽和肋条可以互换,和/或可以使用其他结构(例如,凹槽、翼片、脊部和肋条等)。在一些设置中,旋钮1606和螺杆部件1520(或其部分)可以形成单一零件,或者分成一个或多个连接的部件。图22示出的设置中,螺杆部件具有4个肋条,而图26具有更多肋条。
在一个实施例中,螺杆部件1520是注模塑料,诸如乙缩醛,而在一个实施例中长度约为4.17英寸。在一个实施例中,部件的最大外径在近端肋条处约为1.096英寸,其匹配在手柄壳内,以维持部件与手柄内部共线性。在所示实施例中(例如参见图25A-B),其中两个肋条1517而一个实施例中宽约0.069英寸,间距0.071英寸。在一个设置中,近端长度的外径约为1.036英寸,而在部件中心,径向凹槽1519宽约0.064英寸,将外径减少至约0.966英寸。在一个实施例中,远端外径可以呈锥形,在部件长度的持续时间呈约1度。该锥形外径可以具有锁入旋钮内的凹槽特征。它们长度可以约为0.945英寸,并且根据实施例中的位置,宽度在0.07英寸和0.1英寸之间。在一个实施例中,部件中心和凹槽底部之间的距离可以约为0.477英寸。
如图25B、26A、26B中所示,螺杆部件1520可以包括内螺纹1540。在所示实施例中,内螺纹1520是间距约1.0英寸的双头螺纹。在一个实施例中,部件的内径可以与近端端部和远端端部呈约1度,在中间接触。在一个实施例中,螺纹凹槽的宽度可以约为0.138英寸。在一个实施例中,螺纹的主直径可以约为0.946英寸,而螺纹可以在螺纹部件的整个长度上延伸。在一个设置中,以螺纹完成的型面疱管以增加光滑性。这可以减少螺纹和位于其中且通过部件长度的托架/螺母之间的摩擦。
参考图27和28,在一个实施例中,托架1524(或有时称为“螺母”)是注模塑料,诸如聚碳酸酯。该部件可以是透明材料,以允许进行UV连接处理,而允许连接附加部件,诸如外套管和止血帽。托架1524可以包括两个翼1550,其在所示设置中定位相隔180度。翼1550可以配置以位于螺杆部件1520的内螺纹1540中。在一些设置中,托架1524可以具有沿着托架1524的不同位置处和/或具有不同形状的更多或更少翼。在一个实施例中,翼1550可以替换和/或结合凹槽使用,其与设置在螺杆部件1520内的相应螺纹状突起相互作用。翼1550的模腔可以抛光,以最小化移动部件之间的摩擦。在一个实施例中,翼1550可以呈约68度角,以防止螺杆部件1520翘起和不需要地移动。在所示设置中,翼1550由沿着部件长度的肋条1552支撑。肋条1552可以包括胶合端口1554,以允许接合在部件的内径上。例如,在一个设置中,胶水(或其他粘合剂)可以插入通过胶合端口1554,以通过毛细作用将胶水吸至托架1524上,从而延伸通过托架1524的通孔1560的外套管901。部件1524的近端端部和远端端部在所示实施例中可以为圆形(在一个设置中外径约为0.76英寸,而移除槽口1556,而在一个实施例宽度约为0.28英寸。如下所述,槽口1156可以配置以沿着对齐杆1552。在一个实施例中,翼轮廓的外径可以约为0.897英寸。托架1524可以包括多个通道、通孔和盲孔,用于连接部件、结合、并在不妨碍运动的情况下允许部件通过。
如图27和28所示,通孔1560可以跨越部件的整个长度,并且在一个实施例中以约0.224”的内径在远端以1度开始绘制。在所示设置中,约0.5英寸,但是该部件、通孔1560逐步降低至约0.175英寸的内径,在一个实施例中,其朝向近端端部以约1度向外呈锥形。该内径可以以约内径0.275英寸的沉孔而结束,在所示设置中其可以接受止血密封件。在一个设置中,该近端半部跨越约0.495英寸的长度,其约0.095英寸是沉孔。在所示实施例中,在部件的近端表面上可以提供间隔约90度的3个销钉1562,并且可以延伸约0.127英寸,其外径约0.055英寸并以大约2度被绘制。在其他设置中,可以提供更多或更少的销钉或者间距不同的销钉。托架1524的近端端部也可以包括凹槽1561,用于接收O形环或其他密封部件。在一个实施例中,可以将70硬度的O形环定位在凹槽1561上,以提供止血密封。在一个实施例中,在远端通孔1560之上,可由具有远端盲孔1564,其内径约0.160英寸,而长度约0.465英寸,其逐步减小至维持内径约0.06英寸,而长度约0.137英寸。这些孔可以约1度绘制。在一个实施例中,在部件顶端可以具有盲孔或沉孔,其从部件的顶部跨越至通孔内径内,并且深度约0.375英寸。该孔可以连接前述盲孔和通孔,以允许完全冲洗系统。部件顶面上的沉孔可以设计以使用粘合剂密封,而形成盖。
参考图28,开口1570可以提供与冲洗端口的连接。图28还示出了用于粘合剂端口吸液芯1554的开口1772和肩台1574,其可以作为外套管901的近端端部的止动部件。
图21、22和23示出了对准部件1522。在所示实施例中,对准部件1522包括弯曲呈U形且具有两个向下的端部1521的线。两个向下的端部1521可以位于对准部件1522的近端端部处,并且可以位于形成在手柄1502的下半部中的弯边1523内(参见图20B),以限制对准部件1522的轴向移动并且提供支撑。对准部件1522的远端弯曲端部1525延伸进入螺杆部件1520内。如图23中可见,对准部件1522的两个支架可以形成“轨道”,其形成的轨道,托架1524可以沿着其在螺杆部件1520内移动。即,在所示设置中,托架1524沿着对准部件1522的纵轴而移动。在所示设置中,对准部件1522位于托架1524的中心线上,组装在螺杆部件1520内。修改的设置可以包括单一轨道(或多个轨道)和/或一个或多个轨部件,其啮合托架1524上的突起或其他结构,配置以防止或限制托架1524在螺杆部件1520内旋转。
因此,当组装时,托架1524定位在螺杆部件1520内,而翼1550啮合螺杆部件的内螺纹1540。随着旋钮1506旋转螺杆部件1520,由于托架1524的旋转受对准部件1522限制,托架1524的翼1550沿着螺纹1540移动。结果是托架1524随着旋钮1504的旋转而在螺杆部件1520内轴向移动。外套管901的近端端部可以耦联至托架1524,从而托架1524在手柄1502内的移动使得外套管901相对于手柄1502移动。
在所示实施例,手柄1502可以由2个组件制成。在第一组件中,外套管901的近端端部在托架1560的锥形插座1560中结合至托架1524。在一个设置中,托架是光学透明的,以确认形成适当的接合。在一个实施例中,外套管901就位于托架1524中在0.1和1英寸之间,并且在特定实施例中在0.3和0.5英寸之间。在一个设置中,该接合的接合强度大于30、50或60磅。
在一个实施例中,螺杆部件1520可以包括提供摩擦的机构。在用户输入附近添加摩擦可以防止湿污的感受,并且最小化回弹。在一个实施例中,可以由阻力O形环形成摩擦。
在一个实施例中,旋钮1506啮合具有至少2个弯边或肋条的螺杆部件1520。在一个实施例中,螺杆部件1520位于旋钮1506内侧,以减小输送系统1500的总体长度。在一个实施例中,至少1、2或3英寸的螺杆部件1520位于旋钮1506内。在一个实施例中,托架1524在其上行进的螺杆部件1520的螺纹从手柄组件或旋钮的远端开始行进小于0.3英寸、0.5英寸或1英寸。在一个实施例中,在托架移动器件,托架至少局部地延伸进入旋钮。
如图中所示,在所示实施例中,螺杆部件具有2个径向凹槽,啮合手柄半部中的肋条,以限制正常操作期间的轴向移动。在一些实施例中,可以使用不同形式的更多或更少肋条或结构,以限制移动。螺杆部件优选安装在手柄半部内,以在不影响功能的情况下处理至少30、50或100磅(lbf)的轴向负荷。
因此,在所示实施例中,用户可以旋转旋钮1506,优选在顺时针方向上,其进而旋转螺杆部件1520,该螺杆部件具有内螺纹1534(参见图25B)。托架(或螺母)1524位于内螺纹1534上,并且可以从远端端部至近端端部(或其一部分)在螺纹部件1520的长度行进。进而,托架1524可以耦联至外套管901,从而随着托架1524在螺杆部件1520内向近端移动,外套管901缩回。托管1524还可以耦联至冲洗管道1515。对准部件1522可以在螺杆部件1520内延伸,并且可以跨越螺杆部件1520的长度,以将托架1524维持在合适的方向上,并且以限制托架1524的旋转,从而螺杆部件1520的旋转引起托架1524的轴向运动。图24A和24B示出了随着沿着对准部件1522移动时托架1524在其最近端位置和其最远端位置处。在所示设置中,外套管901和冲洗管道1515在手柄的远端处延伸穿过旋钮1506中的开口(例如,参见图26A和26B,示出了旋钮1506中的开口)。
在所示的实施例中,内管状部件904延伸穿过托架1524和外套管901。参考图20A和20B,手柄1502可以配置有引导管1600和锁定机构1526。如图所示,引导管1600可以从锁定机构1526上延伸。内管状部件904延伸穿过外套管901,托架1524和具有内管状部件904的近端端部的引导管1600设置在锁定机构1626内。定位丝916预先插入多内腔内,导丝内腔194从锁定机构和位于手柄近端端部的通孔(或槽)延伸。如下文所述,锁定机构1526可以配置以夹紧在内管状部件904上,以限制手柄1502和内部部件904之间的轴向移动。这样,随着如上所述外套管901向近端缩回,内部部件903可以基本上维持固定。在所示设置中,定位丝和导丝内腔(以及延伸贯穿其中的导丝)可以在内管状部件904的内腔内轴向移动,而其夹紧在锁定机构1526内。
在使用装置期间,医生可能需要释放和移除输送系统的一部分(例如外套管901)。该锁定机构1526可以允许移除输送系统的一部分,而为另一装置留出空间。如下文所述,这可以包括脱离输送系统的内部部件904。在一些实施例中,外套管901的脱离和移除可以允许取回系统或另一导管在导管的内部部件904上追踪,有利于通过引入器取回植入物。
在所示实施例中,该脱离机构是所示的锁定机构1526,其可以呈夹具的形式,能够固定输送系统的可移除部分(例如外套管901),直至用户使其脱离以有利于输送系统分离。在所示实施例中,将输送导管和驱动机构(例如杆)固定在一起的环圈有利于使得输送系统脱离。
参考图29-31,在所示实施例中,机构1526是蚌壳设计,具有夹紧在一起的、由铰链连接的两个半部1650a、1650b。杆1610可以用于闭合蚌壳,类似于将自行车座椅固定至支柱的机构。在所示实施例中,夹具是具有一个夹点的一体零件设计。在一个实施例中,夹具可以具有与待释放的递送系统部件上的对应特征一起转位的特征。在一个实施例中,驱动机构使用中心上凸轮,以将夹具挤压在一起。在一个实施例中,驱动机构使用螺杆,其在45和360度之间旋转,以将夹具挤压在一起。在一个实施例中,使用杆1610驱动驱动机构。在一个实施例中,驱动机构使用弹簧以将夹具收缩在一起。在一个实施例中,夹具由抗蠕变材料制成。在一个实施例中,夹具由纤维加强聚合物制成。在一个实施例,夹具由PEEK制成。在一个实施例中,夹具由金属材料制成。在一个实施例中,夹具可以承受至少2磅的力。夹具可以设计以沿着内套管部件904的更大区域而分布夹持力,例如可以增加压缩抵靠内管状部件904的夹具的部分的轴向长度。附加地并且作为选择,夹具可以定制以适应固定在夹具内的内管状部件904的特定横截面直径。
在一个用途实施例中,杆1610从图29的锁定位置移动至图30的开启位置。这释放了施加在内管状部件904上的夹持力。定位线的杆部区域917的翼片(参见图5B)可以移除。随后,手柄1502可以缩回在内管状部件904、导丝内腔和定位丝上。这样,可以移除外套管901,留下内管状部件904、导丝内腔和位于患者体内的定位丝。如图31中所示,可以使用枢转销以将杆1610固定至机构1526,并且可以提供螺杆以将机构1526固定在手柄内。
在一个用途实施例中,随后可以将取回系统插入在内管状部件904上。如果植入物尺寸或其相对于原生环面的最终位置并非最佳,则可将取回系统设计成通过例如引入器导管而从人体上移除植入物。在聚合物交换之前的手术中任意时间点,可以使用取回系统从患者体内移除装置。在一个实施例中,取回系统包括篮体,植入物缩回到该篮体中。取回蓝体随后可以缩回至引入器导管内。
上述方法基本上描述了用于置换主动脉瓣的实施例。然而,类似或经修改的方法可以用于置换肺动脉瓣或二尖瓣或三尖瓣。例如,肺动脉瓣可以通过静脉系统而进入,通过股静脉或颈静脉。二尖瓣可以通过如上所述的静脉系统而到达,并且随后从右心房经隔膜地到达左心房。作为选择,二尖瓣可以通过如上参考主动脉瓣所述的动脉系统而到达,此外,导管可以用于穿过主动脉瓣并且随后返回二尖瓣。在Bishop等人的美国专利公开号No.2009/008836中可以找到对二尖瓣和肺动脉瓣置换的其他描述。
上述的各个方法和技术提供了大量方法以实施本文所述的实施例。当然,应当理解,并非必需所述的所有目的或优点可以根据本文所述的任何特定实施例而实现。因而,例如,本领域技术人员将意识到可以执行方法,以实现或优化本文所教导的一个优点或一组优点,而非必须实现本文可能教导或建议的其他目的或优点。
而且,本领域技术人员将意识到本文所公开的不同实施例的各个特征的可互相交换性。类似地,上述的各个特征和/或步骤以及每个这种特征或步骤的其他已知等效,可以混合并且由本领域技术人员匹配以执行根据本文所述的原理的组合、子组合和方法。此外,本文所述和所示的方法并不局限于所述步骤的精确序列,也并非必需受限于本文所述的所有步骤的实践。在实施本发明的实施例中,可以采用其他序列的事件或步骤或者比所有事件更少,或者事件同时发生。
虽然已经结合特定实施例和实力公开了本发明,但是本领域技术人员应当理解,本发明延伸超过特定公开的实施例而形成其他备选实施例和/或用途及其明显修改和等效。因此,本发明并不意于受本发明的优选实施例的特定公开内容受限。
- 还没有人留言评论。精彩留言会获得点赞!