用于经皮的体内组织工程改造的治疗系统的制作方法
本发明涉及一种用于皮肤和皮下组织中定向生成胶原基质的两级治疗系统,所述系统基于nir光源或nir激光光源。
发明背景
de102011052002284公开了一种用于在人皮肤中定向生成胶原基质的激光治疗系统,其首先是基于利用光敏剂结合uva光作皮肤治疗,从而特别地确保了胶原蛋白的光化学交联。其次,利用所述的激光治疗系统,通过聚焦的ir激光和皮肤中不损害表皮的相应能量下,在乳头末端小动脉产生损伤,由此释放红细胞血液成分,从而刺激身体自身的修复过程。随着身体自身的修复过程,一方面破坏的组织被分解,另一方面引发细胞和细胞外基质,如胶原组织的重建,导致皮肤更新。
在皮肤中实现胶原蛋白生成的其它方法,例如根据经皮胶原蛋白诱导的原理进行操作,即所谓的“针刺”,通过纯机械的针辊/模,或通过半-全自动针刺装置,在皮肤和真皮端小动脉中产生损伤,从而使红细胞血液成分,如血小板释放到血管外空间中,并在此分解。结果导致生长因子,例如tgfβ3,vegf,egf的释放。这促进了瘢痕的分解和重塑以及真皮中胶原蛋白的定向生成,从而使皮肤在一定程度上再生或恢复活力。
上述处理方法中,使用含有维生素a和维生素c的霜剂进行手术期间的局部治疗是有利的。这种局部治疗使维生素a和维生素c在皮肤目标区域达到较高局部浓度的维生素a和维生素c,而维生素a和维生素c是生成胶原蛋白和弹性蛋白的重要辅助因子或辅酶。
其他皮肤更新和胶原蛋白形成的方法是基于使用所谓的“能量设备”,其是如由烧蚀的,优选分级的激光系统,如飞梭雷射(fraxel
wo2008/089344a2(neev)公开了一种用于ir激光应用的装置和方法,通过该装置可以产生和应用具有高达10.000个聚焦点或光斑的多个聚焦光束。由于光束集以特定的焦距聚焦,各个光束集以第一横截面进入皮肤,并且在表皮下方被压缩成焦点,从而在焦点处产生比第一横截面处高得多的光和能量密度。其结果是,焦点处的光密度足够大以引起皮肤中的光诱导反应,而在第一横截面处,在聚焦光进入期间,基本不会损伤表皮。
所述应用包括:如刺激或杀死发根,治疗痤疮、纹身、颜色变化、晒黑,眼部护理,包括产生皮下空腔。
wo2008/001284a2(verhagen等人)公开了一种用于皮肤深度治疗的,基于等离子体形成的激光诱导的光击穿(liob)的激光治疗系统和方法。利用相机和显示器,可以看见皮肤上的凹陷,从而特别地在这些凹陷下产生激光伤口刺激。随后的修复过程中,新形成的胶原蛋白填充凹陷。应力矢量和兰格线不作考虑。
wo02/053050a1(altshuler等人)公开了一种在皮肤深度中用于光诱导治疗的装置和方法,其中光源可以是激光光源,也可以是非相干光源。由于该光学装置包含一透镜系统,其具有整体或非整体制造的多个网状分布的透镜,因此能够同时产生多个聚焦的光束集。该装置还包含用于皮肤的冷却元件,其可以是皮肤接触板,或者是透镜系统本身。
us7,198,634公开了一种刺激皮肤的激光治疗系统,其包括红外光源,以及具有紫色或蓝色光谱的光源。
上述的经皮胶原蛋白诱导方法(“针刺”)是侵入性的、疼痛的,具有高感染风险,且不精确。wo2008/089344的方法在胶原蛋白产生方面不具有特异性且不精确。此外,还应用了有毒的紫外光。de102011052002284的方法是具体可控的且有效的,但其需应用有毒的紫外光,并且仅能在结合光敏剂后,实现较低的皮肤渗透深度的效果。其结果是,相对于表面,可以仅对一个聚焦面进行治疗。其中,使用的光敏剂需要用于皮肤的医药产品授权。此外,在局部使用光敏剂时,不能调节或控制皮肤的穿透深度和分布。此外,当局部使用光敏剂时,不耐受反应(光刺激)或过敏反应(光变态反应)频繁发生(spielman,h.l.,müller等,2000)。对于额外激光针刺,需要第二个ir激光源,这就需要额外费用来购买进一步的光源和昂贵的光学器件。为了进行皮肤中末端小动脉的定位,需要应用昂贵、易错、代价高的方法,如oct,荧光显微镜或荧光层析成像。对于de102011052002284中公开的方法,治疗可以仅在一个聚焦面上进行,除此之外,当前所有基于激光的或其他的方法(“能量装置”),都没有考虑对皮肤组织进行解剖学和生理学上的重构或重塑。
因此,本发明的目的是,为了消除现有技术的缺陷,提供一种用于对皮肤组织及更深的组织层,特别是细胞外基质(胶原蛋白和弹性蛋白基质等)进行解剖学和生理学重构的光疗系统,其尽可能少地发射有毒的紫外线辐射,并且可以以尽可能简单,快速和精确的方式使用。
发明概述
根据本发明的第一方面,提供了一种利用第一光线对皮肤和皮下组织层作治疗的系统,所述系统包括:
a)nir光源(1),所述的nir光源产生第一波长为532-1500nm的第一光线,其中所述的第一波长适合在水溶液中激发分子氧的最大吸收,并且其中的光脉冲时间和光能是可控的,
b)图像识别单元(2),所述的图像识别单元被光学耦合到皮肤,包括:
-用于照亮所用皮肤的第二光源,相机单元和用于识别图像的模式识别单元,
-其中,所述第二光源产生具有第二波长的第二光线,使得所述第二光线至少穿透至所述皮肤的乳头状血管的乳头末端小动脉,并且所述的末端小动脉可以通过相比于其他组织的吸收或反射的增强而在皮肤表面被识别,并由所述的相机单元记录,
-其中,所述的模式识别单元包括第一模式识别件,用于识别由所述皮肤表面中末端小动脉的增强的吸收或反射,从而确定所述皮肤表面在平面中的x-y坐标;
-自动对焦模块,用于在垂直于皮肤表面的深度中锐化焦点,其中,皮肤表面下的各个末端小动脉的各深度由所述的自动对焦模块和第二模式识别件确定,
c)光学系统(3),用于所述nir光源(1)的第一光线以及图像识别单元(2)的第二发射和反射的光与皮肤的光耦合,
包括光偏转单元和聚焦单元(3a),具有适配板(3b)作为与皮肤的界面,
其中,所述适配板(3b)设计为放置于所述皮肤上;
其中,所述的光偏转单元和聚焦单元(3a)被设计成将所述第一光线可控地定位在平行于所述适配板(3b)的水平面且在深度上位于皮肤中所述适配板(3b)的下方,作为至少一个聚焦点(4),并且通过所述适配板(3b)发射图像识别单元(2)的第二光线,并接收反射光;
d)控制单元(5),用于控制nir光源(1)、图像识别单元(2)和光学系统(3),被设计成:
-在预设的环形或中空圆柱形区域(14)和预先确定的x-y坐标中,在各末端小动脉和皮肤表面之间的深度区域中,产生具有各自第一光能的多个聚焦点(4),所述的第一光能设计成用于在皮肤中产生氧激发;
-利用第二光能,在预先确定的x-y坐标和各个末端小动脉的深处产生聚焦点(4),所述的第二光能是预设的,以至使各个末端小动脉可透过红细胞血液成分。
优选地,适配板(3b)设有用于光辐射的内部区域(17a)和环绕所述内部区域(17a)的邻接的外部区域(17b),其中,所述的外部区域(17b)伸出超过皮肤治疗区域一定程度,以至于当外部区域(17b)停留在周围皮肤时,内部区域(17a)的位置与皮肤有一定距离。
在一种实施方式中,图像识别单元(2)的模式识别单元包括第三模式识别件,以便能够识别表面丘状皮肤突起,确定皮肤突起的相应坐标;
其中,所述的图像识别单元包括第四图像识别件,所述的第四图像识别件测定在平行于皮肤的平面上皮肤突起相对于彼此的距离,并区分第一区域(16a)与第二区域(16b),其中第一区域(16a)的皮肤突起之间具有第一平均距离,第二区域(16b)的皮肤突起之间具有第二平均距离,
其中,通过控制单元,与第一区域(16a)相比,有更大量的光能施加在第二区域(16b)中的各表面单元。
在一种实施方式中,图像识别单元(2)的模式识别单元包括第三模式识别件,用于检测表面的皮肤突起,从而确定皮肤突起的相应坐标,
其中,用于确定末端小动脉的x-y坐标的第一模式识别件考虑了皮肤突起的坐标,以便增加确定x-y坐标的准确度。
优选地,根据线投影法和三角法,通过激光的投射和探测来确定皮肤突起,和/或
其中,为了确定皮肤突起,在皮肤上产生线的激光的投影通过另一激光产生,而非第一或第二光线,其高度根据线投影法和三角法测量。
优选地,在检测到皮肤突起和相应的乳头后,计算每个表面单元中皮肤突起的局部密度并将其显示在监视器(6)上,从而为给予治疗的人提供皮肤中显著的拉伸应力的指示。
在优选实施方式中,所述的光学系统(3)包括衍射光学元件(doe)和/或数字微镜元件(dmd)和/或另一类型的空间光调制器,其被设计为从第一光线同时产生多个聚焦的光束集,以及相应数量的多个聚焦点(4),其中所述多个聚焦点位于环形或中空圆柱形区域(14)中,并且其中doe和/或dmd和/或另一类型的空间光调制器可以由控制单元(5)移位,使得所述的多个聚焦点(4)环绕预先确定的x-y坐标,并且在深度上位于各末端小动脉和皮肤表面之间的深度区域中。
优选地,相应的x-y坐标上的第一光能,第二光能由doe和/或dmd和/或另一类型的空间光调制器同时产生。
在一种实施方式中,环形或中空圆柱形区域(14)的外径为5-30μm,壁厚为3-8μm,其中,只有壁厚区域充满第一光能。
优选地,所述的第一波长在532-940nm或1064-1500nm之间,更优选地,第一波长为532nm、在577nm、760nm、762nm、765nm、780nm、810nm、880nm、900nm、940nm、1064nm、或1270nm,或者
所述的第一波长在577-765nm或800-1064nm之间,以同时确保用于氧激发的波长和针刺或激光针刺的波长,血红蛋白有足够高的光吸收;和/或所述nir光源(1)是nir激光光源。
优选地,第二波长在450-560nm和577-765nm之间;和/或第二光线以两个或多个光波长范围发射,并相应地由相机单元检测。
在一种实施方式中,聚焦单元(3a)被设计成使第一光线以一定焦距从适配板(3b)发出,所述焦距使位于聚焦点(4)上方、(适配板)下方的上表皮层不被损坏,并且第一和第二光能的光效应仅作用在聚焦点(4)的皮肤上,或者
聚焦单元(3a)被设计成使第一光线以一定焦距和孔径从适配板(3b)发出,从而进入下方皮肤的入口面积,相对聚焦点(4)的横截面积,放大至少30个系数或
其中,在相应的第一聚焦点(4)产生第一光能,并且在相应的第二聚焦点(4)产生第二光能,其中第一聚焦点(4)的直径比第二聚焦点(4)的另一直径大一个系数,其中所述的系数大于2。
优选地,nir光源(1)和光学系统(3)被设计成通过合适的控制,在环形或中空圆柱形区域(14)中的各个聚焦点(4),同时产生多个第一光能,以供应用。
优选地,图像识别单元(2)进一步适用于定量测定适配板(3b)在皮肤上的偏移,其中控制单元(5)被设计成自动执行第一和第二光能在最初尚未治疗的区域的产生和应用。
优选地,具有光束偏转和聚焦光学器件(3a)的光学系统(3)包括至少一个选自下组的透镜作为混杂系统,包括自聚焦透镜、微透镜、凹透镜、柱面透镜、漫射透镜、菲涅耳透镜、液体透镜、第一透镜系统、第二透镜系统、光导体、光导体纤维束、光适配器头、或其组合;和/或
光学系统(3)包括设置在其中的多个光束偏转和聚焦光学器件,其被设计成在适配板(3b)后的皮肤中同时产生相应的多个聚焦光束集和具有相应光点的聚焦点(4)。
在一种实施方式中,控制单元(5)在适配板(3b)的后面,沿着预先定义的光点矩阵,自动产生多个第一和第二光能,其中所述的多个第一或第二光能或者同时或者依次产生。
相机单元可以是数字全息照相机或光场照相机(lightfieldcamera)。
本发明的治疗系统提供了一种光或激光治疗系统,用于细胞外基质,本质上是胶原蛋白和弹性蛋白,在皮肤和皮下组织层中的形成,因为它们的生理结构可以通过具有nir范围内波长的光线(不包括毒的紫外光)产生。而且,与已知方法相比,其不需要额外的光敏剂。可以治疗不同深度的多个组织层。
所述治疗系统包括发射第二光线并检测其从皮肤的反射的图像识别单元。宜为第二波长选择第二光线,使得可以准确识别皮肤乳头中的各个乳头末端小动脉。选择第二波长,从而在乳头端小动脉相对其他组织的反射中,获得最佳对比度。此处,皮肤被第二波长所辐射,其反射由相机单元记录并由图案识别单元评估。以此方式,可以通过模式识别单元很好地检测各个末端小动脉和相应乳头的x-y坐标。由于皮肤中各个末端小动脉的深度或z坐标由自动调焦装置测定,图像识别单元的设计简单且廉价。通过这种类型的末端小动脉的位置确定,可以省去昂贵且复杂的相干断层扫描仪。因此,此种治疗系统成本相对较低,适合家庭使用。
图像识别单元特别有利的是,相机单元的图像中末端小动脉的识别速度,因为仅需要用第二光线不断地照射皮肤,相机单元拍摄图像,其可以通过阈值检测程序在短时间内评估,从而检测末端小动脉为暗点区域或亮点区域。从计算密集型相干断层成像法相比,本图像识别单元的操作速度更快。这也明显降低了由第一和第二光能进行的检测和治疗处理之间的临时位移的风险。
当末端小动脉的x-y坐标和深度或z坐标由图像识别单元确定后,在第二步中,将nir波长范围内的532-1500nm的聚焦的第一光线施加在各个的x-y-z坐标周围进行治疗。聚焦的第一光线的第一波长是预先确定的,使得第一波长适合于最大吸收,用于激发水溶液中的分子氧(参见图8)。结果是在皮肤中产生氧激发,导致细胞外基质中的蛋白质,如胶原蛋白、弹性蛋白、蛋白聚糖和粘多糖(gag)的脱氨基作用,其在脱氨状态下导致用于交联的醛醇缩合。从而完全避免有毒的紫外线辐射。
在第二步或同时,治疗系统的控制单元引起光或激光针刺,在各个末端小动脉的x-y-z坐标中施加第二光能,其以预先确定的方式使得红细胞血液成分透过末端小动脉。
有利地,所述治疗系统仅管控一个光或激光光源,用于治疗性的第一光线,其中,在各个x-y-z坐标的周边产生相应的第一光能,并且在各个x-y-z坐标上产生第二光能。
由于使用了ir或nir光,ir或nir光可以比uv光更深入皮肤和皮下组织层,因此可以在较深层的组织层中进行治疗。特别有利的是,可能治疗皮肤深处的支持韧带区域。
由于优选通过图像检测单元,从形态上检测上表皮的皮肤突起,并同时测定其相互距离,即各个皮肤突起顶点的相互距离,从而能以简单的方式确定下方乳头间的距离。此处假设位于表皮下方的乳头使表皮相应地突起,以这种方式产生乳头的印模。因此,通过测定皮肤突起之间的距离,提供了进一步参数以便在平行于皮肤的x-y平面中识别乳头的x-y坐标。优选地,用于测定乳头x-y坐标的模式识别考虑了皮肤突起的位置,使得乳头x-y坐标的识别变得更准确。
优选地,构成治疗系统和皮肤之间界面的适配板配备有相对于皮肤的槽,使得皮肤不会与适配板直接接触,从而使皮肤表面不会因适配板变形。
在测定皮肤突起时,使用已知的线投影法和三角法。优选地,对于皮肤的形态测量,除了图像识别单元的第二光线之外,还使用具有不同于第二波长的另一波长的另一光线,形态测量可以在测定各个末端小动脉深度的同时进行。这加快了识别过程和治疗。
由于另一波长与第一波长不同,所以形态测量与利用第一或第二光能的治疗处理几乎可以同时进行,结果是适配板相对皮肤的临时位移的风险明显减少。
由于优选测定皮肤突起,因而可以识别具有较小乳头距离的第一区域和具有较大乳头距离的第二区域。假设第二区域代表更加扩张的皮肤,可以推断第二区域中胶原蛋白和弹性蛋白交联的程度必然比第一区域更大。优选地,该信息由控制单元评估,其中,在第二区域中,与第一区域相比,在各个聚焦点中施加更多数量的第一能量。
通过测定皮肤突起相对于彼此的距离,假设皮肤的松弛程度相同,推断由骨骼和皮肤之间的支持韧带引起的皮肤悬浮成为可能。通过区分皮肤突起的第一和第二区域,皮肤中的主要应力矢量变得可识别,或者变得技术上可测。由于在支持韧带外的第二区域,胶原蛋白结构必须在更深的皮肤层中修复,特别是在此处,用nir光进行治疗比用紫外光更有利,因为相比更高频率的紫外光,nir光更加深入皮肤。在使用nir光进行治疗的同时,也可以想到脂肪组织(脂肪团)和/或通过脂肪组织细胞的乳化作用进行脂类分解。
对于第一波长,使用532-940nm或1064-1500nm范围内的波长是特别有利的,以同时确保氧激发的波长,以及针刺或激光针刺的波长和足够大的血红蛋白的光吸收。特别优选的波长包括532nm、577nm、578nm、760nm、762nm、765nm、780nm、810nm、880nm、900nm、940nm、1064nm和1270nm。
优选地,所述光学系统包括衍射光学元件(doe)和/或数字微镜元件(dmd)和/或另一类型的空间光调制器,以便同时应用多个聚焦点。进入光学系统的第一光线被分成几个聚焦的光束集,各光束集分别产生一个聚焦点,并且排列所述光束集,使其施加于末端小动脉的深度上和x-y坐标的周围。由此,进入光学系统的第一光线的能量必然是单个聚焦点的许多倍。此处有利的是同时应用聚焦点,节约时间。因此,与顺序进行位置定位和唯一的较小的第一光能相比,所述治疗可以快许多倍。
优选地,衍射光学元件(doe)和/或数字微镜元件(dmd)和/或另一类型的空间光调制器被设计成使得用于激光针刺的第二光能同时在末端小动脉的x-y坐标上和深度(z坐标)上施加。由此,衍射光学元件(doe)和/或数字微镜元件(dmd)和/或另一类型的空间光调制器定量地考虑了第一光能和第二光能,且进入光学系统的第一光线进行了相应地划分。
优选地,所述光源是激光光源,其也可以由一系列光学互连的半导体激光器组成。
优选地,图像检测单元被设计为检测适配板在皮肤上的位移,以便能够检测已经被治疗系统治疗的区域和仍然需要治疗的区域。有利地,控制单元评估治疗和尚未治疗的区域,使其自动地只治疗仍然需要用光治疗的区域。
附图简要说明
现在,参考以下非限制性实施方式和附图更详细地说明本发明,其中:
图1显示了根据本发明的治疗系统的示意图,其包括nir光源和具有第二光源和照相机的图像识别系统,通过光学系统耦合到皮肤。控制单元控制nir光源和图像识别系统,并进行数据读取。监视器显示照相机的图像数据和图像识别系统的模式识别。两个聚焦点通过nir光的第一光线施加于皮肤深处;
图2显示了其间具有乳头和胶原纤维的皮肤结构的顶视图。各个黑点表示乳头中的末端小动脉,具有各自的x-y坐标。围绕黑点绘制的圆圈是平均乳头上限;
图3显示了乳头中有末端小动脉的皮肤的横截面的侧视图。此外,还显示了由治疗系统产生的聚焦点。聚焦点可以在皮肤的深度上不同设置,从而在锐化期间确定深度;
图4显示了末端小动脉的透视图,在其周围设置有空心圆柱体,并在其上施加具有第一能量的聚焦点;
图5显示了皮肤上皮肤乳头的顶视图,其间具有额外的交联的胶原纤维;
图6显示了具有不同乳头距离的皮肤乳头的顶视图,第一区域的乳头距离小于第二区域的乳头距离;
图7显示了光学系统适配板的侧剖视图,其在治疗系统和皮肤之间形成界面;
图8显示了高压下一定波长范围内分子氧的吸收光谱图;和
图9显示了一定波长范围内对仓鼠的单个卵巢细胞进行激光辐射产生的光损伤的作用光谱图。
优选实施方式的详细说明
现在参照附图对本发明进行更全面地说明,同时示出了本发明的部分实施方式。
如下所述的本发明不限于公开的具体实施方式,稍作修改和其他预期的实施方式包括在本发明的范围内。尽管此处采用了具体的术语,但其仅用于通用的和描述性意义,而不是为了限制性目的。
如本说明书和权利要求所用,单数形式“一”,“一个”和“该”包括复数形式,除非上下文另有明确指示。
本文所用的术语和措辞是为了描述性目的,不应被视为限制。本文所用的术语“包含”、“含有”、“具有”、“包括”及其变体是指包括其后列出的项目及其等同物和附加项目。
图1显示了用光进行皮肤中体积等区域的治疗的优选治疗系统的示意图。应当理解,术语“皮肤”通常是指深度上自表皮延伸至真皮和皮下组织层的人体组织。光线指由nir光源1产生的聚焦光,其穿过光学系统3,并且在光学系统3的适配板3b的后面,至少作为具有焦距和相应焦点4的光的一部分而被发射。治疗系统设计成将焦点4或数个焦点4精确定位于适配板的后面,从而在皮肤中相应地精确的应用。
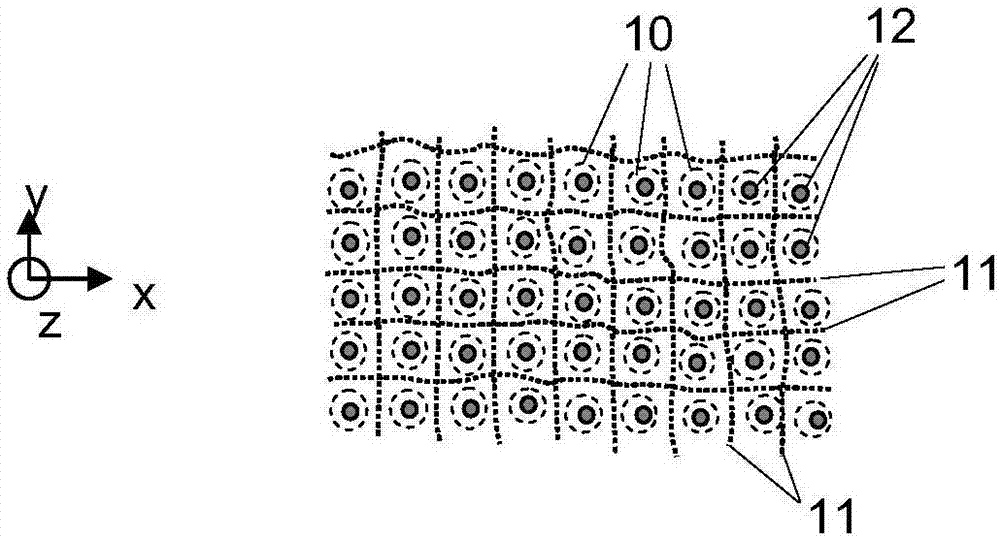
图1显示了具有连接到动脉和静脉血管13的乳头10和末端小动脉12的轮廓的皮肤。胶原组织区域11由虚线表示,并且描绘在乳头10之间。
nir光源产生具有532-1500nm之间的第一波长的光线。第一波长适合于在水溶液中诱导分子氧的最大吸收。光脉冲时间和光能可以由控制单元5控制,其与光学系统3的nir光源和光学元件一致,控制光束的偏转和/或遮蔽。为清晰起见:在此步骤中,波长范围已经从532nm直到nir的范围,也就是其仅为红光。
优选地,nir光源1是纳米或皮秒激光器,其产生具有第一强度的第一波长。
或者,nir光源是飞秒激光器,具有第一波长两倍的波长,但是通过彼此接近的两个光脉冲,产生第一波长。
或者优选的nir光源是用于可见光和近红外光的vis-nir光源。
治疗系统中,图像识别单元2通过光学系统3和适配板3b耦合到皮肤。图像识别单元2包括用于照亮皮肤的第二光源,用于检测反射到皮肤中和皮肤上的第二光线的相机单元,以及除图像识别之外的模式识别单元。由此,产生具有第二波长的第二光源的第二光线,使得第二光线至少穿透至皮肤的乳头状血管的乳头末端小动脉,并且通过相对皮肤表面其他组织增强的吸收或反射来识别所述的末端小动脉,并由所述的相机单元记录。
图像识别单元2的模式识别单元包括第一模式识别,用于识别由所述皮肤表面中末端小动脉产生的增强的吸收或反射,优选是通过相同的黑暗或明亮区域。可以通过简单的图像中像素强度的阈值检测进行识别。由此,首先通过第一模式识别,在与皮肤表面或相对适配板3b平行的平面中测定所有相应的x-y坐标。优选地,第二光线以点阵列投影在皮肤上,点阵之间的距离为7-10μm。因此,对相机单元的图像的评估只需要较少的图像信息,从而节约图案识别的时间。
末端小动脉的第三z坐标表示各个末端小动脉在皮肤表面以下的深度,由模式识别单元具有自动对焦功能的第二模式识别进行测定。利用自动对焦功能,第二光线在有末端小动脉的区域锐化焦点,其中锐化耦合到由第二模式识别测定的相应深度或z坐标。为清晰起见:此处的末端小动脉是指乳头中的动脉和静脉血管。优选地,在末端小动脉转折点的位置测定末端小动脉的深度,并由此确定其相对于皮肤表面的最高点。优选地,通过压电元件确保自动聚焦功能,该压电元件耦合到用于深度适配的透镜系统。
光学系统3用于nir光源1的光线以及自模式识别单元发射和反射的第二光线与皮肤的光耦合。光学系统3包括光偏转单元和聚焦单元3a,以及作为与皮肤界面的适配板3b,用于光线的发射以及第二光线的发射和进入。适配板3b放置于皮肤上。优选地,适配板3b设有用于光照射的内部区域17a和环绕所述内部区域17a的邻接的外部区域17b,其中,所述的外部区域17b突出皮肤治疗区域一定程度,以至于当外部区域17b停留在周围皮肤时,内部区域17a的位置与皮肤有一定距离(参见图7)。
光偏转单元和聚焦单元3a被设计成将光线以受控的方式定位在与适配板3b平行的水平x-y平面以及垂直于适配板3b下方的深度z处,具有至少一个聚焦点4。优选地,对于第一光能,聚焦点4具有30-100μm的直径。优选地,对于第二光能,聚焦点4具有1.5-3μm的直径。其控制由控制单元5确保。优选地,nir光源的光以这样的焦距和孔径聚焦,即,光线尽可能少地损伤表皮,并且以相对较高的光能密度在聚焦点4处深入皮肤,从而使得所述光线产生需要的治疗反应。
通过同样由适配器3b控制的光偏转单元和聚焦单元3a,图像识别单元2的第二光线被发射到皮肤并且其反射部分被接收。
控制单元5用于控制nir光源1,图像识别单元2和光学系统3。优选地,接收来自这些单元的信号,如果必要的话转换并传递给其他单元。
例如,控制单元5优选地控制监视器6,监视器6显示相机单元的图像,优选地控制图像识别单元2的模式识别。同样优选地,输入单元7与控制单元5连接,从而,例如,选择皮肤中的治疗区域,输入光控指令和/或其他控制参数等。
现在参考图1和图4,通过控制单元5,在预先确定的环形或中空圆柱形区域14中,在先前确定的xy坐标周围,且在各个末端小动脉和皮肤表面之间的深度区域,以相应的第一光能产生多个聚焦点4。控制nir光源以及光偏转单元和聚焦单元3a,从而在皮肤中可靠地产生氧激发。氧激发导致基质(胶原蛋白,弹性蛋白,蛋白聚糖和糖胺聚糖)蛋白侧链的脱氨基作用,其在脱氨状态下导致例如胶原蛋白和弹性蛋白质的交联的醛醇缩合。
此外,控制单元5至少在一个聚焦点4处,在先前确定的x-y-z坐标处,在各个末端小动脉的深处,产生并施加第二光能。该第二光能是预先确定的,使得各个末端小动脉可透过红细胞血液成分。
生理条件下,赖氨酰氧化酶(lox)与细胞外间隙的胶原分子在离开细胞后交联。因此,例如,在胶原分子中,特定氨基酸的氨基被转化为醛基,或者通过醇醛缩合与相邻醛基自发反应,或者与具有醛亚胺结构的氨基酸的氨基反应并形成共价交联。这种交联是含胶原蛋白组织具有机械稳定性的主要原因,也确保其生理功能。这就是胶原蛋白如何获得其天然强度和稳定性。由于埃勒斯-当洛斯综合征(ehlers-danlossyndrome)缺乏lox,圆锥形角膜中lox减少,瘢痕疙瘩和瘢痕的情况下则增加(来自kohlhaas,m:圆锥形角膜情况下的利用核黄素和紫外光的胶原蛋白交联,眼科学2008:785-796)
或者,利用uva光,也可以进行胶原蛋白与核黄素的光氧化交联。该方法是已知的,常眼科中用于治疗圆锥形角膜眼病。通过胶原蛋白与核黄素和uva的光氧化交联,可以治疗机械角膜稳定性降低或稳定性增加。选择这种方法是由于其以局部有限的方式起作用,治疗时间短且角膜的透明度保持不变.此处核黄素用作光敏剂,以产生活性氧类,如单线态氧[sporte.raiskup-wolff.,pillunatle.胶原蛋白交联的生物物理学基础,clin.monthly眼科(眼科学)2008,225,131-127)。当核黄素从紫外线吸收能量,其进入激发态(激发的单线态核黄素1rf*)。在交换机制中,激发的单线态核黄素转变为激发的三联核黄素(3rf*)(11).通过与三线态氧(3σg-)的相互作用,可以获得单线态氧(1δg和1σg+),氧自由基进一步与胶原蛋白氨基酸相互作用。
这种光化学过程修饰胶原蛋白的氨基酸。在胶原蛋白交联过程中,沿着分子链形成活性斑点,根据醛亚胺形成和醛醇缩合,其在分子间相互反应,并在胶原分子的氨基酸之间形成共价连接。观察到从酪氨酸形成二酪氨酸,由此产生胶原分子的分子间和分子内交联(来自kollert.,sellert.:利用uva和核黄素的角膜的治疗性交联(clin.monthlyaugenheilkunde(眼科学),2007,224:700-706)。只有在核黄素被uv光激发的地方才会出现光化学交联作用或发生光聚合,因为此处单线态氧的寿命只有10-100μs,因此,最多只能在几微米的范围内扩散(来自:
此外,当核黄素浓度增加时,不一定形成更多的单线态氧,因为核黄素不仅可以作为单线态氧的生产者,而且其浓度高时也作为自由基捕获剂。因此,在高浓度下,单线态氧的形成和破坏之间出现平衡,即发生饱和过程(来自:
术语解释:当多重性为(2s+1)=1时,系统称为单线态(singlet)。是电子自旋的量子数s为0时的情况,即2个电子的旋转相互补偿(s=(+1/2)+(-1/2)=0)。
氧原子的基态是三线态氧(3σg-,两个不配对电子,双自由基),在激发态单线态氧(1δg和1σg+)中。原子,所谓的初生态氧在化学反应形成的时刻出现。
在单线态氧的情况下,电子对可以直接吸收到2pz轨道,而不必改变电子的旋转,因此活化能较小,分子反应性更强(来自:bützer,2014.chemiesauerstoff(化学氧),第4页及其后续)。
使用nir光进行光治疗的优点是,相对使用uva光的更大的穿透深度,以及相对局部存在的核黄素的更大的独立性。例如,由霜剂引入的局部存在的核黄素不受控制且不能渗透到更深的皮肤层中,更不能进入皮下组织。因此,它显示出不均匀的分布模式。
按照设想,图像识别单元2的部件,例如模式识别单元,也可以构成控制单元的一部分。
图2示意性地显示了皮肤结构的俯视图,其中黑点表示末端小动脉12,并且虚线圆圈表示乳头10。分布在乳头10之间的是胶原纤维。
图3概括地显示了具有光学系统3,适配器板3b的治疗装置的侧视图,以及其下皮肤的横截面。还显示了nir光源1的锥形聚焦光和其产生的聚焦点4。在锥形虚线的下方和上方均表示锥形聚焦光,当自动对焦功能在沿z轴的深度上改变聚焦点4时,会出现锥形聚焦光。
图4显示了末端小动脉12的透视图,在预先确定的环形或中空圆柱形区域14的周围,在先前确定的特定末端小动脉的x-y-z坐标的周围,向多个聚焦点4施加相应的第一光能。聚焦点在图4中由星星表示。
图5显示了皮肤乳头10的顶视图,其中,通过在乳头10之间利用第一光能进行治疗,额外形成交联的胶原纤维。
优选地,图像识别单元2的模式识别单元包括第三模式识别件,以识别浅表丘状皮肤突起,并测定皮肤突起的坐标。皮肤突起的坐标是指在平行于适配板3b和皮肤的xy平面中皮肤突起的顶点。此外,优选地,各个皮肤突起正交于x-y平面的高度由第三模式识别件进行测定。
优选地,模式识别单元还包括测定x-y平面中皮肤突起之间距离的第四模式识别件。参见图6,优选地,确定皮肤突起之间具有第一平均距离的第一区域16a,皮肤突起之间具有第二平均距离的第二区域16b,其中第二平均距离至少比第一平均距离大10%。已知皮肤突起是由下方的乳头10引起的,并且胶原纤维的晶格结构分布于乳头之间,因此可以以简单的方式确定乳头间的距离。此外,这种方式可以获得关于真皮中胶原蛋白基质的形状和状况的信息,并由此获得关于皮肤变化或拉伸的信息。以这种方式,还可以确定主要的皮肤应力线以及主要的应力矢量。优选地,控制单元5被设计为在第二区域16b的各表面单元施加比第一区域更大量的光能。
图6显示了皮肤中具有较小的乳头10间距离的第一区域16a和具有较大的乳头10间距离的第二区域16b的俯视图。技术人员将从中识别出支持韧带终止在第一区域16a到第二区域16b的边缘,还可以假定第二区域16b中相应的皮肤应力矢量(指向下)。在这方面,控制单元5优选地被设计成在第二区域16b中更强烈地,以增加的速率施加第一和第二能量。
优选地,用于测定末端小动脉12的x-y坐标的第一模式识别被设计成还考虑皮肤突起的坐标。这将确保末端小动脉12的x-y坐标的测定更精确地进行。
优选地,利用线投影法以及激光的投射和探测来测定皮肤突起。或更优选地,根据三角法或scheimpflug方法,利用激光的投射和探测来测定皮肤突起。优选地,皮肤突起由激光而非nir光源1的光产生,并以线投影到皮肤上,以便基本同时检测皮肤突起和施加靶向问题皮肤突起区域的第一和/或第二光能。这确保了在适配器板3b相对于皮肤有位移的情况下,在皮肤突起坐标的检测和光治疗的应用之间不会发生不必要的更大的偏差。
优选地,所述光学系统3包括衍射光学元件(doe)和/或数字微镜元件(dmd)和/或另一类型的空间光调制器,其被设计为自第一光线产生多个聚焦光束集以及相应多个聚焦点4。所述的多个聚焦点位于环形或中空圆柱形区域14中。优选地,doe和/或dmd和/或另一类型的空间光调制器由控制单元5移动,使得多个聚焦点4位于预先确定的x-y-z坐标周围,在各个末端小动脉和皮肤表面之间的深度区域中。
优选地,doe和/或dmd和/或另一类型的空间光调制器在相应的x-y-z坐标上同时产生第一光能和第二光能。
优选地,环形或中空圆柱形区域14的外径为
优选地,所述的第一波长在532-940nm或1064-1500nm之间。优选地,所述的第一波长为532nm、577nm、578nm、630nm、760nm、762nm、765nm、780nm、810nm、880nm、900nm、940nm、1064nm、或1270nm。
特别优选地,所述第一波长为577nm、578nm、760nm、762nm、765nm、或1064nm,以同时确保用于氧激发的波长,和针刺或激光针刺的波长,血红蛋白有足够高的光吸收。
图8显示了高压下一定波长范围内分子氧的吸收光谱图,图9显示了一定波长范围内利用激光辐射对仓鼠卵巢细胞进行光损伤的作用光谱图。(来自s.d.zakharow,a.v.ivanoc,生物物理学50(增刊1),64,2005)。优选地,nir光源1是nir激光光源。优选地,nir光源1还包括一起提供光线的两个或更多个激光二极管。
优选地,图像识别单元2的第二光线的第二波长在450-560nm和577-765nm范围内。
优选地,图像识别单元2辐射两个或更多个光波长区域,并且相应地由相机单元检测。
优选地,聚焦单元3a被设计成使nir光源1的光线以一定焦距从适配板3b聚焦发出,使得位于聚焦点4上方的(适配板)下方的上表皮层不被损坏,并且仅在第一和第二光能进入皮肤期间,在聚焦点4上或内发生光效应。优选地,聚焦单元3a被设计成使nir光源1的光线以一定焦距和孔径从适配板3b发出,从而进入下方皮肤的入口面积,相对聚焦点4的横截面积,放大至少30个系数或
优选地,nir光源1和光学系统3被设计成通过合适的控制,在环形或中空圆柱形区域14中,对不同的聚焦点4,同时产生多个用于应用的第一光能。
优选地,在各第一聚焦点4产生第一光能,并且在各第二聚焦点4产生第二光能,其中第一聚焦点4的直径比第二聚焦点4的另一直径大一个系数,其中所述的系数大于2。
优选地,图像识别单元2还被设计为定量测定适配板3b在皮肤上的位移,利用电脑鼠标或其他技术设备中已知的方法。在这一点上,控制单元5被设计成自动执行第一和第二光能在最初尚未治疗的区域的产生和应用。
优选地,具有光束偏转和聚焦光学器件3a的光学系统3包括至少一个选自下组的透镜作为混杂系统,包括自聚焦透镜、微透镜、凹透镜、柱面透镜、漫射透镜、菲涅耳透镜、液体透镜、第一透镜系统、第二透镜系统、光导体、光导体纤维束、光适配器头、或其组合。
优选地,光学系统3包括设置在其中的多个光束偏转和聚焦光学器件,其被设计成在适配板3b后的皮肤中同时产生相应的多个聚焦光束集和具有相应光点的聚焦点4。
优选地,控制单元5在适配板3b的后面,沿着预先定义的光点矩阵,自动产生多个第一和第二光能,其中所述的多个第一或第二光能或者同时或者依次产生。
优选地,相机单元为数字全息照相机或光场照相机。
以上描述的本发明的任一说明性实施方式是教导如何执行本发明。本领域普通技术人员已知可以修改各种细节,从而获得进一步的实施方式,但是这些实施方式仍在本发明的范围内。特别地,上述实施方式的各种特征也可以彼此组合,只要其在技术上不相互排斥。
本发明不限于附图所示的实施方式。因此,应当理解,在所附权利要求中涉及的特征后有附图标记,这些标记仅仅是为了增加权利要求的可理解性,而绝不限制权利要求的范围。
- 还没有人留言评论。精彩留言会获得点赞!